Влияние цитофлавина на выраженность метаболического ацидоза у пациентов с острым повреждением головного мозга, осложнившимся развитием стресс-индуцированной гипергликемии
Статьи
Опубликовано в журнале:
Экспериментальная и клиническая фармакология 2017 Том 80 № 7 С. 99
М. И. Неймарк1, И. А. Захарченко2, Р. Б. Абдрашитов2, А. Л. Коваленко3, В. А. Заплутанов4, В. В. Валеев4
1 ГБОУ ВПО “Алтайский государственный медицинский университет” М3 РФ, Россия, 656038, Алтайский край, Барнаул, пр. Ленина, 40.
2 КГБУ3 “Краевая клиническая больница скорой медицинской помощи”, Россия, 656038, Алтайский край, Барнаул, пр. Комсомольский, 73, к. 2.
3 ФГБУН “Институт токсикологии” ФМБА России, Россия, 192019, Санкт-Петербург, ул. Бехтерева, 1.
4 ФГБУН “Институт эволюционной физиологии и биохимии им. И. М. Сеченова РАН”, Россия, 194223, Санкт-Петербург, пр. Тореза, 44.
Проведен ретроспективный анализ 44 историй болезни пациентов с острым повреждением головного мозга (черепно-мозговая травма, сочетанная травма, острое нарушение мозгового кровообращения), находящихся в критическом состоянии и получающих лечение в условиях отделения анестезиологии и реанимации. Оценивали влияние цитофлавина на выраженность стресс-индуцированной гипергликемии и метаболического ацидоза. Пациенты, получившие инфузии цитофлавина (по 40 мл/сут в течение 2 сут через инфузомат) отличались более низкими уровнями гипергликемии, по сравнению с пациентами, чьё стандартное лечение не включало исследуемый препарат (р > 0,05). Цитофлавин также способствовал повышению pH артериальной крови на вторые сутки применения (р<0,05) и поддержанию буферной ёмкости крови, что указывает на способность препарата улучшать утилизацию энергетических субстратов. Полученные результаты позволяют рассматривать цитофлавин в качестве потенциального средства, позволяющего уменьшать степень острых метаболических расстройств, сопровождающих развитие критического состояния.
Ключевые слова: стресс-индуцированная гипергликемия; метаболический ацидоз; острое повреждение головного мозга; ЧМТ; ОНМК; цитофлавин.
Введение
Тяжелое острое повреждение головного мозга, будь то черепно-мозговая травма или острое нарушение церебрального кровотока, сопровождается острыми неспецифическими расстройствами метаболизма, которые, с одной стороны, косвенно характеризуют степень повреждения церебральной ткани, с другой — являются факторами, осложняющими течение острой церебральной недостаточности.
Гипергликемия у пациента при поступлении, не связанная с предшествующим сахарным диабетом (так называемая стресс-индуцированная гипергликемия), ранее считавшаяся кратковременной приспособительной реакцией, в настоящее время рассматривается как один из предикторов неблагоприятного исхода заболевания или травмы [4, 7]. В то же время в ряде работ было показано, что коррекция гипергликемии может улучшать исход заболевания [5, 6, 8].
На сегодняшний день считается, что в основе стресс-индуцированной гипергликемии лежит сочетание как минимум 2 патогенетических механизмов: функциональная инсулинорезистентность, связанная с транзиторным нарушением работы инсулиновых рецепторов, и эффекты контринсулярных гормонов (кортизола, глюкагона, катехоламинов), уровень которых резко повышается в ответ на травму или внезапное нарушение функции органа [7].
Увеличение продукции глюкозы в таких ситуациях связано, главным образом, с усилением глюконеогене- за в печени. Основным субстратом для синтеза глюкозы служит лактат, уровень которого при острых повреждениях тканей повышается в результате гипоксии, ишемии и реперфузии — процессов, нарушающих нормальную работу митохондрий и приводящих к активации реакций гликолиза [7].
Основным методом коррекции стресс-индуцированной гипергликемии остается внутривенная инсулинотерапия, которая, однако, не позволяет добиться полного контроля уровня глюкозы крови и связана с риском развития гипогликемического состояния [4, 7].
Мы считаем, что патогенетическое лечение острых метаболических расстройств (в первую очередь, нарушений углеводного обмена), вызванных развитием критического состояния, должно проводиться лекарственными средствами, восстанавливающими естественные (преимущественно аэробные) пути энергообеспечения клеток.
В связи с вышеизложенным у нас вызвал интерес отечественный препарат цитофлавин (ООО “НТФФ “ПОЛИСАН”, Санкт-Петербург), который согласно инструкции производителя “способствует активации аэробного метаболизма клеток, что приводит к увеличению уровня утилизации глюкозы”.
Препарат является многокомпонентным метаболическим средством и включает в себя коферменты митохондриальных комплексов (рибофлавин, никотинамид), инозин (предшественник АТФ) и сукцинат (компонент цикла Кребса, непосредственный донор электронов для дыхательной цепи). Препарат включен в Перечень жизненно необходимых и важнейших лекарственных препаратов для медицинского применения на 2017 год и применяется у пациентов с острой и хронической церебральной ишемией, токсической и гипоксической энцефалопатией и при посленаркозном угнетении сознания [2, 3].
Мы провели ретроспективный анализ историй болезни пациентов с острым повреждением головного мозга (черепно-мозговая травма, сочетанная травма, острое нарушение мозгового кровообращения). Целью анализа стала оценка влияния цитофлавина на показатели углеводного обмена и кислотно-основного состояния у пациентов со стресс-индуцированной гипергликемией.
Методы исследования
Проведен ретроспективный анализ 44 историй болезни пациентов с диагнозами “черепно-мозговая травма”, “сочетанная травма”, “острое нарушение мозгового кровообращения”, получивших лечение в условиях отделения реанимации и интенсивной терапии (ОРИТ) КГБУЗ “Краевая клиническая больница скорой медицинской помощи” (г. Барнаул) в 2015-2016 гг.
Критерии включения данных пациента в исследование были следующими: возраст 18-60 лет, острое повреждение головного мозга, кома I-II, потребность в искусственной или вспомогательной вентиляции легких, 1-3 сут лечения в ОРИТ, госпитализация в стационар не позднее 48 ч от начала заболевания, гипергликемия при поступлении в ОРИТ 7 ммоль/л и более.
В исследование не включались данные пациентов с сахарным диабетом или уровнем гликированного гемоглобина ≥6,5%, терминальной комой, поражением ствола головного мозга, травмой органов брюшной полости, острой почечной и печеночной недостаточностью, признаками острой ишемии миокарда, сопутствующими заболеваниями в стадии декомпенсации, онкологическим заболеванием, беременностью. Также в исследование не были включены пациенты, которым по тем или иным причинам были назначены препараты глюкокортикостероидов, в том числе однократно.
Все включенные в исследование истории болезни были разделены на 2 группы. В первую группу были собраны данные пациентов, получивших в составе терапии цитофлавин в суточной дозе 40 мл внутривенно в течение 2 сут (во всех случаях препарат вводили в соответствии с инструкцией в разведении с физиологическим раствором с помощью инфузомата согласно сложившейся внутри отделения практике). Во вторую группу (группа сравнения) вошли данные пациентов, стандартное лечение которых не включало препарат цитофлавин.
При анализе данных первой группы оценивали показатели за промежуток времени, включающий 1, 2 и 3 сут использования цитофлавина. При анализе данных второй группы оценивали показатели на протяжении 3 сут со дня впервые выявленной (в условиях ОРИТ) гипергликемии.
Основными анализируемыми параметрами были динамика уровня глюкозы крови, уровня лактата артериальной крови, а также показатели кислотно-основного состояния (pH и щелочной резерв (ВЕ), ммоль/л), характеризующие выраженность метаболического ацидоза [1]. Уровень глюкозы определяли в капиллярной крови глюкометром BIOSENC line (EKF DIAGNOSTIC GMBH, Германия). Показатели кислотно-основного состояния и уровня лактата определяли в артериальной крови анализатором ABL800 Basic (RADIOMETER MEDICAL ApS, Дания).
Результаты статистического анализа данных представлены в виде средней арифметической и стандартного отклонения. Для исследования статистически значимых различий между группами проводили сравнительный анализ с применением непараметрического критерия достоверности Манна — Уитни (U). Для исследования взаимосвязей между показателями проводили корреляционный анализ с применением рангового коэффициента корреляции r Спирмена в каждой группе. Результаты рассматривали при погрешности p≤0,05. Программное обеспечение исследования включало пакет MSOfficeExcel 2010 и программу Statistica 10.0 (ru).
Результаты и их обсуждение
В первую группу вошли данные 23 мужчин и 1 женщины, во вторую группу — данные 19 мужчин и 1 женщины. Средний возраст пациентов первой группы составил (40,8±14,4) лет, второй группы — (39,0±12,3) лет, таким образом группы были сопоставимы по половозрастному составу.
Средний исходный уровень гипергликемии в первой группе данных составил (9,0±1,7) ммоль/л (учитывались показатели уровня глюкозы, полученные до назначения исследуемого препарата), во второй группе средний уровень начальной гликемии составил (8,8±1,6) ммоль/л (учитывались показатели, ставшие основанием для включения данных пациента в анализ). Достоверных различий по показателю “исходный уровень гликемии” между группами не выявлено.
Обе группы на протяжении выбранного периода наблюдения характеризовались умеренно повышенными среднесуточными показателями глюкозы капиллярной крови, не превышающими 6,6 ммоль/л, и не требовали назначения инсулинотерапии (рис. 1). Группа пациентов, получивших инфузии цитофлавина, характеризовалась более низкими среднесуточными показателями глюкозы крови на протяжении всего оцениваемого периода. Однако достоверных различий по данным показателям между группами не выявлено.
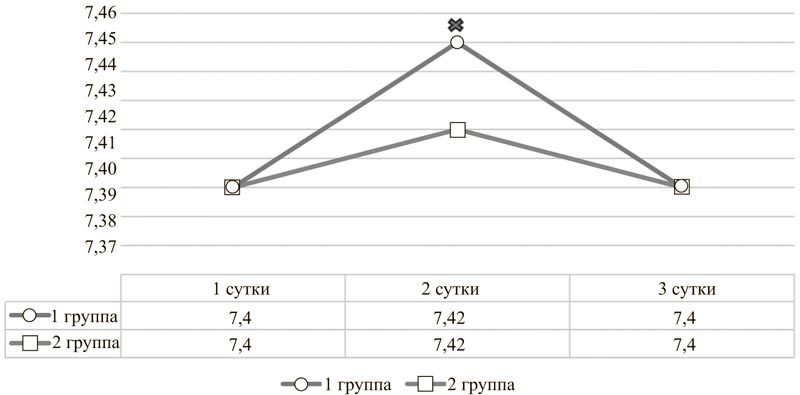
Рис. 1. Динамика pH артериальной крови у пациентов с острым повреждением головного мозга на фоне инфузий цитофлавина (1 группа) и без него (2 группа).
× Различие между группами достоверно при p<0,05.
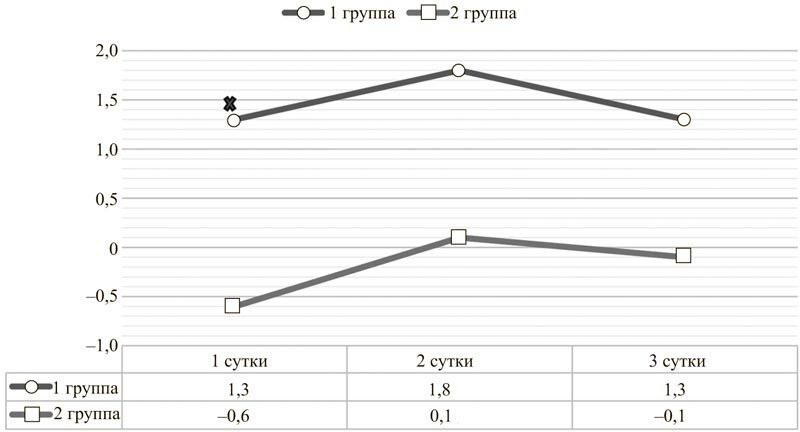
Рис. 2. Динамика BE артериальной крови у пациентов с острым повреждением головного мозга на фоне инфузии цитофлавина (1 группа) и без неё (2 группа).
× Различие между группами достоверно при p<0,05.
Корреляционный анализ данных первой группы выявил значительную прямую (положительную) зависимость (r = + 0,71) между среднесуточным сахаром крови в первые сутки введения цитофлавина и абсолютным снижением данного показателя на вторые сутки. Во второй группе связь между аналогичными показателями была средней (r = + 0,44). Таким образом, среди пациентов обеих групп наиболее очевидная положительная динамика уровня глюкозы крови отмечалась у пациентов первой группы с высокими цифрами суточного сахара после первых суток использования цитофлавина.
Согласно результатам корреляционного анализа, в обеих группах в первые сутки имелась положительная связь показателей среднесуточного сахара и лактата артериальной крови, что, на наш взгляд, в очередной раз подтверждает участие лактат-ацидоза в патогенезе стресс-индуцированной гипергликемии. Во второй группе пациентов (не получавших цитофлавин) данная связь была сильной (r = + 0,82), в первой группе — средней (r = + 0,52).
Уровень лактата артериальной крови в первой группе пациентов в большинстве случаев был измерен уже на фоне применения исследуемого препарата. На протяжении всех 3 сут средние значения лактата крови в первой группе не выходили за пределы нормы. Пациенты второй группы в первые сутки имели склонность к накоплению лактата в артериальной крови с последующей нормализацией данного показателя на вторые и третьи сутки. К сожалению, отсутствие статистически подтвержденных различий между группами, как и отсутствие данных о значении изучаемого показателя в первой группе до начала введения исследуемого препарата, не позволили в полной мере оценить влияние цитофлавина на уровень лактат-ацидоза у исследуемой категории пациентов.
Имеющиеся результаты анализа кислотно-основного состояния первой группы пациентов также в большинстве случаев были получены после начала терапии цитофлавином. Однако собранные данные всё же позволяют сделать вывод о том, что цитофлавин оказывает антиацидотический эффект, приводя к увеличению pH на вторые сутки использования и поддерживая показатель буферных оснований (BE) в пределах нормальных положительных значений (рис. 1, 2). Данный результат косвенно подтверждает то, что цитофлавин способствует более полному внутриклеточному окислению энергетических субстратов.
Таким образом, согласно результатам ретроспективного анализа 44 историй болезни пациентов с острым повреждением головного мозга, осложнившимся развитием стресс-индуцированной гипергликемии, препарат цитофлавин может рассматриваться как потенциальное метаболическое средство, снижающее выраженность гипергликемии и метаболического ацидоза у данной категории пациентов. Полученные данные могут служить основанием для проведения проспективного, рандомизированного клинического исследования для более точной оценки эффективности препарата, так как поиск новых, эффективных методов метаболической терапии пациентов в критических состояниях продолжает оставаться актуальной задачей медицины.
Вывод
Ретроспективный анализ показал, что цитофлавин снижает выраженность метаболического ацидоза у пациентов с острым повреждением головного мозга, осложнившимся развитием стресс-индуцированной гипергликемии.
Литература
- Анестезиология и реаниматология. Руководство для врачей, Ю. С. Полушин (ред.), Санкт-Петербург (2004).
- Е. А. Лебедева, А. А. Куртасов, М. Е. Белоусова и др., Эксперим. и клин. мед., 77(4), 42 - 44 (2014).
- Е. А. Ливанов, А. Н. Лодягин, А. Ю. Андрианов и др., Эксперим. и клин. мед., 76(11), 40 - 43 (2013).
- K. Asadollahi, N. Beeching, DrGeoffrey, J. Royal Soc. Med., № 11,503-507 (2016).
- G. Van den Berghe, P. J. Wouters, R. Bouillon, Crit. Care Med., №31,359-366 (2003).
- G. Van den Berghe, P. J. Wouters, F. Weekers. NEJM, № 345, 1359- 1367 (2001).
- D. Brealey, M. Singer, J. Diabetes. Sci. Technol., № 6, 1250- 1260 (2009).
- S. J. Finney, C. Zekveld, A. Elia, JAMA, №290, 2041 -2047 (2003).
Cytoflavin influence on metabolic acidosis in patients with acute brain damage complicated by stress-induced hyperglycemia
Nejmark M. I.1, Zaharchenko I. A.2, Abdrashitov R. B.2, Kovalenko A. L.3, Zaplutanov V. A.4, Valeev V. V.4
1 Altai State Medical University, pr. Lenina 40, Barnaul, 656038 Russia;
2 Regional Clinical Emergency Hospital, pr. Komsomol’skij 73 korpus2, Barnaul, 656038Russia;
3 ToxicologyInstituteof Federal Medical and Biological Agency, ul. Behtereva 1, Saint Petersburg, 192019Russia;
4 Institute of Evolutionary Physiology and Biochemistry named after I. M. Sechenov, Russian Academy of Sciences, pr. Toreza 44, Saint Petersburg, Russia194223.
We conducted a retrospective analysis of 44 case histories of patients with acute brain injury (traumatic brain injury, polytrauma, acute violation of cerebral circulation) who were in critical condition and receiving treatment in the departments of anesthesiology and intensive care. We evaluated the effect of citoflavin on the severity of stress-induced hyperglycemia and metabolic acidosis. In patients treated with cytoflavin (40 ml/day for two days by infusion pump) had a lower hyperglycemia compared with patients whose treatment did not include the study drug (p > 0.05). Cytoflavin has also contributed to the increase in pH of arterial blood on the second day of application (p<0.05) and maintaining the buffer capacity of the blood, which indicates cytoflavin ability to increase utilization and complete intracellular oxidation of nutrient substrates. The obtained results allow to consider cytoflavin as a potential medicine to reduce acute metabolic disturbances accompanying the development of the critical state.
Key words: stress-induced hyperglycemia; metabolic acidosis; acute brain injury; traumatic brain injury; stroke; cytoflavin.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)