Динамика когнитивных нарушений у пациентов с сахарным диабетом 2-го типа на фоне метаболической терапии
Статьи
Опубликовано в журнале:
Клиническая медицина. 2016; 94(7)
Гацких И.В.1, Петрова М.М.1, Шалда Т.П.1, Варыгина Е.Л.2, Кузнецов М.Н.1,2, Наркевич А.Н.1
1 ГБОУ ВПО «Красноярский государственный медицинский университет им проф. В.Ф. Войно-Ясенецкого» Минздрава России, 660022, г. Красноярск; 2 НУЗ «Дорожная клиническая больница на станции Красноярск ОАО "РЖД"», 660000, г. Красноярск
Целью настоящего исследования было изучение эффективности метаболической терапии в коррекции когнитивных нарушений у пациентов с сахарным диабетом 2-го типа.
Проведен анализ результатов лечения когнитивной дисфункции у 80 пациентов с диагнозом "сахарный диабет 2-го типа". Все пациенты получали базисную сахароснижающую терапию. Кроме того, 32 пациента (основная группа) дополнительно к базисной сахароснижающей терапии получали комплексный метаболический препарат цитофлавин ежедневно внутривенно капельно по 10 мл раствора, разведенного в 200 мл 0,9% раствора натрия хлорида, в течение 10 сут с переходом на таблетированную форму — по 2 таблетки (янтарная кислота 0,6 г, рибоксин 0,1 г, никотинамид 0,05 г, рибофлавин 0,01 г) 2 раза в сутки в течение 25 дней.
Группу сравнения составили 29 пациентов, которым, кроме базисной сахароснижающей терапии, был назначен курс метаболической терапии препаратом тиоктовой кислоты тиоктацидом, содержащим в 24 мл раствора 600 мг тиоктовой кислоты. Пациенты получали препарат ежедневно внутривенно капельно по 24 мл (600 мг) раствора, разведенного в 200 мл 0,9% раствора натрия хлорида, в течение 10 сут с переходом на таблетированную форму (тиоктацид БВ) по 1 таблетке 1 раз в сутки в течение 30 дней.
Контрольную группу составили 19 пациентов, получавших базисную сахароснижающую терапию без дополнительной метаболической терапии.
Включение в схему комплексной терапии пациентов с сахарным диабетом 2-го типа цитофлавина обеспечило более эффективную коррекцию когнитивных нарушений; отмечалось статистически значимое улучшение оптико-пространственной деятельности (р = 0,001), внимания (р = 0,001), абстрактного мышления (р = 0,046), памяти (р < 0,001) по сравнению с пациентами других групп, по показателям Монреальской шкалы оценки когнитивных функций (МоСа-тест). Положительная динамика выражалась в улучшении оптико-пространственной деятельности — на 9,8 ±10,3%, внимания — на 13,5±11,8%, абстрактного мышления — на 7±8,9%, памяти — на 23±14,6%.
При исследовании уровня мозгового нейротрофического фактора в сыворотке крови в динамике на фоне лечения препаратами метаболического ряда зафиксировано статистически значимое повышение этого показателя (р = 0,002) у пациентов, получавших цитофлавин, в отличие от показателей в группе сравнения (р = 0,139) и в контрольной группе (р = 0,078).
Полученные результаты свидетельствуют о влиянии цитофлавина на процессы нейропластичности в условиях гипергликемии, об улучшении церебральной микроциркуляции и церебропротекторном действии препарата.
Ключевые слова: мозговой нейротрофический фактор; когнитивные нарушения; Монреальская шкала оценки когнитивных функций (МоСа-тест); сахарный диабет 2-го типа; цитофлавин; коррекция.
Для цитирования: Гацких И.В., Петрова М.М., Шалда Т.П., Варыгина Е.Л., Кузнецов М.Н., Наркевич А.Н. Динамика когнитивных нарушений у пациентов с сахарным диабетом 2-го типа на фоне метаболической терапии. Клин. мед. 2016; 94 (7): 533—539. DOI 10.18821/0023-2149-2016-94-7-533-539
Dynamics of cognitive disorders in patients with type 2 diabetes mellitus under effect of metabolic therapy
Gatckikh I.V.1, Petrova M.M.1, Shalda T.P.1, Varygina E.L.2, Kuznecov M.N.1,2, Narkevich A.N.1
1 V.F.Voyno-Yasenetsky Krasnoyarsk State Medical University, 660022, Krasnoyarsk; 2 Railway Hospital st. Krasnoyarsk OAO «RJD», 660000, Krasnoyarsk, Russia
The aim of thisstudy was to investigatethe efficiency ofmetabolic therapyincorrectionof cognitive impairmentin patientswith type 2 diabetes. We undertook the analysis of results of the treatment of cognitive dysfunction in 80 patients with a diagnosis of type 2 diabetes. All patients received basic hypoglycemic therapy. 32 patients (study group) received in addition to the basal glucose lowering therapy daily intravenous infusion of 10 mlcytoflavindiluted in 200 ml of a 0.9% sodium chloride solution for 10 days, followed by 2 tablets b.i.d. for 25 days.The group of comparison consisted of 29 patients given in addition to the basal glucose-lowering therapy daily intravenous infusion of 24 ml (600 mg) thioctacid diluted in 200 mL of a 0.9% sodium chloride solution for 10 days. Thereafter, they received 1 tablet ofthioctacid BV once daily for 30 days. The control group consisted of 19 patients who received basic hypoglycemic therapy without additional metabolic therapy.Inclusion of cytoflavin in the combined treatment of patients with type 2 diabetes ensured a more effective correction of cognitive impairment. There was a statistically significant improvement in optical-spatial activities (p = 0.001), attention (p = 0.001), abstract thinking (p = 0.046), and memory ( p<0.001) compared to those in other groups, according to the MOS test. Positive dynamics was expressed as the improvement of the optical-spatial activities by 9,8 ± 10,3%, attention by 13,5 ± 11,8%, abstract thinking by 7,0 ± 8,9%, and memory by 23.0 ± 14 6%. The study of variations of the serum level of brain neurotrophic factor (BDNF) over time during the treatment with metabolic preparations revealedits statistically significant increase (p = 0.002) in the patients treated with cytoflavincompared with comparison (p = 0.139) and control (p = 0.078) groups. These results suggest the influence of cytoflavinon the processes of neuroplasticity under conditions of hyperglycemia, improvement of cerebral microcirculation and cerebroprotective action of this medication.
Keywords: brain-derived neurotrophic factor (BDNF); cognitive impairment; MOS test; type 2 diabetes;cytoflavin correction.
Citation: Gatckikh I.V., Veselova O.F., Brickman I.N., Shalda T.P., Varygina E.L.,Kuznecov M.N., Narkevich A.N., Petrova M.M. Dynamics of cognitive disorders in patients with type 2 diabetes mellitus under effect of metabolic therapy. Klin. med. 2016; 94 (7): 533—539. DOI 10.18821/0023-2149-2016-94-7-533-539
Сахарный диабет (СД) 2-го типа — это тяжелое метаболическое заболевание, характеризующееся хронической гипергликемией, которая является результатом нарушения секреции инсулина, действия инсулина или обоих этих факторов, и сопровождающееся поражением различных органов-мишеней [1]. В результате метаболических нарушений при СД 2-го типа, вызванных гипергликемией, формируются расстройства различных органов и систем организма, в том числе и центральной нервной системы; последнее проявляется клинически значимой когнитивной дисфункцией [2—10]. Когнитивная дисфункция является частым осложнением СД 2-го типа, в значительной степени ухудшающим качество жизни и повседневное функционирование пациентов, а также оказывающим влияние на приверженность больных к терапии (комплаентность).
Важным и актуальным вопросом сегодня является вопрос фармакотерапии когнитивных нарушений (КН) у пациентов с СД 2-го типа.
Исследований, посвященных вопросам фармакотерапии когнитивных нарушений при СД 2-го типа, а именно оценке ее эффективности, достаточно мало, и результаты их противоречивы. Обычно в коррекции когнитивных нарушений при СД 2-го типа используется стандартный подход к терапии указанных осложнений. Поэтому актуальным является поиск объективных маркеров эффективности фармакотерапии при коррекции когнитивных нарушений у пациентов с СД 2-го типа.
Цель исследования — оценить динамику когнитивных нарушений у пациентов с СД 2-го типа на фоне метаболической терапии.
Материал и методы
Настоящее исследование выполнено в рамках научного проекта «Разработка метода диагностики и коррекции когнитивных нарушений у пациентов с СД 2-го типа» при финансовой поддержке грант-программы «УМНИК» (2015 г.) Фонда Бортника.
Исследование проведено на клинических базах кафедры фармакологии с курсами клинической фармакологии, фармацевтической технологии и последипломного образования ГБОУ ВПО «Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого» Минздрава России, НУЗ «Дорожная клиническая больница на станции Красноярск ОАО "РЖД"», МБУЗ «Городская поликлиника № 7 Красноярска», ООО «Лечебно-диагностическая клиника "Медицина компьютерных технологий"».
Протокол настоящего исследования утвержден комитетом по этике Красноярского государственного медицинского университета им. проф. В.Ф. Войно-Ясенецкого (протокол от 27.05.2015 № 62/2015), пациентами подписано информированное согласие на участие в исследовании.
Проведено сравнительное рандомизированное проспективное (метод конвертов) исследование эффективности метаболической терапии в коррекции когнитивных нарушений у пациентов с СД 2-го типа.
С целью коррекции КН у пациентов с СД 2-го типа использованы лекарственные препараты метаболического ряда, содержащие в своем составе тиоктовую или янтарную кислоту. Препараты назначали пациентам с подтвержденным когнитивным дефицитом — с показателями Монреальской шкалы оценки когнитивных функций (МоСа-тест) 20—26 баллов— на фоне базисной сахароснижающей терапии.
Пациенты были разделены на 3 параллельные группы; основную группу составили 32 пациента, которым, кроме базисной сахароснижающей терапии, был назначен курс метаболической терапии с использованием комбинированного препарата янтарной кислоты цитофлавина, содержащего в качестве активных компонентов в 1 мл раствора янтарную кислоту (100 мг), никотинамид (10 мг), рибоксин (20 мг), рибофлавина монокуклеотид (2 мг). Пациенты получали препарат ежедневно внутривенно капельно по 10 мл раствора, разведенного в 200 мл 0,9% раствора натрия хлорида, в течение 10 сут с переходом на таблетированную форму — по 2 таблетки 2 раза в сутки в течение 25 дней. Прием препарата осуществлялся утром натощак.
Группу сравнения составили 29 пациентов, которым, кроме базисной сахароснижающей терапии, был назначен курс метаболической терапии препаратом тиоктовой кислоты тиоктацидом, содержащим в 24 мл раствора 600 мг тиоктовой кислоты.
Пациенты получали препарат ежедневно внутривенно капельно по 24 мл (600 мг) раствора, разведенного в 200 мл 0,9% раствора натрия хлорида, в течение 10 сут с переходом на таблетированную форму (тиоктацид БВ) — по 1 таблетке 1 раз в сутки в течение 30 дней. Прием препарата осуществлялся утром натощак.
Контрольную группу составили 19 пациентов, получавших базисную сахароснижающую терапию без дополнительной метаболической терапии.
Группы наблюдения были сопоставимы по полу, возрасту, индексу массы тела (ИМТ), уровню образования, длительности заболевания, степени компенсации СД 2-го типа (табл. 1).
Таблица 1
Характеристика групп пациентов с СД 2-го типа
| Показатель |
Основная группа (n = 32) |
Группа сравнения (n = 2929) |
Контрольная группа (n = 19) |
р |
| Пол, n (%, M±m): |
|
|
|
|
| мужской |
9 (28,1±15,6) |
8 (27,6±16,3) |
7 (36,8±21,7) |
0,757 |
| женский |
23 (71,9±15,8 |
)21 (72,4±16,3) |
12 (63,2±21,7) |
|
| Возраст, годы (Me [Q1; Q3]) |
61,0 [57,3; 67,0] |
62,0 [54,5; 65,0] |
62,0 [58,0; 67,0] |
0,899 |
| ИМТ, кг/м² (Me [Q1; Q3]) |
31,5 [29,0; 34,7] |
32,0 [28,0; 34,5] |
33,0 [29,0; 36,0] |
0,975 |
| Гликемия натощак, ммоль/л (Me [Q1; Q3]) |
5,7 [4,7; 7,2] |
6 [5,1; 7,3] |
7 [5,5; 7,6] |
0,945 |
| HBA1c,% (Me [Q1; Q3]) |
7,0 [6,3; 7,8] |
7,0 [6,5; 7,5] |
7,0 [6,4; 7,5] |
0,970 |
| Длительность СД 2-го типа, годы (Me [Q1; Q3]) |
7,0 [5,0; 10,0] |
6,0 [5,0; 14,0] |
9,0 [6,0; 12,0] |
0,638 |
Примечание. Здесь и в табл. 2—6: значимость различий между группами на уровне p < 0,05.
У всех пациентов с целью оценки эффективности метаболической терапии за 24 ч до начала лечения и после 35—40 сут терапии проведено нейропсихологическое тестирование с использованием Монреальской шкалы оценки когнитивных функций (МоСа-тест) и определен уровень мозгового нейротрофического фактора (BDNF) в сыворотке крови в динамике с помощью иммуноферментного анализа (ИФА) с использованием набора Human BDNF Quantikine ELISA (Германия).
Критерии включения: пациенты с СД 2-го типа, существующим более 12 мес.
Критерии исключения: гипогликемические и/или кетоацидотические комы за последние 2 мес до исследования; гипотиреоз; тяжелые или нестабильные сопутствующие соматические заболевания в настоящее время; перенесенные нейроинфекции; острое нарушение мозгового кровообращения (за предшествующие 6 мес до исследования); состояния после тяжелых черепно-мозговых травм и операций; стенокардия напряжения IV функционального класса по NYHA; хроническая обструктивная болезнь легких в стадии декомпенсации; бронхиальная астма в стадии декомпенсации; прием ноотропных или психотропных препаратов в настоящее время; гематологические, онкологические, серьезные инфекционные и травматические заболевания; участие в других клинических исследованиях в настоящее время.
Применяли следующие методы исследования.
- Клинические методы: ретроспективный анализ медицинской документации (истории болезни, амбулаторные карты); жалобы; анамнез жизни и болезни; объективное обследование по общепринятой методике стандартного терапевтического обследования: измерение артериального давления (метод С.Н. Короткова), аускультация сердца, исследование магистральных сосудов головы и шеи, исследование пульса, аускультация легких, пальпация живота, расчет ИМТ по формуле Кетле: ИМТ = масса тела, кг/рост, м². В соответствии с критериями ВОЗ при значении ИМТ 30 кг/м² или более диагностировали ожирение соответствующей степени. Учитывали данные о сопутствующих сердечно-сосудистых заболеваниях (артериальная гипертония — АГ, ишемическая болезнь сердца — ИБС). Проводили диагностику типичных осложнений СД 2-го типа — поражения органов-мишеней, консультации офтальмолога, невролога (углубленный неврологический осмотр).
- Лабораторные методы: общий анализ крови, общий анализ мочи, определение концентрации в крови глюкозы, гликированного гемоглобина (HbA1c), мочевины, креатинина, липидного спектра, скорости клубочковой фильтрации), рассчитанной по формуле Кокрофта—Голта, тест на микроальбуминурию, концентрацию BDNF проводили путем твердофазного ИФА по стандартному протоколу с использованием набора Human BDNF Quantikine ELISA на спектрофотометре Thermo Scientific Multiskan FC (Thermo Fisher Scientific Inc., Финляндия). Диапазон измерения: 62,5 — 4000 пг/мл (0,0626 — 4 нг/мл). Чувствительность: 20 пг/мл (0,02 нг/мл) [11].
- Инструментальные методы: ультразвуковую допплерографию экстракраниальных отделов брахиоцефальных артерий (БЦА) на аппарате PHILIPS HD 7 (Нидерланды), выполняли по стандартной методике. Исследования проводили для исключения или подтверждения гемодинамически значимого стеноза БЦА (более 70%) и для выявления эхографических признаков асимметрии скорости кровотока по БЦА.
- Нейропсихологические методы: скрининг когнитивных нарушений проводили с помощью Монреальской шкалы оценки когнитивных функций (МоСа-тест).
- Методы статистической обработки: статистическую обработку полученных данных проводили с использованием программного пакета IBMSPSS Statistics версия 19.0. Проверку на нормальность распределения количественных признаков осуществляли с помощью W-теста Шапиро—Уилка. Все количественные данные не подчинялись закону нормального распределения. В связи с этим количественные данные представлены в виде медианы, а также первого и третьего квартилей— Me (Me [Q1; Q3]). Статистическую значимость различий между двумя группами по количественным признакам определяли с помощью критерия U Манна—Уитни, а по номинальным признакам — критерия χ². Статистическую значимость различий между тремя группами по количественным признакам определяли с помощью критерия H Краскела—Уоллиса. Для оценки связи между количественными признаками использовали коэффициент корреляции Спирмена. Полученные результаты считались статистически значимыми при уровне значимости менее 0,05 ( р < 0,05).
Результаты и обсуждение
Основными жалобами пациентов до лечения были нарушение памяти на текущие события, снижение работоспособности, головная боль, головокружение и эмоциональная лабильность.
Анализ степени компенсации СД 2-го типа в группах с учетом индивидуальных значений HbA1c, возраста, ожидаемой продолжительности жизни, наличия тяжелых осложнений и риска тяжелой гипогликемии показал, что в основной группе (цитофлавин) не достигли индивидуальных целей лечения 8 (25±15%) пациентов, в группе сравнения — 6 (20,7±14,7%), в контрольной группе — 5 (26,3±19,8%) пациентов (р = 0,970).
Оценивали характер базисной сахароснижающей терапии в группах. Так, в основной группе (цитофлавин) 26 (81,3±13,5%) пациентов получали монотерапию пероральными сахароснижающими препаратами, 5 (15,6±13,2%) — инсулинотерапию, 1 (3,1±7,8%) — комбинированную терапию). В группе сравнения (тиоктацид) монотерапию пероральными сахароснижающими препаратами получали 23 (79,3±14%) пациента, инсулинотерапию — 3 (10,3±11,1%), комбинированную терапию — 3 (10,3±13,7%) пациента. В контрольной группе монотерапию пероральными сахароснижающими препаратами получали 16 (84,2±16,4%) пациентов, инсулинотерапию — 3 (15,8±16,4%).
Во всех группах учитывалось наличие сопутствующих сердечно-сосудистых заболеваний в группах наблюдения, таких как АГ и ИБС (рис. 1). По наличию указанных заболеваний группы статистически значимо не различались (p = 0,197, р = 0,231).
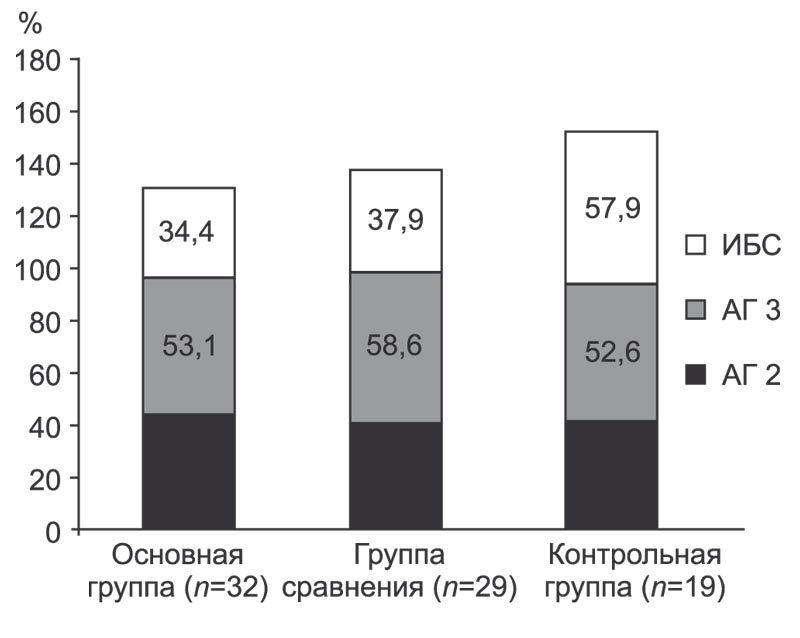
Рис. 1. Соотношение сопутствующих сердечно-сосудистых заболеваний в группах наблюдения.
Характеристика параметров углеводного обмена не показала различий показателей в группах. Средний уровень HbA1c в основной группе составил 7 [6,3; 7,8]%, в группе сравнения — 7 [6,5; 7,5]%, в контрольной группе — 7 [6,4; 7,5]% (р = 0,970).
Оценивались показатели липидного обмена в группах наблюдения, статистически значимое отличие наблюдалось только в группе сравнения (тиоктацид) по уровню липопротеинов высокой плотности (р = 0,045), по остальным параметрам различий между группами не выявлено (табл. 2).
Таблица 2
Показатели липидного спектра у пациентов с СД 2-го типа в группах наблюдения (Me [Q1; Q3])
| Показатель |
Основная группа (n = 32) |
Группа сравнения (n = 29) |
Контрольная группа (n = 19) |
р |
| Общий холестерин, ммоль/л |
5,5 [4,7; 6,1] |
5,5 [4,9; 6,0] |
5,5 [4,5; 6,0] |
0,863 |
| Триглицериды, ммоль/л |
1,9 [1,6; 2,8] |
1,8 [1,4; 2,8] |
1,9 [1,3; 2,7] |
0,833 |
| Липопротеины высокой плотности, ммоль/л |
1,2 [1,1; 1,6] |
1,1 [1,0; 1,4] |
1,3 [1,2; 1,5] |
0,045 |
| Липопротеины низкой плотности, ммоль/л |
3,2 [2,2; 3,7] |
3,1 [2,5; 3,8] |
2,9 [2,3; 3,7] |
0,767 |
| Коэффициент атерогенности |
3,4 [2,6; 4,2] |
3,6 [2,8; 4,1] |
3,0 [2,1; 3,6] |
0,191 |
Среди групп наблюдения у пациентов с СД 2-го типа проведена оценка специфических диабетических осложнений органов-мишеней разной степени выраженности. Так, наиболее частым осложнением во всех группах была диабетическая полинейропатия в форме сенсомоторных нарушений: основная группа — у 31 (96,9±6%), группа сравнения — у 26 (89,7 ±11,1%), контрольная группа — у 18 (94,7±10%) пациентов. Второе место занимала непролиферативная диабетическая ретинопатия: основная группа — у 16 (50,0±17,3)%, группа сравнения — у 9 (31,0±16,8%), контрольная группа — у 11 (57,9±22,2%) пациентов. Третье место занимала диабетическая нефропатия: основная группа — у 9 (28,1±15,5%), группа сравнения — у 9 (31±16,8%), контрольная группа — у 2 (10,6±13,8%) пациентов (рис. 2).
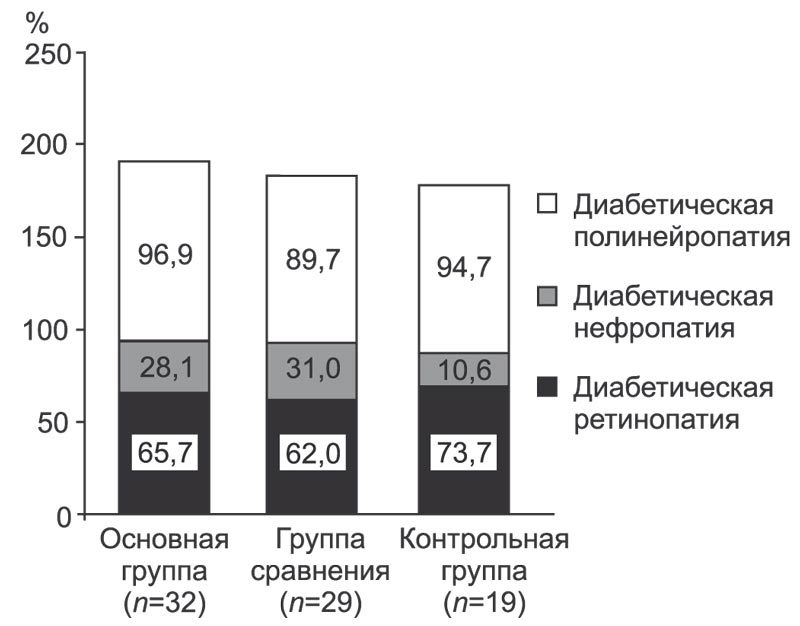
Рис. 2. Структура диабетических осложнений (поражения органов-мишеней) в группах наблюдения.
У всех пациентов с целью оценки эффективности метаболической терапии за 24 ч до начала и после 35—40 сут терапии проведено нейропсихологическое тестирование с использованием МоСа-теста и определен уровень BDNF в сыворотке крови в динамике с помощью ИФА с использованием набора Human BDNF Quantikine ELISA (Германия).
При объективной оценке влияния метаболической терапии на когнитивные нарушения у пациентов с СД 2-го типа выявлено, что у пациентов, получавших цитофлавин, отмечалось статистически значимое улучшение оптико-пространственной деятельности (р = 0,001), внимания (р = 0,001), абстрактного мышления (р = 0,046), памяти (р < 0,001) по сравнению с пациентами других групп.
Средний показатель МоСа-теста к окончанию периода наблюдения претерпел статистически значимую положительную динамику в указанной терапевтической группе (р < 0 ,001). По другим показателям МоСа-теста значимой динамики не выявлено (табл. 3). При этом увеличение суммарного показателя МоСа-теста в основной группе (цитофлавин) к окончанию периода наблюдения было достоверно выше, чем в других группах (р < 0,001; р = 0,276; р = 0,161; см. табл. 3—5).
Таблица 3
Характеристика показателей МоСа-теста у пациентов с СД 2-го типа на фоне метаболической терапии цитофлавином (основная группа), Me [Q1; Q3]
| Показатель МоСа-теста |
Основная группа (n = 32) |
р |
| до лечения |
после лечения |
| Оптико-пространственная деятельность |
4,0 [3,0; 4,0] |
4,0 [3,0; 4,0] |
0,001 |
| Называние |
3,0 [3,0; 3,0] |
3,0 [3,0; 3,0] |
0,317 |
| Внимание |
4,0 [3,3; 5,0] |
5,0 [4,0; 6,0] |
0,001 |
| Речь |
3,0 [2,0; 3,0] |
3,0 [3,0; 3,0] |
0,180 |
| Абстрактное мышление |
2,0 [2,0; 2,0] |
2,0 [2,0; 2,0] |
0,046 |
| Память |
4,0 [3,0; 4,0] |
4,0 [4,0; 4,0] |
< 0,001 |
| Ориентировка |
6,0 [6,0; 6,0] |
6,0 [6,0; 6,0] |
1,0 |
| Сумма баллов |
25,0 [23,3; 26,0] |
27,0 [25,0; 28,0] |
< 0,001 |
Улучшение показателей внимания свидетельствует о положительном влиянии цитофлавина на функцию непроизвольного внимания.
Показатели кратковременной памяти на заучивание и отсроченное самостоятельное воспроизведение 5 слов значимо улучшились на фоне терапии цитофлавином. Такой результат свидетельствует об улучшении мнестических нарушений динамического типа и прочности запоминания на фоне проводимой терапии.
Также значимо повысились показатели контруктивного праксиса (тест рисования часов) и интеллектуальной гибкости (ломаная линия — последовательное соединение цифр и букв) на фоне метаболической терапии с использованием цитофлавина.
В группе сравнения (тиоктацид) и в контрольной группе значимой динамики показателей МоСа-теста не выявлено (см. табл. 4 и 5).
Таблица 4
Характеристика параметров МоСа-теста у пациентов с СД 2-го типа на фоне метаболической терапии тиоктацидом (группа сравнения), Me [Q1; Q3]
| Показатель МоСа-теста |
Группа сравнения (n = 29) |
р |
| до лечения |
после лечения |
| Оптико-пространственная деятельность |
4,0 [3,0; 4,0] |
4,0 [3,0; 4,0] |
0,059 |
| Называние |
3,0 [3,0; 3,0] |
3,0 [3,0; 3,0] |
1,0 |
| Внимание |
4,0 [4,0; 5,0] |
5,0 [4,0; 5,0] |
0,356 |
| Речь |
3,0 [2,0; 3,0] |
3,0 [2,0; 3,0] |
1,0 |
| Абстрактное мышление |
2,0 [2,0; 2,0] |
2,0 [2,0; 2,0] |
1,0 |
| Память |
4,0 [3,0; 4,0] |
3,0 [3,0; 4,0] |
0,346 |
| Ориентировка |
6,0 [6,0; 6,0] |
6,0 [6,0; 6,0] |
1,0 |
| Сумма баллов |
25,0 [23,0; 26,0] |
25,0 [23,0; 25,5] |
0,276 |
Таблица 5
Характеристика показателй МоСа-теста у пациентов с СД 2-го типа без метаболической терапии (контрольная группа), Me [Q1; Q3]
| Показатель МоСа-теста |
Контрольная группа (n = 19) |
р |
| до лечения |
после лечения |
| Оптико-пространственная деятельность |
3,0 [2,0; 4,0] |
3,0 [2,0; 4,0] |
1,0 |
| Называние |
3,0 [3,0; 3,0] |
3,0 [3,0; 3,0] |
0,317 |
| Внимание |
5,0 [4,0; 6,0] |
5,0 [4,0; 5,0] |
0,129 |
| Речь |
3,0 [2,0; 3,0] |
3,0 [2,0; 3,0] |
0,317 |
| Абстрактное мышление |
2,0 [2,0; 2,0] |
2,0 [2,0; 2,0] |
1,0 |
| Память |
4,0 [3,0; 4,0] |
3,0 [3,0; 4,0] |
0,492 |
| Ориентировка |
6,0 [6,0; 6,0] |
6,0 [6,0; 6,0] |
1,0 |
| Сумма баллов |
26,0 [24,0; 27,0] |
24,0 [23,0; 27,0] |
0,161 |
Безопасность и переносимость проводимой терапии была хорошей во всех группах наблюдения. Наиболее распространенным побочным эффектом были диспептические явления в виде тошноты при пероральном приеме тиоктацида.
Указанное нежелательное явление зафиксировано у 4 (13,7%) пациентов, было умеренно выраженным и не требовало прекращения терапии.
Нами был определен уровень BDNF в сыворотке крови в динамике на фоне лечения препаратами метаболического ряда. Зафиксировано статистически значимое повышение концентрации BDNF в сыворотке крови у пациентов, получавших цитофлавин, в отличие от показателей в группе сравнения и контроля (р = 0,002; табл. 6, рис. 3). Полученный результат свидетельствует о влиянии цитофлавина на процессы нейропластичности в условиях гипергликемии и о его церебропротекторном действии.
Таблица 6
Динамика уровня BDNF у пациентов с СД 2-го типа на фоне метаболической терапии (Me [Q1; Q3])
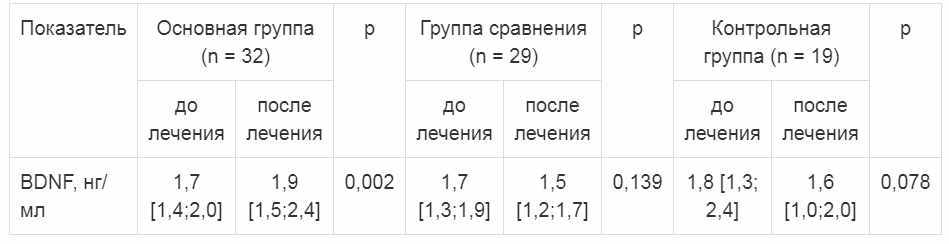
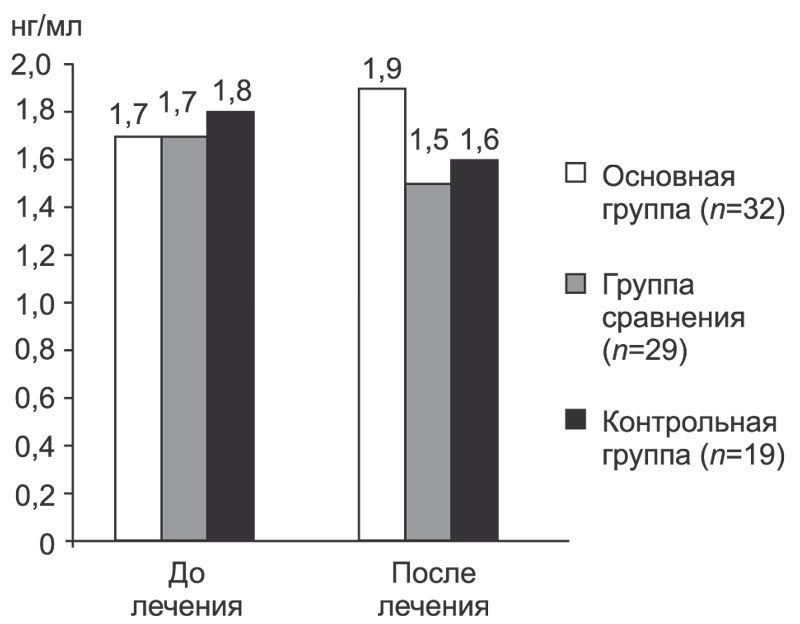
Рис. 3. Динамика уровня BDNF в группах наблюдения на фоне метаболической терапии.
Проведенное исследование показало, что когнитивные нарушения у пациентов с СД 2-го типа претерпевают положительную динамику при лечении комбинированным препаратом янтарной кислоты — цитофлавином, воздействующим на церебральную микроциркуляцию, нейрометаболические процессы и оказывающим церебропротекторное действие.
Положительная динамика выражалась в улучшении результатов нейропсихологического тестирования (МоСа-тест) по таким параметрам, как оптико-пространственная деятельность — на 9,8 ±10,3%, внимание — на 13,5±11,8%, абстрактное мышление — на 7±8,9%, память — на 23±14,6%.
Также отмечено уменьшение выраженности когнитивных расстройств по собственной субъективной оценке пациента в данной терапевтической группе.
Применение препарата цитофлавин в комплексной терапии СД 2-го типа сопровождалось повышением концентрации BDNF в сыворотке крови в отличие от показателей в группе сравнения и контрольной группе, что свидетельствует о церебропротекторном действии препарата и воздействии на процессы нейропластичности.
Следует подчеркнуть, что на сегодняшний день сохраняются методологические трудности оценки эффективности терапии на этапе недементных когнитивных нарушений. Прежде всего это связано с отсутствием общепринятого протокола клинических исследований указанных состояний, что привело к тому, что большинство производителей лекарственных средств воздерживаются от проведения крупных рандомизированных исследований по этому показанию.
С нашей точки зрения, перспективным может стать дальнейшее изучение эффективности комбинированного препарата метаболического ряда цитофлавина с использованием двойного слепого плацебо-контролируемого метода и с изучением уровня BDNF как маркера эффективности терапии.
Следует отметить, что с учетом фармакологических мишеней воздействия цитофлавина он может быть использован одновременно с базисной терапией СД 2-го типа и не обусловливает лекарственного взаимодействия.
Выводы
- Включение в схему комплексной терапии пациентов с сахарным диабетом 2-го типа и когнитивной дисфункцией препарата цитофлавина способствовало коррекции когнитивной дисфункции, что выражалось нейропсихологического тестирования (МоСа-тест): оптико-пространственной деятельности — на 9,8±10,3%, внимания — на 13,5±11,8%, абстрактного мышления — на 7±8,9%, памяти — на 23±14,6% (р < 0,001).
- Применение цитофлавина в комплексной терапии пациентов с сахарным диабетом 2-го типа сопровождалось статистически значимым (р = 0,002) повышением концентрации мозгового нейротрофического фактора в сыворотке крови в динамике в отличие от показателей в группе сравнения (р = 0,139) и контрольной группе (р = 0,078).
- Полученные данные свидетельствуют о воздействии цитофлавина на церебральную микроциркуляцию, нейропластичность в условиях гипергликемии и церебропротекцию.
Литература
- Дедов И. И., Шестакова М. В., Александров А. А. Алгоритмы специализированной медицинской помощи больным сахарным диабетом (6-й выпуск). Сахарный диабет. 2013; Прил. 1: 1—121.
- Бокербаев Т.Т. Диабетическая энцефалопатия: вопросы диагностики и патогенеза [Электронный ресурс]. Вестник КАЗНМУ. 2011; 1—2. Режим доступа: kaznmu.kz/press/2011/10/06/.
- Гацких И.В., Веселова О.Ф., Брикман И.Н., Шалда Т.П. и др. Когнитивные нарушения при сахарном диабете 2 типа [Электронный ресурс]. Современные проблемы науки и образования. 2015; 4: Режим доступа: science-education.ru/ru/article/view
- Маркин С.П. Неврологические проявления сахарного диабета. Consilium medicum. Неврология/ревматология. 2011; 1: 60—3.
- Маркин С.П. Поражение нервной системы у пациентов с сахарным диабетом. Журнал неврологии и психиатрии им. С.С. Корсакова. 2012; 5: 77—80.
- Петрова М.М., Прокопенко С. В., Пронина Е.А. Когнитивные и эмоциональные нарушения у пациентов с сахарным диабетом типа 2. Сибирское медицинское обозрение. 2008; 4: 83—5.
- Товажнянская Е.Л. Умеренные когнитивные нарушения при сахарном диабете 2-го типа. Международный медицинский журнал. 2012; 1: 6—9.
- Чугунов П.А., Семенова И.В. Сахарный диабет и когнитивные нарушения. Сахарный диабет. 2008: 1 (38): 61—8.
- Craft S. The Role of Metabolic Disorders in Alzheimer Disease and Vascular Dementia. Arch. Neurol. 2009; 66: 300—5.
- Mijnhout G.S., Scheltens P., Diamant M. et al. Diabetic encephalopathy: a concept in need of a definition. Diabetologia. 2006; 49: 1447—8.
- Barde Y.A., Davies A.M., Johnson J.E. et al. Brain derived neurotrophic factor. Prog. Brain Res. 1987; 71: 185—9.
References
- Dedov I.I., Shestakova M.V., Aleksandrov A.A. Algorithms specialized medical care to patients with diabetes mellitus (6th edition). Sakharnyy diabet. 2013; Pril. 1: 1—121. (in Russian)
- Bokerbaev T.T. Diabetic encephalopathy: pathogenesis and diagnosis of issues [electronic resource]. Vestnik KAZNMU. 2011. Available at: kaznmu.kz/press (accessed 6 October 2011). (in Russian)
- Gatskikh I.V. Cognitive impairment in diabetes mellitus type 2 [electronic resource]. Sovremennye problemy nauki i obrazovaniya. 2015; 4. Available at: science-education.ru/ru/article/view (in Russian)
- Markin S.P. Neurologic manifestations of diabetes. Consilium medicum. Nevrologiya/revmatologiya. 2011; 1: 60—3. (in Russian)
- Markin S.P. The defeat of the nervous system in patients with diabetes. Zhurnal nevrologii i psikhiatrii im. S.S. Korsakova. 2012; 5: 77—80. (in Russian)
- Petrova M.M. Cognitive and emotional disorders in patients with diabetes mellitus type 2. Sibirskoe meditsinskoe obozrenie. 2008; 4: 83—5. (in Russian)
- Tovazhnyanskaya E.L. Mild cognitive impairment in type 2 diabetes. Mezhdunarodnyy meditsinskiy zhurnal. 2012; 1: 6—9. (in Russian)
- Chugunov P.A. Diabetes mellitus and cognitive impairment. Sakharnyy diabet. 2008; 1: 61—8. (in Russian)
- Craft S. The Role of Metabolic Disorders in Alzheimer Disease and Vascular Dementia. Arch. Neurol. 2009; 66: 300—5.
- Mijnhout G.S., Scheltens P., Diamant M. et al. Diabetic encephalopathy: a concept in need of a definition. Diabetologia. 2006; 49: 1447—8.
- Barde Y.A., Davies A.M., Johnson J.E. et al. Brain derived neurotrophic factor. Prog. Brain Res. 1987; 71: 185—9.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)