Нейрометаболическая терапия у пациентов с COVID-19-ассоциированной энцефалопатией
Статьи
П. В. Дунц1,4, О. В. Военнов2,3, К. В. Мокров2,3, А. В. Турентинов3, П. Ю. Горожин4
1Тихоокеанский государственный медицинский университет, г. Владивосток, РФ
2Приволжский исследовательский медицинский университет, г. Нижний Новгород, РФ
3Городская больница № 33, г. Нижний Новгород, РФ
4Краевая клиническая больница № 2, г. Владивосток, РФ
Цель: оценить эффективность нейрометаболической терапии у пациентов с тяжелым течением новой коронавирусной инфекции COVID-19, осложненной развитием энцефалопатии.
Материал и методы. Проведено пилотное проспективное исследование с участием 61 пациента с тяжелым течением COVID-19, осложненным развитием энцефалопатии. Методом рандомизации пациенты распределены в две группы: исследуемую (n = 34), больные которой, в отличие от контрольной (n = 27), получили дополнительно к основной терапии цитофлавин в суточной дозе 40 мл длительностью 5 дней. Динамику общего и неврологического статуса оценивали на момент включения в исследование, на 3-4-е и 6-7-е сут лечения с помощью шкал NEWS (National Early Warning Score), комы Глазго и ICDSC (Intensive Care Delirium Screening Checklist). Дополнительно исследовали уровень нейронспецифической енолазы (NSE) в крови исходно и на 6-7-е сут.
Результаты. Пациенты в большинстве случаев были пожилого или старческого возраста с высоким индексом коморбидности (до 4 баллов по Charlson). Устойчивость проявлений делирия коррелировала с возрастом и низким уровнем SpO2. В половине случаев (50,8%) заболевание имело неблагоприятный исход. В исследуемой группе к 6-7-му дню лечения наблюдались статистически значимая положительная динамика общего состояния, оцениваемого по шкале NEWS (p = 0,012), тенденция к более быстрому регрессу делириозной симптоматики - по шкале ICDSC (p = 0,055), при сопоставлении с группой сравнения и к восстановлению уровня сознания - увеличение общего балла по шкале Глазго (p = 0,083).
Выводы. Учитывая высокий риск неблагоприятного исхода у пациентов с тяжелым течением COVID-19, осложненным развитием энцефалопатии и делирия, дополнительное применение цитофлавина является целесообразным, поскольку способствует регрессу симптомов делирия и может оказывать положительное влияние на течение заболевания.
Ключевые слова: COVID-19, энцефалопатия, делирий, ICDSC, NSE, цитофлавин
Для цитирования: Нейрометаболическая терапия у пациентов с COVID-19-ассоциированной энцефалопатией / П. В. Дунц, О. В. Военнов, К. В. Мокров [и др.] // Вестник анестезиологии и реаниматологии. – 2021. – Т. 18. – № 6. – С. 30-37. – DOI 10.21292/2078-5658-2021-18-6-30-37. – EDN TLCXGZ.
Neurometabolic Therapy in Patients with Encephalopathy Associated with COVID-19
P. V. Dunts1,4, O. V. Voennov2,3, K. V. Mokrov2,3, А. V. Turentinov3, P. YU. Gorozhin4
1Pacific State Medical University, Vladivostok, Russia
2Privolzhskiy Research Medical University, Nizhny Novgorod, Russia
3City Hospital no. 33, Nizhny Novgorod, Russia
4Regional Clinical Hospital no.2, Vladivostok, Russia
The objective: to evaluate the effectiveness of neurometabolic therapy in patients with severe course of the new coronavirus infection of COVID-19 complicated by the development of encephalopathy.
Subjects and Methods. A pilot prospective study was carried out with the participation of 61 patients with a severe course of COVID-19 complicated by encephalopathy. The patients were randomized into two groups: the study group (n = 34), the patients in which, in contrast to the control group (n = 27), received Cytoflavin in addition to the main therapy in a daily dose of up to 40 ml for 5 days. The dynamics of the general and neurological status was assessed on days 3-4 and 6-7 days of treatment using the NEWS (National Early Warning Score), Glasgow coma and ICDSC (Intensive Care Delirium Screening Checklist) scales. Additionally, the blood level of neuron-specific enolase (NSE) was investigated at baseline and on days 6-7.
Results. Patients in most cases were elderly or senile with a high comorbidity index (up to 4 points according to Charlson). The persistence of delirious symptoms correlated with their age and low SpO2 levels. In half of the cases (50.8%), the disease had an unfavorable outcome. In the study group, by the 6-7th day of treatment, there was a significant positive dynamics of the general condition, assessed by the NEWS scale (p = 0.012), a tendency towards a faster recovery of the overall score on the Glasgow scale (p = 0.083), a tendency towards more rapid regression of delirious symptoms by ICDSC scale (p = 0.055) versus the comparison group.
Conclusions. Given the high risk of an unfavorable outcome in patients with a severe course of COVID-19 complicated by the development of encephalopathy, the additional use of Cytoflavin is advisable since it contributes to the regression of the symptoms of encephalopathy and may have a positive effect on the course of the disease.
Key words: COVID-19, encephalopathy, delirium, ICDSC, NSE, Cytoflavin
По мере накопления данных становится очевидным, что новая коронавирусная инфекция COVID-19 - это системное заболевание, которое поражает не только респираторный тракт, но и другие ткани организма человека, включая центральную нервную систему (ЦНС). Одним из частых неврологических осложнений COVID-19 является энцефалопатия - диффузная дисфункция головного мозга, проявляющаяся растерянностью, смятением, когнитивными нарушениями, спутанностью или угнетением сознания, ажитацией, судорожным синдромом, развитием делирия [10, 12, 16]. По данным разных исследований, частота энцефалопатии у пациентов с тяжелой формой COVID-19 составляет от 9 до 32%, а при крайне тяжелом течении заболевания может достигать 69% [11, 13].
По мнению некоторых авторов, COVID-19-ас-социированная энцефалопатия развивается вследствие гипоксии головного мозга и его токсического повреждения на фоне метаболических сдвигов, вызванных дыхательной недостаточностью и системным воспалительным ответом, т. е. носит характер токсико-метаболической энцефалопатии (ТМЭ) [10, 11, 13]. Также не исключается прямое воздействие вируса на головной мозг: нейротропность коронавирусов была выявлена ранее - при исследовании случаев атипичной пневмонии и ближневосточного респираторного коронавирусного синдрома [14, 15, 20], а в начале марта 2020 г., когда впервые сообщили о случае энцефалита на фоне COVID-19, было подтверждено наличие вируса в спинномозговой жидкости пациента [15].
В большинстве случаев клиническая картина энцефалопатии развивается по мере прогрессирования заболевания. В исключительных случаях, чаще у пожилых и пациентов старческого возраста, помрачение сознания в виде делирия может возникнуть уже в самом начале болезни [10, 13]. Развитие энцефалопатии увеличивает продолжительность лечения пациента в стационаре [18]. При этом у 1/3 таких пациентов к моменту выписки из больницы сохраняются когнитивные нарушения (их можно выявить при применении шкал) [2, 17]. Одно из исследований, посвященных изучению неврологических нарушений при COVID-19, представляющее собой ретроспективный анализ 509 случаев заболевания, показало, что наличие энцефалопатии связано с высоким риском неблагоприятного исхода независимо от тяжести поражения системы дыхания [11].
Лечение энцефалопатии при COVID-19 в первую очередь, безусловно, направлено на лечение основного заболевания, устранение гипоксии и нарушений кислотно-основного состояния [19]. Вместе с тем патогенетически обосновано в качестве дополнительной меры применение лекарственных средств, способствующих нормализации метаболических процессов в ЦНС, нарушенных вследствие гипоксии и интоксикации. Однако к настоящему времени при кажущейся очевидной целесообразности публикаций о применении нейропротекторной терапии у пациентов данной категории весьма немного.
В связи с этим нами проведено исследование, в котором оценивали лечение ТМЭ у пациентов с COVID-19. К основной терапии был добавлен цитофлавин (янтарная кислота + инозин + никотинамид + рибофлавин). Выбор препарата связан с уже имеющимся опытом его применения у пациентов с энцефалопатиями различного генеза, в том числе на фоне нейроинфекций и COVID-19 [1-7].
Цель исследования: оценить эффективность нейрометаболической терапии у пациентов с тяжелым течением новой коронавирусной инфекции COVID-19, осложненной развитием энцефалопатии и делирия.
Материал и методы
Проведено пилотное проспективное исследование с участием 61 пациента с основным диагнозом «новая коронавирусная инфекция COVID-19, тяжелая форма, U07.1», носившее клинический характер, вопросы фармакокинетики и фармакодинамики в цели и задачи настоящего исследования не входили. Исследование одобрено локальным этическим комитетом ГБУЗ «Краевая клиническая больница № 2» (протокол № 23 заседания ЛЭК от 18.09.2020 г.). Сбор данных проводился в период с 10.2020 г. по 03.2021 г. одновременно в двух центрах: ГБУЗ «Краевая клиническая больница № 2» (г. Владивосток) и ГБУЗ НО «Городская больница № 33» (г. Нижний Новгород). В исследование включены пациенты, соответствующие критериям: 1) возраст более 18 лет; 2) установление этиологического диагноза в соответствии с действующими рекомендациями МЗ РФ; 3) отсутствие показаний к инвазивной искусственной вентиляции легких (ИВЛ; дыхательная недостаточность компенсируется инсуффляцией увлажненного кислорода или высокопоточной оксигенотерапией); 4) проведение лечения в условиях отделения реанимации и интенсивной терапии (ОРИТ); 5) наличие клинических признаков нарушения функции ЦНС - нарушение сознания (количество баллов по шкале ком Глазго (ШКГ) ≤ 14), психомоторное возбуждение и/или делирий (количество баллов по Intensive Care Delirium Screening Checklist (ICDSC) ≥ 4). Не включали или выводили из исследования пациентов, у которых неврологические нарушения могли быть связаны с другими причинами (предшествующая деменция, острое нарушение мозгового кровообращения (ОНМК), последствия черепно-мозговой травмы, алкогольный делирий и т. п.), а также пациентов с острой почечной или печеночной недостаточностью. Все пациенты получали лечение в соответствии с актуальными рекомендациями МЗ РФ.
У всех пациентов были проявления церебральной недостаточности - делирий и угнетение сознания -менее 14 баллов по ШКГ. В большинстве случаев мы диагностировали гиперактивный подтип делирия - 23 пациента группы «Цитофлавин» и 18 больных группы «Контроль».
В исследуемой группе (группа «Цитофлавин») 34 пациента дополнительно получили терапию препаратом внутривенно, капельно, в разведении на 100 мл 0,9%-ного раствора натрия хлорида в суточной дозе до 40 мл, курсом не менее 5 дней. Остальные пациенты (п = 27) приняли участие в исследовании в качестве группы сравнения (группа «Контроль») - у них также были неврологические нарушения. Распределение пациентов по группам лечения осуществляли с помощью таблицы случайных чисел. В ходе исследования общее состояние пациентов оценивали по шкале NEWS (National Early Warning Score) [7], степень угнетения сознания - по ШКГ, для скрининга делирия применяли шкалу ICDSC [5, 8, 9]. Оценку по данным шкалам проводили 3 раза: исходно, на 3-4-е и на 6-7-е сут участия в исследовании. Одновременно регистрировали значения лабораторных показателей (общий и биохимические анализы крови, коагулограмма, анализ газов крови и кислотно-основного состояния). Дополнительно исследовали уровень в крови нейронспецифической енолазы (NSE), которая представляет собой гликолитический фермент, содержащийся в нервной ткани и, согласно ряду исследований, может служить специфическим маркером повреждения нейронов при травме и нейровоспалении [6]. На момент исследования не найдено данных литературы о применении NSE и других нейронспецифических белков для диагностики неврологических осложнений COVID-19. В рамках настоящего исследования уровень NSE определяли дважды: исходно и на 6-7-е сут участия в исследовании. Для определения NSE кровь пациентов забирали в вакуумные пробирки Vacuette с диоксидом кремния. Центрифугирование крови осуществляли не позднее 1 ч. Иммуноферментный анализ производили на фотометре iMark (Bio Rad, США). Референсное значение NSE составляет до 13 нг/мл.
В каждом случае регистрировали исход заболевания (летальность), перевод на ИВЛ, длительность лечения в ОРИТ и общую длительность лечения в стационаре.
Статистические методы. Анализ собранных данных проводили в среде IBM SPSS v23 и табличном процессоре MS Excel 2016. Данные, измеренные по номинативной шкале (качественные признаки), сравнивали в режиме таблиц сопряженности при помощи точного критерия Фишера. Нулевая гипотеза отклонялась при уровне значимости (p) менее 0,05. Данные, измеренные с помощью количественной шкалы (непрерывные), обрабатывали с использованием непараметрических методов для малых групп. Межгрупповые сравнения проведены при помощи критерия Манна - Уитни. Оценка внутригрупповой динамики, с учетом наличия на более поздних этапах пропуском из-за умерших, проведена при помощи непараметрического дисперсионного анализа по критерию Краскелла - Уоллиса (т. е. выборки были рассмотрены как независимые). Апостериорные сравнения выполнены в зависимости от равенства дисперсий по критерию Ливиня при помощи критерия Тьюки (равенство) либо Геймса - Хоуэлла (отсутствие равенства). С учетом множественной проверки гипотез для уровня значимости критериев рассчитывали 99%-ный доверительный интервал при помощи метода Монте-Карло (10 000 выборок). Результат считался значимым, если верхняя граница доверительного интервала была ниже 0,05. Описание количественных данных выполнено в виде медианы и 25%, 75% квартилей. Корреляционный анализ проведен при помощи критерия корреляции Пирсона (rxy).
Результаты и обсуждение
Данные групп по возрасту, полу, частоте сопутствующих заболеваний представлены в табл. 1. Пациенты, соответствующие критериям отбора, в большинстве случаев были пожилого или старческого возраста, с избыточной массой тела, с индексом коморбидности Charlson до 4 баллов и выше. На момент включения в исследование сроки от начала заболевания пациентов были в пределах 10-16 сут. Наиболее частые сопутствующие заболевания - сахарный диабет, гипертоническая болезнь, ишемическая болезнь сердца, хроническая сердечная недостаточность.
Таблица 1.
Характеристика групп пациентов
Table 1.
Characteristics of the patients’ groups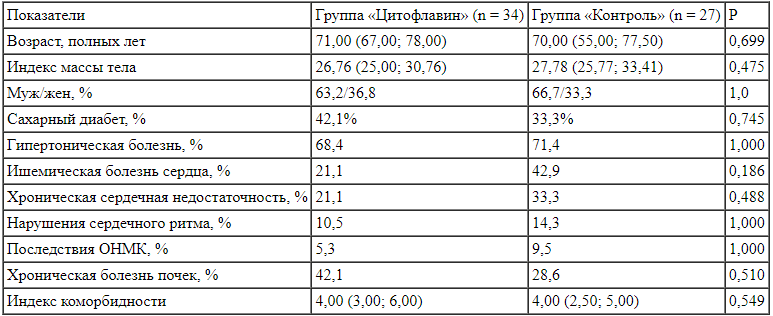 При анализе исходов лечения в обеих группах регистрировался высокий уровень летальности: 44,1% -в группе «Цитофлавин», 59,3% - в группе «Контроль» 5-дневный курс цитофлавина, регистрировали статистически значимую положительную динамику в виде снижения общего балла по шкале NEWS (с 8,5 до 6). В контрольной группе значение данного показателя за указанный период снизилось с 8 до 7 баллов, что указывало на сохраняющуюся потребность в интенсивной терапии у большинства пациентов данной группы (табл. 3). В группе «Цитофлавин» также наблюдали отчетливое снижение показателя «количество баллов по шкале ICDSC»: (табл. 2). Летальные исходы пациентов связаны главным образом с тяжелым течением новой коронавирусной инфекции, выраженностью дыхательной недостаточности и наличием сопутствующей патологии. Делирий можно отнести к дополнительным маркерам неблагоприятного исхода заболевания.
При анализе исходов лечения в обеих группах регистрировался высокий уровень летальности: 44,1% -в группе «Цитофлавин», 59,3% - в группе «Контроль» 5-дневный курс цитофлавина, регистрировали статистически значимую положительную динамику в виде снижения общего балла по шкале NEWS (с 8,5 до 6). В контрольной группе значение данного показателя за указанный период снизилось с 8 до 7 баллов, что указывало на сохраняющуюся потребность в интенсивной терапии у большинства пациентов данной группы (табл. 3). В группе «Цитофлавин» также наблюдали отчетливое снижение показателя «количество баллов по шкале ICDSC»: (табл. 2). Летальные исходы пациентов связаны главным образом с тяжелым течением новой коронавирусной инфекции, выраженностью дыхательной недостаточности и наличием сопутствующей патологии. Делирий можно отнести к дополнительным маркерам неблагоприятного исхода заболевания.
Таблица 2.
Исходы в группах пациентов
Table 2.
Outcomes in the patients’ group При анализе эффективности проводимого лечения на 6-7-е сут в группе пациентов, получивших к 6-7-му дню общегрупповое значение составило 3 балла, что было статистически значимо (р = 0,055) ниже исходного показателя в данной группе (5 баллов) и отличалось от аналогичного показателя в группе «Контроль» (4 балла) (табл. 3). При оценке уровня сознания к 6-7-м сут отмечали тенденцию (р = 0,083) к появлению межгрупповых различий по показателю «количество баллов по шкале Глазго»: 15 баллов в группе «Цитофлавин» против 14 баллов в группе «Контроль» (табл. 3).
При анализе эффективности проводимого лечения на 6-7-е сут в группе пациентов, получивших к 6-7-му дню общегрупповое значение составило 3 балла, что было статистически значимо (р = 0,055) ниже исходного показателя в данной группе (5 баллов) и отличалось от аналогичного показателя в группе «Контроль» (4 балла) (табл. 3). При оценке уровня сознания к 6-7-м сут отмечали тенденцию (р = 0,083) к появлению межгрупповых различий по показателю «количество баллов по шкале Глазго»: 15 баллов в группе «Цитофлавин» против 14 баллов в группе «Контроль» (табл. 3).
Таблица 3.
Сравнительный анализ и внутригрупповая динамика клинических и лабораторных показателей в группах пациентов
Table 3.
Comparative analysis and intragroup changes in clinical and laboratory parameters in patients’ groups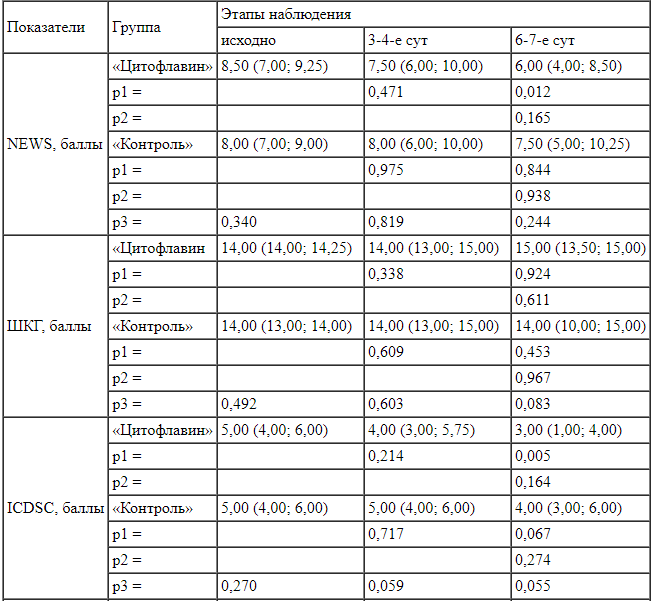
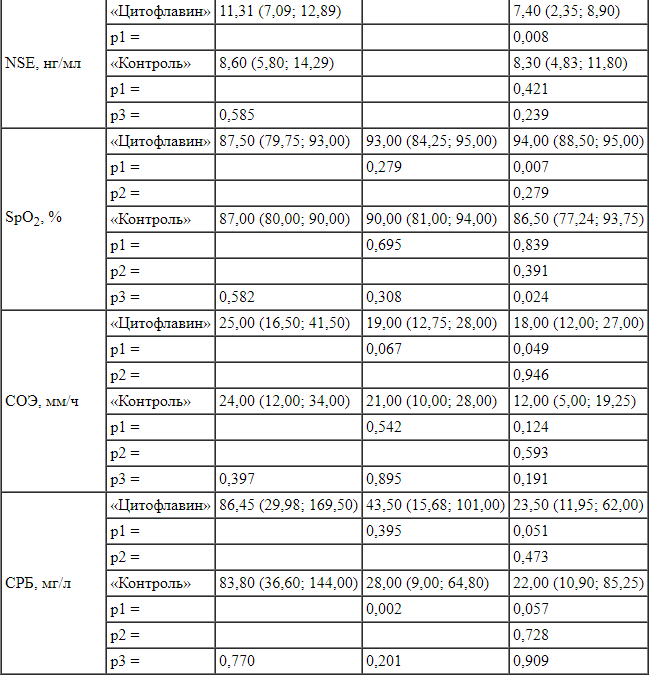
Примечание: р1 - сравнение с исходным значением, р2 - сравнение с предыдущим значением, р3 - сравнение между группами
Гиперактивный подтип делирия у пациентов связывали с проявлениями дыхательной недостаточности и гипоксии. После начала респираторной терапии и сохраняющейся симптоматики пациенты дополнительно получали тримеперидин 20 мг внутримышечно 1-2 раза в день, галоперидол 0,5 мг энтерально 1-2 раза в день.
К 6-7-му дню отмечено статистически значимое увеличение значений SpO2 у пациентов группы «Цитофлавин» по сравнению с группой «Контроль» (94 и 86% соответственно), что свидетельствовало о восстановлении функции дыхания по мере регресса явлений энцефалопатии (табл. 3). В обеих группах происходил регресс симптоматики делирия и явлений острой дыхательной недостаточности, снижение значений СОЭ и С-реактивного белка, что согласуется с общими представлениями о взаимосвязи выраженности воспаления, делирия и ОДН [11].
При оценке уровня NSE в крови установлено, что не у всех пациентов клиника делирия сопровождалась повышением уровня маркера выше референсных значений. Тем не менее в группе «Цитофлавин» регресс явлений делирия сопровождался значимым снижением данного показателя (табл. 3). На основании этих данных мы не можем сделать заключение о диагностической ценности NSE в данной клинической ситуации, но считаем, что исследования в этом направлении целесообразно продолжить.
Сравнительный анализ остальных лабораторных данных (общий и биохимические анализы крови, коагулограмма, анализ газов крови и кислотно-основного состояния) не обнаружил признаков влияния дополнительной терапии цитофлавином на эти показатели.
В ходе корреляционного анализа выявлена совместная вариация показателей «возраст» и «количество баллов по шкале ICDSC» на 3-4-е сут (rxy = 0,329, р = 0,011) и 6-7-е сут (rxy = 0,375, р = 0,013), т. е. устойчивость проявлений делирия закономерно повышалась с возрастом пациента, учитывая полиморбидность и провоцирующие факторы тяжелого течения новой коронавирусной инфекции.
Также установлены обратные корреляционные связи между показателями «количество баллов по ШКГ» и «уровень креатинина» на всех трех этапах измерения (rxy = -0,556, p = 0,0001; rxy = -0,731, p = 0,0001; rxy = -0,514; p = 0,0001) и между показателями «количество баллов по шкале ICDSC» и SpO2 на 3-4-е и 6-7-е сут лечения (rxy = - 0,451, p = 0,0001; rxy = -0,443, p = 0,004), что также частично подтверждает тезис о гипоксическом и эндотоксическом генезе энцефалопатии на фоне тяжелых форм COVID-19.
На основании полученных результатов полагаем, что целесообразно продолжить исследование в этом направлении, чтобы в полной мере оценить значимость нейрометаболической терапии в лечении пациентов с тяжелым течением COVID-19, осложненным развитием энцефалопатии.
Полученные результаты позволяют сделать следующие выводы.
1. Энцефалопатия при COVID-19 характерна для пациентов пожилого и старческого возраста с высоким индексом коморбидности, часто проявляется делирием и указывает на тяжелое течение заболевания и высокий риск неблагоприятного исхода.
2. Дополнительная нейрометаболическая терапия цитофлавином у таких пациентов целесообразна, поскольку может способствовать более быстрому регрессу энцефалопатии и симптомов делирия и оказывать положительное влияние на течение заболевания.
Информация об авторах:
ГБУЗ «Краевая клиническая больница № 2», 690105, г. Владивосток, ул. Русская, д. 55.
Дунц Павел Вадимович
кандидат медицинских наук, заведующий отделением анестезиологии и реанимации.
Горожин Павел Юрьевич
врач - анестезиолог-реаниматолог.
БУЗ НО «Городская больница № 33», 603004, г. Нижний Новгород, пр. Ленина, д. 54.
Военнов Олег Вячеславович
доктор медицинских наук, доцент.
Мокров Константин Васильевич
заведующий отделением реанимации и интенсивной терапии.
Турентинов Алексей Владимирович
врач - анестезиолог-реаниматолог отделения реанимации и интенсивной терапии.
Information about authors:
Regional Clinical Hospital no.2, 55, Russkaya St., Vladivostok, 690105.
Pavel V. Dunts
Candidate of Medical Sciences, Head of Anesthesiology and Intensive Care Department.
Pavel Yu. Gorozhin
Anesthesiologist and Emergency Physician.
City Hospital no. 33, 54, Lenina Ave, Nizhny Novgorod, 603004.
Oleg V. Voennov
Doctor of Medical Sciences, Associate Professor.
Konstantin V. Mokrov
Head of Intensive Care Department.
Aleksey V. Turentinov
Anesthesiologist and Emergency Physician of Anesthesiology and Intensive Care Department.
Литература
1. Исаков В. А., Коваленко А. Л., Мартынова О. В. и др. Эффективность цитофлавина в терапии энцефалопатий у больных нейроинфекциями // Антибиотики и химиотерапия. - 2010. - Т. 55, № 1-2. - С. 36-41.
2. Карташова Е. А., Романцов М. Г., Сарвилина И. В. Влияние цитофлавина на молекулярные механизмы развития гипертензивной энцефалопатии у пациентов с систолической артериальной гипертензией // Экспериментальная и клиническая фармакология. - 2014. -Т. 77, № 6. - С. 18-23.
3. Конькова-Рейдман А. Б., Ратникова Л. И. Нейроиммунные аспекты патогенеза и нитрокcиднегативная модификация патогенетической терапии клещевых нейроинфекций // Журнал неврологии и психиатрии им. С. С. Корсакова. - 2012. - Т. 112, № 2. - С. 40-45.
4. Методика двухкомпонентной модели нейровегетативной и метаболической стабилизации больных с осложненным течением коронавирус-ной инфекции COVID-19. В кн.: Некоторые аспекты лечения больных с тяжелой формой коронавирусной инфекции COVID-19: пособие для врачей / под ред. проф. А. Н. Кондратьева. СПб.: Ассоциация анестезиологов-реаниматологов Северо-Запада, 2021. - 128 с.
5. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Временные методические рекомендации. Версия 11 (07.05.2021). Министерство здравоохранения Российской Федерации.
6. Селезнева А. Г., Петрова А. Г. Опыт применения цитофлавина в составе комплексной терапии у больных клещевым энцефалитом // Журнал неврологии и психиатрии им. С. С. Корсакова. - 2012. - Т. 7. - С. 68-69.
7. Скрипченко Н. В., Егорова Е. С. Применение цитофлавина в комплексной терапии нейроинфекций у детей // Журнал неврологии и психиатрии им. С. С. Корсакова. - 2011. - Т. 111, № 9. - С. 28-31.
8. Bergeron N., Dubois M. J., Dumont M. Intensive care delirium screening checklist: evaluation of a new screening tool // Intens. Care Med. - 2012. -Vol. 7, № 5. - P 859-864.
9. Carr E., Bendayan R., Bean D. et al. Evaluation and improvement of the National Early Warning Score (NEWS2) for COVID-19: a multi-hospital study // BMC Med. - 2021. - Vol. 19. - P 23.
10. Cummings M.J., Baldwin M.R., Abrams D. et al. Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: a prospective cohort study. Lancet, 2020, vol. 395, pp. 1763-1770.
11. Duggan M.C., Van J., Ely E.W. Delirium assessment in critically ill older adults: considerations during the COVID-19 pandemic. Crit. Care Clin., 2021, vol. 37, no. 1, pp. 175-190.
12. Fischer D., Threlkeld Z.D., Bodien Y.G. et al. Intact brain network function in an unresponsive patient with COVID-19. Ann. Neurol., 2020, vol. 4, pp. 851-854.
13. Garg R.K., Paliwal V.K., Gupta A. Encephalopathy in patients with COVID-19: A review. J. Med. Virol., 2021, vol. 93, no. 1, pp. 206-222.
14. Haque A., Polcyn R., Matzelle D. et al. New insights into the role of neuron-specific enolase in neuro-inflammation, neurodegeneration and neuroprotection. Brain Sci., 2018, vol. 18, no. 8 (2), pp. 33.
15. Helms J., Kremer S., Merdji H. et al. Neurologic features in severe SARS-CoV-2 infection. N. Engl. J. Med., 2020, vol. 382, pp. 2268-2270.
16. Koralnik I.J., Tyler K.L. COVID-19: A global threat to the nervous system. Ann. Neurol., 2020, vol. 88, no. 1, pp. 1-11.
17. Li Y.C., Bai W.Z., Hashikawa T. The neuroinvasive potential of SARS-CoV-2 may play a role in the respiratory failure of COVID-19 patients. J. Med. Virology, 2020, vol. 92, no. 6, pp. 552-555.
18. Liotta E.M., Batra A., Clark J.R. et al. Frequent neurologic manifestations and encephalopathy-associated morbidity in COVID-19 patients. Ann. Clin. Transl. Neurol., 2020, vol. 7, no. 11, pp. 2221-2230.
19. Rogers J.P., Chesney E., Oliver D. et al. Psychiatric and neuropsychiatric presentations associated with severe coronavirus infections: a systematic review and meta-analysis with comparison to the COVID-19 pandemic. Lancet Psychiatry, 2020, vol. 7, pp. 611.
20. Wu Y., Xu X., Chen Z. et al. Nervous system involvement after infection with COVID-19 and other coronaviruses. Brain Behav. Immun., 2020, vol. 87, pp. 18-22. 10. Cummings M.J., Baldwin M.R., Abrams D. et al. Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: a prospective cohort study. Lancet, 2020, vol. 395, pp. 1763-1770.
11. Duggan M.C., Van J., Ely E.W. Delirium assessment in critically ill older adults: considerations during the COVID-19 pandemic. Crit. Care Clin., 2021, vol. 37, no. 1, pp. 175-190.
12. Fischer D., Threlkeld Z.D., Bodien Y.G. et al. Intact brain network function in an unresponsive patient with COVID-19. Ann. Neurol., 2020, vol. 4, pp. 851-854.
13. Garg R.K., Paliwal V.K., Gupta A. Encephalopathy in patients with COVID-19: A review. J. Med. Virol., 2021, vol. 93, no. 1, pp. 206-222.
14. Haque A., Polcyn R., Matzelle D. et al. New insights into the role of neuron-specific enolase in neuro-inflammation, neurodegeneration and neuroprotection. Brain Sci., 2018, vol. 18, no. 8 (2), pp. 33.
15. Helms J., Kremer S., Merdji H. et al. Neurologic features in severe SARS-CoV-2 infection. N. Engl. J. Med., 2020, vol. 382, pp. 2268-2270.
16. Koralnik I.J., Tyler K.L. COVID-19: A global threat to the nervous system. Ann. Neurol., 2020, vol. 88, no. 1, pp. 1-11.
17. Li Y.C., Bai W.Z., Hashikawa T. The neuroinvasive potential of SARS-CoV-2 may play a role in the respiratory failure of COVID-19 patients. J. Med. Virology, 2020, vol. 92, no. 6, pp. 552-555.
18. Liotta E.M., Batra A., Clark J.R. et al. Frequent neurologic manifestations and encephalopathy-associated morbidity in COVID-19 patients. Ann. Clin. Transl. Neurol., 2020, vol. 7, no. 11, pp. 2221-2230.
19. Rogers J.P., Chesney E., Oliver D. et al. Psychiatric and neuropsychiatric presentations associated with severe coronavirus infections: a systematic review and meta-analysis with comparison to the COVID-19 pandemic. Lancet Psychiatry, 2020, vol. 7, pp. 611.
20. Wu Y., Xu X., Chen Z. et al. Nervous system involvement after infection with COVID-19 and other coronaviruses. Brain Behav. Immun., 2020, vol. 87, pp. 18-22.
References
1. Isakov V.А., Kovalenko А.L., Martynova O.V et al. Efficacy of Cytoflavin in therapy of encephalopathies in patients with neuroinfections. Antibiotiki i Khimioterapiya, 2010, vol. 55, no. 1-2, pp. 36-41. (In Russ.) /
2. Kartashova E.А., Romantsov M.G., Sarvilina I.V The influence of Cytoflavin on molecular mechanisms of hypertensive encephalopathy development in patients with systolic arterial hypertension. Eksperimentalnaya i Klinicheskaya Farmakologiya, 2014, vol. 77, no. 6, pp. 18-23. (In Russ.)
3. Konkova-Reydman A.B., Ratnikova L.I. Neuroimmune aspects of pathogenesis and nitroxidenegative modification of pathogenetic therapy of tick-borne neuroinfections. Journal Nevrologii i Psikhiatrii im. S.S.Korsakova, 2012, vol. 112, no. 2, pp. 40-45. (In Russ.)
4. Metodika dvukhkomponentnoy modeli neyrovegetativnoy i metabolicheskoy stabilizatsii bolnykh s oslozhnennym techeniyem koronavirusnoy infektsii COVID-19. V kn.: Nekotoryye aspekty lecheniya bolnykh s tyazheloy formoy koronavirusnoy infektsii COVID-19: posobiye dlya vrachey. [Method of two-component model of neurovegetative and metabolic stabilization of patients with a complicated course of coronavirus infection COVID-19. In: Some aspects of the treatment of patients with severe coronavirus infection COVID-19: Doctors’ Handbook]. VN. Kondratiev, eds., St. Peterburg, Аssotsiatsiya Anesteziologov-Reanimatologov Severo-Zapada Publ., 2021, 128 p.
5. Vremennye metodicheskie rekomendatsii. Profilaktika, diagnostika i lechenie novoy koronavirusnoy infektsii (COVID-19) Versiya 11. [Provisional guidelines on prevention, diagnostics and treatment of the new coronavirus infection (COVID-19). Version 11]. (07.05.2021). Ministerstvo Zdravookhraneniya Rossiyskoy Federatsii Publ.
6. Selezneva А.G., Petrova А^. Experience of using Cytoflavin as part of complex therapy in patients with tick-borne encephalitis. Journal Nevrologii i Psikhiatrii im. S.S.Korsakova, 2012, vol. 7, pp. 68-69. (In Russ.)
7. Skripchenko N.V., Egorova E.S. The use of Cytoflavin in the treatment of neuroinfections in children. Journal Nevrologii i Psikhiatrii im. S.S.Korsakova, 2011, vol. 111, no. 9, pp. 28-31. (In Russ.)
8. Bergeron N., Dubois M.J., Dumont M. Intensive care delirium screening checklist: evaluation of a new screening tool. Intens. Care Med., 2012, vol. 7, no. 5, pp. 859-864.
9. Carr E., Bendayan R., Bean D. et al. Evaluation and improvement of the National Early Warning Score (NEWS2) for COVID-19: a multi-hospital study. BMC Med., 2021, vol. 19, pp. 23.
10. Cummings M. J., Baldwin M. R., Abrams D. et al. Epidemiology, clinical course, and outcomes of critically ill adults with COVID-19 in New York City: a prospective cohort study // Lancet. - 2020. - Vol. 395. - P. 1763-1770.
11. Duggan M. C., Van J., Ely E. W. Delirium assessment in critically ill older adults: considerations during the COVID-19 pandemic // Crit. Care Clin. - 2021. -Vol. 37, № 1. - P. 175-190.
12. Fischer D., Threlkeld Z. D., Bodien Y. G. et al. Intact brain network function in an unresponsive patient with COVID-19 // Ann. Neurol. - 2020. - Vol. 4. -P. 851-854.
13. Garg R. K., Paliwal V. K., Gupta A. Encephalopathy in patients with COVID-19: A review // J. Med. Virol. - 2021. - Vol. 93, № 1. - P. 206-222.
14. Haque A., Polcyn R., Matzelle D. et al. New insights into the role of neuron-specific enolase in neuro-inflammation, neurodegeneration and neuroprotection // Brain Sci. - 2018. - Vol. 18, № 8 (2). - P. 33.
15. Helms J., Kremer S., Merdji H. et al. Neurologic features in severe SARS-CoV-2 infection // N. Engl. J. Med. - 2020. - Vol. 382. - P. 2268-2270.
16. Koralnik I. J., Tyler K. L. COVID-19: A global threat to the nervous system // Ann. Neurol. - 2020. - Vol. 88, № 1. - P. 1-11.
17. Li Y. C., Bai W. Z., Hashikawa T. The neuroinvasive potential of SARS-CoV-2 may play a role in the respiratory failure of COVID-19 patients // J. Med. Virology. - 2020. - Vol. 92, № 6. - P. 552-555.
18. Liotta E. M., Batra A., Clark J. R. et al. Frequent neurologic manifestations and encephalopathy-associated morbidity in COVID-19 patients // Ann. Clin. Transl. Neurol. - 2020. - Vol. 7, № 11. - P. 2221-2230.
19. Rogers J. P., Chesney E., Oliver D. et al. Psychiatric and neuropsychiatric presentations associated with severe coronavirus infections: a systematic review and meta-analysis with comparison to the COVID-19 pandemic // Lancet Psychiatry. - 2020. - Vol. 7. - P. 611.
20. Wu Y., Xu X., Chen Z. et al. Nervous system involvement after infection with COVID-19 and other coronaviruses // Brain Behav. Immun. - 2020. - Vol. 87. -P. 18-22.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)