Персонифицированный подход к лечению сосудистого когнитивного расстройства (клиническое наблюдение)
Статьи
Э.Ю. Соловьева, И.П. Филатова
Кафедра неврологии ФДПО ФГАОУ ВО “Российский национальный исследовательский медицинский университет им. Н.И. Пирогова” Минздрава России, Москва.
Элла Юрьевна Соловьева - докт. мед. наук, профессор, зав. кафедрой.
Инна Павловна Филатова - канд. мед. наук, ассистент кафедры.
Контактная информация: Филатова Инна Павловна, inna. filatova03@mail.ru
Статья посвящена вопросам сосудистого когнитивного расстройства (СКР) в контексте одного из наиболее распространенных патологических состояний, неразрывно связанных с различными формами цереброваскулярных заболеваний. Обсуждаются причины развития СКР, при этом уточняется, что одним из доминирующих механизмов, лежа- щих в основе развития нейрокогнитивных нарушений, является хроническая возрастная дисрегуляция, хотя другие факторы, такие как воспалительная сосудистая реакция и, как следствие, гипоксически-ишемические повреждения, сердечно-сосудистая дисфункция, также играют немаловажную роль. По этой причине контроль основных факторов риска цереброваскулярной патологии, включая мультимодальные стратегии с использованием модификации образа жизни, является наиболее многообещающим подходом в лечении и профилактике СКР. Авторы считают, что решение проблемы выбора и назначения лекарственных средств при лечении данного патологического состояния должно осуществляться с позиций осмысления собственного клинического опыта. На основании обзора литературы и собственных данных авторы делают вывод, что применение препарата Цитофлавин в лечении больных с синдромом умеренного когнитивного расстройства на фоне хронической ишемии головного мозга, обусловленной артериальной гипертонией, является целесообразным и эффективным.
Ключевые слова: цереброваскулярные заболевания, сосудистые когнитивные расстройства, хроническая ишемия головного мозга, Цитофлавин.
Термин “сосудистое когнитивное расстройство” (СКР) относится к гетерогенной группе состояний, основным признаком которых является когнитивное нарушение, связанное с цереброваскулярными заболеваниями [1].
Мощным фактором инициации когнитивных нарушений служат последствия как острых нарушений мозгового кровообращения, так и хронической ишемии головного мозга (ХИГМ) [2].
Хроническая ишемия головного мозга - один из наиболее распространенных диагнозов в отечественной неврологии, выделенный в раздел I67.8 “Другие уточненные поражения сосудов мозга” в Международной классификации болезней 10-го пересмотра (МКБ-10) и совпадающий с ранее использовавшимся термином “дисциркуляторная энцефалопатия”.
С клинической точки зрения диагноз ХИГМ подразумевает особую разновидность сосудистой патологии мозга, связанную с многоочаговым или распространенным поражением головного мозга, обусловленную нарастающим ухудшением кровоснабжения мозговой ткани и проявляющуюся комплексом эмоциональных, двигательных и, прежде всего, когнитивных расстройств.
В последние годы большинство исследователей клинические и радиологические признаки сосудистого поражения мозга обозначают термином “болезнь малых сосудов”, основой которой являются диффузные изменения ткани головного мозга, связанные с поражением мелких перфорирующих артерий, артериол, капилляров, венул и мелких вен. В значительной степени это обусловлено тем, что основная масса белого вещества и подкорковых ядер получает кровоснабжение из артерий малого калибра, которые являются артериями конечного типа и практически не анастомозируют друг с другом [3]. Эти артерии исключительно уязвимы при артериальной гипертонии (АГ), сахарном диабете (СД), их сочетании. Стойкое повышение системного артериального давления (АД), высокое пульсовое давление, обусловленное отхождением артерий малого калибра непосредственно от крупных артериальных стволов основания мозга (отсутствие демпфирующего механизма, способного сгладить амплитуду пульсовой волны), и ряд других причин приводят к изменению структуры и физических свойств сосудистой стенки. Ситуация осложняется и тем, что малые церебральные артерии выполняют функции резистивного сосудистого русла, играя исключительно важную роль в реализации ауторегуляции мозгового кровообращения. В итоге снижается или даже извращается чувствительность гладкой мускулатуры сосуда к эндогенным сосудорасширяющим стимулам, что обусловливает нарушение перераспределения крови в полости черепа и нестабильность поступления крови к нуждающимся в ней областям мозга [4]. Так, структурное повреждение головного мозга, связанное с болезнью сосудов малого калибра, - это основной фактор развития когнитивных нарушений, частота которого составляет примерно 40% для деменций и 20% для всех видов инсультов [5-7].
Диагностические критерии СКР постоянно совершенствуются и основываются на клинических проявлениях когнитивной дисфункции, связи возникновения симптомов с сосудистым эпизодом и данными нейровизуализации. В качестве этиопатогенетических факторов развития СКР выделяют следующие: атеросклероз, гипертоническая болезнь и их сочетания; сердечные, атеросклеротические и системные эмболии; артериолосклероз; СД; стенозы и деформации магистральных артерий головы; экстравазальная компрессия; липогиалиноз; амилоидная ангиопатия; инфекционные и неинфекционные васкулиты; венозные коллагенозы; дуральная или паренхиматозная артериовенозная фистула; наследственные ангиопатии (CADASIL (cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy - церебральная аутосомно-доминантная артериопатия с подкорковыми инфарктами и лейкоэнцефалопатией), CARASIL (cerebral autosomal-recessive arteriopathy with subcortical infarcts and leukoencephalopathy - церебральная аутосомно-рецессивная артериопатия с подкорковыми инфарктами и лейкоэнцефалопатией)); гигантоклеточный артериит; мешотчатые аневризмы; фибромаскулярная дисплазия, болезнь мойя-мойя; системные микроангиопатии без воспалительной клеточной инфильтрации; церебральный венозный тромбоз [8, 9].
При этом установлено, что одним из доминирующих механизмов, лежащих в основе развития нейрокогнитивных нарушений, является хроническая возрастная дисрегуляция, хотя другие факторы, такие как воспалительная сосудистая реакция и, как следствие, гипоксически-ишемические повреждения, сердечно-сосудистая дисфункция, также играют немаловажную роль. В частности, АГ, СД, гиперхолестеринемия и курение связаны с повышением риска развития деменции на 20-40% [1]. Поэтому контроль этих факторов риска, включая мультимодальные стратегии с использованием модификации образа жизни, является наиболее многообещающим подходом в лечении и профилактике СКР.
Среди СКР выделяют легкие и умеренные расстройства, а также сосудистую деменцию, которая в МКБ-10 определяется как следствие церебрального инфаркта или как цереброваскулярное расстройство, обусловленное АГ.
Выделяют 4 основных подтипа сосудистой деменции: 1) постинсультная деменция, определяемая как деменция, проявляющаяся в течение 6 мес после инсульта; 2) подкорковая (субкортикальная) ишемическая сосудистая деменция (болезнь Бинсвангера), характеризующаяся чисто двигательным дефицитом, признаками бульбарного паралича, дизартрией, эмоциональной лабильностью и дефицитом исполнительных функций; 3) мультиинфарктная (кортикальная) деменция, характеризующаяся наличием инфарктов в корковых и подкорковых отделах мозговых артерий и клинически - наличием двигательного дефицита, одностороннего нарушения чувствительности, грубой когнитивной дисфункции и афазии; 4) смешанная (корковая и подкорковая) сосудистая деменция [10, 11].
Диагноз легких или умеренных СКР основывается на: 1) жалобах пациента и (или) близких ему людей на нарушения памяти и другие когнитивные расстройства; 2) наличии легких или умеренных когнитивных нарушений по данным нейропсихологических методов исследования; 3) снижении когнитивных функций по сравнению с прошлым уровнем; 4) отсутствии выраженных нарушений повседневной активности и деменции; 5) наличии клинических, анамнестических, КТ- и МРТ-признаков (КТ - рентгеновская компьютерная томография, МРТ - магнитно-резонансная томография) цереброваскулярного заболевания; 6) отсутствии данных о других заболеваниях, включая болезнь Альцгеймера [12].
Таким образом, СКР представляют собой широкий спектр цереброваскулярных заболеваний с различными механизмами, лежащими в основе их инициации. Поэтому коррекция факторов риска при развитии смешанных когнитивных нарушений позволяет замедлить прогрессирование нейродегенеративного процесса.
Основные стратегии терапии церебральной патологии следующие:
• антигипертензивная терапия;
• гипогликемизирующая терапия;
• антитромбоцитарная или антикоагулянтная терапия;
• гиполипидемическая терапия (статины);
• методы сосудистой хирургии (каротидная эндартерэктомия, стентирование сонных артерий);
• лечение нарушений сердечного ритма;
• диета с низким содержанием соли, животных жиров;
• коррекция массы тела;
• отказ от курения и злоупотребления алкоголем.
На сегодняшний день существуют общие принципы терапии всех пациентов с СКР, но тем не менее необходим персонифицированный подход, при котором жалобы и симптомы определяют симптоматическое лечение и поддерживающие меры, а этиологический диагноз определяет управление сосудистыми факторами риска и этиотропное лечение.
При сосудистой деменции для улучшения когнитивных функций препаратами первого выбора являются ингибиторы ацетилхолинэстеразы (ИАХЭ), уменьшающие холинергический дефицит, и (или) блокаторы глутаматных рецепторов (мемантин) [2].
В настоящее время успешно применяются 3 препарата из группы ИАХЭ:
• галантамин - агонист постсинаптических никотиновых рецепторов. Эффективность галантамина (р < 0,001) показана в двойных слепых исследованиях терапии галантамином (GAL-INT-6 и GAL-INT-26) с продолженной открытой фазой у пациентов с сосудистой и смешанной деменцией по результатам шкал ADAS-Cog (Alzheimer’s Disease Assessment Scale-Cognitive Subscale - шкала оценки болезни Альцгеймера-когнитивная субшкала) и CIBIC-Plus (Clinician’s Interview-Based Impression of Change Plus caregiver input - шкала оценки изменений клиницистом на основании опроса пациента и данных лица, осуществляющего уход) [13];
• ривастигмин - ингибирует ацетилхолинэстеразу и бутирилхолинэстеразу. Ингибирование обеих холинэстераз в синаптической щели потенциально может обеспечивать более продолжительный терапевтический эффект, что повышает преимущества препарата в лечении пресенильных и быстро прогрессирующих форм деменции;
• донепезил - ингибирует исключительно ацетилхолинэстеразу. Препарат был исследован в 2 рандомизированных контролируемых исследованиях в течение 6 мес. Было отмечено дозозависимое улучшение когнитивных функций в основной группе. Также была обнаружена тенденция к улучшению функциональных возможностей пациентов, однако различия были статистически недостоверными и имели разнонаправленный характер [14].
Все 3 вышеперечисленных препарата, являясь третичными аминами и, следовательно, липофильными веществами, хорошо проникают через гематоэнцефалический барьер, что позволяет им оказывать центральный эффект. Напротив, неостигмина метилсульфат и пиридостигмина бромид, содержащие в структуре четвертичный атом азота, практически лишены центральных эффектов в терапевтических дозах и применяются исключительно в терапии периферических расстройств. Положительный эффект от приема препаратов из группы ИАХЭ центрального действия отмечается приблизительно у 50-70% пациентов. Он выражается в улучшении или стабилизации памяти, других когнитивных функций, регрессе поведенческих нарушений, повышении или стабилизации уровня независимости и самостоятельности. В случае отсутствия положительного эффекта назначенный препарат следует заменить на другой препарат из этой же группы.
Как правило, клиническое улучшение состояния, достигнутое в начале терапии, сохраняется в среднем в течение 6-12 мес. Затем, в силу естественного прогрессирования заболевания, возможно нарастание выраженности когнитивных и других нервно-психических расстройств. Последнее, однако, не говорит об “истощении” терапевтического эффекта, так как при отсутствии ацетилхолинергической терапии прогрессирование нервно-психических расстройств происходит более быстрыми темпами.
Еще одной немаловажной группой лекарственных средств при лечении СКР являются препараты, воздействующие на метаболизм глутамата.
В физиологических условиях глутамат выступает в роли ведущего возбуждающего медиатора в центральной нервной системе, обеспечивающего различные виды памяти и процессы обучения. Глутамат реализует свою функцию через 3 класса ионотропных рецепторов глутамата, включая AMPA-рецептор (AMPA - а-амино-3-гидрокси-5-метил-4-изоксазолпропионовая кислота; GluR1-4), NMDA-рецептор (NMDA - N-метил-D-аспартат-рецептор; NR1, NR2A-D, NR3A-B), каинатные рецепторы (GluR5-7, KA1-2), а также класс метаботропных рецепторов глутамата (mGluRs, mGluR1-8), взаимодействие которых до настоящего времени недостаточно изучено [15]. В этой связи в литературе обсуждается возможность применения антагониста NMDA-рецепторов мемантина, который широко используется для лечения первично-дегенеративных и сосудистых поражений головного мозга.
Мемантин - производное адамантана, является конкурентным низкоаффинным антагонистом NMDA-рецепторов. Механизм действия этого препарата заключается в том, что он поддерживает сохранность взаимодействия глутамата с рецептором, обеспечивая таким образом физиологические функции, но при этом слабо блокирует ионный канал для устранения чрезмерного и хронического возбуждения рецептора [16].
Наиболее часто при развитии легких и умеренных когнитивных расстройств, связанных с ХИГМ, используют нейрометаболические и вазотропные препараты [17].
Нейрометаболические препараты. Эта группа препаратов оказывает комплексное воздействие на ткань головного мозга, поскольку при нарушении мозгового кровообращения требуется защита не только нейронов, но и других клеток нервной ткани - астроцитов, олигодендроцитов, микроглии. Применение таких препаратов помогает повысить жизнеспособность клеток в неблагоприятных условиях, обеспечить восстановление кровотока в пораженных сосудах.
Выделяют несколько групп нейрометаболических препаратов [18]:
• пептидергические препараты животного происхождения (церебролизин, кортексин, актовегин);
• производные пирролидона (пирацетам, фенотропил, оксирацетам, анирацетам);
• производные у-аминомасляной кислоты (пикамилон, фенибут, аминалон);
• производные пантотеновой кислоты (пантогам);
• производные пиридоксина (энцефабол (пиритинол));
• препараты, содержащие диметиламиноэтанол (мекло-феноксат, ацефен, деанол, центрофеноксин);
• витамины Е и В15, фолиевая кислота, янтарная кислота, этиламиносукцинат натрия;
• энергодающие субстраты (рибоксин, аденозинтрифос-форная кислота (АТФ));
• препараты, содержащие янтарную и фумаровую кислоты. Препаратами, созданными на основе янтарной кислоты, являются реамберин и Цитофлавин (содержит янтарную кислоту, инозин, никотинамид и рибофлавина мононуклеотид);
• предшественники ацетилхолина (холина альфосцерат, цитиколин).
Вазотропные препараты. Воздействие на микроциркуляцию при сосудистой мозговой недостаточности является патогенетически оправданным. Применение вазотропных препаратов способствует улучшению кровообращения в ишемизированных участках головного мозга. Наиболее часто назначаемыми лекарственными средствами данной группы являются винпоцетин, вазобрал, стандартизированный экстракт гинкго билобы, цинна-ризин, пентоксифиллин, ницерголин, истенон и др. [18]. Вазотропные препараты обычно назначаются курсами на 2-3 мес 1-2 раза в год.
Однако, принимая во внимание существующие в настоящее время представления о патогенезе хронической недостаточности мозгового кровообращения, с одной стороны, и требования доказательной медицины к лекарственным препаратам - с другой, перед практическим врачом, имеющим большой клинический опыт использования конкретных медикаментов, стоит серьезная задача обоснования выбора и использования лекарственных средств, поскольку в специализированной зарубежной литературе и в рекомендациях по лечению неврологических заболеваний всё реже всерьез говорят о нейропротективной концепции.
Решение проблемы выбора и назначения лекарственных средств, на наш взгляд, должно осуществляться с позиций осмысления собственного клинического опыта.
Клиническое наблюдение
Пациентка А., 62 года, обратилась на амбулаторный прием в сопровождении сына с жалобами на повышенную забывчивость, трудности с концентрацией внимания, ощущение “тумана” в голове, отсутствие “ясности мышления” в последние 6 мес. Сын пациентки также отмечает невнимательность, рассеянность матери, неустойчивость фона настроения, нарушение сна.
Анамнез заболевания: в течение 10 лет страдает АГ с максимальным повышением АД до 190/110 мм рт. ст. Постоянную антигипертензивную терапию (энап 5 мг 2 раза в сутки) принимает нерегулярно. Со слов пациентки и ее сына, в 2022 г. возник острый эпизод нарушения речи с апраксией ходьбы длительностью менее 24 ч, в связи с чем по экстренным показаниям больная была госпитализирована в отделение реанимации и интенсивной терапии для дальнейшего обследования и лечения. Осмотрена неврологом, проведена КТ головного мозга, данных в пользу острого нарушения мозгового кровообращения не получено (рис. 1). Выписана с диагнозом: транзиторная ишемическая атака (код G45.9 по МКБ-10); синдром вертебробазилярной артериальной системы; гипертоническая болезнь III стадии, риск сердечно-сосудистых осложнений IV степени.
Общий анамнез: дорсопатия шейного отдела позвоночника, ремиссия. Дислипидемия. Язвенная болезнь двенадцатиперстной кишки вне обострения. Оба глаза гиперметропия средней степени; начальная катаракта; ангиосклероз сетчатки. Холецистэктомия от 2003 г. Деменции, когнитивных или поведенческих расстройств ни у кого из родственников не отмечалось. Вредные привычки отрицает.
Соматический статус: состояние средней степени тяжести. Кожный покров и видимые слизистые обычной окраски, отеков нет, следов травм нет. Венозный рисунок не усилен. Дыхание спонтанное. В легких дыхание везикулярное, хрипов нет, проводится с обеих сторон. Частота дыханий 18 в 1 мин. Тоны сердца приглушены, ритм правильный. На электрокардиограмме ритм синусовый; частота сердечных сокращений 72 в 1 мин; АД 160/90 мм рт. ст. Пульсация на периферических артериях сохранена. Живот мягкий, безболезненный, на пальпацию не реагирует; перистальтика сохранена. Печень по краю реберной дуги. Область почек не изменена, почки не пальпируются, симптом поколачивания отрицательный с обеих сторон. Мочеиспускание свободное, безболезненное. Рост 170 см, масса тела 100 кг, индекс массы тела 34,6 кг/м2.
Неврологический статус: сознание ясное. Эмоционально лабильна, фиксирована на своих ощущениях. Менингеальных знаков нет. Легкая дизартрия. Глазные щели D=S, зрачки OD=OS. Установочный нистагм в крайних отведениях. Лицо симметрично. Глотание сохранено. Язык по средней линии. Мышечный тонус D=S, сухожильные рефлексы D=S симметрично оживлены. Парезов нет. Чувствительность не изменена. Патологических стопных знаков нет. Координаторные пробы выполняет неуверенно слева. Функции тазовых органов контролирует.
Нейропсихологическое тестирование: контактна, испытывает трудности с концентрацией внимания, планированием, целеполаганием. Правильно ориентирована в месте, времени и собственной личности. Показатель по Монреальской шкале оценки когнитивных функций (Montreal Cognitive Assessment, МоСА) 24 балла (норма >26 баллов). Показатель в пробе Шульте 20 с (норма 25-30 с). Показатель по краткой шкале оценки психического статуса (MiniMental State Examination, MMSE) 27 баллов, что выше общепринятого показателя деменции (<24 балла). Результаты теста “12 слов” указывают на легкие нарушения памяти по неспецифическому типу: при непосредственном воспроизведении самостоятельно вспомнила 6 слов, с помощью подсказок - еще 5. После отвлечения внимания на 2 мин самостоятельно вспомнила 7 слов, с помощью подсказок -еще 3. Проведена оценка аффективного статуса по госпитальной шкале тревоги и депрессии (Hospital Anxiety and Depression Scale, HADS): тревога - 16 баллов, депрессия -6 баллов. По шкале депрессии Бека пациентка набрала 13 баллов. Таким образом, у пациентки выявлен клинически значимый уровень тревоги и субклинический уровень депрессии.
Общий анализ крови: норма.
Коагулограмма: норма.
Биохимический анализ крови: глюкоза 6,2 (3,9-6,4) ммоль/л; креатинин 83 (62-106) мкмоль/л; общий холестерин (ХС) 6,0 (3,08-5,18) ммоль/л; триглицериды 1,62 (0,00-2,30) ммоль/л; ХС липопротеидов высокой плотности (ЛПВП) 0,80 (0,90-1,94) ммоль/л; ХС липопротеидов низкой плотности (ЛПНП) 4,36 (0,00-4,45) ммоль/л; ХС липопротеидов очень низкой плотности 0,74 (0,00-0,90) ммоль/л; индекс атерогенности 6,4 (0,0-4,0).
Электрокардиография: положение электрической оси сердца горизонтальное; ритм - синусовая нормокардия; частота сердечных сокращений 76 в 1 мин.
Ультразвуковое дуплексное сканирование (УЗДС) брахиоцефальных артерий (БЦА): в бифуркации правой общей сонной артерии (ОСА) с переходом на внутреннюю сонную артерию (ВСА) визуализируется концентрическая, гетерогенная, преимущественно повышенной эхогенности с кальцинозом, с неровной поверхностью атеросклеротическая бляшка, стеноз ОСА 30-35%, ВСА - 30-35%; в бифуркации левой ОСА с переходом на ВСА визуализируется концентрическая, гетерогенная, преимущественно повышенной эхогенности с кальцинозом, с неровной поверхностью атеросклеротическая бляшка, стеноз ОСА 25-30%, ВСА - 25-30%.
Эхокардиография: уплотнение аорты, створок аортального, митрального клапанов. Камеры сердца не расширены. Толщина стенок левого желудочка в норме. Сократительная функция левого желудочка в норме (фракция выброса 58%). Зоны нарушения локальной сократимости не выявлены. Признаков легочной гипертензии нет. Митральная регургитация I степени. Трикуспидальная регургитация I степени. Легочная регургитация I степени.
Нейровизуализационное исследование: на МРТ головного мозга - единичные мелкие очаги сосудистого характера в лобно-теменной области белого вещества головного мозга. Визуализируются очаги гиперинтенсивного МР-сигнала в режимах DWI (диффузионно-взвешенное изображение), T2-FLAIR (инверсия-восстановление с ослаблением сигнала от жидкости) и Т2-ВИ (Т2-взвешенное изображение). Лейкоареоз вдоль рогов боковых желудочков (рис. 2).
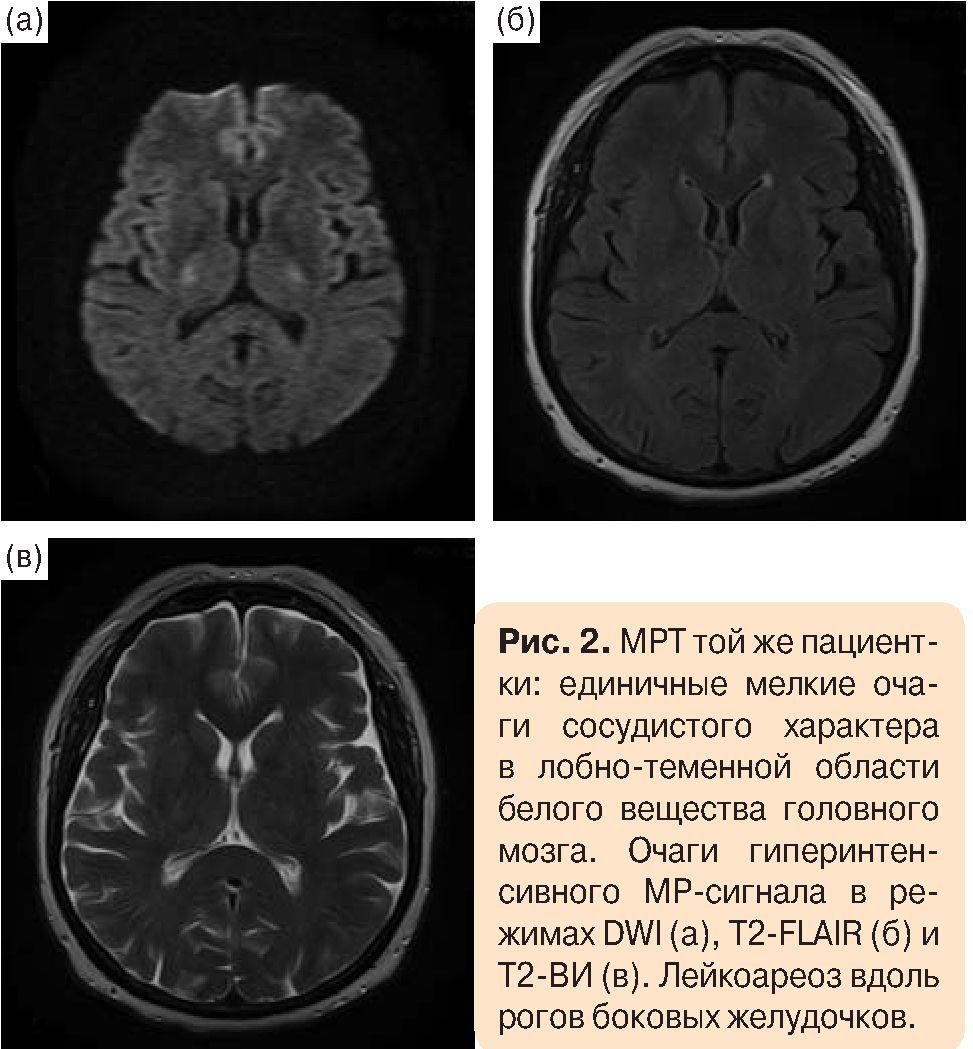
Заключение: цереброваскулярная болезнь (код I67.8/1 по МКБ-10), ХИГМ II стадии, субкомпенсация; синдром умеренных когнитивных нарушений по подкорковому типу; гипертоническая болезнь III стадии, риск сердечно-сосудистых осложнений IV степени; атеросклероз с сочетанными стенозами сонных артерий.
Назначено следующее лечение.
1. Наблюдение врачами-специалистами неврологом, терапевтом амбулаторно в поликлиническом учреждении по месту жительства.
2. Комплекс лечебных мероприятий.
2.1. Соблюдение диеты: ограничение поваренной соли, жиров животного происхождения, продуктов, богатых ХС, легкоусвояемых углеводов.
2.2. Курсы (противорецидивной) вазоактивной и нейро-метаболической терапии 2 раза в год.
2.3. Лекарственные средства/препараты:
- постоянно гипотензивная терапия: ингибиторы ангиотензинпревращающего фермента (эналаприл 5 мг по 1 таблетке 2 раза в день) под контролем АД, при необходимости титрование дозы препарата;
- постоянно бисопролол 5 мг по 1 таблетке 1 раз в день под контролем пульса, при необходимости титрование дозы препарата;
- постоянно антиагрегантная терапия (ацетилсалициловая кислота кишечного всасывания 125 мг вечером);
- постоянно статины (розувастатин 20 мг вечером) под контролем липидного профиля (ХС, триглицериды, липопротеиды) и трансаминаз (аспартатаминотрансфераза (АСТ), аланинаминотрансфераза (АЛТ));
- курсами вазоактивная и нейрометаболическая терапия (Цитофлавин по двухступенчатой схеме: 10,0 мл на 200 мл 0,9% раствора хлорида натрия внутривенно капельно - 10 дней, затем по 2 таблетки 2 раза в день -25 дней).
Все препараты могут быть заменены на аналогичные в эквивалентных дозах в пределах федерального списка.
2.4. Физиотерапевтическое лечение: лечебная физкультура, физиотерапия.
3. Контрольные лабораторные исследования: липидограмма в динамике, контроль уровней АСТ, АЛТ в биохимическом анализе крови.
4. Функциональные исследования: УЗДС БЦА 1 раз в год.
5. Другое: контроль АД, пульса.
Повторная консультация (через 3 мес): пациентка сообщает о значительном улучшении памяти, внимания, отмечает ощущение “ясности в голове”. Сын пациентки подтверждает, что у матери действительно улучшилась память, уменьшилась забывчивость, нормализовался фон настроения, улучшились функции планирования и целеполагания. В настоящее время сохраняется лишь небольшая бытовая забывчивость. Артериальное давление колеблется в диапазоне 120-150/80-90 мм рт. ст. Масса тела снизилась до 89 кг. Уровень ЛПНП 3,2 ммоль/л, ЛПВП 1,5 ммоль/л, общего ХС 5,5 ммоль/л. В неврологическом статусе - без особенностей. При повторном когнитивном тестировании: показатель по МоСА - 26 баллов, в пробе Шульте - 25 с, по MMSE - 29 баллов (не вспомнила 1 из 3 слов). В тесте “12 слов”: самостоятельно вспомнила 8 слов, с подсказкой - еще 4. После отвлечения внимания на 2 мин самостоятельно вспомнила 7 слов, с подсказкой - еще 4. Проведена повторная оценка аффективного статуса по HADS: тревога - 8 баллов, депрессия - 3 балла. По шкале депрессии Бека пациентка набрала 9 баллов.
Рекомендовано: продолжить прием антигипертензивной терапии (эналаприл 5 мг по 1 таблетке 2 раза в день, бисопролол 5 мг по 1 таблетке 1 раз в день), антиагреган-тов (ацетилсалициловая кислота кишечного всасывания 125 мг вечером), статинов (розувастатин 20 мг вечером) под контролем липидного профиля (ХС, триглицериды, липопротеиды) и трансаминаз (АСТ, АЛТ).
Ранее на амбулаторном этапе больная использовала нейрометаболические препараты (холина альфосцерат, пирацетам и его производные), прием которых вызывал у нее выраженное нарушение сна. В связи с этим (инсомния в анамнезе) данные лекарственные средства не были рекомендованы.
Обсуждение
При развитии острого и хронического нарушения мозгового кровообращения в отечественной литературе широко обсуждаются нейропротективные, в том числе антиоксидантные, свойства Цитофлавина. Активными компонентами препарата являются янтарная кислота, рибоксин, никотинамид, рибофлавин, которые в совокупности обеспечивают его метаболическую активность, повышающую в том числе жизнеспособность нейронов и нейрональную пластичность, церебральный энергетический метаболизм и уменьшающую образование свободных радикалов с восстановлением активности антиоксидантных ферментов. Цитофлавин, улучшая усвоение кислорода и глюкозы нервными клетками, оказывает активизирующее действие на метаболические процессы в головном мозге, действует как нейрометаболический стимулятор, увеличивая энергообеспечение путем усиления потребления и утилизации кислорода и глюкозы не только в нервных клетках, но и в мышечной ткани. Всё это приводит к ускорению синтеза АТФ в головном мозге, стимуляции всего клеточного метаболизма, улучшению кровоснабжения ишемизированной ткани мозга и улучшению мозговых функций. Доказано, что препарат обладает способностью нейтрализовать действие лактата, пирувата и цитрата при гипоксии, а также восстанавливать активность фермента цитохромоксидазы при церебральной ишемии [19-21]. Цитофлавин повышает устойчивость мембран нейронов и клеток глии, а также их органелл к воздействию ишемии, гипоксии, токсическим воздействиям [22].
Эффективность Цитофлавина в лечении пациентов с острыми и хроническими формами нарушений мозгового кровообращения была продемонстрирована в нескольких клинических, в том числе многоцентровых, рандомизированных двойных слепых исследованиях [19, 23-26]. Так, у пациентов в восстановительном периоде после первого ишемического инсульта на фоне приема Цитофлавина отмечалось улучшение когнитивных функций и повышение уровня нейротрофических факторов (BDNF (нейротрофический фактор головного мозга)) [27, 28]. Схожие клинические результаты в отношении когнитивных функций были отмечены и в других исследованиях [29]. Было подтверждено положительное влияние Цитофлавина на состояние микроциркуляторного русла у больных с цереброваскулярной патологией [30]. Цитофлавин является эффективным средством профилактики и коррекции послеоперационных когнитивных расстройств у пациентов группы высокого риска [31].
В представленном нами клиническом наблюдении у больной с умеренными когнитивными нарушениями при ХИГМ на фоне проведенного лечения препаратом Цитофлавин отмечалось улучшение, главным образом, управляющей функции (планирование, целеполагание), что подтверждалось результатами когнитивного тестирования. В частности, пациентка лучше стала концентрировать внимание, более четко формулировала мысль (оценка по МоСА 24/26 баллов; в пробе Шульте - 20/25 с).
Таким образом, СКР - это не отдельное заболевание, а синдромальный диагноз с множеством клинических вариантов и потенциальных причин, их вызывающих, что подчеркивает многогранную природу данного патологического процесса и, как следствие, необходимость индивидуального подхода в лечении этой категории пациентов. Терапия должна иметь этиопатогенетическую, симптоматическую и нейропротективную направленность.
Комплексная нейропротективная терапия когнитивных нарушений при ХИГМ обусловлена различными точками приложения в цепи патогенетических процессов, в первую очередь воздействием на процессы гипоксически-ишемического повреждения, а также на нейромедиаторные системы регуляции, что приводит к повышению нейрофункциональной активности и морфологической целостности клеток мозга [32].
Собственные результаты клинического наблюдения позволяют считать эффективным и целесообразным применение препарата Цитофлавин в лечении больных с синдромом умеренного когнитивного расстройства на фоне ХИГМ, обусловленной АГ.
ЛИТЕРАТУРА
1. Paradise MB, Sachdev PS. Vascular cognitive disorder. Seminars in Neurology 2019 Apr;39(2):241-50.
2. Cerebrovascular disease, cognitive impairment and dementia. 2nd ed. O’Brien J, Ames D, Gustafson L, Folstein MF, Chiu E, editors. London, England: Martin Dunitz; 2004. 406 p.
3. Blinder P, Tsai PS, Kaufhold JP, Knutsen PM, Suhl H, Kleinfeld D. The cortical angiome: an interconnected vascular network with noncolumnar patterns of blood flow. Nature Neuroscience 2013 Jul;16(7):889-97.
4. Nishimura N, Rosidi NL, Iadecola C, Schaffer CB. Limitations of collateral flow after occlusion of a single cortical penetrating arteriole. Journal of Cerebral Blood Flow & Metabolism 2010 Dec;30(12):1914-27.
5. Iadecola C. The pathobiology of vascular dementia. Neuron 2013 Nov;80(4):844-66.
6. Путилина М.В. Современные представления о болезни мелких сосудов головного мозга. Журнал неврологии и психиатрии им. С.С. Корсакова 2019;119(11):65-73.
7. Lozano R, Naghavi M, Foreman K, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. The Lancet 2012 Dec;380(9859):2095-128.
8. Sachdev P, Kalaria R, O’Brien J, et al.; International Society for Vascular Behavioral and Cognitive Disorder. Diagnostic criteria for vascular cognitive disorders: a VASCOG statement. Alzheimer Disease and Associated Disorders 2014 Jul-Sep;283(3):206-18.
9. Шишкова В.Н. Взаимосвязь развития метаболических и когнитивных нарушений у пациентов с сахарным диабетом, предиабетом и метаболическим синдромом. Consilium Medicum. Неврология и ревматология 2010;1:36-42.
10. Skrobot OA, Black SE, Chen C, et al.; VICCCS group; Ben-Shlomo Y, Passmore AP, Love S, Kehoe PG. Progress toward standardized diagnosis of vascular cognitive impairment: guidelines from the Vascular Impairment of Cognition Classification Consensus Study. Alzheimer’s and Dementia 2018 Mar;14(3):280-92.
11. Albu CV, Pădureanu V, Boldeanu MV, Bumbea AM, Enescu AŞ, Albulescu DM, Siloși CA, Enescu A. Vascular neurocognitive disorders and the vascular risk factors. Journal of Mind and Medical Sciences 2018;5(1):7-15.
12. Charidimou A. Book review: “Cerebral small vessel disease”. What’s the big deal about small vessels? Frontiers in Neurology 2015 Aug;6:175.
13. Erkinjuntti T, Kurz A, Gauthier S, Bullock R, Lilienfeld S, Damaraju CV. Efficacy of galantamine in probable vascular dementia and Alzheimer’s disease combined with cerebrovascular disease: a randomised trial. The Lancet 2002 Apr;359(9314):1283-90.
14. Wilkinson D, Doody R, Helme R, Taubman K, Mintzer J, Kertesz A, Pratt RD; Donepezil 308 Study Group. Donepezil in vascular dementia: a randomized, placebo-controlled study. Neurology 2003 Aug;61(4):479-86.
15. Granzotto A, Canzoniero LMT, Sensi SL. A neurotoxic Ménageà-trois: glutamate, calcium, and zinc in the excitotoxic cascade. Frontiers in Molecular Neuroscience 2020 Nov;13:600089.
16. Parsons CG, Stöffler A, Danysz W. Memantine: a NMDA receptor antagonist that improves memory by restoration of homeostasis in the glutamatergic system – too little activation is bad, too much is even worse. Neuropharmacology 2007 Nov;53(6):699-723.
17. Захаров В.В., Вахнина Н.В., Ковалева А.Г., Межмидинова С.К. Диагностика и лечение хронической ишемии головного мозга. Медицинский совет 2020;8:11-20.
18. Путилина М.В., Теплова Н.В. Рациональная фармакотерапия хронической ишемии головного мозга. Клинические рекомендации. 2-е изд., испр. и доп. М.: МЕДпресс-информ; 2020. 549 c.
19. Белкин А.А., Лейдерман И.Н., Коваленко А.Л., Ризоханова О.А., Парфенов С.А., Сапожников К.В. Цитофлавин как компонент реабилитационного лечения пациентов с ишемическим инсультом, осложненным ПИТ-синдромом. Журнал неврологии и психиатрии им. С.С. Корсакова 2020;120(10):27-32.
20. Путилина М.В., Теплова Н.В., Баирова К.И., Петрикеева А.Е., Шабалина Н.И. Эффективность и безопасность Цитофлавина при реабилитации больных с постковидным синдромом: результаты проспективного рандомизированного исследования ЦИТАДЕЛЬ. Журнал неврологии и психиатрии им. С.С. Корсакова 2021;121(10):39-45.
21. Максимова М.Ю. Комбинированное действие янтарной кислоты, рибоксина, никотинамида, рибофлавина при лечении хронической ишемии головного мозга. Медицинский совет 2022;16(21):20-6.
22. Камчатнов П.Р., Чугунов А.В., Осмаева З.Х. Цитофлавин: возможности метаболической терапии у больных с дисциркуляторной энцефалопатией. Доктор.Ру 2019;1(156):14-9.
23. Федин А.И., Румянцева С.А., Пирадов М.А., Скоромец А.А., Парфенов В.А., Клочева Е.Г., Шоломов И.И., Кухцевич И.И., Золкорняев И.Г., Белоногов М.А. Эффективность нейрометаболического протектора цитофлавина при инфарктах мозга (многоцентровое рандомизированное исследование). Вестник Северо-Западного государственного медицинского университета им. И.И. Мечникова 2005;1:13-9.
24. Суслина З.А., Румянцева С.А., Танашян М.М., Скоромец А.А., Клочева Е.Г., Федин А.И., Коваленко А.Л., Силина Е.В., Шоломов И.И. Комплексная энергокоррекция хронической ишемии мозга. Журнал неврологии и психиатрии им. С.С. Корсакова 2011;111(3):25-30.
25. Румянцева С.А., Коваленко А.Л., Силина Е.В., Ступин В.А., Кабаева Е.Н., Чичановская Л.В., Назаров М.В., Цукурова Л.А., Буреничев Д.В., Голиков К.В., Сальников М.В., Белова Л.А., Машин В.В., Мазина Н.К., Жилина Е.А., Колотик-Каменева О.Ю., Шерман М.А. Эффективность комплексной антиоксидантной энергокоррекции разной длительности при лечении инфаркта головного мозга (результаты многоцентрового рандомизированного исследования). Журнал неврологии и психиатрии им. С.С. Корсакова 2015;115(8):45-52.
26. Cазонов И.Э., Лаврентьева И.В., Головина Н.П. Применение цитофлавина при реперфузионной терапии ишемического инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова 2016;116(3):25-8.
27. Каракулова Ю.В., Селянина Н.В., Желнин А.В., Филимонова Т.А., Цепилов С.В. Влияние антиоксидантной терапии на нейротрофины и процессы реабилитации после инсульта. Журнал неврологии и психиатрии им. С.С. Корсакова 2016;116(8):36-9.
28. Путилина М.В. Нейропротекторная терапия хронической ишемии головного мозга. Врач 2008;8:27-32.
29. Полтавская Т.С., Баженов В.А., Воложанин А.В. Эффективность метаболической коррекции в раннем восстановительном периоде у пациентов с ишемическим инсультом. Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2020;120(3-2):49-53.
30. Белова Л.А., Машин В.В., Колотик-Каменева О.Ю., Белова Н.В., Скудери А., Антигнани П.Л. Влияние терапии препаратом цитофлавин на состояние церебральной гемодинамики при различных стадиях гипертонической болезни. Журнал неврологии и психиатрии им. С.С. Корсакова 2017;117(7):28-35.
31. Боголепова А.Н. Послеоперационная когнитивная дисфункция. Журнал неврологии и психиатрии им. С.С. Корсакова 2022;122(8):7-11.
32. Путилина М.В. Новые возможности комплексных препаратов в терапии цереброваскулярных заболеваний. Лечебное дело 2022;3/4:15-22.
Personalized Approach to Treatment of Vascular Cognitive Impairment (a Clinical Case)
E.Yu. Solovieva and I.P. Filatova
The article is devoted to the problems of vascular cognitive impairment (VCI) in the context of one of the most common pathological conditions, inextricably connected to different types of cerebrovascular disorders. The reasons for VCI development are discussed, specifying that one of the dominating mechanisms underlying the development of neurocognitive impairments is chronic age-related dysregulation, although other factors, such as inflammatory vascular reaction and, therefore, hypoxic and ischemic lesions and cardiovascular dysfunction also play an important role. Therefore, the control over the main risk factors of cerebrovascular disease, including multimodal strategies using lifestyle modification, is the most promising approach in treatment and prevention of VCI. The authors suggest that the solution for problem of choosing and prescribing drugs for management of this pathological condition should rely on the comprehension of own clinical experience. Based on the literature review and original data, the authors conclude that it is reasonable and efficient to apply Cytoflavin in treatment of patients with mild cognitive impairment accompanied by cerebral small vessel disease associated with hypertension.
Key words: cerebrovascular diseases, vascular cognitive impairments, cerebral small vessel disease, Cytoflavin.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)