Постковидный синдром глазами невролога
Статьи
В.В. Захаров
Первый Московский государственный медицинский университет им. И.М. Сеченова
Ключевые слова: COVID-19, SARS-CoV-2, коронавирус, астения, когнитивные нарушения, инсульт, эндотелиит, нейропротекция
Для цитирования: Захаров, В. В. Постковидный синдром глазами невролога / В. В. Захаров // Поведенческая неврология. – 2021. – № 2. – С. 14-22. – DOI 10.46393/2712-9675_2021_2_14_22. – EDN FAJIBO.
Аннотация
Не менее чем у трети пациентов с COVID-19 в острой и/или резидуальной фазе наблюдаются неврологические расстройства. Чаще всего фиксируются астенические, когнитивные нарушения, спутанность сознания, инсульты, периферические невропатии, аносмия, дисгевзия, болевые синдромы. Наиболее вероятными механизмами поражения нервной системы при COVID-19 являются патологические иммунные реакции, цереброваскулярные заболевания в связи с коронавирусным эндотелиитом и гипоксическая травма мозга; обсуждается также прямое нейротропное воздействие вируса. Имеется положительный опыт использования нейропротективных препаратов в лечении астенических и когнитивных последствий новой коронавирусной инфекции.
Post-COVID syndrome from the point of view of a neurologist
V.V. Zakharov
I.M. Sechenov First Moscow State Medical University
Key words: COVID-19, SARS-CoV-2, coronavirus, asthenia, cognitive impairment, stroke, endotheliitis, neuroprotection
Annotation
At least one third of COVID-19 patients develop neurologic disorders in acute and/or residual phase of the disease. The most often neurologic disturbances are: asthenia, cognitive impairment, confusion, strokes, peripheral neuropathy, anosmia, dysguesia and pain. Probable mechanisms of nervous system involvement in COVID-19 are pathologic immune reactions, cerebral vascular disease because of coronavirus endotheliitis and hypoxic brain trauma; direct neurotropic viral invasion is discussed also. The article presents positive experience of treatment of asthenia and cognitive complications of new coronavirus infection with neuroprotective medications.
С самого начала пандемии COVID-19 стали появляться сообщения о частой ассоциации новой коронавирусной инфекции с неврологическими расстройствами. Китайские врачи первыми показали значительную распространенность выраженной и упорной головной боли, не соответствующей тяжести общей интоксикации, частые эпизоды делириозной спутанности сознания, также не соответствующие тяжести общей интоксикации, снижение обоняния и вкуса [1].
Дальнейшие наблюдения подтвердили нейротропизм нового заболевания. В настоящее время ни у кого не вызывает серьезных сомнений, что COVID-19 очень часто сопровождается неврологическими осложнениями, причем как в остром периоде, так и спустя недели и месяцы после заражения. По некоторым данным, частота заинтересованности нервной системы может достигать половины и даже двух третей от всех случаев инфицирования SARS-(CoV-2 [2, 3]. Чаще всего описываются нарушения обоняния и вкуса (35,6%), миалгии (18,5%), головная боль (10,7%), инсульты (8,1%), головокружение (7,9%), нарушения сознания (7,8%), эпилептические припадки (1,5%), энцефалиты, невралгии, атаксия, синдром Гийена-Барре, синдром Миллера-Фишера, внутримозговые кровоизлияния, краниальные невропатии и мышечная дистония [4]. Пока остается открытым и требует дальнейшего изучения вопрос об обратимости или длительности неврологических осложнений.
Клиницисту важно иметь представление о наиболее частых неврологических расстройствах, ассоциированных с вирусом SARS-CoV-2, и механизмах их развития. Это важно для оптимизации ранней диагностики неврологических осложнений и выработки патогенетически обоснованных подходов к терапии.
Механизмы поражения нервной системы при COVID-19
Обсуждается несколько механизмов, по которым новая коронавирусная инфекция может приводить к поражениям центральной и периферической нервной системы (рис. 1).
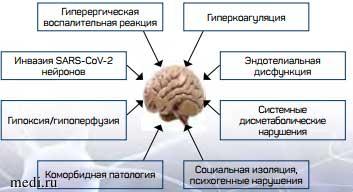 Рис. 1. Предполагаемые механизмы поражения мозга при COVID-19
Рис. 1. Предполагаемые механизмы поражения мозга при COVID-19
Прямое инфицирование нейронов и глиоцитов
Как известно, «ключом», открывающим вирусу SARS-CoV-2 вход в клетку, является рецептор к ангиотензинпревращающему ферменту. Данный тип рецепторов широко представлен в центральной нервной системе и присутствует как на мембране, так и в цитоплазме нейронов и глиоцитов, в коре и подкорковых серых узлах [5]. Поэтому теоретически можно ожидать развития у части пациентов с COVID-19 вирусного энцефалита. Обсуждаются два возможных пути проникновения SARS-CoV-2 в головной мозг: из кровеносного русла через гематоэнцефалический барьер вместе с иммунокомпетентными клетками и через слизистую носа и обонятельные нервные волокна [5]. Однако на практике число случаев доказанного вирусного энцефалита коронавирусной этиологии совсем невелико [6].
Иммуноопосредованное поражение
В ряде гистологических работ было показано, что у пациентов в острой фазе COVID-19 могут наблюдаться повышение проницаемости гематоэнцефалического барьера и выход иммунокомпетентных клеток из кровеносного русла в паренхиму головного мозга, а также активация местной воспалительной микроглиальной реакции в белом веществе [7]. Наиболее тяжелым вариантом иммуноопосредованного поражения головного мозга у пациентов с COVID-19 является острая некротическая энцефалопатия, которая изредка развивается у пациентов с COVID-19 c синдромом так называемого цитокинового шторма [6]. Вероятно, менее тяжелые гиперергические дизиммунные реакции развиваются значительно чаще.
COVID-19 приводит к снижению церебрального метаболизма преимущественно в лобной и теменной долях головного мозга, что было показано в работе J.A. Hosp и соавт. методом позитронно-эмиссионной томографии (ПЭТ) [8]. Важно отметить, что церебральный гипометаболизм сохранялся после выздоровления - ПЭТ-исследование в цитируемой работе выполнялось после двух отрицательных результатов ПЦР-теста и двух дней без респираторных симптомов. При этом снижение церебрального метаболизма в сером веществе головного мозга достоверно коррелировало с результатами нейропсихологических тестов. При обычной магнитно-резонансной томографии (МРТ) у обследованных пациентов не выявлялось патологических отклонений, за исключением церебрального инфаркта в одном случае [8]. Таким образом, страдание головного мозга в постковидном периоде у большинства пациентов имеет преимущественно функциональный характер, что позволяет надеяться на его обратимость. О связи церебрального гипометаболизма с дизиммунными реакциями говорит сочетание изменения метаболизма с активацией микроглии в белом веществе, что было продемонстрировано при патоморфологическом исследовании головного мозга [8].
Цереброваскулярные заболевания
Возможно, наиболее важным механизмом поражения как головного мозга, так и периферической нервной системы и других органов и систем у пациентов с COVID-19 является поражение вирусом эндотелиоцитов сосудов. Многочисленные свидетельства прямого воздействия вируса на эндотелий сосудов различных органов и тканей имеются в современной литературе [9-11]. Доказано, что инфицирование вирусом SARS-СоV-2 сопровождается выраженными изменениями реологических свойств крови со сдвигом баланса между свертывающей и противосвертывающей системой крови в сторону гиперкоагуляции, в частности, со значительным повышением уровня D-димера [11-13]. В этих случаях неврологические расстройства в острой фазе и постковидном периоде имеют понятную сосудистую этиологию. Известно, что риск инсульта, как ишемического, так и геморрагического, у пациентов с новой коронавирусной инфекцией многократно повышен [12, 14]. Развитием церебрального эндотелиита в остром и подостром периоде коронавирусной инфекции можно также объяснить такие симптомы, как головная боль, делирий и эпилептические припадки.
В связи с обсуждаемой ролью коронавирусного эндотелиита в развитии ассоциированных с COVID-19 неврологических расстройств следует упомянуть единообразие механизмов развития инсультов и хронического прогрессирующего цереброваскулярного заболевания - так называемой хронической ишемии мозга. Исследования с использованием методов нейровизуализации свидетельствуют, что за диагнозами «хроническая ишемия мозга», «сосудистые когнитивные нарушения», «церебральная микроангиопатия» и другими скрываются в том числе такие сосудистые поражения, как немые инфаркты и микрокровоизлияния [15]. Поэтому можно обоснованно предположить, что перенесенный COVID-19 увеличивает не только риск инсульта, но и риск декомпенсации так называемой хронической ишемии мозга. Следовательно, постковидные когнитивные нарушения в значительной части случаев, вероятно, имеют преимущественно сосудистую природу.
Гипоксическая травма
При тяжелом течении COVID-19 у пациентов с дыхательной недостаточностью один из механизмов церебрального повреждения вполне очевиден - это острая и/или хроническая гипоксия головного мозга [16, 17]. Известно, что нейроны головного мозга очень чувствительны к гипоксическому состоянию. При этом кора и подкорковые серые узлы страдают раньше и в значительно большей степени, чем белое вещество. При критической гипоксемии гибель нейронов развивается в течение нескольких минут. В отсутствие нарушений сознания (без гипоксической комы) связанные с гипоксией изменения в нейронах являются потенциально обратимыми. Однако восстановление нормального функционирования нейронов может занять значительное время, измеряемое неделями и месяцами, особенно у пациентов с остаточными дыхательными расстройствами. Когнитивное снижение - достаточно характерное последствие церебральной гипоксии, хорошо известное и описанное, например, у пациентов с хронической обструктивной болезнью легких [18, 19]. Поэтому наличие астенических и когнитивных расстройств в постковидном периоде у пациентов с дыхательными расстройствами в остром периоде является закономерным и ожидаемым.
Социальная изоляция
Определенную угрозу для психоневрологического здоровья пациентов, особенно пожилого и старческого возраста, несут ограничительные меры, принятые в большинстве стран мира в связи с пандемией коронавирусной инфекции. Речь идет о запрете общественных собраний и публичных мероприятий, ограничении перемещения людей, в ряде случаев запрете на посещение родственниками пожилых лиц, проживающих в пансионатах, и даже на выход на улицу. Вынужденное ограничение умственной и физической активности, бездействие и социальная изоляция оказывают неблагоприятное влияние на когнитивную функцию и эмоциональную сферу человека, особенно в пожилом возрасте. В ряде исследований показано, что социальная изоляция и чувство одиночества негативно коррелируют с показателями памяти и когнитивных функций [20] и даже со степенью церебрального амилоидоза [21]. Особенно неблагоприятно влияние церебральной изоляции у лиц с начальными проявлениями дементирующих заболеваний. Так, наблюдения во время пандемии коронавирусной инфекции показали, что у пациентов с легкими когнитивными нарушениями и начальной деменцией введение ограничительных мер сопровождалось нарастанием выраженности когнитивного дефицита, увеличением частоты эпизодов делириозной спутанности сознания, ростом распространенности тревожно-депрессивных реакций, а также ухудшением походки с повышением риска падений [22-24].
Тревожно-депрессивные расстройства
Закономерным результатом нового серьезного вызова человечеству и последствием катастрофизации вопросов пандемии в средствах массовой информации стал значительный рост распространенности расстройств тревожно-депрессивного спектра. Согласно популяционным эпидемиологическим исследованиям, в настоящее время клинически значимая тревожно-депрессивная симптоматика выявляется у 25-30% населения в разных странах мира [24-26]. Расстройства тревожно-депрессивного спектра сами по себе снижают качество жизни пациентов и их родственников и могут приводить к декомпенсации преморбидного неврологического заболевания. Кроме того, как известно, длительная и выраженная тревога или депрессия за счет активации гипоталамо-гипофизарной надпочечниковой системы способствует увеличению темпа дегенеративно-атрофического процесса головного мозга. В ряде исследований было показано, что после депрессивного эпизода отмечается уменьшение объема важных для познавательной деятельности зон головного мозга, в том числе гиппокампа и префронтальной коры [27, 28]. При этом наблюдаются достоверные корреляции между длительностью депрессии и объемом гиппокампа [29].
Распространенность различных видов неврологических нарушений в постковидном периоде
Наиболее масштабным и репрезентативным исследованием эпидемиологии неврологических расстройств после перенесенной новой коронавирусной инфекции стала работа M. Taquet и соавт. [30]. В указанной работе была использована международная медицинская база данных TriNetX. Из общей популяции более 81 млн человек были выбраны данные 236 379 пациентов в возрасте 10 лет и старше, переболевших COVID-19 любой степени выраженности. Авторы проанализировали частоту встречаемости различных неврологических диагнозов, которые впервые в жизни выставлялись пациентам в течение 6 месяцев после заражения COVID-19 (табл. 1). В результате самыми распространенными неврологическими диагнозами оказались периферические невропатии, острые нарушения мозгового кровообращения и деменция [30].
Таблица 1.
Новые неврологические диагнозы, установленные в первые 6 месяцев после заражения COVID-19
| Диагноз |
Распространенность |
| Периферическая невропатия |
2,85% (2,69-3,0) |
| Ишемический инсульт |
2,1% (1,97-2,23) |
| Деменция |
0,67% (0,59-0,75) |
| Внутримозговое кровоизлияние |
0,56% (0,50-0,63) |
| Нервно-мышечные заболевания |
0,45% (0,40-0,52) |
| Паркинсонизм |
0,11% (0,08-0,14) |
| Энцефалит |
0,10% (0,08-0,13) |
Представляет большой практический интерес исследование из клиники Мэйо (США), также посвященное анализу различных видов неврологических и иных нарушений после перенесенной новой коронавирусной инфекции. Были проанализированы данные 100 последовательных пациентов, обратившихся в клинику по любой причине в первые несколько месяцев после COVID-19 и не страдавшие до COVID-19 каким-либо хроническим заболеванием. Большинство пациентов, включенных в исследование, были моложе 65 лет, средний возраст составил 45,0 ± 4,2 года. Пациенты обращались в клинику в различные сроки после перенесенного инфекционного заболевания, в среднем через 93,4 ± 65,2 дня после заражения. Как свидетельствует цитируемая работа, самыми частыми неврологическими причинами для обращения к врачу в постковидном периоде являются астения, когнитивные нарушения, расстройства сна и легкая психопатологическая симптоматика (табл. 2). При этом большинство пациентов имели одновременно несколько неврологических жалоб или симптомов. Постковидные неврологические нарушения у обследованных больных вызывали существенные затруднения в повседневной жизни. Лишь треть из проанализированных пациентов смогли вернуться к труду в том же объеме, что и до болезни [31].
Таблица 2.
Неврологические расстройства в постковидном периоде. Анализ 100 последовательных пациентов, обратившихся в клинику Мэйо (США), после «выздоровления» от COVID-19
| Неврологический симптом |
Частота, % |
| Утомляемость, астения |
80 |
| Когнитивные нарушения |
45 |
| Нарушения сна |
30 |
| Пограничные психические расстройства |
26 |
| Головная боль |
20 |
| Головокружение |
19 |
| Парестезии |
17 |
| Нарушение обоняния/вкуса |
9 |
| Лабильность АД/ЧСС |
7 |
| Выпадение волос |
6 |
Периферические невропатии
В остром периоде и сразу после выздоровления от коронавирусной инфекции повышен риск развития периферических невропатий. Описываются различные виды поражений периферической нервной системы, в том числе мононевропатия лицевого, других краниальных нервов, поражение периферических нервов конечностей, а также дизиммунные и иные полиневропатии, синдром Гийена-Барре и редкая дизиммунная невропатия Миллера-Фишера (сочетание офтальмоплегии, атаксии и арефлексии) [32-34]. Обсуждается роль заинтересованности обонятельного нерва в развитии таких характерных для острой фазы COVID-19 и постковидного периода симптомов, как снижение обоняния и вкуса, которые развиваются не менее чем у трети заболевших [32, 33]. Достаточно частым и тяжелым следствием периферической невропатии после COVID-19 являются невропатические боли [35].
По некоторым данным, риск развития острой воспалительной демиелинизирующей полирадикулоневропатии Гийена-Барре увеличивается в связи с коронавирусной инфекцией приблизительно в 10 раз по сравнению со среднестатистическим популяционным риском [36]. Наиболее часто симметричные восходящие вялые параличи вместе с характерными сенсорными расстройствами развиваются в первые две-три недели после заражения коронавирусной инфекцией. Предполагается, что причиной синдрома Гийена-Барре, ассоциированного с вирусом SARS-CoV-2, являются «перекрестная» атака миелина периферических нервов иммуноглобулинами, образующимися в иммунокомпетентных клетках в ответ на проникновение в организм коронавируса [36]. Данный механизм аналогичен механизму возникновения синдрома Гийена-Барре при других бактериальных и вирусных заболеваниях (инфекционном мононуклеозе, цитомегаловирусе и др.). Однако нельзя исключить и роль ишемического повреждения периферических нервов в связи с предполагаемым развитием коронавирусного эндотелиита. Для подобного патогенетического механизма поражения периферической нервной системы более характерно развитие множественной мононевропатии как последствия множественных инфарктов периферических нервов.
Острые нарушения мозгового кровообращения
Как видно из табл. 1, риск развития ишемического инсульта в течение 6 месяцев после заражения COVID-19 составляет 2,1%, а внутримозгового кровоизлияния - 0,56% [30]. В то же время среднестатический риск инфаркта мозга в нашей стране, согласно сборнику статистических материалов за 2017 г., составляет 0,28%, а внутримозгового кровоизлияния - 0,044% в течение года [37]. Таким образом, новая коронавирус-ная инфекция многократно увеличивает риск развития как ишемического, так и геморрагического инсульта. В большинстве случаев непосредственной причиной ишемического инсульта, ассоциированного с корона-вирусной инфекцией, является тромбоз или эмболия крупного сосуда; нередко наблюдается одновременное поражение нескольких крупных сосудов [12, 14, 35, 38]. Напротив, инсульт, ассоциированный с COVID-19, несколько реже, чем инсульт в отсутствие коронавирусной инфекции, связан с патологией церебральных сосудов небольшого калибра (церебральной микроангиопатией) [12, 14, 35, 38]. Важно подчеркнуть, что в достаточно большом проценте случаев инсульт может быть первым проявлением COVID-19. По некоторым данным, приблизительно у четверти пациентов с инсультом и COVID-19 коронавирусная инфекция была диагностирована методом ПЦР или компьютерной томографии легких в отсутствие характерной клинической симптоматики, а причиной обращения за медицинской помощью было острое развитие нейроваскулярного синдрома [12]. Прогноз при инсульте на фоне коронавирусной инфекции серьезный, показатели летальности существенно выше, чем при инсульте без COVID-19 [12, 14, 38].
Наиболее частой лабораторной находкой у пациентов с инсультом на фоне COVID-19 является повышение D-димера и фибриногена, нередко значительное, что свидетельствует о роли дисбаланса свертывающей и противосвертывающей системы крови в патогенезе связанных с коронавирусной инфекцией острых нарушений мозгового кровообращения [12-14]. Имеются также сообщения о повышенной частоте встречаемости антител к волчаночному антикоагулянту и кардиолипину, то есть о развитии вторичного антифосфолипидного синдрома [12]. Обычно инсульт на фоне COVID-19 развивается у пациентов пожилого возраста с артериальной гипертензией, другими заболеваниями сердечно-сосудистой системы, сахарным диабетом и др. Однако в литературе нередко встречается также описание случаев острого нарушения мозгового кровообращения у лиц молодого и среднего возраста без каких-либо дополнительных факторов сосудистого риска. При этом ишемический инсульт может развиваться на фоне нетяжелого течения коронавирусной инфекции [39].
Когнитивные нарушения
По данным М. Taquet и соавт., относительный риск развития деменции в первые 6 месяцев после коронавирусной инфекции в 1,7 раза выше, чем после обычной ОРВИ [30]. Однако деменция, как известно, лишь часть спектра когнитивных расстройств, который включает субъективные, легкие и умеренные нарушения. В настоящее время имеются многочисленные свидетельства, что легкие и умеренные когнитивные нарушения, возможно, являются самым частым неврологическим последствием новой коронавирусной инфекции. Британские нейропсихологи провели онлайн-тестирование более 84 тыс. пациентов старше 16 лет, у которых до коронавирусной инфекции не отмечалось каких бы то ни было когнитивных трудностей. Результаты когнитивных тестов достоверно отличались от возрастных нормативов как по интегративным показателям, так и особенно в сферах памяти и внимания; при этом степень отклонения от нормы зависела от тяжести перенесенной коронавирусной инфекции [40].
Когнитивное ухудшение после коронавирусной инфекции у лиц пожилого возраста может сохраняться в течение достаточно длительного времени. Так, в работе T Lui и соавт. [41] были проанализированы когнитивные показатели 1539 пациентов старше 60 лет через 6 месяцев после заражения вирусом SARS-CоV-2. Выраженные когнитивные нарушения сохранялись у 10,5%, а легкие - у 25,2% пациентов с тяжелой формой COVID-19. У пациентов с легкой формой COVID-19 данные показатели составили 0,7 и 4,8% соответственно, что также достоверно отличалось от подобранной по возрасту и другим значимым показателям контрольной группы. При этом более высокий риск когнитивных нарушений отмечался у пациентов более пожилого возраста, при более тяжелом течении коронавирусной инфекции и в особенности у тех, кто в остром периоде получал ИВЛ или кислородотерапию. Предикторами когнитивного ухудшения в постковидном периоде были также сердечно-сосудистые заболевания, хроническая обструктивная болезнь легких и делирий в острой фазе коронавирусной инфекции [41].
Новая коронавирусная инфекция вызывает ухудшение в различных когнитивных сферах. По данным A. Jaywant и соавт., наиболее часто страдают гибкость мышления, темп познавательной деятельности и непосредственное воспроизведение слов, в то время как трудности отсроченного воспроизведения и узнавания слов относительно редки [42]. М. Mazza и соавт. на основании исследования 226 пациентов после коронавирусной пневмонии сообщают, что самым частым когнитивным симптомом в постковидном периоде является недостаточность управляющей функции [43].
На конкретные патогенетические механизмы когнитивных нарушений косвенно указывают корреляции когнитивных нарушений с теми или иными лабораторными изменениями. По данным M. Mazza и соавт., выраженность нарушений внимания, управляющей функции и памяти в постковидном периоде достоверно коррелирует с уровнем воспалительных маркеров в начале болезни [43]. K.W. Miskowiak и соавт. сообщают о достоверной корреляции между показателями отсроченной памяти, темпом познавательной деятельности и уровнем D-димера в острой фазе [44]. Таким образом, наиболее актуальными являются два патогенетических механизма, которые обсуждались выше: дизиммунные расстройства и цереброваскулярные заболевания.
Наблюдается ассоциация между когнитивными нарушениями и другими неврологическими осложнениями GOVID-19. Так, M. Almeria и соавт. [45] сообщают о достоверной связи между более выраженными нарушениями оперативной памяти и наличием головной боли, дисгевзии и аносмии. Головная боль также была достоверно связана со степенью недостаточности управляющей функции. На основании сказанного можно обоснованно предполагать общность механизмов развития когнитивных и других неврологических последствий COVID-19 [45].
Приводим собственное наблюдение пациентки молодого возраста с когнитивными и астеническими расстройствами после коронавирусной инфекции.
Пациентка, 38 лет, по профессии юрист, на момент консультации получает второе высшее образование, учится на психолога. Всегда пользовалась хорошим здоровьем. За 9 месяцев до консультации переболела новой коронавирусной инфекцией в легкой форме: в течение двух недель отмечались небольшой субфебрилитет, общая слабость и выраженная сонливость. После этого и вплоть до даты консультации сохраняются общая слабость, сонливость, утомляемость при умственной и физической работе, трудности концентрации внимания и повышенная забывчивость. Указанные симптомы мешают повседневной деятельности, привели к снижению успеваемости в вузе, вызывают выраженный эмоциональный дискомфорт.
При осмотре: физикальный осмотр по органам и системам - без патологии, неврологический статус в норме. Нейропсихологическое исследование: мини-исследование психического статуса (Mini-Mental State Examination) - 25 баллов, ошибки в пробе на серийный счет, конструктивная диспраксия, брадифрения (проба Шульте - 56 секунд) (рис. 2).
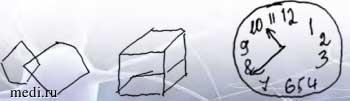 Рис. 2. Рисунок пациентки 38 лет с постковидными когнитивными нарушениями
Рис. 2. Рисунок пациентки 38 лет с постковидными когнитивными нарушениями
МРТ головы не выявляет патологических изменений в мозге.
Таким образом, у молодой женщины без анамнеза цереброваскулярных и нейродегенеративных заболеваний после коронавирусной инфекции развиваются когнитивные нарушения, которые вызывают существенный дискомфорт в повседневной жизни и сохраняются на протяжении значительного времени.
Нейропротективный препарат Цитофлавин можно рекомендовать для широкого клинического использования при астенических и когнитивных нарушениях, а также последствиях цереброваскулярных событий на фоне COVID-19
Лечение неврологических нарушений в постковидном периоде
Поскольку вся ситуация вокруг COVID-19 является новой, устоявшихся международных рекомендаций по лечению тех или иных постковидных неврологических расстройств пока нет. Лечение строится исходя из представлений о патогенетических основах неврологических осложнений и имеющегося клинического опыта.
В лечении последствий цереброваскулярных заболеваний, когнитивных и астенических расстройств, ассоциированных с COVID-19, наиболее перспективно использование нейрометаболических препаратов с нейропротективными и нейротрофическими свойствами. Представляет большой интерес опыт использования нейропротективного и нейротрофического препарата Цитофлавин у пациентов с неврологическими расстройствами в постковидном периоде. Цитофлавин содержит четыре ключевых для клеточного дыхания биологических активных метаболита: янтарную кислоту (сукцинат), рибофлавин, никотинамид и инозин. Эти вещества являются непосредственными участниками и главными катализаторами реакций базисного для синтеза АТФ-цикла митохондриальных биохимических реакций - цикла Кребса. Нормализация клеточного метаболизма под влиянием Цитофлавина лежит в основе антиоксидантного и противоишемического эффектов, которые описываются у данного препарата [46-50].
Как известно, инфекция COVID-19, равно как и ряд других вирусных заболеваний, приводит к выраженной митохондриальной дисфункции [51]. Клиническим проявлением крайнего истощения нейрональных энергетических ресурсов становится астенический симптомокомплекс. Как уже говорилось выше, астения - самое частое осложнение COVID-19. Она развивается у подавляющего большинства переболевших коронавирусной инфекцией и может сохраняться в течение очень длительного времени, серьезно снижая качество жизни [30]. Несомненна также роль митохондриальной дисфункции в формировании когнитивных последствий COVID-19. Обычно когнитивные и астенические расстройства у переболевших коронавирусной инфекцией сочетаются.
Цитофлавин используется в российской неврологической практике более 20 лет. Клинические исследования, в том числе с использованием двойного слепого метода, и опыт повседневного практического применения свидетельствуют об эффективности данного препарата в восстановительном периоде ишемического инсульта, при хронической ишемии головного мозга, последствиях черепно-мозговой травмы, нейроинфекции, астенических расстройствах различной этиологии. Терапия Цитофлавином способствует улучшению самочувствия, положительной динамике нейропсихологических тестов, нормализации биоэлектрической активности головного мозга по данным электроэнцефалографии и повышению качества жизни пациентов с церебральной дисфункцией различной природы. Полученный эффект носит стойкий характер и сохраняется, как свидетельствует ряд работ, и после прекращения лечения данным препаратом [46-50].
А.Е. Терешин и соавт. использовали Цитофлавин для нейрометаболической поддержки реабилитационных мероприятий у 21 пациента с астеническими расстройствами после коронавирусной пневмонии [52]. Поражение легких у пациентов в острой фазе COVID-19 составило 25-80%. Цитофлавин вводили внутривенно по 10 мл препарата на 100 мл физиологического раствора, 10 инфузий на курс. Пациенты контрольной группы (п = 24) были сопоставимы по возрасту, полу и объему поражения легких. Они получали только реабилитацию без метаболической поддержки. К выписке пациенты, получившие такой курс лечения, достоверно отличались от контрольной группы по шкалам реабилитационной маршрутизации, шкале астенического состояния, шкале депрессии Гамильтона и тесту с шестиминутной ходьбой [52].
Т.Л. Оленская и соавт. [53, 54] изучали эффективность Цитофлавина в таблетках в качестве монотерапии и в сочетании с методом гипобарической барокамерной адаптации (ГБА) у пациентов с жалобами на повышенную утомляемость при умственных и/или физических нагрузках после перенесенной коронавирусной пневмонии. 315 пациентов были разделены на три сопоставимые по демографическим и клиническим характеристикам группы: 160 получали только ГБА, 50 - только Цитофлавин и 105 - комбинацию Цитофлавина и ГБА. Было показано, что наибольший эффект оказывает сочетание обеих методик, однако и в качестве монотерапии Цитофлавин способствовал увеличению темпа познавательной деятельности и умственной работоспособности. Одновременно наблюдались положительная динамика по шкале оценки травматического события и повышение качества жизни пациентов по шкале EQ-5D. Полученный эффект сохранялся в течение по меньшей мере трех месяцев после окончания курса терапии (рис. 3) [53, 54].
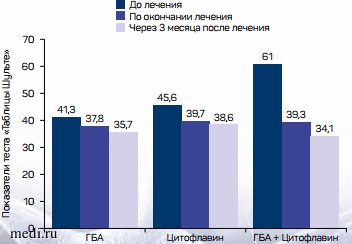 Рис. 3. Динамика темпа познавательной деятельности и концентрации внимания на фоне лечения Цитофлавином и гипобарической адаптацией (n = 315)
Рис. 3. Динамика темпа познавательной деятельности и концентрации внимания на фоне лечения Цитофлавином и гипобарической адаптацией (n = 315)
В ретроспективном исследовании К.Г. Шаповалова и соавт. [55] был проанализирован имеющийся опыт использования сукцинатов у пациентов с тяжелым течением коронавирусной инфекции. Была проанализирована терапия 223 пациентов с тяжелым течением коронавирусной пневмонии. В 21% случаев назначались препараты янтарной кислоты для парентерального введения, в том числе в 9,4% случаев - Цитофлавин. Авторы подчеркивают, что препараты янтарной кислоты назначались не с исследовательской целью, а по решению врача в условиях реальной клинической практики, для решения конкретных лечебных задач. Основной точкой приложения сукцинатов, с точки зрения авторов анализа, была тканевая гипоксия, неизбежная при развитии дыхательной недостаточности [55].
Важными преимуществами Цитофлавина являются безопасность его применения и хорошая переносимость, что было отмечено во всех проведенных к настоящему времени исследованиях, а также в условиях повседневной клинической практики. Оптимальным является назначение препарата по ступенчатой схеме: 10 дней внутривенно капельно по 10 мл на 100-200 мл физиологического раствора, далее перорально по 2 таблетки 2 раза в день в течение 25 дней.
Заключение
Патогенетически обоснованная терапия является безальтернативной при появлении новых вызовов перед клинической медициной, таких как новая коронавирусная инфекция. Мы не можем в ожидании результатов рандомизированных исследований воздерживаться от лечения пациентов, которые нуждаются в помощи уже сегодня. Важными особенностями нейропротективных препаратов являются безопасность применения и нацеленность на универсальные патогенетические механизмы повреждения нервной ткани. Поэтому нейропротективную терапию можно рекомендовать для широкого клинического использования при астенических и когнитивных нарушениях, а также при последствиях цереброваскулярных событий на фоне COVID-19. Безусловно, одновременно требуется проводить рандомизированные клинические исследования для формирования доказательной базы, удовлетворяющей строгим современным требованиям.
Литература
1. Mao L., Jin H., Wang M. et al. Neurologic manifestations of hospitalized patients with coronavirus disease 2019 in Wuhan, China // JAMA Neurol. 2020. Vol. 77. № 6. p. 683-690.
2. Lu Y., Li X., Geng D. et al. Cerebral micro-structural changes in COVID-19 patients - an MRI-based 3-month follow-up study // EClinicalMedicine. 2020. Vol. 25. P. 100484.
3. Miners S., Kehoe P.G., Love S. Cognitive impact of COVID-19: looking beyond the short term // Alzheimers Res. Ther. 2020. Vol. 12. № 1. P. 170.
4. Tsai S.T., Lu M.K., San S. et al. The neurologic manifestations of coronavirus disease 2019 pandemic: a systemic review // Front. Neurol. 2020. Vol. 11. P. 498.
5. Zubair A.S., McAlpine L.S., Gardin T et al. Neuropathogenesis and neurologic manifestations of the coronaviruses in the age of coronavirus disease 2019: a review // JAMA Neurol. 2020. Vol. 77. № 8. P. 1018-1027.
6. Ellul M.A., Benjamin L., Singh B. et al. Neurological associations of COVID-19 // Lancet Neurol. 2020. Vol. 19. № 9. P. 767-783.
7. Lee M.H., Perl D.P., Nair G. et al. Microvascular injury in the brains of patients with Covid-19 // N. Engl. J. Med. 2021. Vol. 384. № 5. P. 481-483.
8. Hosp J.A., Dressing A., Blazhenets G. et al. Cognitive impairment and altered cerebral glucose metabolism in the subacute stage of COVID-19 // Brain. 2021. Vol. 144. № 4. P. 1263-1276.
9. Varga Z., Flammer A.J., Steiger P et al. Endothelial cell infection and endotheliitis in COVID-19 // Lancet. 2020. Vol. 395. № 10234. P. 1417-1418.
10. Ackermann M., Verleden S.E., Kuehnel M. et al. Pulmonary vascular endothelialitis, thrombosis, and angiogenesis in Covid-19 // N. Engl. J. Med. 2020. Vol. 383. № 2. P. 120-128.
11. Koralnik I.J., Tyler K.L. COVID-19: a global threat to the nervous system // Ann. Neurol. 2020. Vol. 88. № 1. P. 1-11.
12. Tan Y.K., Goh C., Leow A.S.T et al. COVID-19 and ischemic stroke: a systematic review and meta-summary of the literature // J. Thromb. Thrombolysis. 2020. Vol. 50. № 3. P. 587-595.
13. Rostami M., Mansouritorghabeh H. D-dimer level in COVID-19 infection: a systematic review // Expert. Rev. Hematol. 2020. Vol. 13. № 11. P. 1265-1275.
14. Nannoni S., de GrootR., Bell S., Markus H.S. Stroke in COVID-19: a systematic review and meta-analysis // Int. J. Stroke. 2021. Vol. 16. № 2. P. 137-149.
15. Wardlaw J.M., Smith E.E., Biessels G.J. et al. STandards for Reporting Vascular changes on nEuroimaging (STRIVE v1). Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration // Lancet Neurol. 2013. Vol. 12. № 8. P. 822-838.
16. Alonso-Lana S., Marquie M., Ruiz A., Boada M. Cognitive and neuropsychiatric manifestations of COVID-19 and effects on elderly individuals with dementia // Front. Aging. Neurosci. 2020. Vol. 12. P. 588872.
17. Almeria M., Cejudo J.C., Sotoca J. et al. Cognitive profile following COVID-19 infection: Clinical predictors leading to neuropsychological impairment // Brain Behav. Immun. Health. 2020. Vol. 9. P. 100163.
18. Dodd J.W., Getov S.V., Jones P.W. Cognitive function in COPD // Eur. Respir. J. 2010. Vol. 35. № 4. P. 913-922.
19. Hung W W, Wisnivesky J.P., Siu A.L., Ross J.S. Cognitive decline among patients with chronic obstructive pulmonary disease // Am. J. Respir. Crit. Care. Med. 2009. Vol. 180. № 2. P. 134-137.
20. Shankar A., Hamer M., McMunn A., Steptoe A. Social isolation and loneliness: relationships with cognitive function during 4 years of follow-up in the English Longitudinal Study of Ageing // Psychosom. Med. 2013. Vol. 75. № 2. P. 161-170.
21. Johnson K.A., Sperling R.A. Association of higher cortical amyloid burden with loneliness in cognitively normal older adults // JAMA Psychiatry. 2016. Vol. 73. № 12. P. 1230-1237.
22. Manca R., De Marco M., Venneri A. The impact of COVID-19 infection and enforced prolonged social isolation on neuropsychiatric symptoms in older adults with and without dementia: a review // Front. Psychiatry. 2020. Vol. 11. P. 585540.
23. Cohen G., Russo M.J., Campos J.A., Allegri R.F. COVID-19 epidemic in Argentina: worsening of behavioral symptoms in elderly subjects with dementia living in the community // Front. Psychiatry. 2020. Vol. 11. P. 866.
24. Barguilla A., Fernandez-Lebrero A., Estragues-Gazquez I. et al. Effects of COVID-19 pandemic confinement in patients with cognitive impairment // Front. Neurol. 2020. Vol. 11. P. 589901.
25. Salari N., Hosseinian-Far A., Jalali R. et al. Prevalence of stress, anxiety, depression among the general population during the COVID-19 pandemic: a systematic review and meta-analysis // Global Health. 2020. Vol. 16. № 1. P. 57.
26. Luo M., Guo L., Yu M. et al. The psychological and mental impact of coronavirus disease 2019 (COVID-19) on medical staff and general public - a systematic review and meta-analysis // Psychiatry Res. 2020. Vol. 291. P. 113190.
27. MacMaster F.P., Kusumakar V. Hippocampal volume in early onset depression // BMC Med. 2004. Vol. 2. P. 2.
28. Bremner J.D. Structural changes in the brain in depression and relationship to symptom recurrence // CNS Spectr. 2002. Vol. 7. № 2. P 129-130, 135-139.
29. Sheline Y.I., Gado M.H., Kraemer H.C. Untreated depression and hippocampal volume loss // Am. J. Psychiatry. 2003. Vol. 160. № 8. P 1516-1518.
30. Taquet M., Geddes J.R., Husain M. et al. 6-month neurological and psychiatric outcomes in 236 379 survivors of COVID-19: a retrospective cohort study using electronic health records // Lancet Psychiatry. 2021. Vol. 8. № 5. P. 416-427.
31. Vanichkachorn G., Newcomb R., Cowl C.T et al. Post-COVID-19 syndrome (Long Haul Syndrome): description of a multidisciplinary clinic at Mayo clinic and characteristics of the initial patient cohort // Mayo Clin. Proc. 2021. Vol. 96. № 7. P. 1782-1791.
32. Koralnik I.J., Tyler K.L. COVID-19: a global threat to the nervous system // Ann. Neurol. 2020. Vol. 88. № 1. P. 1-11.
33. Garg R.K. Spectrum of neurological manifestations in Covid-19: a review // Neurol. India. 2020. Vol. 68. № 3. P. 560-572.
34. Lima M.A., Silva M.T.T., Soares C.N. et al. Peripheral facial nerve palsy associated with COVID-19 // J. Neurovirol. 2020. Vol. 26. № 6. P. 941-944.
35. Mao L., Jin H., Wang M. et al. Neurologic manifestations of hospitalized patients with Coronavirus disease 2019 in Wuhan, China // JAMA Neurol. 2020. Vol. 77. № 6. P. 683-690.
36. Fragiel M., Miro 0., Llorens P. et al.; SIESTA (Spanish Investigators in Emergency Situations Team) network. Incidence, clinical, risk factors and outcomes of Guillain-Barre in Covid-19 // Ann. Neurol. 2021. Vol. 89. № 3. P. 598-603.
37. Поликарпов А.В., Александрова Г.А., Голубев Н.А. и др. Заболеваемость всего населения России в 2017 году. Статистические материалы. Часть II. М., 2018.
38. Hernandez-Fernandez F., Valencia S.H., Barbella-Aponte R.A. et al. Cerebrovascular disease in patients with COVID-19: neuroimaging, histological and clinical description // Brain. 2020. Vol. 143. № 10. P 3089-3103.
39. Qi K.A., Huang K., Huang J.H. COVID-19 and stroke: a review // Brain Hemorrhages. 2021. Vol. 2. № 2. P. 76-83.
40. Hampshire A., Trender W, Chamberlain S.R. et al. Cognitive deficits in people who have recovered from COVID-19 // EClinicalMedicine. 2021. Vol. 39. P 101044.
41. Liu Y.H., Wang Y.R., Wang Q.H. et al. Post-infection cognitive impairments in a cohort of elderly patients with COVID-19 // Mol. Neurodegeneration. 2021. Vol. 16. № 1. P 48.
42. Jaywant A., Vanderlind W.M., Alexopoulos G.S. et al. Frequency and profile of objective cognitive deficits in hospitalized patients recovering from COVID-19 // Neuropsychopharmacology. 2021. P. 1-6.
43. Mazza M.G., Palladini M., De Lorenzo R. et al. Persistent psychopathology and neurocognitive impairment in COVID-19 survivors: effect of inflammatory biomarkers at three-month follow-up // Brain Behav. Immun. 2021. Vol. 94. P. 138-147.
44. Miskowiak K.W., Johnsen S., Sattler S.M. et al. Cognitive impairments four months after COVID-19 hospital discharge: pattern, severity and association with illness variables // Eur. Neuropsychopharmacol. 2021. Vol. 46. P. 39-48.
45. Almeria M., Cejudo J.C., Sotoca J. et al. Cognitive profile following COVID-19 infection: clinical predictors leading to neuropsychological impairment // Brain Behav. Immun. Health. 2020. Vol. 9. P. 100163.
46. Бульон В.В., Зарубина И.В., Коваленко А.Л. и др. Церебропротективный эффект Цитофлавина при закрытой черепно-мозговой травме // Экспериментальная и клиническая фармакология. 2003. № 6. С. 46-48.
47. Клочева Е.Г., Александров М.В., Фомина Е.Б. Применение Цитофлавина больных с гипоксическим состоянием головного мозга ишемического генеза // Вестник Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова. 2002. № 1-2. С. 24-30.
48. Федин А.И., Румянцева С.А., Пирадов М.А. и др. Эффективность нейрометаболического протектора Цито-флавина при инфарктах мозга // Вестник Санкт-Петербургской государственной медицинской академии им. И.И. Мечникова. 2005. № 1. С. 13-19.
49. Федин А.И., Румянцева С.А., Пирадов М.А. и др. Клиническая эффективность Цитофлавина у больных с хронической ишемией головного мозга (многоцентровое плацебоконтролируемое рандомизированное исследование) // Врач. 2006. № 13. С. 52-58.
50. Исаков В.А., Коваленко А.Л., Мартынова О.В. и др. Эффективность цитофлавина в терапии энцефалопатий у больных нейроинфекциями // Антибиотики и химиотерапия. 2010. Т. 55. С. 1-2.
51. Wood E., Hall K., Tate W Role of mitochondria, oxidative stress and the response to antioxidants in myalgic encephalomyelitis/chronic fatigue syndrome: a possible approach to SARS-CoV-2 ‘long-haulers’? // Chronic. Dis. Transl. Med. 2020 Nov 21. Online ahead of print.
52. Терешин А.Е., Кирьянова В.В., Решетник Д.А. Коррекция митохондриальной дисфункции в комплексной реабилитации пациентов, перенесших COVID-19 // Журнал неврологии и психиатрии им. С.С. Корсакова. 2021. Т. 121. № 8. C. 25-29.
53. Оленская Т.Л. Инновационные методы реабилитации на амбулаторном и домашнем этапах у пациентов после пневмонии COVID-19 // Медицинский совет. 2021. № 4. С. 220-229.
54. Оленская Т.Л., Николаева А.Г., Петько О.В. и др. Применение гипобарической барокамерной адаптации как компонента медицинской реабилитации пациентов после COVID-19 // Профилактическая медицина. 2021. Т. 24. № 4. С. 76-82.
55. Шаповалов К.Г., Цыденпилов Г.А., Лукьянов С.А. и др. Перспективы применения сукцинатов при тяжелом течении коронавирусной инфекции // Экспериментальная и клиническая фармакология. 2020. Т. 85. С. 40-43.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)