Ультраструктурные и морфофункциональные изменения митохондриального аппарата гепатоцитов при экспериментальном распространенном гнойном перитоните
Статьи
Опубликовано в журнале:
Новости хирургии Том 26, № 1, 2018
doi: 10.18484/2305-0047.2018.1.5
Н.Н. Яроцкая1, В.К. Гостищев2, В.А. Косинец1, И.В. Самсонова1
Витебский государственный медицинский университет1, г. Витебск, Республика Беларусь
Первый Московский государственный медицинский университет им. И.М. Сеченова, (Сеченовский Университет)2, г. Москва, Российская Федерация
Цель. Изучить ультраструктурные изменения митохондрий печени при экспериментальном распространенном гнойном перитоните на фоне применения метаболической поддержки.
Материал и методы. Проведена морфометрическая оценка электронно-микроскопических изображений митохондрий печени кроликов (n=55) при экспериментальном распространенном гнойном перитоните. Полученные электронограммы оценивали с использованием программы ImageJ 1.45s, в рамках которой подсчитывали количество профильных срезов митохондрий, количество межмитохондриальных контактов, количество поврежденных и неповрежденных митохондрий. Рассчитывали среднюю площадь, периметр и удельный объем (в %), приходящийся на неповрежденные профили митохондрий. В качестве лекарственных средств, являющихся препаратами метаболического действия с энерготропными свойствами, были использованы фосфокреатин, содержащий натриевую соль креатин фосфата, и комбинированный препарат, содержащий янтарную кислоту, никотинамид, рибоксин и рибофлавин.
Результаты. Электронно-микроскопический анализ митохондрий гепатоцитов позволил выявить значительные изменения в их структуре, обусловленные развитием гнойного перитонита. Морфометрическая оценка митохондрий печени всех исследуемых групп выявила изменения в количестве профильных срезов, соотношении поврежденных и неповрежденных митохондрий, образовании межмитохондриальных контактов, а также размерных характеристик площади, периметра и удельного объема, занимаемого митохондриями. Применение метаболической поддержки позволило снизить в послеоперационном периоде негативный эффект гнойного перитонита, оказываемый на митохондрии печени, в сравнении с контрольной группой животных, не получавших метаболической поддержки. Проведение сравнительного анализа применения метаболических средств выявило более высокую эффективность препарата, содержащего янтарную кислоту, никотинамид, рибоксин и рибофлавин, которая заключалась в более интенсивном восстановлении структуры митохондрий.
Заключение. Развитие гнойного перитонита сопровождается нарушением ультраструктурной организации митохондрий печени всех исследуемых групп. Использование метаболической коррекции позволяет восстановить структуру митохондрий и, как следствие, улучшить энергообеспечение клеток для борьбы с негативными последствиями эндотоксикоза при перитоните.
Ключевые слова: перитонит, печень, митохондрии, эндотоксин, воспаление, активные формы кислорода
Novosti Khirurgii. 2018 Jan-Feb; Vol 26 (1): 5-15
Ultrastructural and Morphofunctional Changes in the Mitochondrial Apparatus of Hepatocytes in Experimental Diffuse Purulent Peritonitis
N.N. Yarotskaya, V.K. Gostishev, V.A. Kosinets, I.V. Samsonova
Objective. To study the ultrastructural changes in the liver mitochondria in experimental diffuse purulent peritonitis against the background of the metabolic support.
Methods. The morphometric evaluation of the rabbit liver mitochondria electron microscopic images (n=55) was performed in experimental diffuse purulent peritonitis. The obtained electron diffraction patterns were estimated using the ImageJ 1.45s program, in which the number of mitochondria sections, the number of intermithochondrial contacts and the number of damaged and intact mitochondria were counted. The average area, perimeter, and specific volume (measured in %) were calculated for the undamaged mitochondrial profiles. Metabolic agents with energotropic properties, phosphocreatine preparations containing creatine phosphate and preparations containing the succinic acid, niacinamide, inosine diphosphate and riboflavin were used.
Results. Electron microscopic analysis of mitochondria of hepatocytes made it possible to reveal significant changes in their structure, caused by the development of purulent peritonitis. Morphometric evaluation of electron diffraction patterns showed changes in the quantitative and qualitative characteristics of mitochondria: the ratio of the damaged and intact mitochondria, their size, perimeter and specific volume of all groups. The use of metabolic support permitted to reduce the negative effect of purulent peritonitis in the postoperative period, which is exerted on the liver mitochondria, in comparison with the control group of animals that did not receive any metabolic support. Conducting a comparative analysis revealed a higher efficacy of the metabolic agent containing the succinic acid, niacinamide, inosine diphosphate and riboflavin, which resulted in more intensive restoration of the mitochondrial membrane structure.
Conclusions. The development of purulent peritonitis is accompanied by a violation of the ultrastructural organization of the liver mitochondria in all studied groups. Metabolic correction allows restoring the membrane structure of mitochondria, and as the result improving the energy supply of cells to combat the negative consequences of endotoxicosis in peritonitis.
Keywords: peritonitis, liver, mitochondria, endotoxin, inflammation, active forms of oxygen
Научная новизна статьи
Изучено влияние метаболической поддержки на ультраструктурное состояние митохондрий печени при распространенном гнойном перитоните. Установлено, что использование метаболической поддержки улучшало состояние митохондрий, повышало выживаемость органелл. Применение препарата, содержащего янтарную кислоту, никотинамид, рибоксин и рибофлавин, способствовало более эффективному сохранению и восстановлению митохондриального аппарата гепатоцитов при распространенном гнойном перитоните.
What this paper adds
The impact of the metabolic support on the ultrastructural liver mitochondria state in diffuse purulent peritonitis has been studied. The use of the metabolic support has been found out to improve the mitochondria state and to increase the survival of organelles. Using the drug containing the succinic acid, niacinamide, inosine diphosphate and riboflavin has contributed to more effective saving and restoring the mitochondria apparatus of hepatocytes in diffuse purulent peritonitis.
Введение
Интраабдоминальные инфекции вызывают большую озабоченность в связи с высокими показателями смертности. Основной причиной летальности при перитоните является эндогенная интоксикация, вызванная снижением барьерных функций кишечника продуктами тканевой деградации, транслокацией липополисахаридного комплекса грамотрицательных бактерий, неметилированной бактериальной ДНК целых микробных клеток [1]. Одна из ключевых ролей в обезвреживании токсинов, попадающих из кишечника в кровь, принадлежит печени – важной барьерной и детоксикационной системе организма [2].
Эндогенная интоксикация сопровождается активацией различных иммунных клеток и медиаторов воспаления, необходимых для эффективной ликвидации очага инфекции, и наносит значительный сопутствующий ущерб здоровым паренхимным клеткам печени вследствие гиперпродукции активных форм кислорода [3]. По мнению ряда авторов, наиболее ранними патофизиологическими признаками формирования печеночной недостаточности являются образование избыточного количества свободных радикалов и интенсификация процессов перекисного окисления липидов, приводящая к нарушению мембранной проницаемости клетки с повреждением субклеточных структур [4].
Наиболее важным индикатором функционального состояния клетки, определяющим ее способность к выживанию или гибели, является состояние митохондрий. Нарушение в ультраструктурной организации митохондриального аппарата оказывает значительное влияние на течение патологического процесса вследствие подавления окислительного фосфорилирования и развития дефицита энергии [5]. Кроме того, митохондрии являются ключевыми органеллами, инициирующими реализацию процесса апоптоза или некроза. Подавление реализации программы апоптоза в ответ на острое воспаление приводит к доминированию процесса некроза и характеризуется дисбалансом окислительного метаболизма [6].
В этой связи большой интерес представляет возможность использования препаратов, способствующих поддержанию энергетической составляющей клетки и обладающих антиоксидантным и мембраностабилизирующим действием.
Цель. Изучить ультраструктурные изменения митохондрий печени при экспериментальном распространенном гнойном перитоните на фоне применения метаболической поддержки.
Материал и методы
Эксперимент проведен на 55 кроликах самцах породы шиншилла, массой 2600-3000 г, содержащихся в стандартных условиях вивария. Животные были распределены на следующие группы: I – интактная (n=5); II – 6-часовой распространенный гнойный перитонит без хирургического лечения (n=5); III – контрольная, хирургическое лечение перитонита (n=15); IV – хирургическое лечение перитонита с применением в послеоперационном периоде препарата, содержащего креатинфосфат (n=15); V – хирургическое лечение перитонита с применением в послеоперационном периоде препарата, содержащего янтарную кислоту, рибоксин, никотинамид, рибофлавин (n=15).
Работу с экспериментальными животными проводили согласно рекомендациям Конвенции Совета Европы по охране позвоночных животных, используемых в экспериментальных и других научных целях, от 18.03.1986, Директиве Совета ЕЭС от 24.11.1986, рекомендациям FELASA (1994-1996) и ТКП 125-2008.
Моделирование перитонита проводили путем однократного интраабдоминального введения полимикробной аэробно-анаэробной взвеси E.coli (штамм 0111 К58 НИ С 130-53) и B.fragilis (штамм 323) из расчета 6 млрд. микробных тел на 1 кг массы кролика. Количество микробных тел рассчитывали по стандарту мутности McFarland. Через 6 часов после введения микроорганизмов в III, IV и V группах животных с целью лечения перитонита и устранения энтеральной недостаточности выполняли лапаротомию, санацию брюшной полости, декомпрессию тонкой кишки. Животные IV и V групп получали внутривенно капельно препараты, содержащие янтарную кислоту, рибоксин, никотинамид, рибофлавин (28,6 мг янтарной кислоты на 1 кг массы) и фосфокреатин (0,05 г на 1 кг массы) соответственно, животные III группы – эквивалентный объем 0,9% раствора натрия хлорида.
Животных II группы выводили из эксперимента (летальная доза пентобарбитала) через 6 часов после заражения, животных III, IV и V групп – на 1, 3 и 5 сутки после операции.
Оба использованных лекарственных средства являются препаратами метаболического действия с энерготропными свойствами. Фосфокреатин – метаболическое средство, содержащее креатинфосфат, выполняющий роль резерва химической энергии и используемый для быстрого ресинтеза АТФ, и препарат комплексного метаболического действия, содержащий янтарную кислоту, никотинамид, рибоксин и рибофлавин, стимулирующий процессы клеточного дыхания, а также обладающий детоксицирующим, антигипоксическим и антиоксидантным свойствами.
Для трансмиссионного электронно-микроскопического исследования кусочки печени фиксировали в 2,5% растворе глютарового альдегида на 0,1 М фосфатном буфере (рН 7,4) в течение 24 часов с постфиксацией в 2% растворе четырехокиси осмия (2 часа). После дегидратации и пропитки все образцы заключали в эпон-аралдитную смесь. Ультратонкие срезы изготавливали с помощью ультратома «LKB-III» (Швеция), дополнительно контрастировали уранилацетатом и цитратом свинца по Рейнольдсу [7]. Фотографическую съемку каждого случая проводили с помощью электронного микроскопа «JEM-100CX» (Япония): фотографировали 10 непересеченных зон при увеличении х14000.
Полученные электронограммы оценивали с использованием программы ImageJ 1.45s, в рамках которой подсчитывали количество профильных срезов митохондрий, количество межмитохондриальных контактов, количество поврежденных и неповрежденных митохондрий. Рассчитывали среднюю площадь, периметр и удельный объем (в %), приходящийся на неповрежденные профили митохондрий.
Для анализа изображений электронограмм пересчет цифровых характеристик изображений, имевших расширение JPЕG, 8 бит, разрешение 37,795 пикс/см, производили в единицы СИ.
Статистика
Статистическая обработка результатов проводилась с помощью стандартного пакета статистических программ «STATISTICA 10.0» и «MS Excel». Величины анализируемых показателей в группах представляли в виде медианы (Ме), интерквартильного интервала [25%; 75%]. Достоверность межгрупповых значений средних величин оценивали по критерию Манна-Уитни (U) и Вилкоксона (W). Различия принимались за достоверные при р<0,05.
Результаты
Электронно-микроскопический анализ митохондрий гепатоцитов позволил выявить значительные изменения в их структуре, обусловленные развитием гнойного перитонита (рис. 1 А).
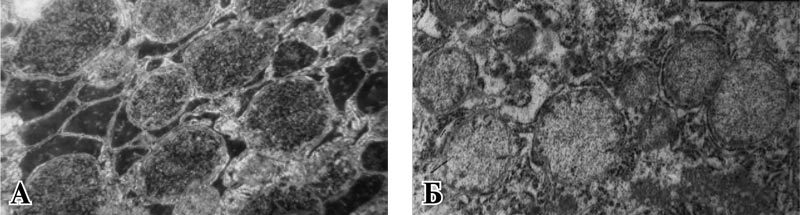
Рис. 1. Ультраструктурные изменения митохондрий печени при экспериментальном распространенном гнойном перитоните. Ув. ×14000.
А – интактная группа, Б – через 6 часов после инициации перитонита.
Уже через 6 часов после инициации перитонита появлялись митохондрии с просветленным и увеличенным в объеме матриксом с видимыми электронно-прозрачными зонами, лишенными крист. Наряду с этим, выявлялись деструктивные изменения в гладкой и шероховатой эндоплазматической сети с образованием вакуолей и потерей рибосом (рис. 1 Б).
Морфометрический анализ выявил уменьшение общего количества митохондрий в 1,4 раза (р<0,001), площади – в 1,8 раза (р<0,001) и периметра – в 1,7 раза (р<0,001), удельного объема – в 1,3 раза (р<0,001) в сравнении с интактной группой. Количество поврежденных митохондрий увеличивалось в 4 раза (р<0,01), а количество межмитохондриальных контактов снижалось в 2 раза (р<0,001) в сравнении с интактной группой (таблица).
Таблица
Электронная микроскопия препаратов митохондрий печени при экспериментальном распространенном гнойном перитоните на фоне применения
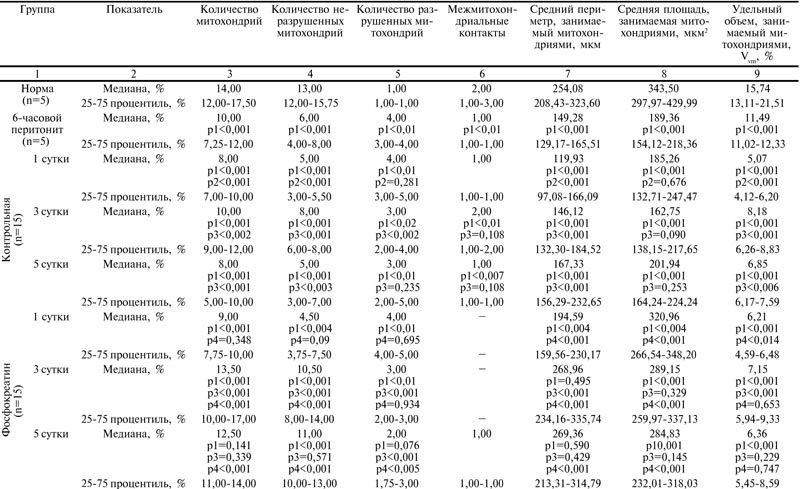
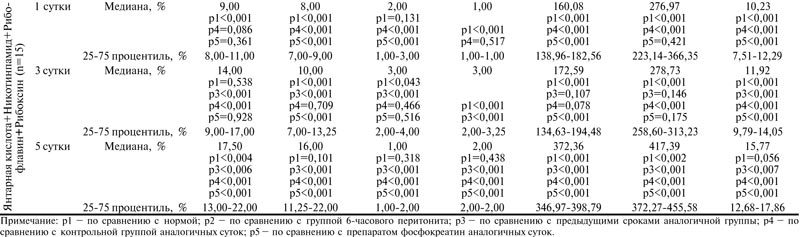
В 1 сутки после операции в контрольной группе в митохондриях гепатоцитов отмечались выраженный отек, деструкция крист и нарушение целостности наружной мембраны. Выявлялись также значительно увеличенные в объеме митохондрии с просветленным матриксом, а также полностью разрушенные (рис. 2 А).

Рис. 2. Ультраструктурные изменения митохондрий печени контрольной группы животных. Ув. ×14000.
А – в 1 сутки после операции, Б – на 3 сутки после операции, В – на 5 сутки после операции.
Морфометрия митохондриального аппарата выявила снижение количества митохондрий в 1,2 раза (р<0,001), периметра – в 1,2 раза (р<0,001), а также удельного объема – в 2,2 раза (р<0,001) в сравнении с группой 6-часового перитонита. Количество поврежденных митохондрий, а также занимаемая ими площадь сохранялись на уровне группы 6-часового перитонита и не имели достоверно значимых отличий (р=0,281; р=0,676) (таблица).
Ультраструктурные изменения митохондрий на фоне применения препарата фосфокреатин в 1 сутки после операции характеризовались сохранностью большинства митохондрий. При этом отмечался их значительный полиморфизм. Мембраны митохондрий в большинстве своем были сохранены, но имели набухший и просветленный матрикс с участками лизиса крист. При этом отмечались вакуолизация и потеря рибосом эндоплазматической сетью, что характеризует нарушения биосинтетических процессов клетки (рис. 3 А). Морфометрия митохондриального аппарата выявила снижение количественных характеристик всех исследуемых параметров в сравнении с интактной группой, однако в сравнении с контрольной группой площадь, периметр и удельный объем, занимаемый митохондриями, были значительно выше: в 1,73; 1,62; 1,22 раза соответственно (р<0,001; р<0,001; р<0,014) (таблица). Характерной особенностью, выявленной в данной группе, было отсутствие межмитохондриальных контактов, являющихся показателем объединенной и слаженной работы митохондрий, направленной на выживание клетки в условиях дефицита энергии.
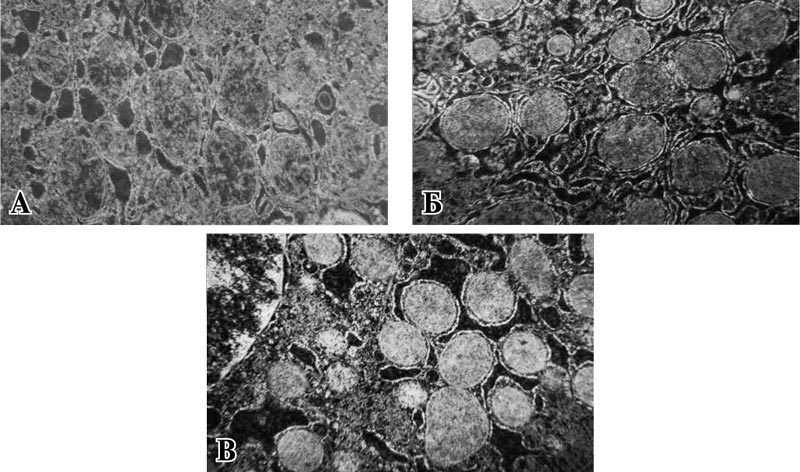
Рис. 3. Ультраструктурные изменения митохондрий печени животных, получавших препарат фосфокреатин. Ув. ×14000.
А – в 1 сутки после операции, Б – на 3 сутки после операции, В – на 5 сутки после операции.
Применение препарата, содержащего янтарную кислоту, никотинамид, рибоксин, рибофлавин, уже в 1 сутки после операции продемонстрировало сохранность большей части митохондрий. Тем не менее, при сохраненной наружной мембране внутри митохондрий формировались участки лизиса и деструкции крист. Размер и форма органелл были подвержены полиморфизму (рис. 4 А). Морфометрическая обработка изображений выявила снижение площади в 1,2 раза (р<0,001), периметра в 1,6 раза (р<0,001) и занимаемого митохондриями удельного объема в 1,5 раза (р<0,001) в сравнении с интактной группой. Однако данные характеристики достоверно значимо были выше в сравнении с контрольной группой в 1,5; 1,3; 2 раза соответственно (р<0,001; р<0,001; р<0,001) (таблица).
На 3 сутки послеоперационного периода в контрольной группе сохранялись признаки нарушения структурной организации мембран митохондрий. Многие митохондрии имели набухший и просветленный матрикс со сжатым межмембранным пространством и значительными участками лизиса и деструкции крист (рис. 2 Б). Морфометрические характеристики достоверно отличались в сравнении с 1 сутками: увеличивалось их общее количество в 1,2 раза (р<0,001), количество межмитохондриальных контактов – в 2 раза (р<0,001), в 1,3 раза снижалось количество поврежденных митохондрий (р<0,002). Периметр и удельный объем, занимаемый митохондриями, незначительно нарастали в сравнении с 1 сутками (р<0,001; р<0,001) (таблица).
Митохондрии группы животных, получавших препарат фосфокреатин, на 3 сутки после операции сохраняли признаки деструкции мембран, в некоторых имелись трещины и разрывы (рис. 3 Б). Многие митохондрии находились в состоянии отека с видимым отсутствием крист. Морфометрическая обработка электронограмм продемонстрировала увеличение в 1,5 раза (р<0,001) количества митохондрий в сравнении с 1 сутками и в 1,35 раза в сравнении с контрольной группой аналогичного периода. В 1,3 раза снижалось количество поврежденных митохондрий в сравнении с предыдущим сроком. И количество профильных срезов митохондрий, и количество неповрежденных органелл были увеличены в 1,3 раза в сравнении с контрольной группой аналогичного периода и имели достоверно значимые различия (р<0,001; р<0,001). Отмечалось отсутствие межмитохондриальных контактов. Периметр, занимаемый митохондриями, достоверно значимо увеличивался в 1,4 раза в сравнении с 1 сутками (р<0,001). Показатели площади и удельного объема достоверно значимых отличий не имели (р=0,329; р=0,653) (таблица).
На 3 сутки послеоперационного периода в группе животных, получавших комплексный препарат, содержащий янтарную кислоту, ультраструктурный анализ показал, что большинство митохондрий имело четко очерченные границы мембран. Митохондрии в большинстве своем были плотно окружены элементами эндоплазматической сети, что можно расценивать как признак повышенной биосинтетической функции. Однако имелись митохондрии с просветленным матриксом и разрушенными кристами (рис. 4 Б). Морфометрия митохондриального аппарата продемонстрировала тенденцию к увеличению их количества в 1,5 раза (р<0,001). В 1,25 раза увеличивалось количество неразрушенных митохондрий (р<0,001), в 3 раза нарастало количество межмитохондриальных контактов (р<0,001) в сравнении с 1 сутками. Показатели площади и периметра, занимаемого митохондриями, достоверно не отличались в сравнении с предыдущими сроками послеоперационного периода (р=0,146; р=0,107) (таблица).
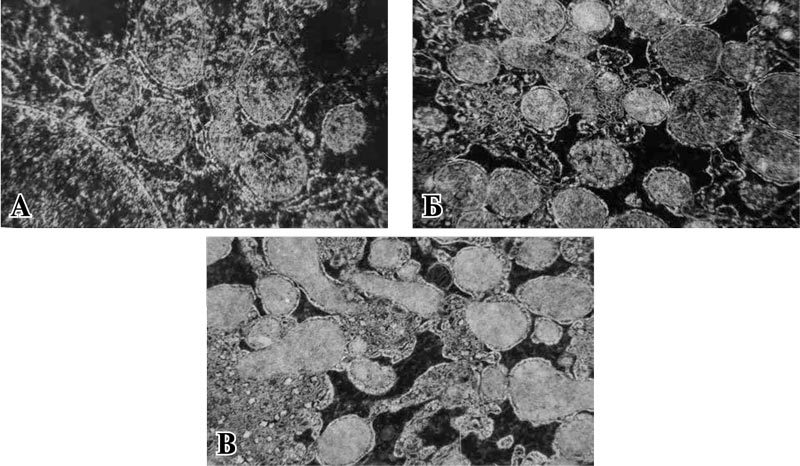
Рис. 4. Ультраструктурные изменения митохондрий печени животных, получавших комплексный препарат, содержащий янтарную кислоту, никотинамид, рибоксин, рибофлавин. Ув. х14000.
На 5 сутки послеоперационного периода в контрольной группе сохранялись признаки полиморфизма митохондрий, их набухание, деструкция мембран. Часть митохондрий выглядела оптически пустой, со слабо различимыми либо разрушенными кристами. Многие митохондрии были разрушены (рис. 2В). Морфометрический анализ не выявил достоверно значимых изменений количества, степени образования межмитохондриальных контактов, количества поврежденных и неповрежденных митохондрий в сравнении с 1 сутками. Наряду с этим определялась незначительная тенденция к увеличению площади в 1,1 раза (р=0,253) и периметра митохондрий в 1,4 раза (р<0,001), их удельного объема в 1,3 раза (р<0,006) в сравнении с 1 сутками (таблица).
Ультраструктурные изменения митохондрий на 5 сутки после операции в группе животных, получавших препарат фосфокреатин, характеризовались полиморфизмом. Сохранялись митохондрии в состоянии отека с деструкцией крист и разрывом наружной мембраны. Количество межмитохондриальных контактов было незначительным (рис. 3 В). Анализ морфометрических параметров показал, что в сравнении с 1 сутками общее количество митохондрий увеличивалось в 1,4 раза (р<0,001), в 2,4 раза (р<0,001) увеличивалось количество неповрежденных митохондрий, в 2 раза снижалось среднее количество разрушенных митохондрий (р<0,001). Однако данные показатели не достигали значений интактной группы. При сравнении с показателями контрольной группы на 5 сутки после операции количество неповрежденных митохондрий, их площадь и периметр были выше в 2,2; 1,4 и 1,6 раза соответственно (р<0,001) (таблица).
На 5 сутки послеоперационного периода в группе животных, получавших препарат янтарной кислоты, рибоксина, никотинамида, рибофлавина, митохондрии характеризовались наличием четкого контура наружной и внутренней мембран. Из-за более плотного расположения крист на электронограммах митохондрии выглядели более темными. Встречались единичные поврежденные митохондрии (рис. 4 В). Результаты морфометрии свидетельствовали о восстановлении структуры и функции митохондрий, что подтверждалось увеличением их общего количества в 1,9 раза (р<0,001), занимаемого ими удельного объема в 1,5 раза (р<0,001), средней площади в 1,5 раза (р<0,001) и периметра в 2,3 раза (р<0,001), а также восстановлением межмитохондриальных контактов в сравнении с 1 сутками. При сравнении с контрольной группой, не получавшей метаболической поддержки, на 5 сутки послеоперационного периода количество профильных срезов митохондрий было выше в 2,2 раза (р<0,001), межмитохондриальных контактов – в 2 раза (р<0,001), количество неповрежденных митохондрий – в 3,2 раза (р<0,001), площади – в 2 раза (р<0,001), периметра – в 2,2 раза (р<0,001).
Результаты морфометрии свидетельствовали о восстановлении структуры и функции митохондрий, которые по количеству поврежденных и неповрежденных митохондрий, а также образованию контактов друг с другом и удельному объему приближались к значениям интактной группы и не имели с ней достоверно значимых отличий.
Обсуждение
Таким образом, результаты исследования свидетельствуют о выраженных изменениях митохондриального аппарата гепатоцитов при экспериментальном распространенном гнойном перитоните. Обнаруженные изменения митохондрий различной степени выраженности уже на ранних этапах инициации перитонита могут оказывать негативный эффект на метаболические процессы, нарушая жизнедеятельность гепатоцитов. Нарастание негативных изменений без применения метаболической поддержки в митохондриях печени уже через сутки после операционного вмешательства приводило к необратимым морфофункциональным нарушениям, способствуя гибели гепатоцитов. Различного рода ультраструктурные изменения митохондрий, в том числе увеличение в размерах, просветление матрикса, деструкция и лизис крист, свидетельствовали, надо полагать, о разобщении процессов окисления и фосфорилирования и развивающихся некротических процессах в результате энергодефицита. Уменьшение удельного объема, занимаемого митохондриями, а также периметра и площади коррелировало также с деструктивными изменениями, затрагивающими эндоплазматический ретикулум и рибосомальные структуры, что может указывать на угнетение биосинтетической функции клеток.
Исследование показало, что использование метаболической поддержки улучшало состояние митохондрий, способствуя повышению выживаемости органелл, вследствие изменения проницаемости мембран для активных форм кислорода (АФК) и восстановления синтеза аденозинтрифосфорной кислоты (АТФ).
На фоне применения комплексного препарата, содержащего янтарную кислоту, было выявлено интенсивное восстановление мембранных структур митохондрий. Известно, что сочетание его активных компонентов способно стимулировать разные этапы энергосинтеза за счет содержания большого количества сукцината, являющегося прямым метаболитом цикла Кребса. Позитивный эффект терапии сукцинатсодержащими препаратами был показан у пациентов при разлитом перитоните, при энтеральной недостаточности, при инфекционных и вирусных заболеваниях [8, 9]. В то же время наличие никотинамида и рибоксина регулирует окислительно-восстановительные процессы в клетке. Препарат также стимулирует процессы клеточного дыхания и образования энергии, улучшая утилизацию кислорода и восстанавливая антиоксидантную активность клеток [10]. Адекватный энергосинтез дает возможность корректировать метаболический дисбаланс митохондрий, тем самым участвуя в поддержании жизни не только клеток, но и всего организма в целом [11].
Изучение метаболического эффекта препарата фосфокреатин, содержащего экзогенный креатинфосфат, продемонстрировало меньший эффект в сравнении с комплексным препаратом, содержащим янтарную кислоту, никотинамид, рибоксин, рибофлавин. Являясь донатором макроэргических фосфатных связей, фосфокреатин обеспечивает механизм быстрого ресинтеза АТФ для клеток в состоянии энергодефицита, когда нарушение целостности мембранных структур не происходит. По данным ряда исследователей, креатинфосфат оказывает защитное действие на энергетический метаболизм, замедляя наступление необратимых изменений в структуре клеток, связанных с дефицитом энергии [12, 13]. Как показал эксперимент, развитие перитонита приводило к инициации воспалительной реакции с нарушением целостности мембран митохондрий, что, возможно, снижало действие препарата.
Выводы
- Гнойный перитонит оказывает негативное влияние на ультраструктурную организацию митохондрий гепатоцитов, что может отрицательно сказываться на энергозависимых процессах, происходящих в клетках.
- Нарушение структуры и повреждение митохондриального аппарата печени наблюдается уже через 6 часов после инициации перитонита (снижение общего количества митохондрий в 1,4 раза, их площади и периметра – в 1,8 и 1,7 раза соответственно (p<0,0001)), что свидетельствует о быстром распространении инфекции и развитии полиорганной недостаточности.
- Применение препарата метаболического действия, содержащего креатинфосфат, оказывает положительное воздействие на состояние структуры митохондрий в послеоперационном периоде при экспериментальном распространенном гнойном перитоните. На 5 сутки после операции при сравнении показателей с показателями группы, где отсутствовала метаболическая поддержка, на фоне применения препарата количество неповрежденных митохондрий, их площади и периметра было выше в 2,2; 1,4 и 1,6 раза соответственно (р<0,001).
- Применение комплексного препарата метаболического действия, содержащего янтарную кислоту, никотинамид, рибоксин и рибофлавин, способствует сохранению и более интенсивному восстановлению митохондриального аппарата гепатоцитов при экспериментальном распространенном гнойном перитоните. По сравнению с группой без метаболической поддержки на 5 сутки послеоперационного периода количество профильных срезов митохондрий было выше в 2,2 раза (р<0,001), межмитохондриальных контактов – в 2 раза (р<0,001), количество неповрежденных митохондрий – в 3,2 раза (р<0,001), площади – в 2 раза (р<0,001), периметра – в 2,2 раза (р<0,001).
Финансирование
Работа выполнялась в соответствии с планом научных исследований Витебского государственного медицинского университета. Финансовой поддержки со стороны компанийпроизводителей лекарственных препаратов авторы не получали.
Конфликт интересов
Авторы заявляют, что конфликт интересов отсутствует.
Этические аспекты
Исследование было одобрено комитетом по биоэтике Витебского государственного медицинского университета.
Литература
- Власов АП, Тарасова ТВ, Козлов ИГ, Логинова ОВ, Лещанкина НЮ, Висаитов ДА. Пути повышения возможностей естественных механизмов детоксикации при остром перитоните. Кубан Науч Мед Вестн. 2010;(2):17-22.
- Чернов ВН. Очаги внедрения инфекции и печеночная недостаточность при распространенной абдоминальной инфекции. Кубан Науч Мед Вестн. 2013;(3):135-38.
- Mittal M, Siddiqui MR, Tran K, Reddy SP, Malik AB. Reactive oxygen species in inflammation and tissue injury. Antioxid Redox Signal. 2014 Mar 1; 20(7):112667. doi: 10.1089/ars.2012.5149.
- Burnstock G, Vaughn B, Robson SC. Purinergic signalling in the liver in health and disease. Purinergic Signal. 2014 Mar;10(1):51-70. doi: 10.1007/s11302013-9398-8.
- Camara AK, Lesnefsky EJ, Stowe DF. Potential therapeutic benefits of strategies directed to mitochondria. Antioxid Redox Signal. 2010 Aug 1;13(3):279-47. doi: 10.1089/ars.2009.2788.
- Jain MV, Paczulla AM, Klonisch T, Dimgba FN, Rao SB, Roberg K, Schweizer F, Lengerke C, Davoodpour P, Palicharla VR, Maddika S, Łos M. Interconnections between apoptotic, autophagic and necrotic pathways: implications for cancer therapy development. J Cell Mol Med. 2013 Jan;17(1):12-29. doi: 10.1111/jcmm.12001.
- Reynolds ES. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy. J Cell Biol. 1963 Apr;17:208-12.
- Багненко СФ, Горбачев НБ, Амагыров ВП, Батоцыренов БВ, Мирошниченко ВН. Фармакологическая коррекция метаболических нарушений при разлитом перитоните: пособие для врачей. С-Петербург, РФ; 2007. 20 с.
- Якубовский СВ., Лапша ВИ, Емельянова АА, Чайка ЛД. Изменения ультраструктуры микроциркуляторного русла печени при абдоминальной хирургической инфекции и их фармакологическая коррекция в эксперименте. Новости Мед-Биол Наук. 2010;2(4):189-95.
- Румянцева СА, Ступин ВА, Афанасьев ВВ, Оганов РГ, Силина ЕВ. Рациональная фармакотерапия при сосудистой патологии, или что такое хорошо и что такое плохо: клин практикум по лекарств терапии. Москва-С-Петербург, РФ: Мед кн; 2014. 339 с.
- Власов ПА, Суслов АВ, Шибитов ВА, Тимошкин СП, Логинов МА. Метаболическая терапия в коррекции энтеральной недостаточности. Вестн Мордов Ун-та. 2013;(1-2):142-45.
- Оковитый СВ, Шуленин СН, Смирнов АВ. Клиническая фармакология антигипоксантов и антиоксидантов. С-Петербург, РФ: ФАРМиндекс; 2005. 72 с.
- Перепеч НБ. Неотон (механизмы действия и клиническое применение. 2-е изд. С-Петербург, РФ: Прогресс-погода; 1997. 88 с.
References
- Vlasov AP, Tarasova TV, Kozlov IG, Loginova OV, Leshankina NY, Visaitov DA. The ways rising of detoxication natural mechanisms during peritonitis. Kuban Nauch Med Vestn. 2010;(2):17-22. (in Russ.)
- Chernov VN. Foci of introduction of infection and hepatic failure-accuracy in common abdominal infections. Kuban Nauch Med Vestn. 2013;(3):135-38. (in Russ.)
- Mittal M, Siddiqui MR, Tran K, Reddy SP, Malik AB. Reactive oxygen species in inflammation and tissue injury. Antioxid Redox Signal. 2014 Mar 1; 20(7):112667. doi: 10.1089/ars.2012.5149.
- Burnstock G, Vaughn B, Robson SC. Purinergic signalling in the liver in health and disease. Purinergic Signal. 2014 Mar;10(1):51-70. doi: 10.1007/s11302013-9398-8.
- Camara AK, Lesnefsky EJ, Stowe DF. Potential therapeutic benefits of strategies directed to mitochondria. Antioxid Redox Signal. 2010 Aug 1;13(3):279-47. doi: 10.1089/ars.2009.2788.
- Jain MV, Paczulla AM, Klonisch T, Dimgba FN, Rao SB, Roberg K, Schweizer F, Lengerke C, Davoodpour P, Palicharla VR, Maddika S, Łos M. Interconnections between apoptotic, autophagic and necrotic pathways: implications for cancer therapy development. J Cell Mol Med. 2013 Jan;17(1):12-29. doi: 10.1111/jcmm.12001.
- Reynolds ES. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy. J Cell Biol. 1963 Apr;17:208-12.
- Bagnenko SF, Gorbachev NB, Amagyrov VP, Batotsyrenov BV, Miroshnichenko VN. Farmakologicheskaia korrektsiia metabolicheskikh narushenii pri razlitom peritonite: posobie dlia vrachei. S-Petersburg; 2007. 20 p. (in Russ.)
- Yakubouski SV, Lapsha VI, Emelianovа АА, Chaika LD. Alterations of liver microcirculation in experimental abdominal surgical infection and their pharmacological correction. Novosti Med-Biol Nauk. 2010;2(4):189-95. (in Russ.)
- Rumiantseva SA, Stupin VA, Afanas'ev VV, Oganov RG, Silina EV. Ratsional'naia farmakoterapiia pri sosudistoi patologii, ili chto takoe khorosho i chto takoe plokho: Klin praktikum po lekarstv terapii. Moscow - SPetersburg, RF: Med kn; 2014. 339 p. (in Russ.)
- Vlasov PA, Suslov AV, Shibitov VA, Timoshkin SP, Loginov MA. Metabolicheskaia terapiia v korrektsii enteral'noi nedostatochnosti. Vestn Mordov Unta. 2013;(1-2):142-45. (in Russ.)
- Okovityi SV, Shulenin SN, Smirnov AV. Klinicheskaia farmakologiia antigipoksantov i antioksidantov. S-Petersburg, RF: FARMindeks; 2005. 72 p. (in Russ.)
- Perepech NB. Neoton (mekhanizmy deistviia i klinicheskoe primenenie. 2-e izd. S-Petersburg: ProgressPogoda; 1997. 88 p. (in Russ.)
Сведения об авторах
Яроцкая Наталья Николаевна, научный сотрудник научно-исследовательской лаборатории, Витебский государственный медицинский университет, г. Витебск, Республика Беларусь.
Гостищев Виктор Кузьмич, д.м.н., профессор, академик РАМН, заведующий кафедрой общей хирургии лечебного факультета, Первый Московский государственный медицинский университет им. И.М. Сеченова (Сеченовский Университет), г. Москва, Российская Федерация.
Косинец Владимир Александрович, д.м.н., профессор кафедры госпитальной хирургии с курсами урологии и детской хирургии, Витебский государственный медицинский университет, г. Витебск, Республика Беларусь.
Самсонова Инна Васильевна, к.м.н., доцент, заведующая кафедрой патологической анатомии, Витебский государственный медицинский университет, г. Витебск, Республика Беларусь.
Information about the authors
Yarotskaya Natalia N., Researcher of the Research Laboratory, Vitebsk State Medical University, Vitebsk, Republic of Belarus.
Gostishev Victor K., MD, Professor, Academician of RAMS, Head of the General Surgery Department of the Medical Faculty, I.M. Sechenov First Moscow State Medical University (Sechenov University), Moscow, Russian Federation.
Kosinets Vladimir A., MD, Professor of the Hospital Surgery Department with the Courses of Urology and Pediatric Surgery of Vitebsk State Medical University, Vitebsk, Republic of Belarus.
Samsonova Inna V., PhD, Associate Professor, Head of the Pathologic Anatomy Department, Vitebsk State Medical University, Vitebsk, Republic of Belarus.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)