Изучение протективной активности и механизма действия Циклоферона в клеточной культуре и при экспериментальной летальной гриппозной инфекции у белых м: Результаты исследования
Статьи
Изучение протективной активности и механизма действия Циклоферона
в клеточной культуре и при экспериментальной летальной гриппозной инфекции у белых мышей.
3.1. Протективная активность Циклоферона в опытах на животных.
3.2. Влияние Циклоферона на репродукцию вирусов гриппа в организме животных.
3.3. Влияние Циклоферона на морфогенез экспериментальной летальной гриппозной инфекции у белых мышей.
3.4. Влияние Циклоферона на морфологию вирусной популяции в легких животных.
3.5. Влияние Циклоферона на морфогенез гриппозной инфекции в культуре клеток.
3.1. Протективная активность Циклоферона в опытах на животных.
В ходе опыта по определению протективной активности Циклоферона на животных не было отмечено неспецифической смертности в контрольной группе интактных животных.
Клинические признаки заболевания не зависели от выбранного штамма и были типичными для гриппозной инфекции. Они включали: затрудненное дыхание, атаксию, тремор, а также снижение потребления корма и воды.
Данные по динамике смертности животных в контрольных и опытных группах суммированы в табл. 1-5 и на рис. 1-5.
Таблица 1.
Протективная активность Циклоферона при экспериментальной летальной гриппозной пневмонии белых мышей, вызванной вирусом гриппа A/Swine/1976/31 (H1N1).
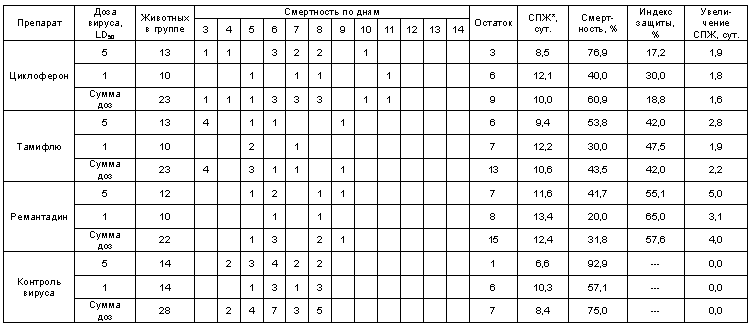
* - средняя продолжительность жизни
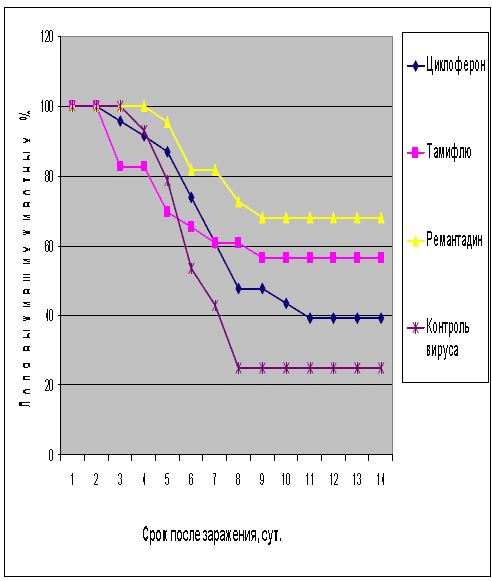
Рис.1. Протективная активность Циклоферона при экспериментальной летальной гриппозной пневмонии белых мышей, вызванной вирусом гриппа A/Swine/1976/31 (H1N1). Приведены данные по сумме двух доз вируса – 1 и 5 LD50.
Таблица 2. Протективная активность Циклоферона при экспериментальной летальной гриппозной пневмонии белых мышей, вызванной вирусом гриппа A/Mallard/Pennsylvania/10218/84 (H5N2).
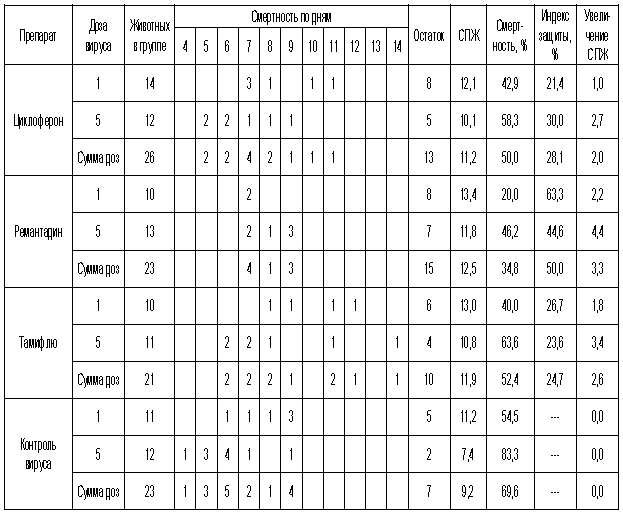
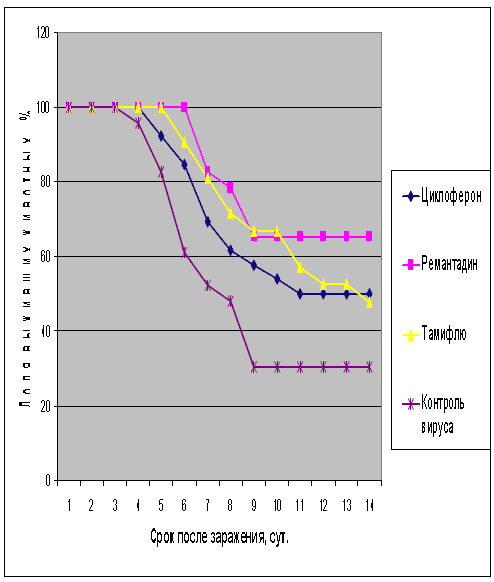
Рис.2. Протективная активность Циклоферона при экспериментальной летальной гриппозной пневмонии белых мышей, вызванной вирусом гриппа A/Mallard/Pennsylvania/10218/84 (H5N2). Приведены данные по сумме двух доз вируса – 1 и 5 LD50.
Таблица 3. Протективная активность Циклоферона при экспериментальной летальной гриппозной пневмонии белых мышей, вызванной вирусом гриппа A/Aichi/2/68 (H3N2).
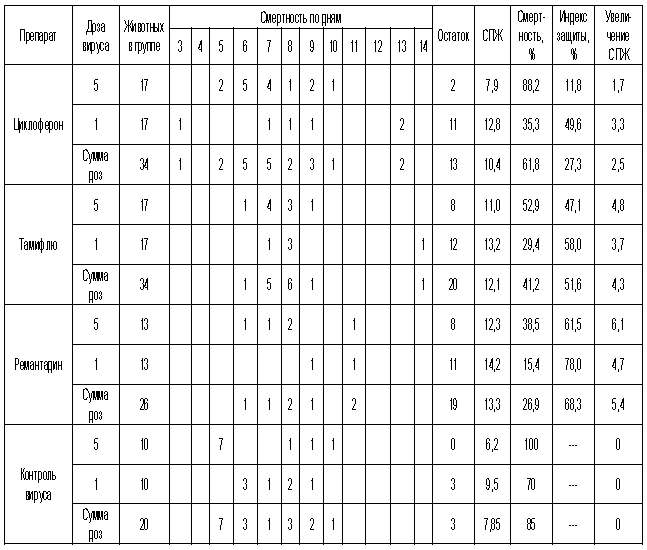
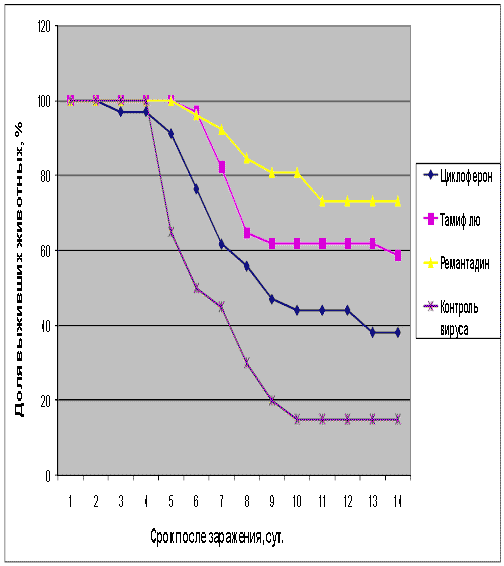
Рис.3. Протективная активность Циклоферона при экспериментальной летальной гриппозной пневмонии белых мышей, вызванной вирусом гриппа A/Aichi/2/68 (H3N2). Приведены данные по сумме двух доз вируса – 1 и 5 LD50.
Таблица 4. Протективная активность Циклоферона при экспериментальной летальной гриппозной пневмонии белых мышей, вызванной вирусом гриппа A/Puerto Rico/8/34 (H1N1).
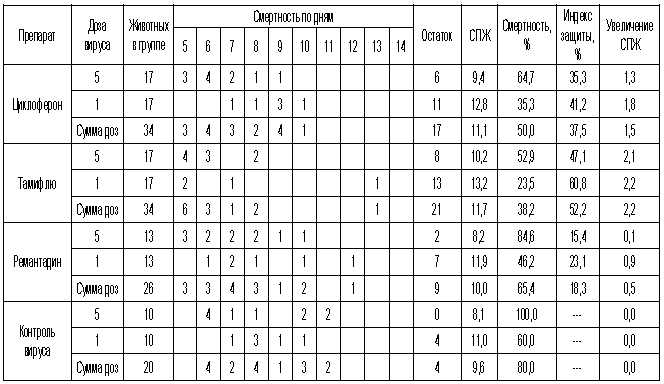
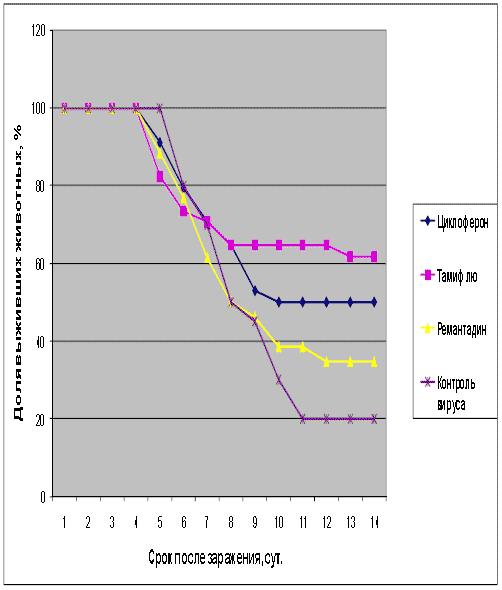
Рис.4. Протективная активность Циклоферона при экспериментальной летальной гриппозной пневмонии белых мышей, вызванной вирусом гриппа A/Puerto Rico/8/34 (H1N1). Приведены данные по сумме двух доз вируса – 1 и 5 LD50.
Таблица 5. Протективная активность Циклоферона при экспериментальной летальной гриппозной пневмонии белых мышей, вызванной вирусом гриппа A/Владивосток/2/09 (H1N1).
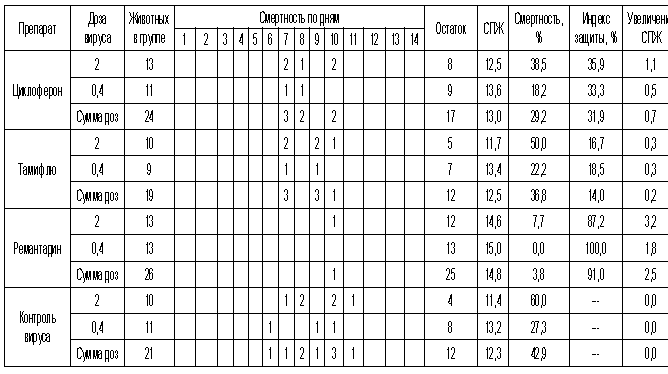
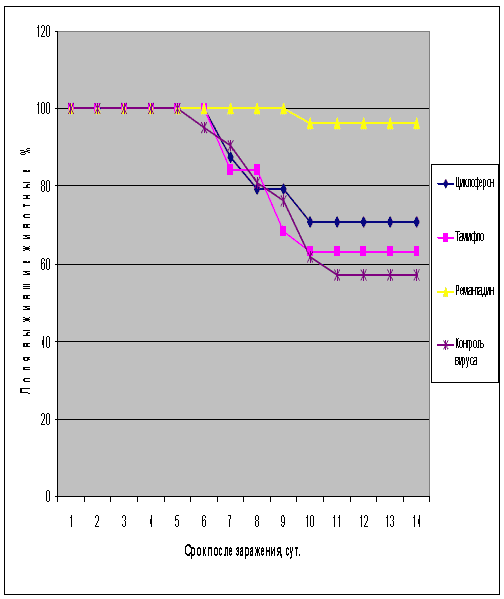
Рис.5. Протективная активность Циклоферона при экспериментальной летальной гриппозной пневмонии белых мышей, вызванной вирусом гриппа A/Владивосток/2/09 (H1N1). Приведены данные по сумме двух доз вируса – 0,4 и 2 LD50.
Как видно из представленных результатов, вирус гриппа вызывал летальную инфекцию у белых мышей, сопровождающуюся гибелью животных начиная с 3-4 суток после инфицирования в зависимости от дозы вируса и использованного штамма. Такой показатель, как продолжительность жизни животных, был связан с использованной дозой вируса обратной зависимостью. Активность Ремантадина, использованного в опытах как референс- препарат, была существенной для всех использованных штаммов, за исключением гриппа A/PR/8/34. Протективные свойства ремантадина при этой инфекции оказались весьма умеренными, что проявлялось некоторым снижением смертности в опытных группах по сравнению с контролем (индекс защиты 13-29 %) и незначительным увеличением продолжительности жизни (на 1,1 - 1,6 суток в зависимости от дозы вируса). Полученные данные, таким образом, согласуются с ранее полученными результатами экспериментов in vitro и in vivo, свидетельствующих о нечувствительности этого штамма вируса к ремантадину. Некоторый протективный эффект в этом случае можно объяснить антитоксическим действием препарата.
В то же время препарат сравнения Тамифлю проявлял в случае вируса A/PR/8/34 выраженный защитный эффект, как снижая смертность в группах мышей, получавших лечение (50-60 % по сравнению с контролем), так и увеличивая средний срок жизни животных (на 2 суток). Таким образом, использованный вирус оказался устойчив к ремантадину, однако чувствителен к Тамифлю.
С другой стороны, применение Тамифлю практически не влияло на показатели гибели животных, зараженных вирусом А/Владивосток/2/09 (H1N1). Таким образом, ранее полученные данные об устойчивости этого изолята к озельтамивиру - активному компоненту Тамифлю - были подтверждены в опытах на животных. Другой препарат сравнения - ремантадин - оказывал при этой инфекции выраженный защитный эффект.
Показатели протективной активности Циклоферона находились в промежутке 11-50% в зависимости от использованной дозы вируса и собственно модельного штамма. Увеличение средней продолжительности жизни животных составило 1,0 - 3,3 суток по сравнению с контролем. Следует отметить, что защитный эффект Циклоферона был выражен слабее, чем активность этиотропных препаратов сравнения (за исключением случаев резистентных штаммов), однако проявлялся в равной степени в отношении вирусов, различающихся по чувствительности к ремантадину и Тамифлю. Так, индекс защиты ремантадина против устойчивого вируса A/PR/8/34 составил 15-23%, тогда как Циклоферона - 35-41%. В то же время при использовании ремантадин- чувствительных штаммов активность ремантадина существенно превосходила эффект Циклоферона (табл.3).
3.2. Влияние Циклоферона на репродукцию вирусов гриппа в организме животных.
На следующем этапе исследования было изучено влияние Циклоферона на репликативную активность вирусов гриппа в ткани легких инфицированных животных. С этой целью из легких животных на 3 сутки после заражения были приготовлены гомогенаты, в которых затем определяли инфекционный титр вируса в культуре клеток.
Данные об уровне репликации модельных вирусов гриппа в организме животных приведены в табл. 6.
Таблица 6. Инфекционная активность вирусов гриппа в ткани легких белых мышей в условиях применения химиопрепаратов.
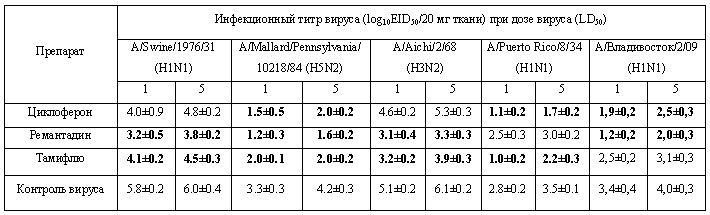
* - отличия от контроля достоверны при p
Как видно из приведенных результатов, Циклоферон снижал инфекционные титры всех исследованных вирусов, хотя и в разной степени. В отношении вирусов A/Swine/1976/31 и A/Aichi/2/68 это снижение оказалось недостоверным. Тем не менее, эффект Циклоферона отмечался и для вирусов A/Puerto Rico/8/34 и А/Владивосток/2/09, нечувствительных к препаратам сравнения.
3.3. Влияние Циклоферона на морфогенез экспериментальной летальной гриппозной инфекции у белых мышей.
На следующем этапе исследований были изучены особенности морфогенеза гриппозной инфекции в организме животных в условиях применения Циклоферона. Качественно морфологические картины гриппозной пневмонии, вызванной пятью использованными вирусами гриппа, были сходны между собой. Несколько более слабая реакция отмечалась в легких животных, зараженных озельтамивир- устойчивым вирусом А/Владивосток/2/09. Эти данные согласуются с результатами предыдущих этапов исследования о пониженной патогенности этого штамма для лабораторных животных (см. выше).
Морфологически изменения легочной ткани у зараженных животных на 3 сутки мосле инфицирования характеризовались поражениями легких в виде скоплений нейтрофилов и клеточного детрита в просветах крупных бронхов, вирусспецифическим поражением клеток бронхиального эпителия с формированием в них вирусных включений и отторжением пораженных клеток в просвет бронха, интенсивного серозного интерстициального отека, очагов геморрагического отека, нейтрофильной инфильтрации и распада клеток в респираторных отделах, расширением сосудов и спадением альвеол (Рис.6). У всех животных наблюдалась экссудация серозной жидкости в просвет спавшихся альвеол. Значительная часть нейтрофилов при этом находилась в стадии распада (Рис.7).
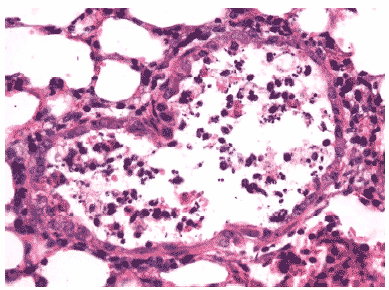
Рис.6. Деструкция клеток бронхиального эпителия и клеточный экссудат в просвете бронха мыши на 3 сутки после инфицирования вирусом гриппа А/Владивосток/2/09 (H1N1). Гематоксилин-эозин, ?400.
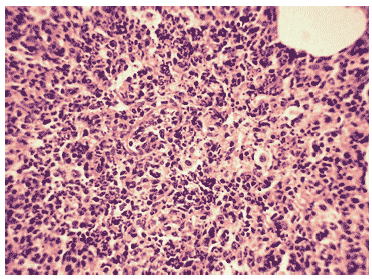
Рис.7. Интенсивный клеточный экссудат в респираторных отделах легкого мыши на 3 сутки после заражения вирусом гриппа A/Aichi/2/68 (H3N2). Гематоксилин-эозин, ?240.
У выживших животных через 12 дней после заражения серозный экссудат замещался клеточным, состоящим из нейтрофилов, лимфоцитов и макрофагов. Пораженный слой бронхиального эпителия восстанавливался, образуя характерные структуры гиперплазированных клеток. Избыточные пролиферативные и репаративные процессы в ткани легких приводили к бронхиолярной метаплазии альвеолярного эпителия, образующего аденоматозные структуры, окруженные массивными инфильтратами лимфоидно-макрофагальных элементов, что приводило к карнификации обширных отделов легких. Эпителий бронхов был гиперплазирован. Просветы бронхов были заполнены экссудатом, состоящим из нейтрофилов, круглоклеточных элементов и клеточного детрита. В просветах ателектазированных альвеол в респираторных отделах отмечалась мощная клеточная воспалительная реакция и большое количество клеточного детрита (Рис.8, 9).
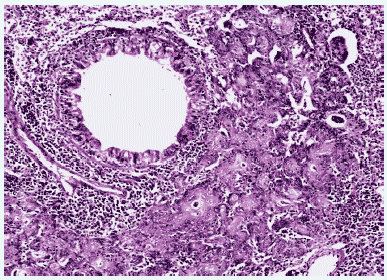
Рис. 8. Метаплазия бронхиального эпителия и интенсивный клеточный инфильтрат в респираторных отделах легкого мыши на 12 сутки после инфицирования вирусом гриппа A/swine/1976/31 (H1N1). Гематоксилин-эозин, ув. ?240.
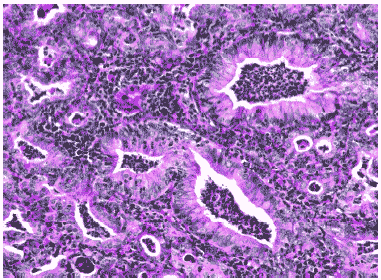 Рис. 9. Гиперплазия бронхиального эпителия и клеточный экссудат в просвете бронхов мыши на 12 сутки после инфицирования вирусом гриппа A/swine/1976/31 (H1N1). Гематоксилин-эозин, ув. ?240.
Рис. 9. Гиперплазия бронхиального эпителия и клеточный экссудат в просвете бронхов мыши на 12 сутки после инфицирования вирусом гриппа A/swine/1976/31 (H1N1). Гематоксилин-эозин, ув. ?240.
Применение ремантадина приводило к существенному ограничению очагов гриппозной пневмонии как на стадии острой, так и на стадии хронической инфекции. Очаги постгриппозной пневмонии в легких животных, получавших ремантадин, на всех стадиях эксперимента не отличались качественно и по клеточному составу от очагов в легких контрольных животных. На 3 сутки после заражения в ткани легких отмечался отек и утолщение межальвеолярных перегородок. Процессы серозно-геморрагической инфильтрации респираторных отделов были выражены в намного меньшей степени, чем у контрольных животных. Клеточный экссудат в просветах бронхов отмечался в незначительном количестве или отсутствовал совсем. В целом клетки бронхиального эпителия выглядели интактными, вирусспецифические включения в них отмечались редко. Средний размер очагов острой гриппозной пневмонии был меньше, чем в контроле. На 12 сутки после заражения интенсивность воспалительных процессов была также ниже по сравнению с контролем, что обусловлено специфическим снижением титра вируса на ранних сроках инфекционного процесса и, как следствие, уменьшением выраженности вирусиндуцированных процессов на дальних стадиях пневмонии (Рис.10, 11).
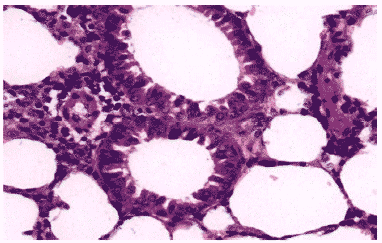
Рис.10. Просветы бронхов в легком мыши на 3 сутки после инфицирования вирусом гриппа А/Владивосток/2/09 (H1N1) в условиях применения ремантадина. Клетки бронхиального эпителия выглядят интактными, клеточный экссудат в просветах бронхов незначителен, периваскулярная инфильтрация умеренная. Гематоксилин-эозин, ?400.
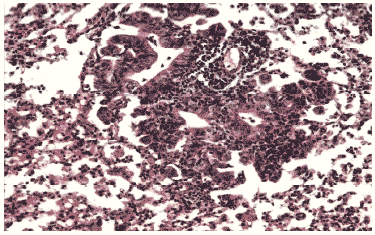
Рис. 11. Умеренная метаплазия бронхиального эпителия и незначительный клеточный инфильтрат в респираторных отделах легкого мыши на 12 сутки после инфицирования вирусом гриппа A/swine/1976/31 (H1N1) в условиях применения ремантадина. Гематоксилин-эозин, ув. ?240.
Следует отметить, что у животных, зараженных ремантадин- устойчивым штаммом гриппа A/PR/8/34 степень поражения легких и выраженность вирусиндуцированных процессов в легочной ткани практически не отличались от таковых в контрольной группе мышей (Рис.12, 13).
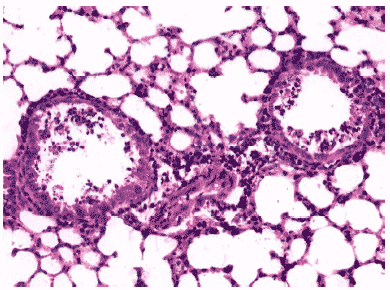 Рис.12. Деструкция клеток бронхиального эпителия и клеточный экссудат в просветах бронхов мыши на 3 сутки после инфицирования ремантадин- устойчивым вирусом гриппа A/Puerto Rico/8/34 (H1N1) на фоне применения ремантадина. Гематоксилин-эозин, ?240.
Рис.12. Деструкция клеток бронхиального эпителия и клеточный экссудат в просветах бронхов мыши на 3 сутки после инфицирования ремантадин- устойчивым вирусом гриппа A/Puerto Rico/8/34 (H1N1) на фоне применения ремантадина. Гематоксилин-эозин, ?240.
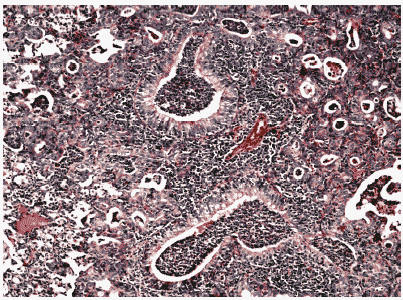
Рис.13. Метаплазия бронхиального эпителия и интенсивный клеточный инфильтрат в респираторных отделах легкого мыши на 12 сутки после инфицирования ремантадин- устойчивым вирусом гриппа A/Puerto Rico/8/34 (H1N1) в условиях применения ремантадина. Гематоксилин-эозин, ув. ?240.
Сходные данные были получены при лечении животных препаратом Тамифлю. Так же, как и в случае Ремантадина, применение его для лечения инфекции, вызванной чувствительными штаммами A/Puerto Rico/8/34 (H1N1) и A/swine/1976/31 (H1N1), приводило к резкому ограничению очагов гриппозной пневмонии (как на острой, так и на хронической стадиях). В то же время в отношении озельтамивир- устойчивого штамма А/Владивосток/2/09 снижение уровня вирусспецифических патологических процессов оказалось минимальным (Рис. 14, 15).
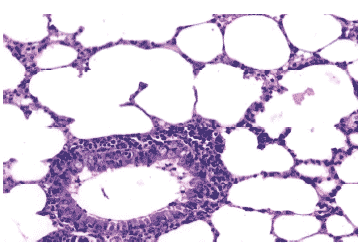 Рис. 14. Очаг гриппозной пневмонии в легком мыши на 3 сутки после инфицирования вирусом гриппа А/mallard/ Pennsylvania/10218/84 (H5N2) в условиях применения Тамифлю. Клетки бронхиального эпителия и межальвеолярные перегородки выглядят интактными, клеточный экссудат в просветах бронхов незначителен, перибронхиальная инфильтрация умеренная. Гематоксилин-эозин, ?240.
Рис. 14. Очаг гриппозной пневмонии в легком мыши на 3 сутки после инфицирования вирусом гриппа А/mallard/ Pennsylvania/10218/84 (H5N2) в условиях применения Тамифлю. Клетки бронхиального эпителия и межальвеолярные перегородки выглядят интактными, клеточный экссудат в просветах бронхов незначителен, перибронхиальная инфильтрация умеренная. Гематоксилин-эозин, ?240.
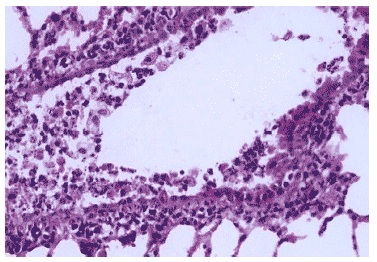
Рис.15. Деструкция клеток эпителия крупного бронха и клеточный экссудат в просвете на 3 сутки после инфицирования Тамифлю - устойчивым вирусом гриппа A/Владивосток/2/09 (H1N1) на фоне применения Тамифлю. Гематоксилин-эозин, ?240.
При изучении особенностей морфогенеза экспериментальной гриппозной инфекции при лечебно-профилактическом введении Циклоферона в дозе 120 мг/кг было отмечено, что морфогенез инфекционного процесса в легких животных, получавших препарат, во многом отличался от морфологических изменений в легких контрольных животных. Основное отличие на 3 сутки после инфицирования касалось характера воспалительного экссудата. Клеточный компонент экссудата был представлен исключительно интактными нейтрофилами, лимфоцитами и макрофагами в несколько большем количестве по сравнению с легкими контрольных животных. Клетки бронхиального эпителия выглядели сохранными (Рис.16), в отличие от разрушенных клеток с многочисленными вирусными включениями у контрольных животных. Сами очаги воспаления занимали меньшую по сравнению с контролем площадь. Стимуляция местного иммунного ответа проявлялась также в наличии зон интенсивной периваскулярной инфильтрации круглоклеточными элементами (Рис.17).
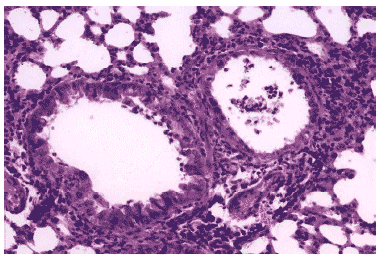
Рис. 16. Очаг гриппозной пневмонии в легком мыши на 3 сутки после инфицирования вирусом гриппа А/mallard/Pennsylvania/10218/84 (H5N2) в условиях применения Циклоферона. Клетки бронхиального эпителия выглядят интактными, клеточный экссудат в просветах бронхов незначителен, интенсивная перибронхиальная инфильтрация. Гематоксилин-эозин, ?240.
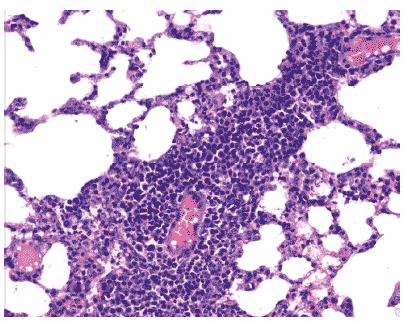
Рис. 17. Очаг периваскулярной инфильтрации в легком мыши на 3 сутки после заражения вирусом гриппа A/swine/1976/31 (H1N1). Клеточные элементы инфильтрата интактны, серозный экссудат в респираторных отделах выражен слабо, межальвеолярные перегородки умеренно отечны. Гематоксилин-эозин, ?240.
Те же тенденции отмечались и на стадии постгриппозной пневмонии. Очаги поражения легких были ограничены в размерах, при морфологическом исследовании выявлялась умеренная метаплазия эпителия и инфильтрация интерстиция интактными нейтрофилами и круглоклеточными элементами (Рис.18). В отличие от контрольных животных, очаги постгриппозной пневмонии были резко отграничены от окружающей легочной паренхимы. Межальвеолярные перегородки выглядели при этом практически интактными (Рис.19, 20).
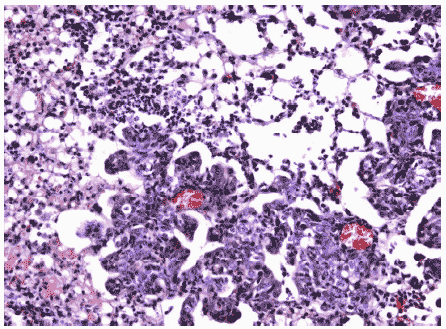
Рис.18. Умеренная метаплазия бронхиального эпителия и клеточный инфильтрат в респираторных отделах легкого мыши на 12 сутки после инфицирования ремантадин- устойчивым вирусом гриппа A/Puerto Rico/8/34 (H1N1) в условиях применения Циклоферона. Гематоксилин-эозин, ув. ?240.
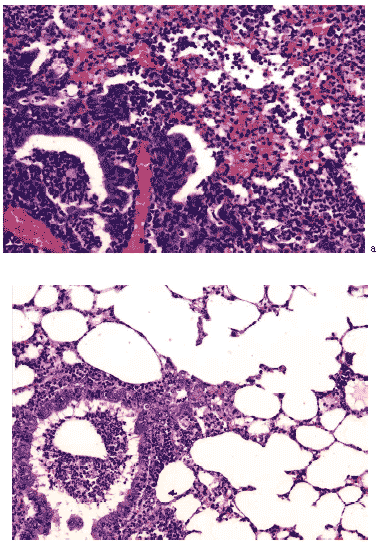
Рис. 19. Очаг постгриппозной пневмонии в легком мыши на 12 сутки после инфицирования вирусом гриппа A/Владивосток/2/09 (H1N1). а – контрольная группа, б – в условиях применения циклоферона. Гематоксилин- эозин, ув. ?240.
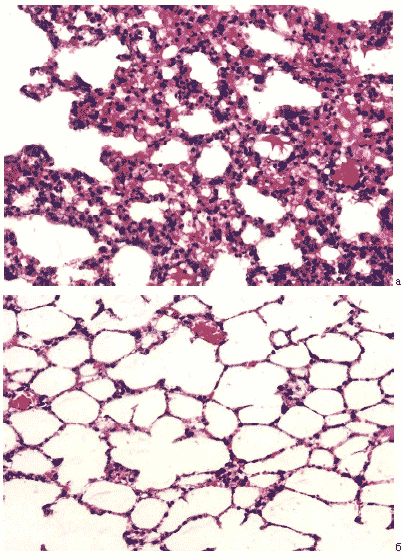
Рис.20. Респираторные отделы легких мыши на 12 сутки после заражения вирусом гриппа A/Владивосток/2/09 (H1N1). а – контрольная группа, б – в условиях применения циклоферона. Гематоксилин-эозин, ув. ?240.
Таким образом, стимуляция иммунного ответа на стадии острого гриппа при применении Циклоферона приводит к ограничению очагов постгриппозной пневмонии и нормализации структуры респираторных отделов легких по окончании острой фазы заболевания. Следует отдельно отметить, что эффект Циклоферона наблюдался при заражении животных любым из пяти исследованных вирусов независимо от их чувствительности или устойчивости к препаратам сравнения.
3.4. Влияние Циклоферона на морфологию вирусной популяции в легких животных.
Для изучения влияния Циклоферона на особенности морфологии вирионов, реплицирующихся в легких животных, бронхолегочные смывы, освобожденные от клеточной фракции, были подвергнуты центрифугированию для концентрирования вирусного содержимого, после чего ресуспендированный осадок был исследован под электронным микроскопом.
В ходе исследований был показано, что бронхолегочные смывы интактных животных не содержали вирионов. В поле зрения обнаруживались агломераты сурфактанта в виде округлых образований, гомогенных по структуре или содержащих полость, с гладкой поверхностью (Рис.21).

Рис. 21. Агломераты сурфактанта (указаны стрелками) в легких интактной мыши. Негативное контрастирование, ?50 000.
На 3 сутки после заражения животных вирусом гриппа A/swine/1976/31 (H1N1) в бронхолегочных смывах в большом количестве обнаруживались вирионы гриппа, которые можно было идентифицировать по типичной морфологии - округлыеили чуть продолговатые частицы с плотной каемкой поверхностных гликопротеидов по периферии (Рис.22, 23).
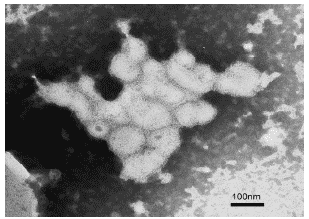
Рис.22. Вирионы гриппа A/swine/1976/31 (H1N1) в бронхолегочных смывах мыши на 3 сутки поле инфицирования. Негативное контрастирование, ?50 000.

Рис. 23. Типичная морфология вирионов гриппа A/swine/1976/31 (H1N1) в бронхолегочных смывах мыши на 3 сутки поле инфицирования. a, b – круглые, с – продолговатые или бобовидные. Негативное контрастирование, ?50 000.
У животных, прошедших обработку Циклофероном, в бронхолегочных смывах также обнаруживались скопления вирионов гриппа. Однако с точки зрения морфологии они существенно отличались от вирионов контрольной группы. Среди вирусной популяции преобладали искривленные, вытянутые и нитчатые формы. При этом многие вирионы имели бoльшие по сравннию с контрольными размеры и протяженные дефекты щетки поверхностных гликопротеидов (Рис. 24, 25).

Рис.24. Вирионы гриппа A/swine/1976/31 (H1N1) в бронхолегочных смывах мыши на 3 сутки поле инфицирования на фоне применения Циклоферона. Дефектные частицы указаны стрелками. Негативное контрастирование, ?50 000.
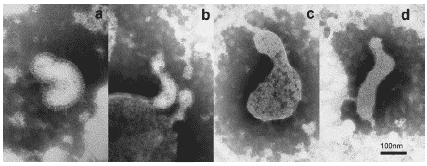
Рис. 25. Типичная морфология вирионов гриппа A/swine/1976/31 (H1N1) в бронхолегочных смывах мыши на 3 сутки поле инфицирования в условиях применения Циклоферона. a, b, d – вытянутые, с – гигантские полигеномные с протяженными дефектами поверхностных гликопротеидов. Негативное контрастирование, ?50 000.
Таким образом, в результате проведенной серии опытов показано, что действие Циклоферона в отношении реплицирующегося вируса гриппа in vivo заключается в нарушении морфогенеза вирусных частиц, что выражается в преобладании в вирусной популяции крупных частиц неправильной формы, часть с поверхностными дефектами. Инфекционность таких популяций бывает снижена за счет двух обстоятельств. Во- первых, гигантские вирусные частицы, хотя и содержат большое количество копий вирусного генома, однако неспособны инфицировать больше одной клетки, что приводит к неполной реализации инфекционного потенциала вируса. Во- вторых, дефекты в поверхностных гликопротеидах затрудняют адгезию вирионов на поверхности клеток- мишеней. Это приводит к задержке вируса во внеклеточном пространстве, делая его мишенью для протеолитических ферментов и иммунокомпетентных клеток. Учитывая эти данные, можно говорить о Циклофероне как о препарате комплексного механизма действия, воздействующем как на активность системы врожденного иммунитета хозяина, так и - возможно, опосредованно - на процессы собственно вирусного морфогенеза, снижая инфекционность вирусного потомства.
3.5. Влияние Циклоферона на морфогенез гриппозной инфекции в культуре клеток.
Для более детального изучения действия Циклоферона в культуре клеток морфогенез вируса гриппа в контроле и в присутствии Циклоферона был изучен при помощи электронной микроскопии.
Как было показано в ходе ультраструктурных исследований, клетки интактной культуры MDCK имели округлую или продолговатую форму и содержали крупное центрально расположенное ядро. В цитоплазме находились многочисленные округлые или овальные митохондрии, вакуоли гранулярной и агранулярной эндоплазматической сети. В вакуолях определялись рыхлые округлые тела умеренной электронной плотности. Аппарат Гольджи был представлен скоплениями уплощенных цистерн, вакуолями и микропузырьками. Ядерный хроматин в нуклеоплазме в виде конденсатов располагался по всему объему ядра, в центре которого обнаруживались крупные ядрышки (Рис. 26).
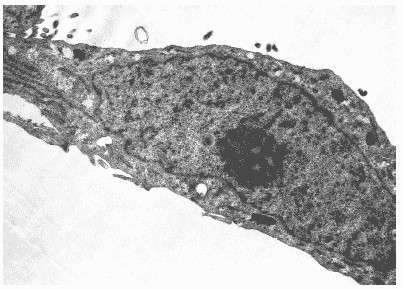
Рис.26. Клетка интактной культуры MDCK. Ув. 10 000.
Заражение вирусом гриппа A/swine/1976/31 (H1N1) приводило к развитию в клетках характерных изменений клеточных структур. Так, через 12 часов после инфицирования в ядрах клеток наблюдались пересортировка хроматина и развитие многочисленных оформленных и диффузных ядерных включений различной плотности. В их составе были хорошо различимы типичные спиральные структуры, представляющие собой новосинтезированные нуклеокапсиды, еще не покрытые оболочкой (Рис.27).
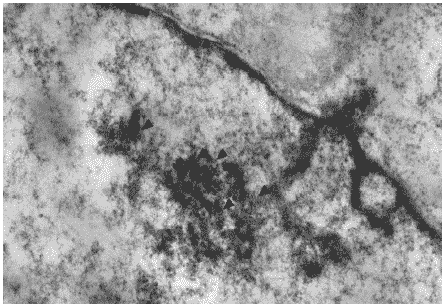
Рис.27. Вирусспецифические включения в ядре клетки MDCK через 12 часов после заражения вирусом гриппа A/swine/1976/31 (H1N1). Видна спиральная структура нуклеокапсидов (указаны стрелками). Ув. 20000.
Через 24 часа после инфицирования клеток хроматин располагался преимущественно по периферии ядер. Ядрышки исчезали. Вирусспецифические включения большей частью исчезали, что свидетельствовало об окончании ядерной стадии синтеза вирусных нуклеокапсидов, их транспорте в цитоплазму и далее, к плазматической мембране (Рис.28).
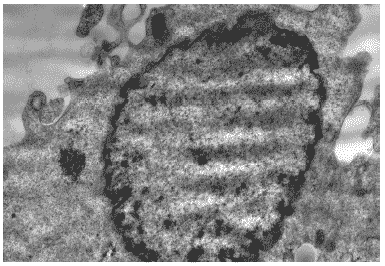
Рис.28. Клетка MDCK через 24 часа после инфицирования вирусом гриппа A/swine/1976/31 (H1N1). Периферическая локализация хроматина, ядрышко отсутствует. Ув. 10 000.
В цитоплазме клеток на этой стадии отчетливо прослеживались признаки цитотоксического действия вируса. Сама цитоплазма содержала большое число вакуолей, в которых отмечались многочисленные почкующиеся вирионы гриппа (Рис. 29). В ряде случаев периферические зоны цитоплазмы содержали большое количество расширенных цистерн комплекса Гольджи (Рис.30), что свидетельствовало об интенсивно идущих процессах процессинга белков для построения дочерних вирионов. На поверхности клеток отмечались вирионы потомства, почкующиеся от плазматической мембраны, а также зрелые внеклеточные вирусные частицы.
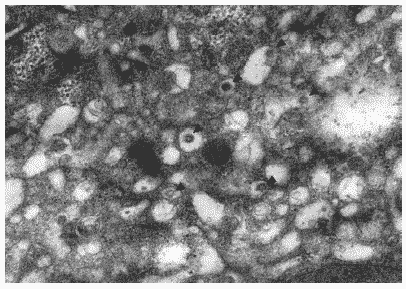
Рис.29. Вакуолизированная цитоплазма клетки MDCK через 24 часа после инфицирования вирусом гриппа A/swine/1976/31 (H1N1). Вирионы, почкующиеся в вакуоли, отмечены стрелками. Ув. 20 000.
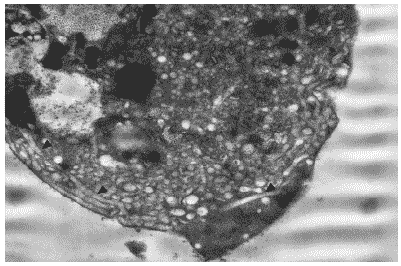
Рис.30. Цитоплазма клетки MDCK через 24 часа после инфицирования вирусом гриппа A/swine/1976/31 (H1N1). Многочисленные вакуоли и расширенные цистерны комплекса Гольджи (последние указаны стрелками) в перифероческих бластях цитоплазмы. Ув. 10 000.
При культивировании клеток в присутствии карбоксилата озельтамивира формирования внутриядерных включений и вирионов потомства практически не наблюдалось. Клетки выглядели практически интактными, органеллы были не изменены, ядерные включения были практически не выражены, распределение хроматина было характерным для нормальных клеток или с небольшими нарушениями, ядрышко было хорошо выражено и расположено центрально.
Клетки незараженной культуры, инкубированные с Циклофероном в течение 48 часов выглядели интактными, их органеллы были сохранны и морфологически не отличались от соответствующих структур контрольных клеток (Рис.31).
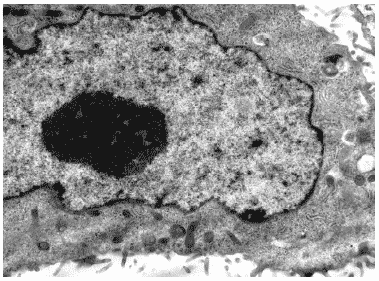
Рис.31. Клетка MDCK через 48 часов инкубации с Циклофероном (200 мкг/мл). Ув. 10 000.
При заражении вирусом гриппа через 12 часов развития инфекционного процесса морфологических признаков репликации вируса в клетках не отмечалось (Рис.32). Вакуоли в цитоплазме наблюдались в небольшом количестве, ядра выглядели округлыми, ядрышки были хорошо сформированы, характер расположения хроматина и структура клеточных органелл были типичными для интактных клеток.
 Рис.32. Клетка MDCK через 12 часов после инфицирования вирусом гриппа A/swine/1976/31 (H1N1) в присутствии Циклоферона. (200 мкг/мл). Ув. 10 000.
Рис.32. Клетка MDCK через 12 часов после инфицирования вирусом гриппа A/swine/1976/31 (H1N1) в присутствии Циклоферона. (200 мкг/мл). Ув. 10 000.
На поздних стадиях инфекционного процесса (24 часа после заражения) инфицированные клетки в присутствии Циклоферона существенно отличались от контрольной культуры. В первую очередь это отличие касалось структуры цитоплазмы. В отличие от контрольных клеток, цитоплазма клеток, культивированных с Циклофероном не содержала вакуолей, характерных для цитопатического эффекта вируса, а выглядела практически интактной, несмотря на почкующиеся от плазматической мембраны вирионы потомства, свидетельствующие об интенсивно проходящих процессах вирусной репликации (Рис. 33).
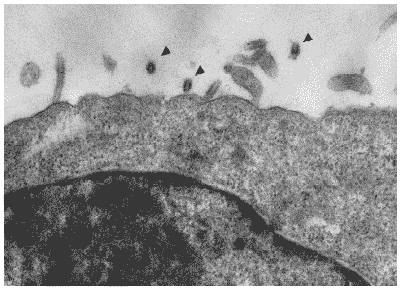
Рис. 33. Клетка MDCK через 24 часа после инфицирования вирусом гриппа A/swine/1976/31 (H1N1) в присутствии Циклоферона. (200 мкг/мл). Вирионы потомства, почкующиеся от плазматической мембраны, указаны стрелками. Ув. 10 000.
Некоторые клетки, однако, как и клетки контрольной культуры, имели сильно вакуолизированную цитоплазму. Отличие таких клеток от контрольных заключалось в том, что в их вакуолях не было обнаружено почкующегося вируса (Рис.34). Этот факт может свидетельствовать о способности Циклоферона к задержке нормального хода вирусного морфогенеза. Кроме того, среди вакуолей не отмечалось цистерн и пузырьков аппарата Гольджи, что говорит о некотором угнетении синтеза и процессинга белка, необходимого для построения вирионов потомства.
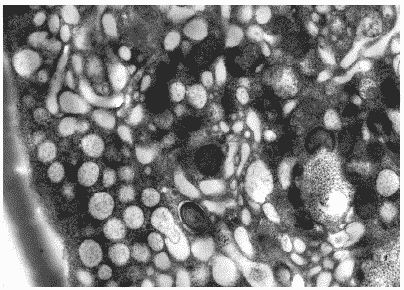
Рис.34. Цитоплазма клетки MDCK через 24 часа после инфицирования вирусом гриппа A/swine/1976/31 (H1N1) в присутствии Циклоферона. Ув. 20 000.
В ядрах инфицированных клеток изредка отмечались вирусспецифические включения. В ряде клеток их структура отличалась от таковой в клетках контрольной культуры на том же сроке развития инфекции. В этом случае сформированные вирусные включения не имели характерной спиральной структуры нуклеокапсидов, а имели диффузный и неоформленный характер (Рис. 35 а, б)
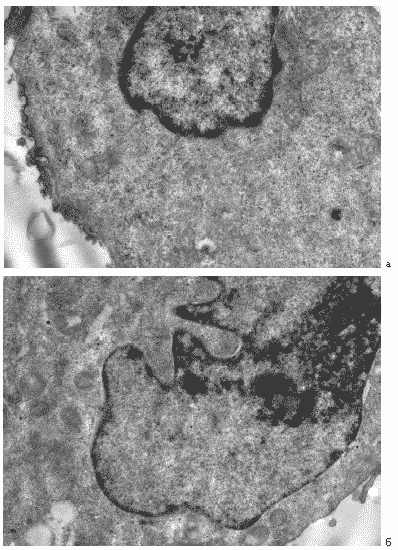
Рис. 35. Клетки MDCK через 24 часа после инфицирования вирусом гриппа A/swine/1976/31 (H1N1) в присутствии Циклоферона. (200 мкг/мл). а - небольшое вирусспецифическое ядерное включение нормальной ультраструктуры, б – диффузное неоформленное включение. Ув. 10 000.
Таким образом, действие Циклоферона на морфогенез вируса гриппа в культуре клеток MDCK заключалось в предотвращении цитопатического действия вируса, задержке вирусной репликации и нарушении структуры вирусспецифических включений в ядре клетки.
Далее: 4. Заключение
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)