Особенности течения и терапии респираторного микоплазмоза у детей в эпидемический сезон 2020-2021 гг.
Статьи
С.П.Кремплевская1,2, А.Д.Музыка1, Е.Ю.Солдатова1, О.О.Погорелова1, В.И.Барыкин2, В.А.Мирзонов2, Е.В.Мелехина1
1Центральный научно-исследовательский институт эпидемиологии Роспотребнадзора, Москва, Российская Федерация;
2Химкинская областная больница, Химки, Российская Федерация
Опубликовано в: Кремплевская С.П., Музыка А.Д., Солдатова Е.Ю., Погорелова О.О., Барыкин В.И., Мирзонов В.А., Мелехина Е.В.
Особенности течения и терапии респираторного микоплазмоза у детей в эпидемический сезон 2020–2021 гг. Вопросы практической педиатрии. 2021; 16(3): 37–46. DOI: 10.20953/1817-7646-2021-3-37-46
По данным ряда авторов, инфекция, вызванная Mycoplasma pneumoniae, является одной из наиболее часто встречающихся в текущем эпидемическом сезоне 2020-2021 гг. во всем мире. Данный факт имеет важное значение в текущем эпидсезоне в связи с необходимостью проведения дифференциального диагноза с легкими формами COVID-19 и своевременного подбора этиотропной терапии.
Материалы и методы. В статье представлены данные по частоте выявления микоплазменных пневмоний в детском инфекционном отделении ГАУЗ МО «Химкинской ОБ» МЗ РФ за последние 5 лет.
Результаты. Отмечается рост доли пациентов, госпитализированных с внебольничными пневмониями, с преимущественным увеличением частоты регистрации внебольничных пневмоний с октября 2017 г. по апрель 2018 г., а также весной 2020 г. Этиологическая роль микоплазменной инфекции в развитии внебольничных пневмоний в 2020-2021 гг. у детей составила от 31 до 67% в зависимости от месяца и сезона. Представлена сравнительная клиническая характеристика течения внебольничных пневмоний микоплазменной и немикоплазменной этиологии. Описан клинический случай течения сочетанной инфекции, вызванной микоплазменной пневмонией и вирусом Эпштейна-Барр, обосновано применение препарата меглюмина акридонацетат (Циклоферон) в комплексной терапии данного состояния.
Ключевые слова: внебольничная пневмония, дети, микоплазменная инфекция, меглюмина акридонацетат
Characteristics of and treatment for respiratory mycoplasmosis in children during the epidemic season 2020-2021
S.P.Kremplevskaya 1,2, A.D.Muzyka1, E.Yu.Soldatova1, O.O.Pogorelova1, V.I.Barykin2, V.A.Mirzonov2, E.V.Melekhina1
1Central Research Institute of Epidemiology of The Federal Service on Customers' Rights Protection and Human Well-being Surveillance, Moscow, Russian Federation;
2Khimki Regional Hospital, Khimki, Russian Federation
According to some authors, infection caused by M. pneumoniae is one of the most common in the current epidemic season of 2020-2021 worldwide. This fact is particularly important now because of the need for differential diagnosis between mild COVID-19 and respiratory infection caused by M. pneumoniae, as well as for timely administration of causal therapy.
Materials and methods. In this study, we analyzed the frequency of pneumonia caused by M. pneumoniae detected among children admitted to the Pediatric Department for Infectious Diseases of Khimki Hospital over the last 5 years.
Results. We observed an increase in the proportion of patients hospitalized with community-acquired pneumonia, primarily between October 2017 and April 2018, as well as in the spring of 2020. In 31% to 67% of children treated in 2020-2021 (depending on the month and season), community-acquired pneumonia was caused by M.pneumoniae. We also analyzed clinical characteristics of community-acquired pneumonia caused by M. pneumoniae and other pathogens. In addition to that, we report a case of mixed infection (M. pneumoniae plus Epstein-Barr virus) and provide a rationale for administration of meglumine acridone acetate (Cycloferon) as a part of comprehensive treatment for this pathology.
Key words: community-acquired pneumonia, children, infection caused by Mycoplasma pneumoniae, meglumine acridone acetate
Респираторный микоплазмоз - группа инфекционно-воспалительных заболеваний органов дыхания, вызываемых патогенными микроорганизмами рода Mycoplasma. Основным возбудителем при этом является Mycoplasma pneumoniae, поэтому термин «респираторный микоплазмоз» в основном ассоциируется с инфекцией, вызванной M. pneumoniae. Роль других микоплазм в генезе респираторных инфекций до настоящего времени остается дискутабельной.
Респираторный микоплазмоз широко распространен в популяции и регистрируется повсеместно. На долю инфекций, вызванных M. pneumoniae, приходится до 10-16% всех случаев острых респираторных заболеваний, а в период эпидемических вспышек - до 30-40%. При этом отмечено, что респираторный микоплазмоз характеризуется определенными возрастными особенностями: наиболее часто заболевание регистрируется у детей-школьников, подростков и лиц молодого возраста. Эпидемический подъем заболеваемости M. pneumoniae-инфекции, по данным ряда авторов, имеет место каждые 4-8 лет [1-3].
В период пандемии новой коронавирусной инфекции, учитывая, что во время предыдущих пандемий гриппа сопутствующие бактериальные инфекции были основной причиной смертности, сочетание COVID-19 и M. pneumoniae является предметом повышенного внимания клиницистов. Ко-инфекция с M. pneumoniae была описана как у взрослых, так и у детей [1-7]. f^
Lansbury L. et al. провели систематический обзор и метаанализ исследований, опубликованных в Embase, Medline, Cochrane Library, LILACS и CINAHL с 1 января 2020 г. по 17 апреля 2020 г. На основании анализа 30 исследований с участием 3834 пациентов всех возрастов показали, что 7% госпитализированных пациентов с COVID-19 имели сопутствующую бактериальную инфекцию (95% ДИ 3-12%, n = 2183, 12 = 92,2%). Самыми распространенными патогенами были M. pneumonia, Pseudomonas aeruginosa и Haemophilus influenzae [2].
По данным Zha L. et al, в Центральной больнице Ухани с 15 января 2020 г. по 15 марта 2020 г. частота ко-инфекции M. pneumoniae составила лишь 2,5% - 22 из 874 пациентов с лабораторно подтвержденным COVID-19 [3]. Лю Ю-Цзин с соавт., напротив, показали, что из 174 детей с COVID-19, госпитализированных в отделение детской больницы Ухани, ко-инфекция с M. pneumoniae была подтверждена в 32% случаев [8].
В то же время Fujita J. опубликовал данные о том, что в Японии после начала пандемии COVID-19 распространенность пневмонии, вызванной M. pneumoniae, заметно снизилась в течение сезона 2020 г. по сравнению с сезонами 2012 и 2016 гг. - возможно, потому, что дети, которые являются основными резервуарами M. pneumoniae, не посещали детские учреждения во время пандемии из-за принятых карантинных и других мер по предотвращению передачи коронавирусной инфекции (использование масок, мытье рук, удаленная работа и отмена крупных мероприятий) [9].
Следует отметить, что в основе патогенетического действия микоплазм лежит способность длительно персистировать в клетках хозяина и размножаться не только вне-, но и внутриклеточно, нарушая нормальные регуляторные механизмы стволовых, иммунокомпетентных и других клеток. Микоплазмы вначале проявляют цитотоксический эффект, что активизирует систему комплемента, за этим следует иммунокомплексный процесс, а через 5-6 нед. развиваются аутоиммунные механизмы [10]. Таким образом, инфекцию, вызванную M. pneumoniae, можно рассматривать как потенциальный триггер цитокинового шторма, ведущий к развитию мультисистемного воспалительного синдрома (МВС) у детей, который регистрируется при COVID-19 [11]. По мнению Plebani A. et al., у детей с МВС важно проводить серологические тесты на микоплазменную инфекцию, поскольку двойной инфекционный провоспалительный триггер (SARS-CoV-2 и M. pneumoniae) может вызвать быстрое ухудшение клинической картины [7].
Интересно отметить, что в ряде случаев (до 10%) при микоплазменной пневмонии имеет место преходящая макулопапулезная сыпь. В обзоре Terraneo L. et al. показано, что M. pneumoniae может вызывать, помимо эритематозных макулопапулезных высыпаний и многоформной эритемы, синдром Фукса и высыпания, подобные ветряной оспе. Кроме того, описана связь инфекции, вызванной M. pneumonia, с лейкоцитокластическими васкулитами или узловатой эритемой, которая требует дальнейшего изучения [12]. Представленные поражения кожи также описаны и у пациентов с COVID-19, что диктует необходимость проведения дополнительных исследований для установления этиологического диагноза [13].
Клинические проявления инфекции, вызванной M. pneumoniae, вариабельны и могут характеризоваться как субклиническим, так и манифестным течением с поражением верхних и/или нижних дыхательных путей и внелегочными синдромами [7, 10, 11, 14]. Дебют микоплазменной пневмонии напоминает развитие инфекции верхних дыхательных путей (фарингит), но с более выраженной лихорадкой. Однако, несмотря на гипертермию, симптомы интоксикации обычно выражены неярко, что является одним из немногих специфических признаков микоплазменной пневмонии. Кроме этого, через несколько дней от начала болезни появляется сухой, навязчивый и/или приступообразный кашель, который может отмечаться в течение длительного времени - до нескольких недель. Кашель постепенно становится продуктивным и более редким, в легких при этом могут выслушиваться рассеянные сухие и разнокалиберные влажные хрипы. При рентгенологическом обследовании в легких выявляют двусторонние очаги негомогенной инфильтрации, но могут быть и односторонние инфильтративные тени [10].
Gayam V. et al. описали клинические характеристики 6 пациентов с ко-инфекцией M. pneumoniae из 350 пациентов с подтвержденным COVID-19. Общие симптомы в начале болезни включали лихорадку всех пациентов; у 5 (83,3%) пациентов отмечались кашель, одышка и повышенная утомляемость. Другими симптомами были миалгия (66,6%), желудочно-кишечные симптомы (33,3-50%) и изменение психического статуса (16,7%). Лабораторные параметры включали лимфопению, повышение скорости оседания эритроцитов, С-реактивного белка, лактатдегидрогеназы, интерлейкина-6, ферритина сыворотки и D-димера у всех 6 (100%) пациентов. На рентгенограмме грудной клетки при поступлении отмечались двусторонние инфильтраты у всех пациентов [15].
Ряд исследований продемонстрировали, что ко-инфекция M. pneumoniae с SARS-CoV-2 связана с более тяжелыми клиническими симптомами [16], повышением уровня прокальцитонина [17] и более высокой смертностью [18]. У пациентов с ко-инфекцией очень часто наблюдались одышка, кашель и гипертермия. Большинство из них имели повышенный уровень С-реактивного белка, лимфопению, нейтрофилию, двустороннюю пневмонию и рентгенологические изменения по типу «матового стекла» [19].
Fang Z.F. продемонстрировал технологию белковых микрочипов для одновременного количественного измерения специфических IgA для восьми различных респираторных патогенов, включая аденовирус, респираторно-синцитиальный вирус, вирус гриппа типа A, вирус гриппа типа B, вирус парагриппа, M. pneumoniae, Chlamydia pneumoniae и вирус SARS-CoV-2, в сыворотке крови пациентов. В исследование были включены 42 пациента с COVID-19, разделенные на тяжелые (20) и нетяжелые (22) случаи. Совместное обнаружение специфического IgA для SARS-CoV-2 по крайней мере с одним патогеном в тяжелых случаях было значительно выше, чем в нетяжелых (72,2% против 46,2%, p = 0,014) [20].
Однако Zha L. et al., напротив, показали, что тяжесть болезни была сопоставимой в группах моноинфекции SARS-CoV-2 и в группе с ко-инфекцией M. pneumoniae, и большинство пациентов были отнесены к категории пациентов с пневмонией средней степени тяжести (95,5% против 95,5%) в обеих группах [4]. Продолжительность кашля, однако, была больше в группе с ко-инфекцией M. pneumoniae [20,00 (12,00-25,75) против 16,25 (12,25-22,50), p = 0,043], а продолжительность госпитализации - у пациентов с моноинфекцией SARS-CoV-2 [16,00 (10,00 - 22,25) против 14,00 (7,25 - 18,25), p = 0,145], но без статистической значимости [8].
По данным Li Y., Wang H. et al.. также не наблюдалось значительных различий в клинических характеристиках, лабораторных обследованиях и длительности пребывания в стационаре между пациентами с сопутствующими инфекциями и пациентами с моноинфекцией SARS-CoV-2. Отмечались только меньшее количество лейкоцитов (CI: 5,54 ± 0,36 против SI: 7,38 ± 0,37, p = 0,002), нейтрофилов (CI: 2,20 ± 0,20 против SI: 2,92 ± 0,23, p = 0,024) и лимфоцитов (CI: 2,72 ± ± 0,024 против SI: 3,87 ± 0,28, p = 0,006) у пациентов с ко-инфекцией [21]. Liu L. также отмечено, что ко-инфицированные M. pneumoniae имели более низкий процент нейтрофилов (p < 0,0264) и более высокий процент моноцитов (p < 0,0044) [22].
Guo Y. et al. и Ma L. et al. также не обнаружили статистически значимых различий по клиническим симптомам и радиологическими особенностям, а также продолжительности пребывания в стационаре и смертности между группой с моноинфекцией SARS-CoV-2 и группой с ко-инфекцией M. pneumoniae [6, 23].
Таким образом, инфекция, вызванная M. pneumoniae, по данным мировой литературы, часто регистрируется в текущем эпидемиологическом сезоне 2020-2021 гг. и имеет неспецифические клинические проявления, затрудняющие этиологическую диагностику заболевания. Данный факт имеет важное значение в связи с необходимостью проведения дифференциального диагноза с COVID-19 и своевременного подбора этиотропной терапии. Кроме того, ко-инфекции SARSCov2 и M. pneumonia в ряде случаев имеют более тяжелое течение, чем моноинфекции. С учетом того факта, что COVID-19 у детей имеет неспецифические клинические проявления и протекает по типу ОРЗ с поражением верхних и/ или нижних дыхательных путей [10], оценка этиологической роли M. pneumonia в развитии внебольничной пневмонии у детей в настоящее время приобретает особое значение.
Цель - проанализировать частоту выявления внебольничных пневмоний, в том числе микоплазменной этиологии, у пациентов детского возраста в условиях инфекционного стационара.
Структура настоящего исследования представлена на рис. 1.
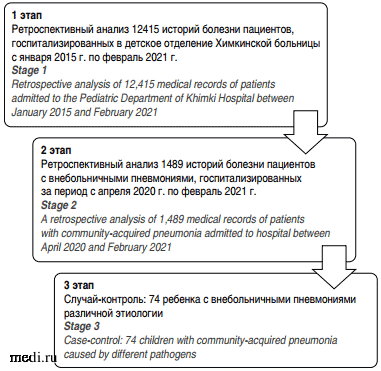 Рис. 1.
Рис. 1. Схема исследования.
Fig. 1. Scheme of the study.
Материалы и методы
На первом этапе исследования были ретроспективно проанализированы истории болезни пациентов, госпитализированных в детское отделение Химкинской областной больницы с января 2015 г. по февраль 2021 г.
На втором этапе проведен анализ 1489 историй болезни пациентов с внебольничными пневмониями, госпитализированных за период с апреля 2020 г. по февраль 2021 г.
На третьем этапе на базе Химкинской областной больницы были обследованы 74 пациента с внебольничными пневмониями (из них 44 - микоплазменной этиологии, 30 -не микоплазменной этиологии). Дети с подтвержденной коронавирусной инфекцией исключены из исследования. Пациенты были обследованы по стандартному плану, включавшему физикальные, лабораторные и инструментальные методы. Этиология заболевания устанавливалась на основании непрямых методов диагностики (определение уровней IgA, IgG, IgM количественным методом иммуноферментного анализа).
Результаты исследования и их обсуждение
На базе ГАУЗ МО «Химкинской ОБ» производилось наблюдение за пациентами с внебольничными пневмониями в течение 5 лет (2015-2020 гг.). Общее число госпитализированных и доля пациентов с внебольничными пневмониями представлены на рис. 2.
 Рис. 2. Внебольничные пневмонии в структуре госпитализированных пациентов (по месяцам).
Рис. 2. Внебольничные пневмонии в структуре госпитализированных пациентов (по месяцам).
Fig. 2. Community-acquired pneumonia among patients admitted to hospital (by month).
Как видно на диаграммах, увеличение доли пациентов с внебольничными пневмониями наблюдалось с октября 2017 г. по апрель 2018 г., а также весной 2020 г. Следует отметить, что число госпитализированных в детское отделение Химкинской ОБ в декабре 2019 г. было несколько выше, чем в другие месяцы.
В целом за год доля пациентов с внебольничной пневмонией от общего числа госпитализированных в детское отделение была максимальной в 2018 г., минимальной в 2015 году (табл. 1).
Таблица 1.
Table 1.
Доля внебольничных пневмоний в структуре госпитализированных пациентов
Proportion of community-acquired pneumonia among patients admitted to hospital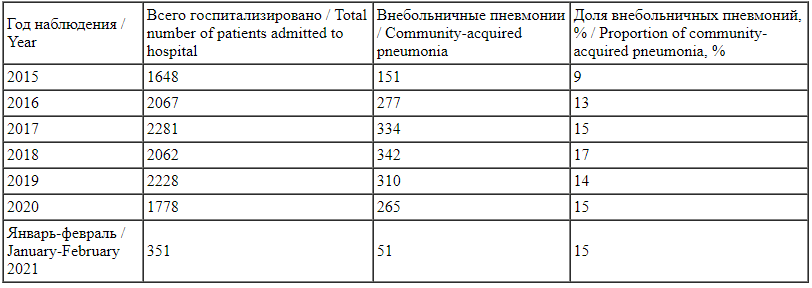 Были проанализированы по сезонам доли пациентов с внебольничной пневмонией в зависимости от года наблюдения (рис. 3).
Были проанализированы по сезонам доли пациентов с внебольничной пневмонией в зависимости от года наблюдения (рис. 3).
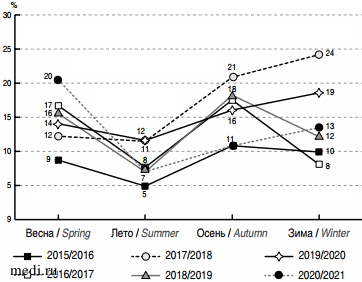 Рис. 3. Сезонность госпитализации пациентов с внебольничными пневмониями (доля пневмоний от общего числа госпитализированных за сезон).
Рис. 3. Сезонность госпитализации пациентов с внебольничными пневмониями (доля пневмоний от общего числа госпитализированных за сезон).
Fig. 3. Seasonality of hospitalization of patients with community-acquired pneumonia (proportion of patients with pneumonia from the total number of patients hospitalized during the season).
Наблюдается снижение доли пациентов с внебольничными пневмониями в летний период. Зимой 2017/2018 гг. доля пневмоний среди госпитализированных составила 24%, в 2019/2020 гг. - 19% (рис. 4).
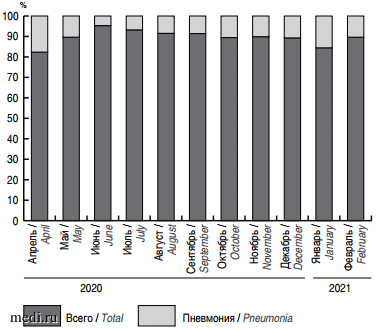 Рис. 4. Доля пациентов с внебольничными пневмониями среди госпитализированных за период с апреля 2020 г. по февраль 2021 г.
Рис. 4. Доля пациентов с внебольничными пневмониями среди госпитализированных за период с апреля 2020 г. по февраль 2021 г.
Fig. 4. Proportion of patients with community-acquired pneumonia among those admitted to hospital between April 2020 and February 2021.
Задачей второго этапа исследования было оценить роль микоплазменной инфекции в структуре внебольничной пневмонии у детей в период пандемии COVID-19.
Доля микоплазменной инфекции в этиологической структуре внебольничных пневмоний за период с апреля 2020 г. по февраль 2021 г. составляла от 31 до 67% (табл. 2).
Таблица 2.
Table 2.
Этиологическая структура внебольничных пневмоний на фоне пандемии COVID-19 (апрель 2020 г. - февраль 2021 г.)
Etiological structure of community-acquired pneumonia during the COVID-19 pandemic (April 2020 - February 2021)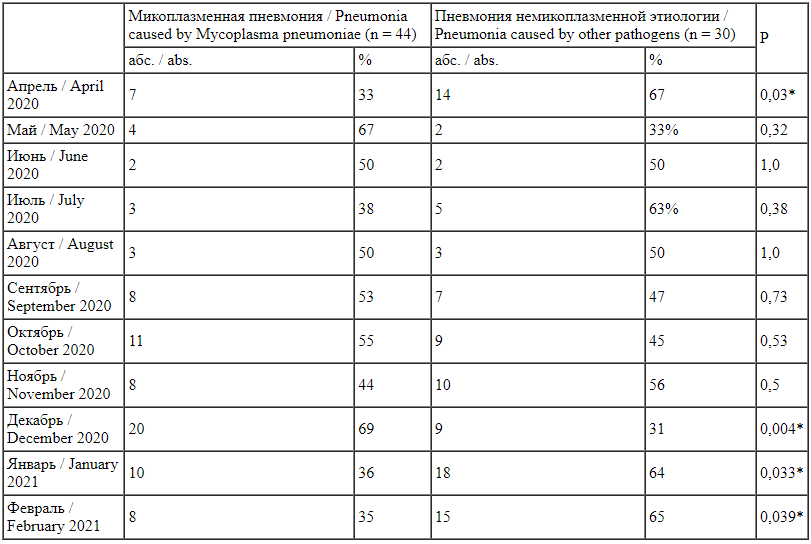 В апреле 2020 г. доля пневмоний немикоплазменной этиологии была выше, чем микоплазменных пневмоний (7 (33 %) и 14 (67 %), р = 0,03). В мае-ноябре 2020 г. доли микоплазменных пневмоний и пневмоний немикоплазменной этиологии достоверно не различались. В декабре 2020 г. доля пневмоний микоплазменной этиологии достоверно превышала пневмонии немикоплазменной этиологии (20 (69%) и 9 (31%) соответственно, р = 0,004), в то время как в январе и феврале 2021 г. доля микоплазменной инфекции снизилась. Роль хламидийной инфекции в этиологии внебольничных пневмоний невелика, зарегистрировано 2 случая в течение периода наблюдения (рис. 5).
В апреле 2020 г. доля пневмоний немикоплазменной этиологии была выше, чем микоплазменных пневмоний (7 (33 %) и 14 (67 %), р = 0,03). В мае-ноябре 2020 г. доли микоплазменных пневмоний и пневмоний немикоплазменной этиологии достоверно не различались. В декабре 2020 г. доля пневмоний микоплазменной этиологии достоверно превышала пневмонии немикоплазменной этиологии (20 (69%) и 9 (31%) соответственно, р = 0,004), в то время как в январе и феврале 2021 г. доля микоплазменной инфекции снизилась. Роль хламидийной инфекции в этиологии внебольничных пневмоний невелика, зарегистрировано 2 случая в течение периода наблюдения (рис. 5).
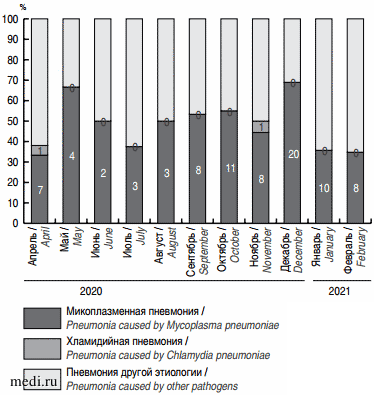 Рис. 5. Доля микоплазменной инфекции в этиологической структуре внебольничных пневмоний у детей, госпитализированных с апреля 2020 г. по февраль 2021 г.
Рис. 5. Доля микоплазменной инфекции в этиологической структуре внебольничных пневмоний у детей, госпитализированных с апреля 2020 г. по февраль 2021 г.
Fig. 5. Proportion of infections caused by Mycoplasma pneumoniae in the etiological structure of community-acquired pneumonia among children hospitalized between April 2020 and February 2021.
На третьем этапе исследования были описаны клинические характеристики 74 пациентов с внебольничными пневмониями. Половозрастная характеристика пациентов с пневмонией микоплазменной и немикоплазменной этиологии представлена в табл. 3.
Таблица 3.
Table 3.
Половозрастная характеристика пациентов
Gender and age characteristics of patients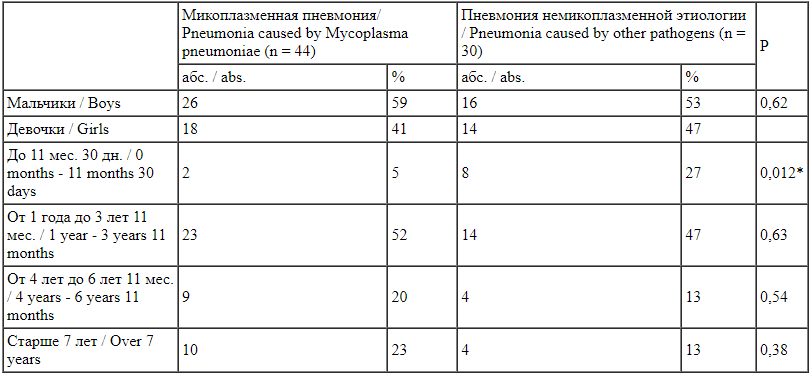 Различий по гендерным признакам в зависимости от этиологии пневмонии получено не было. Отмечены возрастные особенности в зависимости от этиологии заболевания. Так, пациенты младше 1 года в группе детей с пневмониями немикоплазменной этиологии встречались чаще, чем в группе детей с микоплазменной пневмонией (р = 0,012).
Различий по гендерным признакам в зависимости от этиологии пневмонии получено не было. Отмечены возрастные особенности в зависимости от этиологии заболевания. Так, пациенты младше 1 года в группе детей с пневмониями немикоплазменной этиологии встречались чаще, чем в группе детей с микоплазменной пневмонией (р = 0,012).
Были проанализированы рентгенологические характеристики, выраженность дыхательной недостаточности у пациентов сравниваемых групп (табл. 4).
Таблица 4.
Table 4.
Клинические особенности внебольничной пневмонии
Clinical characteristics of community-acquired pneumonia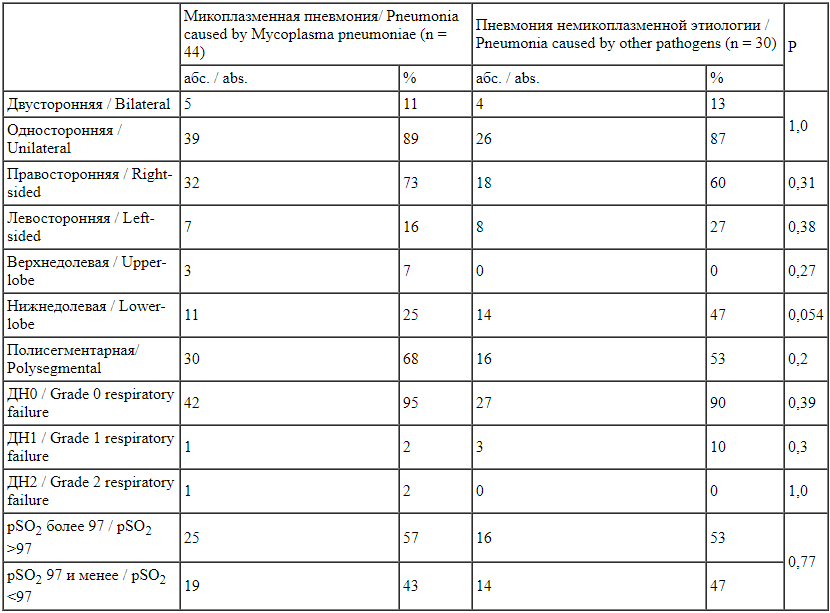 Не было получено достоверных различий ни по одному из сравниваемых показателей. Однако частота поражения нижней доли в группе пациентов с немикоплазменной этиологией была выше, чем в группе с микоплазменной (р = 0,054).
Не было получено достоверных различий ни по одному из сравниваемых показателей. Однако частота поражения нижней доли в группе пациентов с немикоплазменной этиологией была выше, чем в группе с микоплазменной (р = 0,054).
Средняя частота дыхания в группе микоплазменной пневмонии составила 28,11 ± 1,15 (95% ДИ 25,79-30,44), в группе немикоплазменной пневмонии - 30,63 ± 1,05 (95% ДИ 28,4832,78). Различия статистически не значимы.
Среднее рSО2 в группе микоплазменной пневмонии составило 97,21 ± 0,27% (95% ДИ 96,65-97,76), в группе немикоплазменной пневмонии 97,27 ± 0,3% (95% ДИ 96,6697,87). Различия статистически не значимы.
Средняя продолжительность пребывания в стационаре у пациентов с микоплазменной пневмонией составила 9,32 ± 0,7 суток (95% ДИ 7,9-10,73), с пневмонией немикоплазменной этиологии - 9,5 ± 0,7 суток (95% ДИ 8,07-10,93). Различия статистически не значимы.
В качестве иллюстрации атипичного клинического течения ко-инфекции, вызванной M. pneumonia и вирусом Эпштейн-Барр (ВЭБ), представляем историю болезни пациентки А., 16 лет.
Клинический пример
Пациентка А., 16 лет поступила в детское инфекционное отделение 20.01.2020 с жалобами на повышение температуры тела, малопродуктивный кашель. Из анамнеза известно, что пациентка больна с 13.01.2020, начало заболевания с подъема температуры (max 39,5°С), принимала жаропонижающие средства. В связи с сохраняющимся кашлем, лихорадкой 16.01.2020 обратилась к педиатру, была выполнена рентгенография грудной клетки, диагностирован острый бронхит. Назначен амоксициллина клавуланат из расчета 30 мг/кг/сутки на 5 дней. Температура нормализовалась, кашель сохранялся. С 20.01.2020 отмечен повторный подъем температуры до 39,5°С. Педиатром была направлена в стационар.
На момент поступления состояние расценивалось как средней степени тяжести, температура тела 39°С. Кожные покровы обычной окраски, чистые. Лимфатические узлы не увеличены. Язык влажный, чистый. Зев гиперемирован. Увеличение миндалин 1-й ст. Налетов нет. В легких дыхание жесткое, ослаблено справа в нижних отделах. Хрипы не выслушиваются. Тоны сердца ритмичные, звучные. Живот при пальпации мягкий, безболезненный. Печень, селезенка не увеличены. Стул ежедневный, оформленный. Мочеиспускание свободное, безболезненное.
Результаты клинического и биохимического анализов крови представлены в табл. 5, 6.
Таблица 5.
Table 5.
Показатели клинического анализа крови пациентки А. в динамике
Complete blood count of patient A. in dynamics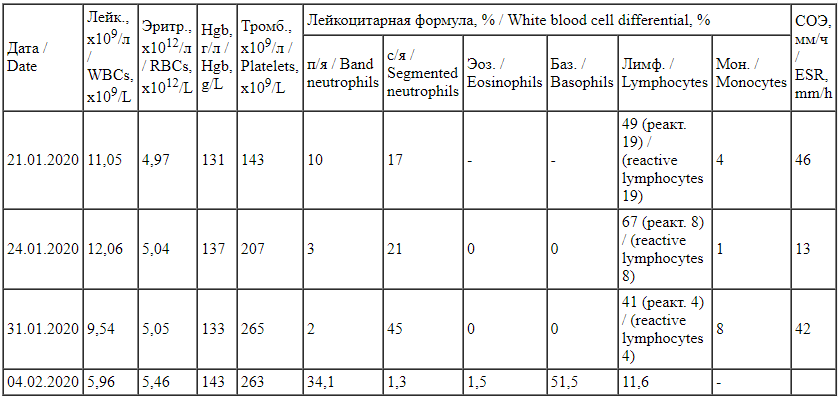 Таблица 6.
Таблица 6.
Table 6.
Показатели биохимического анализа крови пациентки А. в динамике
Liver function tests of patient A. in dynamics
| Показатель / Parameter |
23.01.2021 |
28.01.2021 |
| АЛТ, ед/л / ALT, U/L |
389,4 |
115,7 |
| АСТ, ед/л / AST, U/L |
234,7 |
28,8 |
| ЩФ, ед/л / ALP, U/L |
665,0 |
410,4 |
| Глюкоза, ммоль/л / Glucose, mmol/L |
6,65 |
6,13 |
| Общ.белок, мкмоль/л / Total protein, μmol/L |
94,0 |
78,5 |
| Креатинин, мкмоль/л / Creatinine, μmol/L |
2,91 |
93,6 |
| Мочевина, ммоль/л / Urea, mmol/L |
4,12 |
4,3 |
| ОбБил, мкмоль/л / Total bilirubin, μmol/L |
17,5 |
9,1 |
| ПрБил, мкмоль/л / Conjugated bilirubin, μmol/L |
11,6 |
3,9 |
| СРБ, мг/л / CRP, mg/L |
6,5 |
8,5 |
На основании данных анамнеза, клинической картины, физикальных и лабораторных данных поставлен диагноз: «J20.9 Острый бронхит». Назначено лечение: цефтриаксон из расчета 100 мг/кг/сутки в/м, ингаляции с беродуалом, ингаляции с пульмикортом, мукалтин.
На 3-и сутки пребывания в стационаре температура нормализовалась, кашель редкий продуктивный. Однако 24.01.2020 появились жалобы на боль в горле, 26.01.2020 подъем температуры тела до 38,7°. При объективном осмотре: миндалины увеличены до 2-й степени, налет с 2 сторон, грязно-серого цвета (рис. 6). Печень +3 см, селезенка +1 см. Заднешейные, подчелюстные л/у до 30 мм, плотноэластической консистенции, умеренно болезненные при пальпации, не спаяны с окружающей тканью.
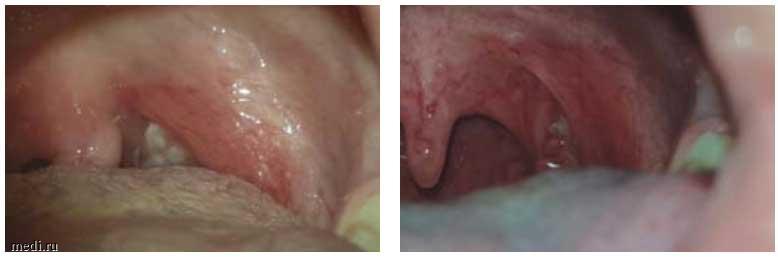 Рис. 6. Фарингоскопическая картина, пациентка А., 16 лет, 4-е сутки от начала болезни.
Рис. 6. Фарингоскопическая картина, пациентка А., 16 лет, 4-е сутки от начала болезни.
Fig. 6. Pharyngoscopy image of patient A. (16 years old); day 4 of the disease.
При исследовании от 23.01.2020 в сыворотке крови обнаружены IgM к капсидному антигену ВЭБ 8,01 УЕ (>1,0 антитела (АТ) обнаружены), АТ IgG к ранним белкам ВЭБ 35,11 УЕ (0,00-9,00), АТ к M. pneumoniae IgM 1,14 УЕ (>1,1 АТ обнаружены); IgG 1,06 УЕ (>1,1 АТ обнаружены).
УЗИ органов брюшной полости от 27.01.2020: признаки гепатоспленомегалии (ПД 146 мм, ЛД 65 мм, 1 сегмент 18 мм, селезенка 140 х 70 мм).
Учитывая волнообразное течение болезни (повторный подъем температуры до фебрильных цифр на фоне проведения антибактериальной терапии), клинические проявления острого бронхита, острого тонзиллита на фоне выраженного лимфопролиферативного синдрома (увеличение печени и селезенки, гипертрофия небных миндалин), выявление атипичных мононуклеаров >10% в клиническом анализе крови, обнаружение лабораторных маркеров острой первичной инфекции, вызванной ВЭБ, был установлен окончательный клинический диагноз: «Инфекционный мононуклеоз, вызванный гамма-герпетическим вирусом (Эпштейна-Барр)». Учитывая наличие признаков активной микоплазменной инфекции, сопутствующий диагноз: «Острый бронхит, вызванный M. pneumonia».
Была проведена коррекция терапии: подключен кларитромицин из расчета 15 мг/кг/сутки на 7 дней, меглюмина акридонацетат (Циклоферон) раствор 250 мг/сут внутримышечно по базовой схеме - через день №5, урсодез 500 мг 1 р/д.
В представленном клиническом случае продемонстрировано течение сочетанной вирусно-бактериальной инфекции (респираторный микоплазмоз, ВЭБ-инфекция), резистентной к проведению терапии р-лактамными антибиотиками. При назначении противовирусной терапии необходимо было учитывать этиологическую значимость в развитии инфекционного процесса сразу двух внутриклеточных возбудителей: М. pneumoniae и ВЭБ. На наш взгляд, препаратом выбора в данном случае является препарат меглюмина акридоноацетат (Циклоферон), который имеет доказательную базу по эффективности в отношении ВЭБ и микоплазменной инфекции. Так, Е.Г.Королёвой и соавт. были обследованы 90 детей в возрасте 1-14 лет, находящихся на стационарном лечении в детском инфекционном отделении с верифицированной микоплазменной инфекцией, и доказано, что применение Циклоферона в комплексной терапии у детей с респираторным микоплазмозом способствует уменьшению длительности острого лихорадочного периода заболевания и значительно сокращает срок катаральных проявлений основного заболевания за счет повышения макрофагальной активности, синтеза интерферона (в 1,5-2 раза), IgA и, наоборот, ингибирует синтез провоспалительных цитокинов (фактора некроза опухоли) [24]. В исследовании О.Н.Германовой (2011) доказана этологическая значимость вирусно-бактериальных ассоциаций (вирусно-хламидийная - 2,4%, вирусно-микоплазменная - 3%) в формировании тяжелых форм обструктивного бронхита, а также в развитии затяжного рецидивирующего течения заболевания. Учитывая высокий риск рецидива обструктивного бронхита вирусного генеза в формировании бронхиальной астмы (13-20%), детям, перенесшим обструктивный бронхит, имеющим очаги хронической ЛОР- или бронхолегочной патологии, рекомендуется проведение иммунокорригирующей терапии, которая способствует предотвращению повторных эпизодов обструктивного бронхита в 68% наблюдений. Эффективна и сезонная профилактика Циклофероном, уменьшающим заболеваемость ОРЗ и, в частности, бронхитами в 2,9 раза, снижающим в 4,3 раза частоту тяжелых и осложненных форм [25].
У нашей пациентки на фоне проводимого лечения температура нормализовалась, катаральные явления купированы, миндалины 1-й ст., налетов нет. Печень +1, селезенка не пальпируется, лимфоузлы не пальпируются. Наблюдалась положительная динамика в отношении основных показателей клинического и биохимического анализов (табл. 5, 6). Девочка была выписана с клиническим выздоровлением. Рекомендовано: продолжить прием Циклоферона 3 таб. (1 р/сут) по противогерпетической схеме через 2 дня на 3-й, всего 5 приемов, повторное обследование с применением прямых методов диагностики на ВЭБ-инфекцию и респираторный микоплазмоз не ранее чем через 7 дней после окончания всей терапии.
Данный клинический пример демонстрирует течение сочетанной инфекции (микоплазменная, Эпштейна-Барр-вирусная), которая протекала с явлениями острого бронхита в дебюте заболевания и развитием симптомов инфекционного мононуклеоза на 2-й неделе от начала болезни. Подключение к терапии препарата меглюмина акридонацетат (Циклоферон) привело к купированию основных симптомов заболевания, в этиологии которого доказанную роль играли сразу два возбудителя с внутриклеточным типом паразитирования. Наличие различных лекарственных форм препарата позволило подобрать оптимальный курс лечения в стационарных и амбулаторных условиях с переходом с парентерального приема препарата на пероральный.
Заключение
Таким образом, по данным ГАУЗ МО «Химкинская ОБ» МЗ РФ, в последние годы отмечается рост доли пациентов, госпитализированных с внебольничными пневмониями, с преимущественным увеличением частоты регистрации внебольничных пневмоний с октября 2017 г. по апрель 2018 г., а также весной 2020 г. Ежегодно в летний период отмечается снижение доли пациентов с внебольничными пневмониями.
Этиологическая роль микоплазменной инфекции в развитии внебольничных пневмоний в 2020-2021 гг. у детей значительна, частота ее обнаружения составляет от 31 до 67%. В группе больных младше 1 года достоверно чаще выявлялись пневмонии немикоплазменной этиологии. Клинические особенности течения болезни не имели достоверных различий у пациентов с микоплазменной пневмонией и пневмонией иной этиологии, что подчеркивает необходимость включения в план обследования этиологической расшифровки. В случае подтверждения сочетанной с герпесвирусами этиологии болезни препарат меглюмина акридонацетат (Циклоферон) может быть включен в схему терапии пациентов старше 4 лет.
Информация о соавторах:
Музыка Анна Драгиевна, кандидат медицинских наук, старший научный сотрудник клинического отдела инфекционной патологии Центрального научно-исследовательского института эпидемиологии Роспотребнадзора Адрес: 111123, Москва, ул. Новогиреевская, 3а
Солдатова Евгения Юрьевна, младший научный сотрудник клинического отдела инфекционной патологии Центрального научно-исследовательского института эпидемиологии Роспотребнадзора Адрес: 111123, Москва, ул. Новогиреевская, 3а
Погорелова Ольга Олеговна, кандидат медицинских наук, старший научный сотрудник клинического отдела инфекционной патологии Центрального научно-исследовательского института эпидемиологии Роспотребнадзора Адрес: 111123, Москва, ул. Новогиреевская, 3а
Барыкин Вадим Иванович, заведующий детским инфекционным отделением Химкинской областной больницы
Адрес: 141407, Химки, Куркинское шоссе, 11
Мирзонов Владислав Александрович, доктор медицинских наук, главный врач Химкинской областной больницы
Адрес: 141407, Химки, Куркинское шоссе, 11
Мелехина Елена Валериевна, доктор медицинских наук, доцент по специальности педиатрия, ведущий научный сотрудник клинического отдела инфекционной патологии Центрального научно-исследовательского института эпидемиологии Роспотребнадзора
Адрес: 111123, Москва, ул. Новогиреевская, 3а
For correspondence:
Anna D. Muzyka, MD, PhD, Researcher, Clinical Department of Infectious Diseases, Central Research Institute of Epidemiology of the Federal Service on Customers' Rights Protection and Human Well-being Surveillance
Address: 3a Novogireevskaya str., Moscow, 111123, Russian Federation
Evgeniya Yu. Soldatova, Researcher, Clinical Department of Infectious Diseases, Central Research Institute of Epidemiology of the Federal Service on Customers' Rights Protection and Human Well-being Surveillance
Address: 3a Novogireevskaya str., Moscow, 111123, Russian Federation
Olga O. Pogorelova, MD, PhD, Researcher, Clinical Department of Infectious Diseases, Central Research Institute of Epidemiology of the Federal Service on Customers' Rights Protection and Human Well-being Surveillance
Address: 3a Novogireevskaya str., Moscow, 111123, Russian Federation
Vadim I. Barykin, head of the Pediatric Department for Infectious Diseases Khimki Regional Hospital
Address: 11 Kurkinskoe highway, Khimki, 141407, Russian Federation
Vladislav A. Mirzonov, MD, PhD, DSc, chief doctor of Khimki Regional Hospital
Address: 11 Kurkinskoe highway, Khimki, 141407, Russian Federation
Еlena V. Melekhina, MD, PhD, DSc, Associate Professor in Pediatrics, Senior Researcher, Clinical Department of Infectious Diseases, Central Research Institute of Epidemiology of the Federal Service on Customers' Rights Protection and Human Well-being Surveillance
Address: 3a Novogireevskaya str., Moscow, 111123, Russian Federation
Литература / References
1. Oliva A, Siccardi G, Migliarini A, Cancelli F, Carnevalini M, DAndria M, et al. Co-infection of SARS-CoV-2 with Chlamydia or Mycoplasma pneumoniae: a case series and review of the literature. Infection. 2020 Dec;48(6):871-877. DOI: 10.1007/s15010-020-01483-8
2. Lansbury L, Lim B, Baskaran V, Lim WS. Co-infections in people with COVID-19: a systematic review and meta-analysis. J Infect. 2020 Aug;81(2):266-275. DOI: 10.1016/j.jinf.2020.05.046
3. Chiu CY, Chen CJ, Wong KS, Tsai MH, Chiu CH, Huang YC. Impact of bacterial and viral coinfection on mycoplasmal pneumonia in childhood community-acquired pneumonia. J Microbiol Immunol Infect. 2015 Feb;48(1):51-6. DOI: 10.1016/j. jmii.2013.06.006
4. Zha L, Shen J, Tefsen B, Wang Y, Lu W, Xu Q. Clinical features and outcomes of adult COVID-19 patients co-infected with Mycoplasma pneumoniae. J Infect. 2020 Sep;81(3):e12-e15. DOI: 10.1016/j.jinf.2020.07.
5. Cai X, Jiang H, Zhang S, Xia S, Du W, Ma Y, et al. Clinical manifestations and pathogen characteristics in children admitted for suspected COVID-19. Front Med. 2020 Dec;14(6):776-785. DOI: 10.1007/s11684-020-0820-7
6. Guo Y, Xia W, Peng X, Shao J. Features Discriminating COVID-19 From Community-Acquired Pneumonia in Pediatric Patients. Front Pediatr. 2020 Nov 5;8:602083. DOI: 10.3389/fped.2020.602083
7. Plebani A, Meini A, Cattalini M, Lougaris V, Bugatti A, Caccuri F, et al. Mycoplasma infection may complicate the clinical course of SARS-Co-V-2 associated Kawasaki-like disease in children. Clin Immunol. 2020 Dec;221:108613. DOI: 10.1016/j. clim.2020.108613
8. Zha L, Shen J, Tefsen B, Wang Y, Lu W, Xu Q. Clinical features and outcomes of adult COVID-19 patients co-infected with Mycoplasma pneumoniae. J Infect. 2020 Sep;81(3):e12-e15. DOI: 10.1016/j.jinf.2020.07.010
9. Fujita J. Mycoplasma pneumoniae pneumonia and respiratory syncytial virus infection in Japan during the severe acute respiratory syndrome coronavirus 2 pandemic. Respir Investig. 2021 Jan;59(1):5-7. DOI: 10.1016/j.resinv.2020.11.002
10. Jiang Z, Li S, Zhu C, Zhou R, Leung PHM. Mycoplasma pneumoniae Infections: Pathogenesis and Vaccine Development. Pathogens. 2021 Jan 25;10(2):119. DOI: 10.3390/pathogens10020119
11. Plebani A, Meini A, Cattalini M, Lougaris V, Bugatti A, Caccuri F, et al. Mycoplasma infection may complicate the clinical course of SARS-CoV-2 associated Kawasaki-like disease in children. Clin Immunol. 2020 Dec;221:108613. DOI: 10.1016/j. clim.2020.108613
12. Terraneo L, Lava SA, Camozzi P, Zgraggen L, Simonetti GD, Bianchetti MG, et al. Unusual Eruptions Associated with Mycoplasma pneumoniae Respiratory Infections: Review of the Literature.Dermatology. 2015;231(2):152-7. DOI: 10.1159/ 000430809
13. Monte Serrano J, Garcia-Gil MF, Cruanes Monferrer J, Aldea Manrique B, Prieto-Torres L, Garcia Garcia M, et al. COVID-19 and Mycoplasma pneumoniae: SARS-CoV-2 false positive or coinfection? Int J Dermatol. 2020 Oct;59(10):1282-1283. DOI: 10.1111/ijd.15090
14. Gao ZA, Gao LB, Chen XJ, Xu Y. Fourty-nine years old woman co-infected with SARS-CoV-2 and Mycoplasma: A case report. World J Clin Cases. 2020 Dec 6;8(23):6080-6085. DOI: 10.12998/wjcc.v8.i23.6080
15. Gayam V, Konala VM, Naramala S, Garlapati PR, Merghani MA, Regmi N, et al. Presenting characteristics, comorbidities, and outcomes of patients coinfected with COVID-19 and Mycoplasma pneumoniae in the USA. J Med Virol. 2020 Oct;92(10):2181-2187. DOI: 10.1002/jmv.26026
16. De Francesco MA, Poiesi C, Gargiulo F, Bonfanti C, Pollara P, Fiorentini S, et al. Co-infection of Chlamydia pneumoniae and Mycoplasma pneumoniae with SARS-CoV-2 is associated with more severe features. J Infect. 2021 Jan 19:S0163-4453(21)00031-1. DOI: 10.1016/j.jinf.2021.01.009
17. Tang ML, Li YQ, Chen X, Lin H, Jiang ZC, Gu DL, et al. Co-Infection with Common Respiratory Pathogens and SARS-CoV-2 in Patients with COVID-19 Pneumonia and Laboratory Biochemistry Findings: A Retrospective Cross-Sectional Study of
78 Patients from a Single Center in China. Med Sci Monit. 2021 Jan 3;27:e929783.
DOI: 10.12659/MSM.929783
18. Amin D, McKitish K, Shah PS. Association of mortality and recent Mycoplasma pneumoniae infection in COVID-19 patients. J Med Virol. 2021 Feb;93(2):1180-1183. DOI: 10.1002/jmv.26467
19. Choubey A, Sagar D, Cawley P, Miller K. Retrospective review analysis of COVID-19 patients co-infected with Mycoplasma pneumoniae. Lung India. 2021 Mar;38(Supplement):S22-S26. DOI: 10.4103/lungindia.lungindia_607_20
20. Fang ZF, Sun BQ, Zhu AR, Lin LC, Zhao JC, He S, et al. Multiplexed analysis of circulating IgA antibodies for SARS-CoV-2 and common respiratory pathogens in COVID-19 patients. J Med Virol. 2021 Jan 28. DOI: 10.1002/jmv.26829
21. Li Y, Wang H, Wang F, Lu X, Du H, Xu J, et al. Co-infections of SARS-CoV-2 with multiple common respiratory pathogens in infected children: A retrospective study. Medicine (Baltimore).2021 Mar 19;100(11):e24315. DOI: 10.1097/ MD.0000000000024315
22. Liu L, Lei X, Xiao X, Yang J, Li J, Ji M, et al. Epidemiological and Clinical Characteristics of Patients With Coronavirus Disease-2019 in Shiyan City, China. Front Cell Infect Microbiol. 2020 May 22;10:284. DOI: 10.3389/fcimb.2020.00284
23. Ma L, Wang W, Le Grange JM, Wang X, Du S, Li C, et al. Coinfection of SARS-CoV-2 and Other Respiratory Pathogens. Infect Drug Resist. 2020 Aug 26;13:3045-3053. DOI: 10.2147/IDR.S267238
24. Королёва ЕГ, Головачёва ЕГ, Орлов АВ, Милькинт КК, Образцова ЕВ, Осидак ЛВ, и др. Циклоферон в терапии респираторной микоплазма пневмонии инфекции у детей с отягощенным преморбидным фоном. Детские
инфекции. 2008;7(2):54-58. / Koroleva EG, Golovacheva EG, Orlov AV, Milkint KK, Obrazcova EV, Osidak LV, et al. Cycloferone in the treatment of respiratory mycoplasma pneumonia infection in children with premorbid anamnesis record. Detskie infektsii. 2008;7(2):54-58. (In Russian).
25. Лазуткина ЕЛ, Лазаренко ЛЛ, Ландышев ЮС, Цырендоржиев ДД, Ландышев СЮ. Эффективность применения индуктора интерферона в период обострения бронхиальной астмы на фоне острой респираторной вирусной инфекции. Бюллетень физиологии и патологии дыхания. 2012;43: 23-27. / Lazutkina EL, Lazarenko LL, Landyshev YuS, Tsyrendorzhiev DD, Landyshev SYu. Effectiveness of interferon inducer in patients with bronchial asthma exacerbation in time of respiratory viral epidemic. Bulletin physiology and pathology of respiration. 2012;43:23-27. (In Russian).
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)


 Рис. 1. Схема исследования.
Рис. 1. Схема исследования. Рис. 2. Внебольничные пневмонии в структуре госпитализированных пациентов (по месяцам).
Рис. 2. Внебольничные пневмонии в структуре госпитализированных пациентов (по месяцам). Были проанализированы по сезонам доли пациентов с внебольничной пневмонией в зависимости от года наблюдения (рис. 3).
Были проанализированы по сезонам доли пациентов с внебольничной пневмонией в зависимости от года наблюдения (рис. 3). Рис. 3. Сезонность госпитализации пациентов с внебольничными пневмониями (доля пневмоний от общего числа госпитализированных за сезон).
Рис. 3. Сезонность госпитализации пациентов с внебольничными пневмониями (доля пневмоний от общего числа госпитализированных за сезон). Рис. 4. Доля пациентов с внебольничными пневмониями среди госпитализированных за период с апреля 2020 г. по февраль 2021 г.
Рис. 4. Доля пациентов с внебольничными пневмониями среди госпитализированных за период с апреля 2020 г. по февраль 2021 г. В апреле 2020 г. доля пневмоний немикоплазменной этиологии была выше, чем микоплазменных пневмоний (7 (33 %) и 14 (67 %), р = 0,03). В мае-ноябре 2020 г. доли микоплазменных пневмоний и пневмоний немикоплазменной этиологии достоверно не различались. В декабре 2020 г. доля пневмоний микоплазменной этиологии достоверно превышала пневмонии немикоплазменной этиологии (20 (69%) и 9 (31%) соответственно, р = 0,004), в то время как в январе и феврале 2021 г. доля микоплазменной инфекции снизилась. Роль хламидийной инфекции в этиологии внебольничных пневмоний невелика, зарегистрировано 2 случая в течение периода наблюдения (рис. 5).
В апреле 2020 г. доля пневмоний немикоплазменной этиологии была выше, чем микоплазменных пневмоний (7 (33 %) и 14 (67 %), р = 0,03). В мае-ноябре 2020 г. доли микоплазменных пневмоний и пневмоний немикоплазменной этиологии достоверно не различались. В декабре 2020 г. доля пневмоний микоплазменной этиологии достоверно превышала пневмонии немикоплазменной этиологии (20 (69%) и 9 (31%) соответственно, р = 0,004), в то время как в январе и феврале 2021 г. доля микоплазменной инфекции снизилась. Роль хламидийной инфекции в этиологии внебольничных пневмоний невелика, зарегистрировано 2 случая в течение периода наблюдения (рис. 5). Рис. 5. Доля микоплазменной инфекции в этиологической структуре внебольничных пневмоний у детей, госпитализированных с апреля 2020 г. по февраль 2021 г.
Рис. 5. Доля микоплазменной инфекции в этиологической структуре внебольничных пневмоний у детей, госпитализированных с апреля 2020 г. по февраль 2021 г. Различий по гендерным признакам в зависимости от этиологии пневмонии получено не было. Отмечены возрастные особенности в зависимости от этиологии заболевания. Так, пациенты младше 1 года в группе детей с пневмониями немикоплазменной этиологии встречались чаще, чем в группе детей с микоплазменной пневмонией (р = 0,012).
Различий по гендерным признакам в зависимости от этиологии пневмонии получено не было. Отмечены возрастные особенности в зависимости от этиологии заболевания. Так, пациенты младше 1 года в группе детей с пневмониями немикоплазменной этиологии встречались чаще, чем в группе детей с микоплазменной пневмонией (р = 0,012). Не было получено достоверных различий ни по одному из сравниваемых показателей. Однако частота поражения нижней доли в группе пациентов с немикоплазменной этиологией была выше, чем в группе с микоплазменной (р = 0,054).
Не было получено достоверных различий ни по одному из сравниваемых показателей. Однако частота поражения нижней доли в группе пациентов с немикоплазменной этиологией была выше, чем в группе с микоплазменной (р = 0,054). Таблица 6.
Таблица 6. Рис. 6. Фарингоскопическая картина, пациентка А., 16 лет, 4-е сутки от начала болезни.
Рис. 6. Фарингоскопическая картина, пациентка А., 16 лет, 4-е сутки от начала болезни.