Моно- и комбинированная терапия препаратом мексидол у пациентов молодого возраста с церебральной ангиодистонией
СтатьиЕ.Н. Дьяконова*, В.В. Макерова
ФГБОУ ВО «Ивановская государственная медицинская академия» Минздрава России, Иваново, Россия
Цель исследования. Оценить эффект моно- и комбинированной терапии препаратом мексидол у пациентов молодого возраста с церебральной ангиодистонией.
Материал и методы. Обследовали 90 пациентов (38 мужчин и 52 женщины в возрасте от 25 до 44 лет) с синдромом вегетативной дисфункции в форме астеновегетативного и цефалгического синдромов, принимавших мексидол (1-я группа, 30 больных), винпоцетин (2-я группа, 30) и их сочетание (3-я группа, 30). Состояние церебральной гемодинамики оценивали с помощью алгоритма комплексного ультразвукового исследования, состояние вегетативной регуляции — с помощью анализа вариабельности ритма сердца, функциональное состояние микроциркуляции — путем проведения лазерной допплеровской флоуметрии до и через 10 сут после курса применения препаратов.
Результаты и заключение. Мексидол как в моно-, так и комплексном лечении пациентов с церебральной ангиодистонией обладал вегетостабилизирующим, церебропротективным действием. Было выявлено улучшение церебральной гемодинамики и микрогемоциркуляции. В составе комбинированной терапии (мексидол и винпоцетин) эффект каждого препарата был усилен, причем адаптация мозгового кровотока проходила значительно быстрее, чем при применении только винпоцетина. Таким образом, применение комбинированной терапии (мексидол и винпоцетин) у пациентов с цереброваскулярной патологией способствует минимизации негативного прогноза развития заболевания и может препятствовать развитию острого нарушения мозгового кровообращения.
Ключевые слова: мексидол, винпоцетин, микроциркуляторные расстройства, вегетативная дистония, лазерная допплеровская флоуметрия, церебральная ангиодистония.
Цереброваскулярная недостаточность — один из наиболее частых клинических синдромов в неврологии, который, по данным профилактических осмотров населения, выявляется у 20—30% пациентов трудоспособного возраста и составляет не менее 700 случаев на 100 000 населения. При прогрессирующем течении сосудистого процесса недостаточность церебральной гемодинамики приводит к крайне тяжелым исходам — инсульту и сосудистой деменции, в связи с чем ее своевременная диагностика и адекватная терапия являются крайне актуальными [1—3]. Хроническая ишемия головного мозга развивается постепенно, лечение проводят, когда уже имеются клинические проявления. Вместе с тем оказание помощи целесообразно начинать с профилактических мероприятий, препятствующих развитию тяжелых органических изменений головного мозга.
Этиология цереброваскулярных заболеваний у пациентов молодого возраста отличается от таковой в среднем и пожилом возрасте, где превалируют хронические заболевания (сахарный диабет, артериальная гипертензия, церебральный атеросклероз). У молодых гемодинамические нарушения часто не связаны с вазоструктурными изменениями, значимую роль в их генезе играет вегетативная дизрегуляция, приводящая к ангиоспазму. Существенный вклад в расстройство гемодинамики вносят нарушения венозного оттока [3—6].
Показано [7—9], что изменения в системе микроциркуляции зачастую возникают задолго до развития грубых сосудистых расстройств, поэтому в терапию пациентов с легкими цереброваскулярными нарушениями, особенно в совокупности с имеющейся вегетативной дисфункцией, необходимо включать препараты, влияющие на микроциркуляторное звено гемодинамики.
В связи с отсутствием адекватной ранней медикаментозной и немедикаментозной коррекции на начальной стадии сосудистых нарушений у пациентов молодого возраста, проявляющихся спазмом церебральных сосудов и затруднением интракраниального венозного оттока, происходит ухудшение состояния, приводящее к постепенному развитию хронической ишемии головного мозга.
При применяемой в коррекции цереброваскулярных заболеваний традиционной терапии не всегда учитываются особенности патогенеза нарушений у пациентов молодого возраста и потому она не всегда является эффективной. Дифференцированный подход в лечении молодых пациентов является актуальным, поскольку нецелесообразное сочетание препаратов приводит к полипрагмазии. В связи с этим необходимо более детальное изучение влияния наиболее часто применяемых препаратов как на церебральный кровоток, так и систему микроциркуляции.
Мексидол — отечественный оригинальный препарат, противоишемическое действие которого реализуется за счет выраженного антиоксидантного и антигипоксантного, вегетокорригирующего действия. Он занимает особое положение, поскольку оказывает влияние на разные звенья свободнорадикальных процессов в биомембранах и внутри клетки и не обладает прооксидантным действием. Мексидол состоит из двух связанных и функционально значимых соединений: 2-этил-6-метил-3-гидроксипиридина и янтарной кислоты. Наличие 3-гидроксипиридина в структуре мексидола обеспечивает комплекс его антиоксидантных и мембранотропных эффектов, способность уменьшать глутаматную эксайтотоксичность, модулировать функционирование рецепторов. Антигипоксантный эффект мексидола связан в основном с наличием в его структуре сукцината, который является антигипоксантом прямого энергизирующего действия, влияющим на эндогенное дыхание митохондрий с активацией их энергосинтезирующей функции. Кроме того, сукцинат стимулирует диффузию кислорода в различные органы и ткани, улучшая при этом клеточное дыхание и утилизацию кислорода тканями, восстанавливая НАД-зависимое дыхание. Роль оксипиридина в реализации противоишемического действия мексидола выражается в улучшении микроциркуляции за счет устранения дисфункции эндотелия сосудов через снижение уровня свободнорадикального окисления липидов; улучшении реологических свойств крови за счет уменьшения агрегации тромбоцитов; снижении вазоспастической активности за счет уменьшения активности свободнорадикального окисления липидов и улучшении функционального состояния мембран тромбоцитов и эритроцитов. Также оксипиридин «отвечает» за стимуляцию синтеза оксида азота, мощного фактора вазодилатации. Сукцинат улучшает микроциркуляцию и нормализацию сосудистого тонуса за счет регуляции тонуса сосудов на фоне нормализации соотношения в крови гистамина и серотонина, активирует резервный сукцинатдегидрогеназный путь окисления и восстанавливает активность ключевого окислительно-восстановительного фермента дыхательной цепи митохондрий клеток — цитохромоксидазы [10, 11].
Винпоцетин является препаратом, улучшающим мозговое кровообращение. Он оказывает положительное влияние на мозговой метаболизм за счет увеличения потребления и утилизации глюкозы и кислорода тканями мозга и, следовательно, улучшения переносимости гипоксии мозговыми клетками. Препарат активирует аденилатциклазу и ингибирует фосфодиэстеразу 1-го типа, которая участвует в регуляции тонуса мозговых сосудов. В итоге мозговой кровоток улучшается, усиливается доставка глюкозы к тканям мозга. Винпоцетин ингибирует агрегацию тромбоцитов, снижает патологически увеличенную вязкость крови, особенно при малых скоростях сдвига, нормализует деформируемость эритроцитов, способствует внутритканевому транспорту кислорода. Препарат избирательно повышает мозговой кровоток, уменьшает сопротивление мозговых сосудов без воздействия на системное кровообращение [12].
Цель исследования — оценить эффект моно- и комбинированной терапии препаратом мексидол у пациентов молодого возраста с церебральной ангиодистонией.
Материал и методы
В исследование были включены 90 пациентов (38 мужчин и 52 женщины) молодого возраста (от 25 до 44 лет) с синдромом вегетативной дисфункции (СВД). Критериями включения явилось наличие цефалгического и астеновегетативного синдромов. У всех пациентов по данным ультразвуковой допплерографии (УЗДГ) наблюдался спазм церебральных сосудов в бассейнах передней, средней, задней мозговой артерий. Данный признак был определяющим при отборе пациентов в исследование.
Анализ анамнестических данных показал, что 83,3% пациентов подвергались воздействию стрессового фактора, 30% связывали стресс с профессиональной деятельностью, 10% — с семьей, 36,7% — с личными отношениями.
Оценка результатов по госпитальной шкале тревоги и депрессии (Hospital Anxiety and Depression Scale — HADS) выявила у 26,7% пациентов субклинически выраженную тревогу, у 46,7% — клинически выраженную тревогу. Часто испытывали напряжение и страх 50% больных, постоянно ощущали чувство внутреннего напряжения и беспокойства 6%.
Астеноневротический синдром наблюдался у 66,7% пациентов и включал в себя жалобы на повышенную раздражительность, быструю физическую и умственную утомляемость, нарушения сна (чаще в виде плохого засыпания), затруднение концентрации внимания. Все пациенты жаловались на снижение работоспособности, общую слабость, утомляемость, колебания артериального давления (у 73,3% оно было сниженным и составило 90—100/55— 65 мм рт.ст.; у 20% — периодически повышалось до 130— 140/90—95 мм рт.ст.). Нарушения сна имели 63,3% пациентов, кардиалгии и ощущения перебоев в работе сердца — 16,7%. Гипергидроз ладоней, стоп, стойкий красный дермографизм, акроцианоз имели около 50% больных. Головные боли у всех пациентов носили непостоянный характер и были связаны с повышенными умственными или эмоциональными нагрузками.
В неврологическом статусе выявлялась рассеянная, слабовыраженная очаговая симптоматика в виде слабости конвергенции (в 36,7% случаев), горизонтального непостоянного нистагма (26,7,0%), повышенных глубоких рефлексов (30,0%), положительного ладонно-подбородочного рефлекса Маринеску—Радовичи (3,3%), кистевого аналога рефлекса Россолимо (6,7%), пошатывание в позе Ромберга (26,6%) и интенционного тремора при пальценосовой пробе (6,7%). Гипергидроз ладоней, стоп, стойкий красный дермографизм, акроцианоз отмечались у 36,7% больных.
Критериями исключения были острые хронические соматические заболевания, субкомпенсированная и декомпенсированная гидроцефалия, эпилепсия, психические, эндокринные, гематологические, онкологические заболевания, а также прием других сосудистых препаратов в течение последних 3 мес.
В зависимости от применяемых препаратов пациенты были разделены на три равные группы (по 30 больных), сопоставимые по полу, возрасту и результатам данных церебральной гемодинамики и микроциркуляции.
Больные 1-й группы получали внутривенно капельно мексидол по 5 мл, разведенный в 200 мл физиологического раствора. Пациенты 2-й группы получали винпоцетин по 5 мл, разведенный в 200 мл физиологического раствора. Препарат вводился 1 раз в сутки в первой половине дня, курсом 10 сут. Больным 3-й группы была назначена комбинированная терапия препаратами мексидол и винпоцетин в дозе по 5 мл каждый, разведенными в 200 мл физиологического раствора. Препараты вводились последовательно 1 раз в сутки в первой половине дня курсом 10 сут.
Всем пациентам проводилось исследование вегетативных функций по таблице Вейна (результат более 25 баллов свидетельствует о наличии вегетососудистой дистонии) и оценка уровня тревоги по шкале тревоги HADS (8—10 баллов — субклинически выраженная тревога, 11 баллов и более — клинически выраженная тревога); депрессии — по шкале депрессии HADS (8—10 баллов — субклинически выраженная депрессия, 11 баллов и более — клинически выраженная депрессия).
Состояние церебральной гемодинамики определяли до и после курса лечения с помощью комплексной УЗДГ сосудистой системы головного мозга на аппарате ClearVue 850 («Philips»), с использованием датчиков S5-1, L12-3, по стандартной методике. Венозная система оценивалась путем исследования скорости кровотока по прямому синусу, венам Розенталя, позвоночным венозным сплетениям.
Состояние вегетативной регуляции оценивали с помощью анализа вариабельности ритма сердца (ВРС). Анализ ВРС проводился всем больным исходно в положении лежа и в условиях активной ортостатической пробы в соответствии с Рекомендациями рабочей группы Европейского кардиологического общества и Североамериканского общества стимуляции и электрофизиологии (1996). Исследование проводилось не ранее чем через 1,5 ч после еды с обязательной отменой физиопроцедур. Вегетативный статус изучали по анализу ВРС по 5-минутным записям кардиоинтервалограммы в состоянии расслабленного бодрствования в положении лежа после 15 мин адаптации и при проведении ортостатической пробы. Учитывались только стационарные участки ритмограмм, т.е. к анализу допускались записи после устранения всех возможных артефактов и при наличии у пациента синусового ритма. Исследовались спектральные характеристики сердечного ритма, которые позволяют выделить периодические составляющие в колебаниях сердечного ритма и оценить количественно их вклад в общую динамику ритма.
Спектры изменяемости интервалов R—R были получены при помощи преобразования Фурье. При проведении спектрального анализа оценивались следующие характеристики: TP (total power) — общая мощность спектра нейрогуморальной регуляции, характеризующая суммарное воздействие всех спектральных компонентов на синусовый ритм; HF (high frequency) — высокочастотные колебания, отражающие активность парасимпатического отдела вегетативной нервной системы; LF (low frequency) — низкочастотные колебания, отражающие активность симпатического отдела вегетативной нервной системы; VLF (very low frequency) — очень низкочастотные колебания, представляющие собой часть спектра нейрогуморальной регуляции, в состав которой входит комплекс различных факторов, влияющих на сердечный ритм (церебральные эрготропные, гуморально-метаболические влияния и др.); LF/HF — показатель, отражающий баланс симпатических и парасимпатических влияний, измеренных в нормализованных единицах; VLF%, LF%, HF% — относительные показатели, отражающие вклад каждого спектрального компонента в спектр нейрогуморальной регуляции; коэффициент К 30/15, который отражает адаптационный потенциал вегетативной нервной системы.
Для исследования функционального состояния и особенностей микроциркуляции пациентам проводили лазерную допплеровскую флоуметрию (ЛДФ) с применением лазерного анализатора капиллярного кровотока ЛАКК-04 (НПО «Лазма», Россия) на тыльной поверхности IV пальца левой кисти [13]. Обработка результатов проводилась с помощью компьютерной программы. Определяли следующие характеристики микроциркуляции: параметр микроциркуляции (ПМ), регистрируемый в относительных перфузионных единицах (перф. ед.) и отражающий степень перфузии, преимущественно эритроцитарной фракции, единицы объема ткани за единицу времени; среднее квадратичное отклонение регистрируемых допплеровских сигналов от среднего значения (СКО), характеризующее колебания величины потока эритроцитов во времени (уровень флакса).
Одним из этапов ЛДФ являлся амплитудно-частотный анализ гемодинамических ритмов колебаний тканевого кровотока в диапазоне частот от 0,01 до 1,2 Гц.
Среди колебаний кровотока, отраженных в ЛДФ-грамме и ее амплитудно-частотном спектре, наиболее физиологически значимыми являются очень низкочастотные (0,01—0,03 Гц) колебания (нейрогенные), характеризующие влияние гуморально-метаболических факторов на состояние микроциркуляции.
Низкочастотные (0,05—0,15 Гц) колебания (миогенные) обусловлены спонтанной периодической активностью гладких миоцитов в стенке артериол. Снижение амплитуды низкочастотных флаксмоций может свидетельствовать о спазме сосудов микроциркуляторного русла.
Высокочастотные (0,2—0,3 Гц) колебания (дыхательные) определяются периодическими изменениями давления в венозном отделе сосудистого русла, вызываемыми дыхательными экскурсиями. Амплитуда дыхательной волны обусловлена распространением в микрососудах со стороны путей оттока крови волн перепадов давления в венозной части кровеносного русла и преимущественно связана с дыхательными экскурсиями грудной клетки.
Пульсовые (1,0—1,2 Гц) колебания отличаются малой амплитудой колебания флаксмоций и обусловлены изменениями скорости движения эритроцитов в микрососудах, вызываемыми перепадами систолического и диастолического давления [1, 2, 9, 14].
Оценивали индекс флаксмоций (ИФМ) амиогенных/ амиогенных+апульсовых, который уменьшается при снижении механизмов активной модуляции (при спазме приносящих артериол), а также повышении активности механизмов пассивной модуляции, вызванных застоем крови в венозном русле. В зависимости от основных характеристик состояния микроциркуляции (амплитуда и процентный вклад колебаний разной частоты) в каждой группе пациентов выделяли основные типы микроциркуляции: нормоциркуляторный, застойный, гиперемический, спастический, спастико-атонический и стазический [5].
При гиперемической форме расстройств на ЛДФ-грамме наблюдается следующая картина: повышение ПМ выше нормы; снижение флакса менее 0,4; амплитуда вазомоторных волн снижается и составляет 0,7; дыхательный ритм обычно сохраняется в пределах нормы, однако может быть незначительно повышен (более 0,4); амплитуда пульсовых колебаний повышена (более 0,5); ИФМ обычно незначительно снижается.
Для спастической формы характерно снижение ПМ (менее 4,5); флакс также снижен — 0,1—0,4; наблюдается подавление миогенного ритма, амплитуда вазомоторных волн снижена, а амплитуда дыхательного (0,4—0,6) и пульсового ритмов существенно возрастает по сравнению с нормой (более 15%). ИФМ снижен (1,5—1,7).
При спастико-атонической форме ПМ менее 5 (может быть вариабельным в связи с большим преобладанием спазма сосудов или нарушений оттока); флакс резко снижен — 0,1—0,3; в частотно-амплитудном спектре наблюдается подавление миогенного ритма, амплитуда вазомоторных волн снижена, а амплитуда дыхательного ритма (более 0,5, с увеличением процентов вклада) и пульсовой ритм возрастают (на 15—20%); ИФМ существенно ниже нормы — 1,0—1,1.
При застойной форме ПМ составляет от 10 до 25; флакс снижен до 0,4; в частотно-амплитудном спектре амплитуда вазомоторных волн снижена, миогенные волны составляют 0,4—0,6, а амплитуда дыхательного (более 0,5, чаще всего повышение вклада более 10—14%) и особенно пульсового ритмов повышена (более 0,5); ИФМ ниже нормы (0,9—1,1).
Статистический анализ результатов проводился с помощью программы Statistics 6.0 («Stat Soft», США) с применением параметрического и непараметрического методов (критерии Стьюдента, Манна—Уитни). В качестве порогового уровня статистической значимости было принято значение p=0,05.
Результаты
Анализ показателей ВРС у пациентов 1-й группы выявил достоверно значимые изменения после 10 сут приема мексидола. При спектральном анализе после окончания терапии абсолютные значения мощности LF- и HF-компонентов, а за счет этого и ТР, были достоверно выше исходных. Более высокие значения низкочастотных колебаний VLF, которые отражают степень активации церебральных эрготропных систем, также наблюдались после 10 сут введения препарата.
Анализ в относительных единицах (отн. ед.) вклада в регуляцию ВРС при фоновой записи HF-, LF- и VLF-компонентов показал значительное преобладание активности симпатоадреналовой системы до проведения терапии и баланс симпатических, парасимпатических и эрготропных влияний после 10 сут введения мексидола. Следовательно, препарат оказал модулирующее влияние на регуляторные функции ЦНС и, как следствие, вегетативное обеспечение.
При спектральном анализе в процессе проведения активной ортостатической пробы после курса терапии отмечена более низкая реактивность симпатического отдела вегетативной нервной системы по сравнению с исходными данными, об этом свидетельствуют значения показателей LF/HF и LF%. Общая мощность спектра после применения препарата сохранила более высокие значения, чем до его введения. Все показатели, составляющие общую мощность спектра в процессе проведения активной ортостатической пробы, имели аналогичную тенденцию.
Таким образом, у пациентов 1-й группы при проведении ВРС после введения мексидола отмечались увеличение общей мощности спектра за счет усиления влияния в большей степени HF-компонента и нормализация симпатико-парасимпатических влияний при проведении фоновой пробы. В активной ортостатической пробе сохранялись те же тенденции, но выраженные в меньшей степени. Анализ динамики К 30/15 позволяет говорить о возросшей реактивности парасимпатического отдела вегетативной нервной системы и, следовательно, увеличении адаптационного потенциала в результате проводимой терапии (табл. 1).
Оценка результатов ВРС у пациентов 2-й группы показала отсутствие достоверного эффекта лечения на вегетативные функции. На фоне приема винпоцетина при спектральном анализе показателей ВРС (фоновая запись и активная ортостатическая проба) по окончании терапии не выявлено достоверно значимой динамики показателей мощности LF- и НF-компонентов и ТР. У всех пациентов наблюдались гиперсимпатикотония и высокая симпатическая реактивность до начала терапии и некоторое снижение значений показателей после окончания терапии, однако процентный вклад симпатического отдела вегетативной нервной системы до и после окончания терапии остался неизменным (см. табл. 1).
Анализ показателей ВРС у пациентов 3-й группы показал достоверно значимые изменения после 10 сут комбинированной терапии препаратами винпоцетин и мекси-дол. До проведения терапии наблюдалось преобладание активности симпатоадреналовой системы, после курса приема препаратов возник баланс симпатических, парасимпатических и эрготропных влияний.
Изменения показателей были более выражены, чем в 1-й группе. Наблюдалось повышение мощности LF- и HF-компонентов, ТР относительно исходных значений, что свидетельствует о возросшем вегетативном обеспечении регуляторных функций организма. После проведения курса терапии определялись более высокие значения VLF, которые отражают степень активации эрготропных систем. При спектральном анализе в процессе проведения активной ортостатической пробы после терапии отмечена более низкая реактивность симпатического отдела вегетативной нервной системы. ТР сохранила более высокие значения.
Все показатели, составляющие ТР, при проведении ортостатической пробы имели тенденцию, аналогичную результатам фоновой записи.
Таким образом, у пациентов 3-й группы при проведении ВРС после приема препаратов винпоцетин и мексидол наблюдались увеличение ТР за счет усиления влияния в большей степени HF-компонента, а также нормализация симпатико-парасимпатических влияний при проведении фоновой пробы. В активной ортостатической пробе сохранялись те же тенденции, но выраженные в меньшей степени. Анализ динамики К 30/15 позволил констатировать возросшую реактивность парасимпатического отдела вегетативной нервной системы и, следовательно, увеличение адаптационного потенциала (см. табл. 1).
Таблица 1. Изменение параметров ВРС на фоне терапии у обследованных пациентов
|
Параметр |
1-я группа |
2-я группа |
3-я группа |
|||
|
до лечения |
после лечения |
до лечения |
после лечения |
до лечения |
после лечения |
|
|
Фоновая запись |
||||||
|
TP, мс2 |
2486,7±1194,5 |
3831,6±1392,8* |
2836,5±1221,5 2926,7±1124,5 |
2940,17±1350,88 |
4103,53±1314,31* |
|
|
VLF, мс2 |
1021,1± 628,9 |
1201,3±582,8 |
1219,1±706,3 |
1146,3±652,1 |
1139,61±934,17 |
1503±978,53 |
|
LF, мс2 |
792,8±545,65 |
999,7±653,1* |
1101,6±653,83 |
1164,3±602,3 |
1112,00±601,34 |
1380,4±374,18* |
|
HF, мс2 |
501,8±331,9 |
1104,0±811,6* |
728,9±311,1 |
748,6±289,63 |
689,34 ±258,18 |
1219,30±420,22* |
|
LF/HF |
1,63 ± 1,26 |
0,90±0,20* |
1,50±0,60 |
1,47±0,67 |
1,90±1,52 |
1,28±0,91* |
|
VLF, % |
41,23±15,2 |
33,19±12,13* |
38,90±11,20 |
37,40±10,90 |
36,90±16,00 |
35,64±9,35* |
|
LF, % |
33,97±12,45 |
28,42±7,40 |
35,80±9,10 |
36,20±8,60 |
38,80±8,13 |
34,21±8,14 |
|
HF, % |
25,54±12,17 |
36,16±15 |
25,2±12,5 |
26,4 ± 1,26 |
24,16 ± 10,73 |
30,45±8,69 |
|
К 30/15 |
1,27±0,20 |
1,41±0,16 |
1,33±0,40 |
1,36±0,30 |
1,26±0,27 |
1,42±0,21 |
|
Ортостатическая проба |
||||||
|
TP, мс2 |
17981,60±742,30 |
2152,90±558,61* |
2471,30±811,40 2519,10±615,20 |
1996,45±564,22 |
3240,74±467,21* |
|
|
VLF, мс2 |
564,50±272,49 |
725,20±382,40 |
699,80±482,41 |
711,90±292,45 |
717,57±289,51 |
150,49±415,65* |
|
LF, мс2 |
934,20±304,62 |
1103,40±750,5 |
1401,2±423,27 |
1399,5±312,1 |
1031,23±384,69 |
1729,12±272,68 |
|
HF, мс2 |
191,61±104,50 |
224,01±154,12 |
387,21±310,2 |
409,7±130,2 |
247,40 ±65,59 |
350,23±42,84* |
|
LF/HF |
4,90±3,22 |
5,02±4,50 |
3,60±1,15 |
3,40±2,10 |
6,20±2,28 |
5,80±2,11 |
|
VLF, % |
32,30±11,30 |
36,25±10,90 |
37,10±9,60 |
35,90±7,30 |
36,86±21,19 |
36,23±11,41 |
|
LF, % |
51,03±12,70 |
50,27±9,70 |
52,21±12,1 |
51,50±11,20 |
51,19±13,48 |
52,80±17,31 |
|
HF,% |
16,51±17,00 |
17,30±11,70 |
10,10±3,90 |
13,40±4,40 |
12,00±1,49 |
10,50±2,41 |
Примечание. Здесь и в табл. 3: * — р<0,05.
Анализ данных УЗДГ показал, что у пациентов 1-й группы до проведения терапии наблюдалось увеличение индекса резистентности до 0,67±0,11, что отражает увеличение сосудистого сопротивления. Было получено увеличение комплекса интима—медиа (КИМ) у 23,7% пациентов. Скорость по прямому синусу до терапии составила 37±3 см/с, по венам Розенталя — 15±3,5 см/с. После 10 сут введения мексидола индекс резистентности снизился до 0,54±0,2, что свидетельствует об уменьшении спазма церебральных сосудов. Скорость по прямому синусу несколько снизилась и составила 30±2,5 см/с, по венам Розенталя — 13±2 см/с, однако без достоверных отличий, что тем не менее позволяет говорить об улучшении церебральной гемодинамики в результате непрямого действия препарата мексидол.
Во 2-й группе до проведения терапии выявлялось повышение индекса резистентности до 0,69±0,21, что отражает увеличение сосудистого сопротивления. Наблюдалось увеличение КИМ с частичной или полной потерей дифференцировки на слои у 13,3% пациентов. Скорость по прямому синусу до терапии составила 36±2,5 см/с, по венам Розенталя — 14±3 см/с. После проведения курса терапии винпоцетином наблюдалось уменьшение индекса резистентности до 0,52±0,5, линейные скорости кровотока по брахиоцефальным артериям увеличились у всех пациентов. В 53,3% случаев скорости по прямому синусу возросли до 60±0,36 см/с, по венам Розенталя — до 32±0,65 см/с. При введении препарата винпоцетин в первые 3, 4, 6 сут у 33,3% пациентов наблюдалось усиление головной боли, которая в условиях затрудненного венозного оттока была связана с антиспастическим действием препарата и увеличением притока по церебральным артериям после внутривенного капельного введения препарата, что свидетельствовало о нарушении адаптации мозгового кровотока к повышенному объему жидкости, при этом увеличивалась нагрузка на венозные сосуды.
Таким образом, у пациентов с СВД адаптация мозгового кровотока при увеличении притока крови в церебральных сосудах происходит медленнее, а следовательно, к лечению целесообразно добавлять препарат нейрометаболи-ческого и вегетокорригирующего действия.
У пациентов 3-й группы до проведения терапии наблюдался спазм приносящих артериальных сосудов, который проявлялся в том числе увеличением индекса резистентности до 0,67±0,11, что показывает повышение сосудистого сопротивления. Наблюдалось увеличение КИМ у 16,7% пациентов. Скорость по прямому синусу до начала терапии составила 33±3,5 см/с, по венам Розенталя — 15± 3 см/с, после 10 сут приема комбинации препаратов мексидол и винпоцетин индекс резистентности снизился до 0,52±0,4, что свидетельствует об уменьшении спазма церебральных сосудов. Линейные скорости кровотока по брахиоцефальным артериям увеличились у всех пациентов. Скорость по прямому синусу после терапии составила 35±2,5 см/с, по венам Розенталя — 16±3 см/с. И только в 6,7% случаев скорости по прямому синусу возросли до 52±0,16 см/с, по венам Розенталя — до 24±0,35 см/с.
Таким образом, было показано, что винпоцетин снимает сосудистый спазм и, усиливая приток крови по мозговым сосудам, оказывает слабый или отсроченный венотонический эффект, который не способствует быстрой адаптации мозгового кровотока к дополнительному объему жидкости в условиях нарушений церебрального кровотока. Винпоцетин в сочетании с мексидолом положительно воздействует на церебральную гемодинамику, уменьшая спазм сосудов, и, благодаря дополнительному нейро-регуляторному действию мексидола, адаптация мозгового кровотока к дополнительному жидкостному объему у пациентов с СВД происходит быстрее. Монотерапия препаратом мексидол оказывает вегетостабилизрующее действие и, как следствие, улучшает церебральную гемодинамику.
Анализ системы микроциркуляции показал, что в зависимости от основных характеристик состояния в каждой группе пациентов присутствовали основные типы микроциркуляции (табл. 2).
Таблица 2. Типы микроциркуляции у обследованных пациентов (%)
Тип микроциркуляции | 1-я группа | 2-я группа | 3-я группа | |||
до лечения после лечения | до лечения | после лечения | до лечения | после лечения | ||
Нормоциркуляторный | 43,3 | 63,3 | 46,6 | 53,3 | 40,1 | 76,6 |
Спастический | 26,7 | 10,0 | 30,0 | 6,7 | 23,3 | 6,7 |
Спастико-атонический | 13,3 | 6,7 | 6,7 | 10,0 | 10,0 | 3,3 |
Гиперемический | 10,0 | 10,0 | 6,7 | 13,3 | 13,3 | 6,7 |
Застойный | 6,7 | 10,0 | 10,0 | 16,7 | 13,3 | 6,7 |
В 1-й группе до проведения терапии мексидолом у 56,7% пациентов наблюдались патологические типы микроциркуляции. Спастический и спастико-атонический типы составили 26,7 и 13,3% соответственно. Реже встречались гиперемический и застойный типы (10 и 6,7%). Варианты нормоциркуляторного типа выявлялись у 43,3% больных. На фоне терапии увеличилось до 63,3% число больных с нормоциркуляторным гемодинамическим типом, что свидетельствует о значимом улучшении состояния микроциркуляции, происходящем за счет уменьшения явлений спазма сосудов микроциркуляторного русла. При этом не наблюдалось увеличения явлений венозного застоя (рис. 1). Значимо уменьшилось число пациентов со спасти-ко-атоническим и спастическим типами микроциркуляции (10 и 6,7%) (см. табл. 2).
Рис. 1. ЛДФ-грамма пациента М. до (а) и после (б) терапии мексидолом.
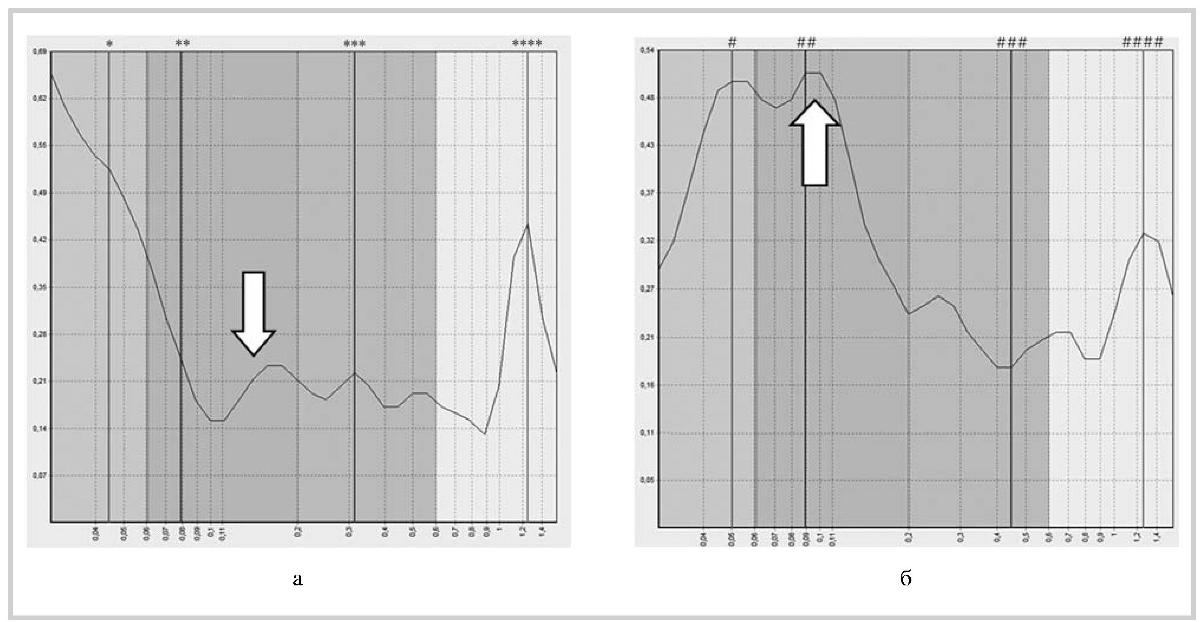
Исходно низкие показатели амплитуды миогенного контура отмечают спазм приносящих сосудов при средних показателях амплитуды дыхательного контура, характеризующих наличие нормального венозного оттока. После лечения отмечены высокие показатели амплитуды миогенного контура (нормальный приток приносящих сосудов) при тех же показателях амплитуды дыхательного контура.
* — нейрогенные 0,04; 0, 52; ** — миогенные 0,08;0,24; *** — дыхательные 0,31;0, 22; **** — сердечные 1,25; 0,44; # — нейрогенные 0, 05; 0, 50;
## — миогенные 0,09; 0,51; ### — дыхательные 0,45; 0, 18; #### — сердечные 1, 26; 0,33.
Здесь и на рис. 2, 3 стрелками обозначены наиболее значимые частотные характеристики ЛДФ-граммы, которые отражали изменения кровенаполнения или тонуса микрососудов на фоне терапии.
У пациентов 2-й группы до проведения терапии препаратом винпоцетин патологические типы микроциркуляции составляли 53,3%, при этом спастический тип определялся в 30% случаев, спастико-атонический и гиперемический — в 6,7% каждый, застойный — в 10%. Варианты нормоциркуляторного типа микроциркуляции выявлялись у 46,7% пациентов.
На фоне лечения наблюдался рост уровня базального кровотока, при этом ИФМ и СКО не изменились. Увеличивалась амплитуда LF-ритма, что свидетельствовало о повышении активности гладких миоцитов в стенке артериол и уменьшении спазма микрососудов. Достоверно увеличилась амплитуда дыхательных волн (HF), что характерно для усугубления нарушений венозного оттока (в ряде случаев наблюдалось усиление характерных для венозной дисгемии головных болей) (рис. 2, табл. 3).
Рис. 2. ЛДФ-грамма пациента Н. до (а) и после (б) терапии винпоцетином.
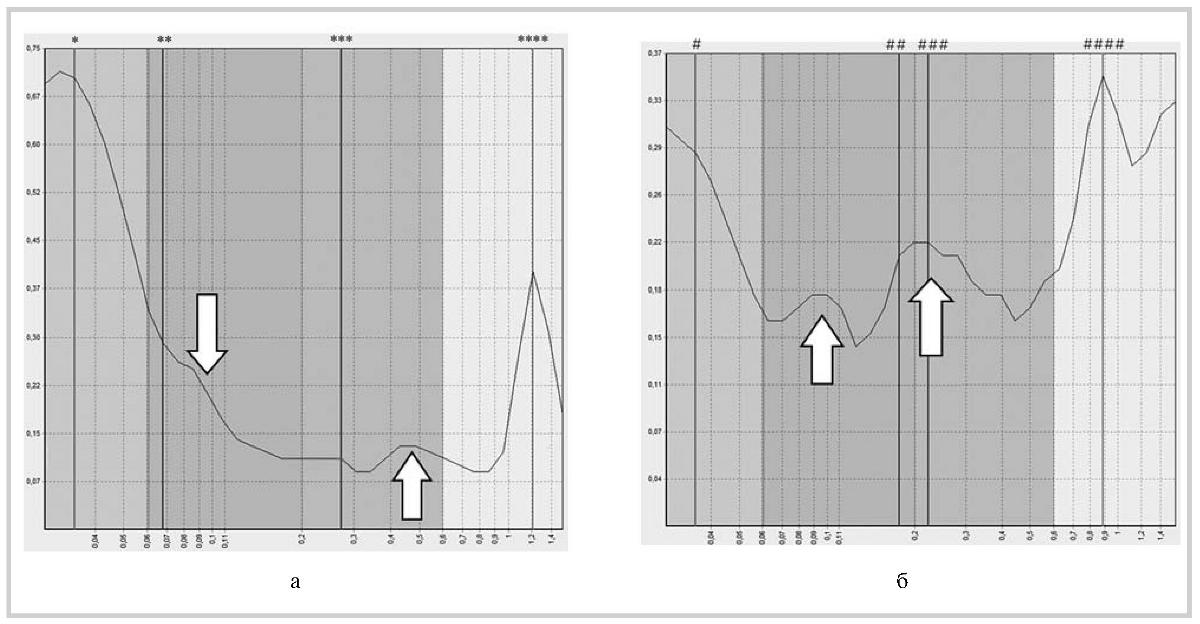
Исходно отмечены низкие показатели миогенного контура, которые характеризуют спазм приносящих сосудов, и повышенные показатели дыхательного контура как проявления затрудненного венозного оттока. После лечения выявлено повышение показателей миогенного контура, отражающее уменьшение спазма и увеличение притока крови приносящих сосудов, а также повышение параметров дыхательного контура, свидетельствующее об усугублении затруднения венозного оттока.
— нейрогенные 0,03; 0, 70; ** — миогенные 0,07; 0,29; *** — дыхательные 0,27; 0, 11; **** — сердечные 1,21; 0,40; # — нейрогенные 0, 04; 0, 29;
## — миогенные 0,18; 0,21; ### — дыхательные 0,22; 0, 22; #### — сердечные 0, 89; 0,35
После лечения уменьшилось число пациентов со спастическим и спастико-атоническим типом микроциркуляции (до 6,7 и 10% соответственно). Число больных с гипертоническим и застойным типами увеличилось и составило 13,3 и 16,7% соответственно. Увеличилось (до 53,3%) число больных с нормоциркуляторным гемодинамическим типом, что свидетельствует об улучшении состояния микроциркуляции, происходящем за счет уменьшения явлений спазма сосудов микроциркуляторного русла, однако в то же время наблюдалась отрицательная динамика в виде увеличения явлений венозного застоя, о чем свидетельствует переход гиперемической формы микроциркуляции в застойную, а спастической — в застойную и гиперемическую.
У пациентов 3-й группы до проведения комбинированной терапии мексидолом и винпоцетином патологические типы микроциркуляции составили 60%, преобладали спастический и спастико-атонический типы микроциркуляции (23,3 и 10% соответственно). В 13,3% встречались гиперемический и застойный типы. Варианты нормоциркуляторного типа имелись у 40% пациентов. На фоне терапии значимо уменьшилось число пациентов со спасти-ко-атоническим и спастическим типом микроциркуляции (3,3 и 6,7% соответственно). Число пациентов с гипереми-ческим и застойным типами микроциркуляции уменьшилось в 2 раза и составило по 6,7% в каждой подгруппе. Увеличилось (до 76,7%) число больных с нормоциркуляторным гемодинамическим типом микроциркуляции, что свидетельствует о значимом улучшении состояния микроциркуляции, происходящем за счет уменьшения явлений спазма сосудов микроциркуляторного русла. При этом не наблюдалось признаков увеличения явлений венозного застоя (см. табл. 2, рис. 3). Происходила быстрая адаптация системы микроциркуляции к изменяющимся условиям кровотока.
Таблица 3. Изменение показателей микроциркуляции на фоне терапии у обследованных пациентов
Показатель | 1-я группа | 2-я группа | 3-я группа | |||
до лечения | после лечения | до лечения | после лечения | до лечения | после лечения | |
Параметры ЛДФ-граммы | ||||||
ПМ, перф. ед. | 10,90±3,20 | 17,60±3,60* | 14,72±3,80 | 16,70±1,18 | 12,40±2,21 | 17,30±2,18* |
уровень флакса, перф. ед. | 0,71±0,41 | 0,98±0,40* | 0,68±0,12 | 0,84±0,17* | 0,66±0,19 | 1,01±0,21* |
ИФМ, усл. ед. | 0,61±0,4 | 1,02±0,34* | 0,63±0,21 | 0,74±0,23* | 0,70±0,14 | 0,90±0,30* |
Вклад видов колебаний в мощность спектра, % | ||||||
нейрогенные | 41,31±2,30 | 34,60±3,16 | 35,10±2,42 | 19,64±2,17 | 35,00±2,80 | 32,56±3,10 |
миогенные | 15,21±1,18 | 27,00±5,10* | 16,23±1,68 | 32,5±2,08* | 14,80±1,90 | 34,20±2,10* |
дыхательные | 9,10±5,20 | 8,00±8,14 | 10,56±2,93 | 20,57±2,80* | 10,60±3,20 | 11,80±1,70 |
пульсовые | 33,85±2,17 | 30,3±4,13 | 34,71±3,24 | 26,90±3,17 | 38,37±4,10 | 23,58±2,90* |
Степень снижения кровотока в дыхательной пробе, % | 21,40±7,30 | 31,80±3,80 | 29,20±4,10 | 32,10±2,90 | 29,60±27,00 | 34,40±3,80 |
Резерв капиллярного кровотока, % | 194,00±34,00 | 239,00±23,00* | 203,35±31,00 | 227,31±28,00 | 199,00±21,00 | 235,00±19,00* |
Рис. 3. ЛДФ-грамма пациента К. до (а) и после (б) комбинированного лечения мексидолом и винпоцетином.
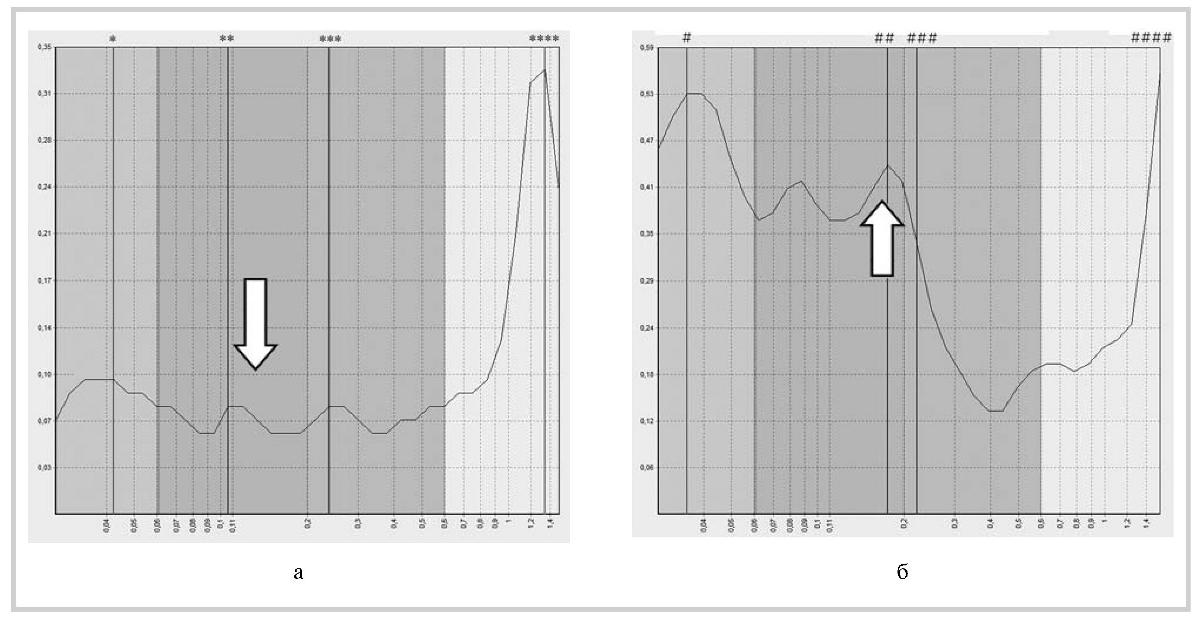
Исходно отмечены низкие показатели амплитуды миогенного контура при средних показателях амплитуды дыхательного контура. После лечения высокие показатели амплитуды миогенного контура характеризуют нормальный приток приносящих сосудов при незначительно повысившихся показателях амплитуды дыхательного контура.
— нейрогенные 0,04; 0, 10; ** — миогенные 0,11; 0,08; *** — дыхательные 0,24; 0, 08; **** — сердечные 1,34; 0,33; # — нейрогенные 0, 04; 0, 53;
## — миогенные 0,18; 0,44; ### — дыхательные 0,22; 0,34; #### — сердечные 1, 56; 0,56.
Применение препарата мексидол как в моно-, так и комплексном лечении пациентов с церебральной ангиодистонией показало вегетостабилизирующее, церебропротективное действие и, как следствие, улучшило как церебральную гемодинамику, так и микрогемоциркуляцию. В составе комбинированной терапии (мексидол и винпоцетин) эффект каждого препарата был усилен. Адаптация мозгового кровотока проходила значительно быстрее, чем при применении винпоцетина в качестве монотерапии.
Применение комбинированной терапии (мексидол и винпоцетин) у пациентов с цереброваскулярной патологией способствует улучшению прогноза развития заболевания.
Авторы заявляют об отсутствии конфликта интересов.
ЛИТЕРАТУРА/REFERENCES
1. Абрамович С.Г., Машанская А.В. Лазерная допплеровская флоуметрия в оценке микроциркуляции у здоровых людей и больных артериальной гипертонией. Сибирский медицинский журнал. 2010;1:57-59. [Abramovich SG, Mashanskaya AV. Laser Doppler flowmetry in assessing microcirculation in healthy subjects and patients with arterial hypertension. Siberian Medical Journal. 2010;1:57-59. (In Russ.)].
2. Абрамович С.Г., Машанская А.В. Типологические особенности показателей микроциркуляции у здоровых людей и больных артериальной гипертонией. Сибирский медицинский журнал. 2010;2:17-19. [Abramovich SG, Mashanskaya AV. typological features of microcirculation in healthy subjects and patients with arterial hypertension. Siberian Medical Journal. 2010;2:17-19. (In Russ.)].
3. Дьяконова Е.Н., Макерова В.В. Эффективная терапия вегетососудистой дистонии у пациентов молодого возраста. Лечащий врач. 2016;2:1723. [Dyakonova EN, Makerova VV. Effective therapy vascular dystonia in young patients. The attending physician. 2016;2:17-23. (In Russ.)].
4. Макерова В.В., Дьяконова Е.Н., Воробьева Н.В., Ковалева Т.Э., Бодунов А.В. Особенности нарушений вегетативной регуляции у лиц с венозной дисгемией в зависимости от уровня артериального давления. Курортная медицина. 2016;2:195-198. [Makerova VV, Dyakonova EN, Vorobiev NV, Kovaleva TE, Bodunov AV. Features violations of autonomic regulation in patients with venous disgemiey depending on blood pressure. Resort Medicine. 2016;2:195-198. (In Russ.)].
5. Метод лазерной допплеровской флоуметрии. Пособие для врачей. Под ред. Козлова В.И. М. 2012. [The method of laser Doppler flowmetry. A Guide for Physicians. Ed. Kozlov V.I. M. 2012. (In Russ.)].
6. Мокина Т.В, Антипенко Е.А., Густов А.В. Астенический синдром при хронической ишемии мозга. Вестник Российского университета дружбы народов. 2009;1:89-92. [Mokina TV, Antipenko EA, Gustov AV. Asthenic syndrome in chronic brain ischemia. Vestnik Russian University of Friendship of Peoples. 2009;1:89-92. (In Russ.)].
7. Дьяконова Е.Н., Макерова В.В., Ковалева Т.Э. Особенности микроциркуляции у пациентов молодого возраста с вегетососудистой дистонией. Материалы IV Международной научно-практической конференции «Scientific achievements of the third millennium» (IV International Scientific Conference). Los Angeles: LJournal; 2016. [Dyakonova EN, Makerova VV, Kovaleva ТE. Features of microcirculation in patients of young age with vascular dystonia. Materials of the IV International Scientific Conference «Scientific achievements of the third millennium» (IV International Scientific Conference). Los Angeles: LJournal; 2016. (In Russ.)]. https://doi.org/10.18411/scc-15-10-2016-04
8. Козлов В.И., Азизов Г.А. Механизм модуляции тканевого кровотока и его изменение при гипертонической болезни. Регионарное кровообращение и микроциркуляция. 2003;4(8):53-59. [Kozlov VI, Azizov GA. Modulation mechanism of tissue blood flow and variation in hypertension. Regional circulation and microcirculation. 2003;4(8):53-59. (In Russ.)].
9. Шмидт Е.В., Лунев Д.К., Верещагин Н.В. Сосудистые заболевания головного и спинного мозга. Практическое пособие. М.: Медицина; 1976. [Shmidt EV, Lunev DK, Vereshchagin NV. Vascular diseases of the brain and spinal cord. Practical manual. M.: Medicene; 1976. (In Russ.)].
10. Луцкий М.А. Анализ эффективности мексидола в комплексном лечении больных с ишемическим инсультом. Журнал неврологии и психиатрии им. C.C. Корсакова. Вып. 2 «Инсульт». 2010;110(4):1-3. [Lutsky MA. Analysis of the effectiveness of mexidol in the complex treatment of patients with ischemic stroke. Journal of Neurology and Psychiatry im. S.S. Korsakova. Issue. 2. 2010;110(4):1-3. (In Russ.)].
11. Смирнова И.Н., Федорова Т.Н., Танашян М.М., Суслина З.А. Клиническая эффективность и антиоксидантная активность Мексидола при хронических цереброваскулярных заболеваниях. Атмосфера. Нервные болезни. 2006;1:33-36. [Smirnova IN, Fedorova TN, Tanashyan MM, Suslina ZA. Clinical efficacy and antioxidant activity of Mexidol in chronic cerebrovascular diseases. Atmosphere. Nervous diseases. 2006;1:33-36. (In Russ.)].
12. Суслина З.А., Танашян М.М., Ионова В.Г., Кистенев Б.А., Максимова М.Ю., Шарыпова Т.Н. Кавинтон в лечении больных с ишемическими нарушениями мозгового кровообращения. Русский медицинский журнал. 2003;10(25):1170-1174. [Suslina ZA, Tanashyan MM, Ionova VG, Kistenev BA, Maksimova MYu, Sharypova TN. Cavinton in the treatment of patients with ischemic impairment of cerebral circulation. Russian Medical Journal. 2003;10(25):1170-1174. (In Russ.)].
13. Лазерная допплеровская флоуметрия микроциркуляции крови. Руководство для врачей. Под ред. Крупаткина А.И., Сидорова В.В. М.: Медицина; 2012. [Laser Doppler flowmetry blood microcirculation. Hand in for doctors. Ed. Krupatkin AI, Sidorov VV. Moscow: Medicine; 2012. (In Russ.)].
14. Сидоров В.В., Сахно Ю.Ф. Возможности метода лазерной допплеровской флоуметрии для оценки состояния микроциркуляции крови. Ультразвуковая и функциональная диагностика. 2003;2:122-127. [Sidorov VV, Sahno YuF. features a method of laser Doppler flowmetry to assess the status of blood microcirculation. Ultrasound and functional diagnostics. 2003;2: 122-127. (In Russ.)].
Mono- and combination therapy with the mexidol in young patients with cerebral angiodystonia
E.N. DYAKONOVA*, V.V. MAKEROVA
Ivanovo State Medical Academy, Ivanovo, Russia
*e-mail: dyael@mail.ru; https://orcid.org/0000-0002-3918-5773
