Результаты многоцентрового двойного слепого рандомизированного плацебо-контролируемого клинического исследования по оценке эффективности и безопасности препарата Мексидол в лечении синдрома дефицита внимания с гиперактивностью у детей (МЕГА)
СтатьиКлиника и лечение нервных и психических заболеваний
Журнал неврологии и психиатрии им. С.С. Корсакова 2022, т. 122, №4, с. 75-86
doi.org/10.17116/jnevro202212204175
Clinical presentation and treatment of nervous and mental diseases
S.S. Korsakov Journal of Neurology and Psychiatry 2022, vol. 122, no. 4, pp. 75-86
doi.org/10.17116/jnevro202212204175
Результаты многоцентрового двойного слепого рандомизированного плацебо-контролируемого клинического исследования по оценке эффективности и безопасности препарата Мексидол в лечении синдрома дефицита внимания с гиперактивностью у детей (МЕГА)
©Н.Н. ЗАВАДЕНКО1, Н.Ю. СУВОРИНОВА1, Т.Т. БАТЫШЕВА2, О.В. БЫКОВА2, А.Н. ПЛАТОНОВА2, Д.Д. ГАЙНЕТДИНОВА3, Е.В. ЛЕВИТИНА4, В.В. МАШИН5, И.Н. ВАКУЛА6, Н.Е. МАКСИМОВА7
11ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия;
2ГБУЗ «Научно-практический Центр детской психоневрологии Департамента здравоохранения г. Москвы», Москва, Россия;
3ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава России, Казань, Россия;
4ФГБОУ ВО «Тюменский государственный медицинский университет» Минздрава России, Тюмень, Россия;
5ФГБОУ ВО «Ульяновский государственный университет», Ульяновск, Россия;
6ООО «Центр профессиональной терапии», Краснодар, Россия;
7ФГБОУ ВО «Тверской государственный медицинский университет», Тверь, Россия
Резюме
Цель исследования. Оценить эффективность и безопасность двух режимов дозирования препарата Мексидол таблетки, покрытые пленочной оболочкой, 125 мг (ООО «НПК «ФАРМАСОФТ», Россия), по сравнению с плацебо, у детей с синдромом дефицита внимания с гиперактивностью (СДВГ) в возрасте от 6 до 12 лет.
Материал и методы. Исследование проводил и в 14 клинических центрах Российской Федерации как многоцентровое рандомизированное двойное слепое плацебо-контролируемое в 3 параллельных группах. В исследовании участвовали 333 ребенка в возрасте от 6 до 12 лет с подтвержденным диагнозом СДВГ, установленным в соответствии с критериями МКБ-10 и DSM-5. После скрининга (до 14 дней) пациенты были рандомизированы в 3 группы в соотношении 1:1:1: Мексидол 125 мг 2 раза в день, Мексидол 125 мг 1 раз в день+плацебо и плацебо. Продолжительность лечения во всех группах составила 42 дня. Исследование завершили 332 ребенка. Динамика состояния оценивалась по шкалам оценки СДВГ и сопутствующих расстройств.
Результаты. Получены статистически значимые изменения суммы общего балла по субшкалам «невнимательность», «гиперактивность/импульсивность» шкалы оценки СДВГ через 6 нед терапии во всех трех группах исследования (p<0,05). При этом между группами Мексидол 125 мг 1 раз в день+плацебо и плацебо, а также между группами Мексидол 125 мг 2 раза в день и плацебо наблюдались выраженные статистически значимые различия (для популяции PP: p=0,000308 и p=0,000024 соответственно; для популяции FAS: p=0,000198 и p=0,000024 соответственно), что свидетельствует о превосходстве терапии Мексидолом над плацебо. По большинству вторичных критериев эффективности (среднего изменения в баллах по субшкале «невнимательность» шкалы SNAP-IV, среднего изменения в баллах по субшкале «гиперактивность⁄импульсивность» шкалы SNAP-IV, среднего изменения в баллах по индексу Коннерса шкалы SNAP-IV, среднего изменения значения по шкале ADHD Rating Scale IV, оценки по шкале общего клинического впечатления степени тяжести СДВГ, оценки по шкале общего клинического впечатления – улучшение) также были получены статистически значимые отличия (p<0,05) при сравнении терапии Мексидолом с плацебо. Результаты статистического анализа частоты возникновения нежелательных явлений, показателей лабораторных анализов, физикального обследования демонстрируют отсутствие значимых различий между сравниваемыми группами по основным показателям безопасности.
Заключение. Схема лечения препаратом Мексидол таблетки, покрытые пленочной оболочкой, 125 мг 2 раза в день, показала преимущество перед схемой Мексидол таблетки, покрытые пленочной оболочкой, 125 мг 1 раз в день + плацебо. Был получен сопоставимый характер профилей безопасности исследуемых режимов дозирования препарата Мексидол и плацебо.
Ключевые слова: синдром дефицита внимания с гиперактивностью, невнимательность, гиперактивность, импульсивность, дети, фармакотерапия, этилметилгидроксипиридина сукцинат, Мексидол.
Информация об авторах:
Заваденко Н.Н. — orcid.org/0000-0003-0103-7422
Суворинова Н.Ю. — orcid.org/0000-0002-1783-7398
Батышева Т.Т. — orcid.org/0000-0003-0928-2131
Быкова О.В. — orcid.org/0000-0001-6576-1765
Платонова А.Н. — orcid.org/0000-0001-8735-9849
Гайнетдинова Д.Д. — orcid.org/0000-0002-4255-9107
Левитина Е.В. — orcid.org/0000-0003-2553-7552
Машин В.В. — orcid.org/0000-0003-0085-3727
Вакула И.Н. — orcid.org/0000-0002-3352-0542
Максимова Н.Е. — orcid.org/0000-0001-9109-6826
Автор, ответственный за переписку: Заваденко Н.Н. — e-mail: zavadenko@mail.ru
Как цитировать: Заваденко Н.Н., Суворинова Н.Ю., Батышева Т.Т., Быкова О.В., Платонова А.Н., Гайнетдинова Д.Д., Левитина Е.В., Машин В.В., Вакула И.Н., Максимова Н.Е. Результаты многоцентрового двойного слепого рандомизированного плацебо-контролируемого клинического исследования по оценке эффективности и безопасности препарата Мексидол в лечении синдрома дефицита внимания с гиперактивностью у детей (МЕГА). Журнал неврологии и психиатрии им. С.С. Корсакова. 2022;122(4):75–86. doi.org/10.17116/jnevro202212204175
Results of a multicentre double-blind randomised placebo-controlled clinical trial evaluating the efficacy and safety of Mexidol in the treatment of Attention Deficit Hyperactivity Disorder in Children (MEGA)
© N.N. ZAVADENKO1, N.Y. SUVORINOVA1, T.T. BATYSHEVA2, O.V. BYKOVA2, A.N. PLATONOVA2, D.D. GAYNETDINOVA3, E.V. LEVITINA4, V.V. MASHIN5, I.N. VAKULA6, N.E. MAXIMOVA7
1Pirogov Russian National Research Medical University, Moscow, Russia
2Scientific Research and Practical Center of Pediatric Psychoneurology, Moscow, Russia;
3Kazan State Medical University, Kazan, Russia;
4Tyumen State Medical University, Tyumen, Russia;
5Ulyanovsk State University, Ulyanovsk, Russia;
6Center of professional therapy, Krasnodar, Russia;
7Tver State Medical University, Tver, Russia
Abstract
Objectives. To evaluate the efficacy and safety of two dosing regimens of Mexidol film-coated tablets, 125 mg ( «RPC «PHARMASOFT» LLC Russia), compared with placebo in children with attention deficit hyperactivity disorder (ADHD) aged 6 to 12 years.
Material and methods. A multicenter randomized, double-blind, placebo-controlled study in 3 parallel groups was conducted in 14 clinical centres of the Russian Federation to assess efficacy and safety of Mexidol film-coated tablets, 125 mg («RPC «PHARMASOFT» LLC Russia) in the treatment of attention deficit hyperactivity disorder (ADHD) in children 6 —12 years old with different dosing regimens. The study involved 333 boys and girls aged 6 to 12 years with a confirmed diagnosis of ADHD established in accordance with ICD-10 and DSM-5 criteria. After screening (up to 14 days) the patients were randomised into 3 treatment groups in a 1:1:1: Mexidol 125 mg 2 times daily, Mexidol 125 mg daily+placebo and the placebo group. The duration of treatment in all groups was 42 days. 332 children completed the study. ADHD and comorbid disorders assessment scales were used.
Results. There were statistically significant changes in the sum of the total scores on the SNAP-IV inattention and hyperactivity/impulsivity subscales after 6 weeks of therapy in all three study groups (p<0.05). There were statistically significant differences between the Mexidol 125 mg and placebo groups and between the Mexidol 125 mg 2 times daily and placebo groups (for the PP population: p=0.000308 and p=0.000024 , respectively; for the FAS population: p=0.000198 and p=0.000024, respectively), indicating that Mexidol therapy is superior to placebo. Statistically significant differences (p<0.05) were also obtained for most of the secondary efficacy criteri a (average change in SNAP-IV inattention subscale score, average change in SNAP-IV hyperactivity&fraslimpulsivity subscale score, average change in SNAP-IV subscale score — Conners index, average change in ADHD-RS-IV score, change in CGI-ADHD-S scores, change in CGI-I score — the Clinical Global Impressions Scale — Improvement) when comparing Mexidol therapy with placebo. The results of statistical analysis of the incidence of adverse events, laboratory values, physical examination show no significant differences between the compared groups in the main safety parameters.
Conclusions. The regimen of Mexidol, 125 mg film-coated tablets twice daily has been shown to be superior to the regimen of Mexidol, 125 mg film-coated tablets once daily and placebo. The safety profiles of the studied dosing regimens of Mexidol and placebo were comparable.
Keywords: attention deficit hyperactivity disorder, inattention, hyperactivity, impulsivity, children, pharmacotherapy, ethylmethylhydroxypyridine succinate, Mexidol.
Information about the authors:
Zavadenko N.N. — orcid.org/0000-0003-0103-7422
Suvorinova N.Y. — orcid.org/0000-0002-1783-7398
Batysheva T.T. — orcid.org/0000-0003-0928-2131
Bykova O.V. — orcid.org/0000-0001-6576-1765
Platonova A.N. — orcid.org/0000-0001-8735-9849
Gaynetdinova D.D. — orcid.org/0000-0002-4255-9107
Levitina E.V. — orcid.org/0000-0003-2553-7552
Mashin V.V. — orcid.org/0000-0003-0085-3727
Vakula I.N. — orcid.org/0000-0002-3352-0542
Maximova N.E. — orcid.org/0000-0001-9109-6826
Corresponding author: Zavadenko N.N. — e-mail: zavadenko@mail.ru
To cite this article: Zavadenko NN, Suvorinova NY, Batysheva TT, Bykova OV, Platonova AN, Gaynetdinova DD, Levitina EV, Mashin VV, Vakula IN, Maximova NE. Results of a multicentre double-blind randomised placebo-controlled clinical trial evaluating the efficacy and safety of Mexidol in the treatment of Attention Deficit Hyperactivity Disorder in Children (MEGA). S.S. Korsakov Journal of Neurology and Psychiatry = Zhurnal nevrologii i psikhiatrii imeni S.S. Korsakova. 2022;122(4):75–86. (In Russ.). doi.org/10.17116/jnevro202212204175
Синдром дефицита внимания с гиперактивностью (СДВГ) является распространенным заболеванием и наблюдается в мире примерно у 5% детей и подростков [1], а в некоторых регионах этот показатель достигает 8,7—15,5% [2]. Для диагностики СДВГ применяются критерии международной классификации болезней МКБ-11 [3] и Американской психиатрической ассоциации DSM-5 [1]. Как в МКБ-11, так и в DSM-5 СДВГ включен в группу расстройств нервно-психического развития, диагноз подтверждается на основании качественных клинических критериев, которые носят описательный характер и представлены двумя группами симптомов: нарушения внимания и гиперактивность-импульсивность.
Для лечения СДВГ рекомендуется комплексный подход с использованием программ тренинга родителей, психолого-педагогических, нейропсихологических, психотерапевтических методов; при неэффективности немедикаментозной коррекции назначается фармакотерапия [1—6]. В качестве средств лекарственной терапии СДВГ в Российской Федерации (РФ) применяются атомоксетин, ноотропные препараты различных групп (производные пирролидона, гамма-аминомасляной кислоты, нейропептиды и их аналоги, многокомпонентные лекарственные средства). При выраженной гиперактивности и сопутствующих расстройствах поведения могут назначаться нейролептики [4, 5].
В США и многих европейских странах в лечении СДВГ широко применяются психостимуляторы, которые обладают эффективностью и удовлетворительным профилем безопасности [2, 7—9]. Наряду с этим психостимуляторы имеют ряд недостатков: они противопоказаны детям младше 6 лет; довольно часто (примерно у 20% пациентов) их назначение сопровождается побочными эффектами в виде раздражительности, нарушений сна, снижения аппетита, болей в животе, а при длительном применении — торможением роста в связи с их влиянием на секрецию гормона роста [5].
Учитывая то, что существующие лекарственные средства у детей и подростков с СДВГ не всегда эффективны и могут давать нежелательные явления (НЯ), исключительно актуальной задачей является разработка новых методов фармакотерапии. Ее решение тесно связано с изучением патогенеза СДВГ, который полностью не раскрыт и включает комплекс механизмов.
СДВГ — заболевание со сложным патогенезом, формирующееся в результате взаимодействия генетических и средовых факторов [5, 7]. Известно, что важными звеньями патогенеза СДВГ являются нарушения метаболизма нейромедиаторов дофамина и норадреналина, которые приводят к нарушениям внимания, когнитивных функций и уровня активности [5, 7]. В ряде современных публикаций [10—14] обращается внимание на то, что нарушения обмена катехоламинов при СДВГ сопровождаются образованием свободных радикалов, так как катехоламины легко окисляются; в результате нескольких этапов окисления развивается оксидантный стресс, и его продукты оказывают цитотоксическое действие на структуры мозга, дисфункция которых ответственна за формирование СДВГ; у пациентов с СДВГ прослеживаются снижение общего антиоксидантного статуса (TAS, total antioxidant status), возрастание общего оксидантного стресса (TOS, total oxidative stress) , а также индекса оксидантного стресса, представляющего соотношение TOS и TAS [10—14]. Поэтому в качестве потенциально эффективных средств фармакотерапии СДВГ рассматриваются препараты, действие которых направлено на снижение оксидантного стресса и защиту клеток мозга от свободных радикалов [15].
Мексидол (этилметилгидроксипиридина сукцинат) — оригинальный российский антиоксидант и антигипоксант. Мексидол состоит из двух связанных и функционально значимых соединений: 2-этил-6-метил-3-гидроксипиридина и сукцината, сочетание которых обусловливает его мультимодальные свойства. Основные эффекты Мексидола — антиоксидантный, антигипоксантный и мембраностабилизирующий. Широкий спектр фармакологических эффектов препарата Мексидол реализуется, по меньшей мере, на двух уровнях — нейрональном и сосудистом. Благодаря сочетанию фармакологических свойств, Мексидол оказывает ноотропный, антиамнестический, анксиолитический, противоэпилептический и другие клинические эффекты. Мексидол на протяжении многих лет активно применяется в неврологии при лечении больных с острыми и хроническими цереброваскулярными заболеваниями, последствиями перенесенных черепно-мозговых травм, энцефалопатиями различного генеза (дисциркуляторными, дисметаболическими, посттравматическими, смешанными) [16—20]. При этом Мексидол имеет высокий профиль безопасности, практически не оказывает побочных эффектов, присущих традиционным нейропсихотропным препаратам.
До настоящего времени эффективность препарата Мексидол главным образом изучалась у взрослых паци- ентов. Имеются отдельные публикации о положительных результатах его применения при неврологических заболеваниях у детей различного возраста, в том числе при СДВГ [21, 22]. Учитывая терапевтический потенциал и удовлетворительный профиль безопасности препарата, перспективно проведение клинических исследований по оценке его эффективности и безопасности в детском возрасте, основанных на современных принципах доказательной медицины.
Цель исследования — оценить эффективность и безопасность двух режимов дозирования препарата Мексидол таблетки, покрытые пленочной оболочкой, 125 мг (ООО «НПК «ФАРМАСОФТ», Россия), по сравнению с плацебо, у детей с СДВГ в возрасте от 6 до 12 лет.
Материал и методы
В 14 клинических центрах РФ проведено многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование в 3 параллельных группах по оценке эффективности и безопасности препарата Мексидол таблетки, покрытые пленочной оболочкой, 125 мг (ООО «НПК «ФАРМАСОФТ», Россия) в лечении СДВГ у детей 6—12 лет при различных режимах дозирования.
Этапы исследования включали периоды скрининга, лечения и наблюдения. После скрининга (до 14 дней) пациенты были рандомизированы на три группы в соотношении 1:1:1. Первая группа принимала Мексидол таблетки, покрытые пленочной оболочкой, 125 мг, по 1 таблетке 1 раз в день+1 таблетка плацебо; вторая группа — Мексидол таблетки, покрытые пленочной оболочкой, 125 мг, по 1 таблетке 2 раза в день; третья группа — плацебо по 1 таблетке 2 раза в день. Продолжительность лечения во всех группах составила 42 дня, период наблюдения после завершения приема препарата — 7 дней. Исследование включало визит скрининга и пять визитов лечения/наблюдения (рис. 1).
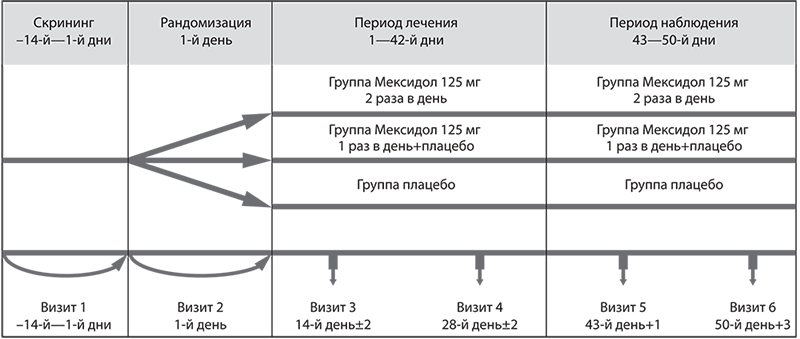
Рис. 1. Схема клинического исследования.
Fig. 1.Clinical trial design.
В исследовании участвовали 333 ребенка обоих полов с СДВГ в возрасте от 6 до 12 лет. Диагноз СДВГ устанавливался в соответствии с критериями Международной классификации болезней 10-го пересмотра (МКБ-10) [23] и классификации DSM-5 [1].
Критерии включения: умеренная степень тяжести СДВГ, не требующая госпитализации для проведения лечения, в соответствии со шкалой оценки общего клинического впечатления степени тяжести СДВГ [24].
Критерии невключения: наличие любой внутричерепной патологии (перенесенные опухоли, нейроинфекции, черепно-мозговые травмы), расстройства аутистического спектра, общее отставание интеллектуального развития, другие психические расстройства, прием или необходимость приема ноотропных, вазоактивных и метаболических препаратов, препаратов для коррекции поведения, тяжелые нарушения функции печени и почек, онкологические заболевания.
При планировании исследования использовались российские и международные рекомендации по проведению клинических исследований у детей с СДВГ [1, 23, 25, 26].
Первичный критерий эффективности: среднее изменение суммы общего балла по субшкалам «невнимательность», «гиперактивность/импульсивность» шкалы SNAP-IV через 6 нед терапии по сравнению с исходным уровнем [27]. Вторичные критерии эффективности: среднее изменение по следующим субшкалам SNAP-IV через 6 нед терапии по сравнению с исходным уровнем — «невнимательность», «гиперактивность/импульсивность», «оппозиционно-вызывающее расстройство поведения», индекс Коннерса; среднее изменение через 6 нед терапии по сравнению с исходными уровнями общей оценки симптомов СДВГ по шкале ADHD Rating Scale-IV , оценки по шкале общего клинического впечатления степени тяжести СДВГ (The Clinical Global Impressions-ADHD-Severity [28], CGI-ADHD-S), оценки по шкале общего клинического впечатления — улучшение (The Clinical Global Impressions Scale — Improvement, CGI-I) [29], общей оценки по шкале детской тревожности SCAS (Spence Children’s anxiety scale) [30].
Основные параметры безопасности — количество НЯ, серьезных нежелательных явлений (СНЯ), а также частота и тяжесть НЯ/СНЯ . Изучение данных параметров является обязательным при оценке безопасности лекарственных препаратов при проведении клинических исследований [31, 32].
Исследование соответствовало всем положениям Хельсинкской Декларации. Все пациенты и/или их родители подписали информированное согласие на участие в исследовании.
Статистическая обработка полученных данных проводилась с использованием статистического пакета Tibco Statistica v.13. Демографические и другие исходные характеристики пациентов (возраст, пол, длительность заболевания, предшествующие и сопутствующие заболевания, предшествующая и сопутствующая терапия) сравнивались между группами терапии для демонстрации сопоставимости групп на исходном уровне.
Анализ эффективности проведен для популяции FAS — всех 333 пациентов, рандомизированных в исследование, включая пациента из группы плацебо, выбывшего досрочно (для указанного пациента оценка проводилась на основании данных визита досрочного выбывания в соответствии с методом LOCF (Last Observation Carried Forward), а также для популяции пациентов PP (рис. 2) [33].
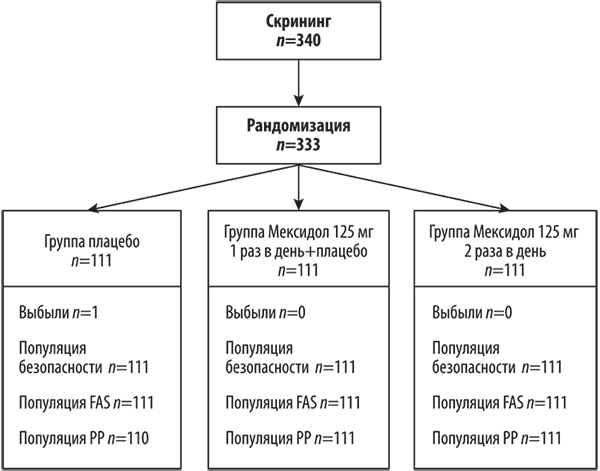
Рис. 2. Распределение пациентов в ходе клинического исследования.
PP популяция — пациенты, завершившие исследование согласно протоколу; FAS популяция — оценивает полный набор данных для анализа эффективности (Full Analysis Set); популяция безопасности — включает всех рандомизированных пациентов, которые приняли хотя бы одну дозу препарата исследования.
Fig. 2. Distribution of patients in the clinical trial.
PP population — patients who have completed the study according to the protocol; FAS population — assesses the Full Analysis Set (FAS); Safety population — includes all randomised patients who have taken at least one dose of the study medicine.
Популяция безопасности включает всех рандомизированных пациентов, которые приняли хотя бы одну дозу препарата исследования. Статистический анализ показателей безопасности проведен для данных, полученных от всех включенных в исследование пациентов, которые приняли хотя бы одну дозу исследуемого препарата (все 333 пациента) [33].
Результаты
В ходе исследования были скринированы 340 пациентов, рандомизированы 333 пациента с равным распределением по группам лечения в соотношении 1:1:1. На рис. 2 представлено распределение пациентов в ходе исследования. Выбыл один пациент из группы плацебо, в остальных оцениваемых группах выбывших пациентов не было.
В табл. 1 представлены демографические и другие исходные характеристики пациентов. В табл. 1 для каждой характеристики приведен результат статистического теста на однородность в виде p-значения, в качестве теста использовался критерий χ2 Пирсона или критерий Краскела—Уоллиса.
В приведенных данных показано, что пациенты во всех исследуемых группах являются однородными по социодемографическим показателям, между группами не отмечается статистически значимых различий (p>0,05) (см. табл. 1).
Таблица 1. Демографические, антропометрические и клинические исходные характеристики пациентов до начала лечения (популяция FAS)
Table 1. Demographic, anthropometric and clinical baseline characteristics of patients before treatment (FAS population)

Примечание. a — критерий χ2 Пирсона; b — критерий Краскела—Уоллиса. Для показателей «возраст», «рост», «масса тела» и «индекс массы тела», баллы по субшкале «невнимательность» шкалы SNAP-IV, баллы по субшкалам «невнимательность», «гиперактивность/импульсивность» шкалы SNAP-IV, баллы по субшкале SNAP-IV — индекс Коннерса, баллы по шкале ADHD Rating Scale IV указана медиана. В квадратных скобках указаны значения 25-го и 75-го процентилей.
Note. a — χ2 Pearson criterion; b — Kraskel—Wallis criterion. For the indicators «age», «height», «body weight» and «body mass index», points on the subscale «inattention» of the SNAP-IV scale, points on the subscales «inattention», «hyperactivity/impulsivity» of the SNAP-IV scale, points on the subscale SNAP-IV — Conners index, points on The median is indicated on the ADHD Rating Scale IV. The values of the 25th and 75th percentiles are shown in square brackets.
Шкала SNAP-IV
Оценка первичной конечной точки эффективности проведена для популяции 332 пациентов , завершивших исследование в соответствии с протоколом (PP популяции), а также для популяции FAS всех 333 пациентов, рандомизированных в исследование, включая пациента из группы плацебо, выбывшего досрочно.
В соответствии с протоколом заключение о превосходстве препарата Мексидол над плацебо могло быть сделано в том случае, если верхняя граница двустороннего 95% доверительного интервала (ДИ) для разности средних изменений баллов по шкале SNA P-IV Мексидола по сравнению с плацебо будет отрицательной.
Было установлено, что верхняя граница 95% ДИ для разности средних значений основного показателя эффективности (среднего изменения суммы общего балла по субшкалам «невнимательность», «гиперактивность/импульсивность» шкалы SNAP-IV) в группах Мексидол 125 мг+плацебо и плацебо составила –1,22 в популяции PP и –1,33 в популяции FAS; в группах Мексидол 125 мг 2 раза в день и плацебо она составила –3,25 в популяции PP и –3,36 в популяции FAS. В обоих случаях для популяции FAS верхняя граница 95% ДИ является отрицательной величиной, что позволяет констатировать превосходящую эффективность терапии препаратом Мексидол над плацебо (табл. 2).
Таблица 2. Результаты статистического анализа первичной конечной точки (популяция FAS)
Table 2. Results of statistical analysis of primary efficacy endpoint (FAS population)

В данных, представленных в табл. 3, показано, что среднее изменение суммы общего балла по субшкалам «невнимательность», «гиперактивность/импульсивность» SNAP-IV через 6 нед терапии по сравнению с исходным уровнем в популяции FAS составило –9,3 балла в группе Мексидол 125 мг 2 раза в день, –7,3 балла в группе Мексидол 125 мг 1 раз в день+плацебо. В группе плацебо данный показатель составил –3,9 балла. Между группами Мексидол 125 мг 1 раз в день+плацебо и плацебо, а также между группами Мексидол 125 мг 2 раза в день и плацебо наблюдались выраженные статистически значимые различия (ANOVA, критерий Даннета, для популяции FAS: p=0,000198 и p=0,000024 соответственно).
Таблица 3. Среднее изменение суммы общего балла основного показателя эффективности по субшкалам «невнимательность», «гиперактивность/импульсивность» шкалы SNAP-IV через 6 нед терапии по сравнению с исходным уровнем (популяция FAS)
Table 3. Average change in the sum of the primary efficacy endpoint scores of the SNAP-IV inattention and hyperactivity/impulsivity subscales after 6 weeks compared to baseline (FAS population)

Примечание. Сравнение препаратов (ANOVA, критерий Даннета): Мексидол 125 мг 2 раза в день vs плацебо: p=0,000024; Мексидол 125 м г 1 раз в день+плацебо vs плацебо: p=0,000198.
Note. Comparison of drugs (ANOVA, Dunnett’s test): Mexidol 125 mg 2 times daily vs placebo: p=0.000024; Mexidol 125 m g daily+placebo vs placebo: p=0.000198.
Таким образом, статистически значимые изменения оценок по субшкалам «невнимательность», «гиперактивность/импульсивность» шкалы SNAP-IV через 6 нед терапии были выявлены во всех трех группах пациентов (p<0,000001, t-критерий для зависимых выборок, оценка внутригрупповой динамики), наиболее выраженная динамика основного критерия эффективности отмечалась в группе Мексидол 125 мг 2 раза в день. Также отмечалось статистически значимое превосходство в отношении первичного критерия эффективности в группе дозы 125 мг 2 раза в день по отношению к группе дозы 125 мг 1 раз в день (p=0,007, критерий Манна—Уитни, популяции FAS и PP). Среднее изменение суммы общего балла по субшкалам «невнимательность», «гиперактивность/импульсивность» шкалы SNAP-IV через 6 нед терапии по сравнению с исходным уровнем в популяциях FAS и PP составило –9,33 балла в группе двукратного дозирования против –7,31 балла в группе однократного дозирования.
При оценке вторичного критерия эффективности (среднее изменение баллов по субшкале «невнимательность» шкалы SNAP-IV через 6 нед терапии ) было установлено, что медианы абсолютной динамики по данной субшкале составили –3,00 [–5,00; –2,00] балла в группе Мексидол 125 мг+плацебо, –4,00 [–7,00; –1,00] балла в группе Мексидол 125 мг 2 раза в день и –1,00 [–3,00; 0,00] балла в группе плацебо (популяция FAS) (табл. 4). Различия между группами по данному показателю статистически значимы (p<0,0001, критерий Краскела—Уоллиса). Проведенный повторный анализ для популяции PP подтверждает данные выводы.
Таблица 4. Среднее изменение балла по субшкале «невнимательность» шкалы SNAP-IV через 6 нед терапии по сравнению с исходным уровнем (популяция FAS)
Table 4. Average change in SNAP-IV inattention subscale score after 6 weeks compared to baseline (FAS population)

Примечание. Различия между группами по абсолютной динамике, критерий Манна—Уитни, p: Мексидол 125 мг 2 раза в день vs плацебо p<0,000001; Мексидол 125 м г 1 раз в в день+плацебо vs плацебо p=0,00001; Мексидол 125 м г 1 раз в день+плацебо vs Мексидо л 125 мг 2 раза в день p=0,075; статистически значимые различия при p<0,017.
Note. Differences between groups in absolute dynamics, Mann —Whitney test, p : Mexidol 125 mg 2 times daily vs placebo p<0.000001; Mexidol 125 m g daily+placebo vs placebo p=0.00001; Mexidol 125 m g daily+placebo vs Mexidol 125 mg 2 times daily p=0.075; statistically significant differences at p<0.017.
В группе Мексидол 125 мг 2 раза в день произошло большее снижение медианы балла по субшкале «невнимательность» SNAP-IV, чем в группе Мексидол 125 мг 1 раз в день +плацебо; однако различия не были статистически значимыми (p=0,075, критерий Манна—Уитни). В группе Мексидол 125 мг 2 раза в день произошло большее снижение балла по субшкале SNAP-IV «невнимательность», чем в группе плацебо, различия между группами Мексидол и плацебо были статистически значимы (p<0,000001, критерий Манна—Уитни). В группе Мексидол 125 мг 1 раз в день+плацебо произошло большее снижение балла по субшкале «невнимательность» SNAP-IV, чем в группе плацебо, различия были статистически значимы (p<0,0000 1, критерий Манна—Уитни). Проведенный повторный анализ для популяции PP подтверждает данные выводы.
При оценке вторичного критерия эффективности (среднее изменение по субшкале «гиперактивность/импульсивность» SNAP-IV через 6 нед терапии ) было установлено, что медианы абсолютной динамики составили –3,00 [–6,00; –1,00] балла в группе Мексидол 125 мг 1 раз в день+плацебо, –5,00 [–7,00; –2,00] балла в группе Мексидол 125 мг 2 раза в день и –1,00 [–3,00; 0,00] балла в группе плацебо (популяция FAS). В квадратных скобках указаны значения 25-го и 75-го процентилей. Различия между группами по данному показателю статистически значимы (p<0,0001, критерий Краскела—Уоллиса). В группе Мексидол 125 мг 2 раза в день произошло большее снижение балла по субшкале «гиперактивность/импульсивность» шкалы SNAP-IV, чем в группе Мексидол 125 мг 1 раз в день+плацебо, данные различия были статистически значимыми (p=0,007, критерий Манна—Уитни). Полученные результаты свидетельствуют в пользу преимущества двукратного режима дозирования над однократным. В группе Мексидол 125 мг 1 раз в день+плацебо произошло большее снижение балла по субшкале «гиперактивность/импульсивность» шкалы SNAP-IV, чем в группе плацебо, различия были статистически значимы (p=0,00003, критерий Манна—Уитни). Различия между группами Мексидол 125 мг 2 раза в день и плацебо также были статистически значимы (p<0,000001, критерий Манна—Уитни) (табл. 5). Проведенный повторный анализ для популяции PP подтверждает данные выводы.
Таблица 5. Среднее изменение балла по субшкале «гиперактивность/импульсивность» шкалы SNAP-IV через 6 нед терапии по сравнению с исходным уровнем (популяция FAS)
Table 5. Average change in SNAP-IV hyperactivity/impulsivity subscale score after 6 weeks compared to baseline (FAS population)

В табл. 6 приведены значения индекса Коннерса. Было выяснено, что по окончании терапии медианы абсолютной динамики индекса Коннерса составили –3,00 [–5,00; –1,00] балла в группе Мексидол 125 мг 1 раз в день+плацебо, –3,00 [–5,00; –1,00] балла в группе Мексидол 125 мг 2 раза в день и –1,00 [–3,00; 0,00] балла в группе плацебо (популяция FAS). Различия между группами по данному показателю статистически значимы (p<0,0001, критерий Краскела—Уоллиса). В группах Мексидол 125 мг 2 раза в день и Мексидол 125 мг 1 раз в день+плацебо произошло одинаковое снижение балла по индексу Коннерса, различия статистически незначимы (p=0,684, критерий Манна—Уитни). В этих группах произошло большее снижение балла по индексу Коннерса, чем в группе плацебо, различия были статистически значимы (p=0,0003 и p=0,00005, критерий Манна—Уитни, соответственно для сравнений групп Мексидол 125 мг 2 раза в день и Мексидол 125 мг 1 раз в день+плацебо с группой плацебо). Проведенный повторный анализ для популяции PP подтверждает данные выводы.
Таблица 6. Среднее изменени е индекса Коннерса через 6 нед терапии по сравнению с исходным уровнем (популяция FAS)
Table 6. Average change in SNAP-IV subscale score — Conners index after 6 weeks of therapy compared to baseline (FAS population)

Шкала ADHD-RS-IV
В табл. 7 приведены данные изменения значений по шкале ADHD-RS-IV. Показано, что медианы абсолютной динамики по данной шкале составили –6,00 [–11,00; –3,00] балла в группе Мексидол 125 мг 1 раз в день+плацебо, –9,00 [–15,00; –5,00] балл а в группе Мексидол 125 мг 2 раза в день и –2,00 [–5,00; 0,00] балла в группе плацебо (популяция FAS). Различия между группами по данному показателю статистически значимы (p<0,0001, критерий Краскела—Уоллиса). В группе Мексидол 125 мг 2 раза в день произошло большее снижение балла по шкале ADHD-RS-IV, чем в группе Мексидол 125 мг 1 раз в день+плацебо, различия были статистически значимыми (p=0,008, критерий Манна—Уитни), что доказывает преимущество двукратного режима дозирования над однократным. Различия между группами Мексидол 125 мг 2 раза в день и плацебо также были статистически значимы (p<0,000001, критерий Манна—Уитни). В группе Мексидол 125 мг 1 раз в день+плацебо произошло большее снижение балла по шкале ADHD-RS-IV, чем в группе плацебо, различия были статистически значимы (p=0,000001, критерий Манна—Уитни). Проведенный повторный анализ для популяции PP подтверждает данные выводы.
Таблица 7. Среднее изменение балла по шкале оценки симптомов ADHD-RS-IV через 6 нед терапии по сравнению с исходным уровнем (популяция FAS)
Table 7. Average change in ADHD-RS-IV score after 6 weeks compared to baseline (FAS population)

Примечание. Различия между группами по абсолютной динамике к визиту 5, критерий Манна—Уитни, p : Мексидол 125 мг 2 раза в день vs плацебо p<0,000001, Мексидол 125 мг 1 раз в день+плацебо vs плацебо p=0,000001, Мексидол 125 мг 1 раз в день+плацебо vs Мексидол 125 мг 2 раза в день p=0,008; статистически значимые различия при p<0,017.
Note. Differences between groups in absolute dynamics at visit 5, Mann —Whitney test, p : Mexidol 125 mg 2 times daily vs placebo p<0.000001, Mexidol 125 mg daily+placebo vs placebo p=0.000001, Mexidol 125 mg daily+placebo vs Mexidol 125 mg 2 times daily p=0.008; statistically significant differences at p<0.017.
Шкала CGI-ADHD-S
В табл. 8 приведены данные изменения значений вторичного показателя эффективности по шкале CGI-ADHD-S через 6 нед терапии по сравнению с исходным уровнем. До начала терапии у всех (100%) пациентов во всех трех группах значение по шкале CGI-ADHD-S составило 4 балла. По окончании терапии между группами были выявлены статистически значимые различия (критерий χ2 Пирсона, p<0,000001) (см. табл. 8). Проведенный повторный анализ для популяции PP подтверждает данный вывод.
Таблица 8. Изменение значений по шкале CGI-ADHD-S через 6 нед терапии по сравнению с исходным уровнем (популяция FAS)
Table 8. Change in CGI-ADHD-S scores after 6 weeks compared to baseline (FAS population)

Шкала CGI-I
В табл. 9 приведены данные изменения значений вторичного показателя эффективности — оценка по шкале CGI-I — через 6 нед терапии по сравнению с исходным уровнем. По окончании терапии между группами были выявлены статистически значимые различия по шкале общего клинического впечатления — улучшение (критерий χ2 Пирсона,pp<0,000001). Проведенный повторный анализ для популяции PP подтверждает данный вывод. Представленные данные показывают преимущества двукратного над однократным режимом дозирования, а также свидетельствуют о превосходящей эффективности в группах препарата Мексидол в сравнении с плацебо.
Таблица 9. Изменение значений оценки по шкале CGI-I через 6 нед терапии по сравнению с исходным уровнем (популяция FAS)
Table 9. Change in CGI-I score after 6 weeks compared to baseline (FAS population)
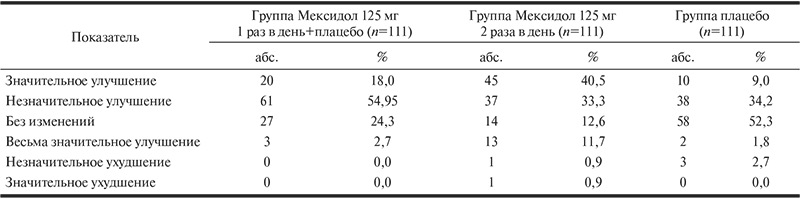
Таким образом, у детей с СДВГ ответ на терапию в виде значительного улучшения и весьма значительного улучшения отмечался у 58 (52,2%) человек в группе Мексидол 125 мг 2 раза в день, у 23 (20,7%) — Мексидол 125 мг 1 раз в день+плацебо и у 12 (10,8%) — плацебо.
При оценке остальных вторичных конечных точек эффективности не были получены статистически значимые различия при оценке эффективности в группе Мексидол по сравнению с плацебо: среднее изменение по субшкале «оппозиционно-вызывающее расстройство поведения» шкалы SNAP-IV через 6 нед терапии по сравнению с исходным уровнем; среднее изменение значения по шкале детской тревожности SCAS . При этом у детей до начала терапии отсутствовали как субклинические, так и начальные клинические проявления тревожности.
Таким образом, при оценке основного критерия эффективности были получены статистически значимые изменения суммы общего балла по субшкалам «невнимательность», «гиперактивность/импульсивность» шкалы SNAP-IV через 6 нед терапии во всех трех группах исследования (p<0,05). При этом между группами Мексидол 125 мг 1 раз в день+плацебо и плацебо, а также между группами Мексидол 125 мг 2 раза в день и плацебо наблюдались выраженные статистически значимые различия. По результатам оценки конечных точек эффективности по окончании 6 нед терапии были получены статистически значимые изменения среднего изменения в баллах по субшкале «невнимательность» шкалы SNAP-IV, среднего изменения в баллах по субшкале «гиперактивность/импульсивность» шкалы SNAP-IV, среднего изменения в баллах по индексу Коннерса шкалы SNAP-IV, среднего изменения значения по шкале ADHD Rating Scale IV, оценки по шкале общего клинического впечатления степени тяжести СДВГ (Clinical Global Impressions-ADHD-Severity, CGI-ADHD-S), оценки по шкале общего клинического впечатления — улучшение (The Clinical Global Impressions Scale — Improvement, CGI-I). Доказана превосходящая эффективность препарата Мексидол над плацебо.
При оценке основного и большинства вторичных критериев эффективности схема лечения Мексидол таблетки, покрытые пленочной оболочкой, 125 мг 2 раза в день показала свое преимущество перед схемой Мексидол таблетки, покрытые пленочной оболочкой, 125 мг 1 раз в день.
Оценка безопасности
исследовании зарегистрировано 62 НЯ у 45 пациентов, из них 2 представляли собой СНЯ. СНЯ отмечались в группах плацебо (ОРВИ) и Мексидол 125 мг 2 раза в день (фурункул левой щечной области). Оба пациента были госпитализированы, после выздоровления последствий не отмечалось.
НЯ были выявлены у 20 (18,02%) пациентов в группе Мексидол 125 мг 2 раза в день (всего 27 НЯ), у 10 (9,09%) — Мексидол 125 мг 1 раз в день+плацебо (всего 15 НЯ) и у 15 (13,51%) — плацебо (всего 20 НЯ). Различия между препаратами по частоте выявления НЯ статистически незначимы (p=0,146, критерий χ2 Пирсона).
Все зарегистрированные в исследовании НЯ относились к легкой и умеренной степени тяжести; во всех группах подавляющее большинство НЯ (49) соответствовало легкой степени тяжести. 23 (85,19%), 12 (80,00%) и 14 (70,00%) НЯ в группах Мексидол 125 мг 2 раза в день, Мексидол 125 мг 1 раз в день+плацебо и плацеб о соответственно относились к легкой степени тяжести. Различия между группами по степени тяжести статистически незначимы (p=0,447, критерий χ2 Пирсона).
В большинстве случаев (10 НЯ (66,67%) в группе Мексидол 125 мг 1 раз в день+плацебо, 21 (77,78%) — Мексидол 125 мг 2 раза в день и 16 (80,00%) — плацебо) дополнительные действия для разрешения НЯ не предпринимались.
Относительный риск возникновения НЯ в группах Мексидол 125 мг 2 раза в день и Мексидол 125 мг 1 раз в день+плацебо по сравнению с группой плацебо составил 1,33 и 0,67 соответственно; 95% ДИ для относительного риска: [0,72; 2,47] и [0,31; 1,42]. В обоих случаях указанные ДИ содержат единицу, что указывает на отсутствие статистически значимых различий между сравниваемыми группами по данному показателю. Обобщенная информация по всем зарегистрированным НЯ представлена в табл. 10.
Таблица 10. Нежелательные явления, зарегистрированные в ходе исследования во всех исследуемых группах
Table 10. Adverse events reported during the trial in all study groups
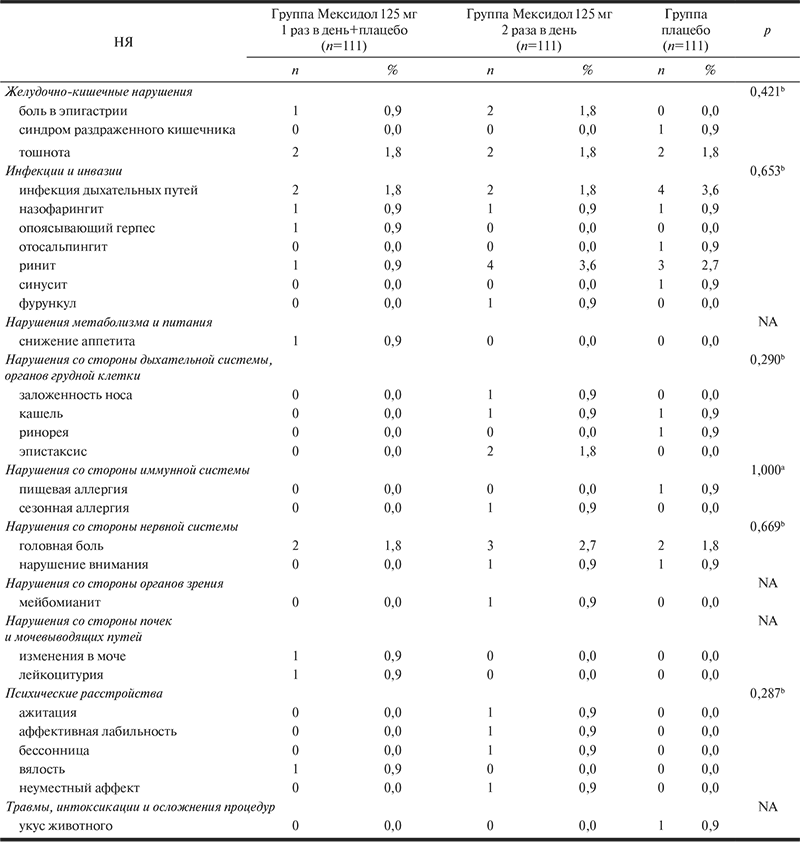
Примечание. а — точный критерий Фишера; b — критерий χ2 Пирсона; NA — не применимо.
Note. а — Fisher exact criterion; b — χ2 Pearson criterion; NA — not applicable.
Результаты статистического анализа частоты возникновения НЯ, показателей лабораторных анализов, физикального обследования демонстрируют отсутствие значимых различий (p>0,05) между сравниваемыми группами по основным показателям безопасности. Таким образом, был доказан схожий профиль безопасности препарата Мексидол (для обоих режимов дозирования) в сравнении с плацебо.
Заключение
Проведенное исследование показало, что препарат Мексидол имеет высокую эффективность при лечении СДВГ у детей от 6 до 12 лет. Доказана превосходящая эффективность препарата Мексидол над плацебо. При оценке основного и большинства вторичных критериев эффективности схема лечения Мексидол таблетки, покрытые пленочной оболочкой, 125 мг 2 раза в день показала свое преимущество перед схемой Мексидол таблетки, покрытые пленочной оболочкой, 125 мг 1 раз в день. Установлено отсутствие значимых различий между сравниваемыми группами по основным показателям безопасности. Изложенное указывает на сопоставимый характер профилей безопасности исследуемых режимов дозирования препарата Мексидол и плацебо.
Конфликт интересов:
статья подготовлена при поддержке фармацевтической компании «Векторфарм».
Conflict of interest:
the article was prepared with the support of the pharmaceutical company «Vectorpharm».
ЛИТЕРАТУРА/REFERENCES
- Diagnostic And Statistical Manual of Mental Disorders, Fifth Edition. American Psychiatric Association. Washington, 2013. doi.org/10.1176/appi.books.9780890425596
- Wolraich ML, Hagan JF, Allan C, et al. AAP Subcommittee on Children and Adolescents with Attention-Deficit/Hyperactive Disorder. Clinical Practice Guideline for the Diagnosis, Evaluation, and Treatment of Attention-Deficit/Hyperactivity Disorder in Children and Adolescents. Pediatrics. 2019;144(4):e20192528. doi.org/10.1542/peds.2019-2528
- ICD-11 International Classification of Diseases 11th Revision The global standard for diagnostic health information. https://icd.who.int/ru
- Федеральное государственное бюджетное учреждение «Федеральный медицинский исследовательский центр психиатрии и наркологии имени В.П. Сербского» Минздрава России. Гиперкинетические расстройства (СДВГ). Под ред. Корень Е.В., Куприянова Т.А. 2015.
Federal State Budgetary Institution «Federal Medical Research Center for Psychiatry and Narcology named after V.P. Serbsky» of the Ministry of Health of Russia. Hyperkinetic Disorders (ADHD). Koren E, Kupriyanova T. eds. 2015. (In Russ.). - Заваденко Н.Н. Гиперактивность и дефицит внимания в детском возрасте. М.: Юрайт; 2019.
Zavadenko NN. Hyperactivity and deficiency of attention at children’s age. M.: Jurite; 2019. (In Russ.). - Rohde LA, Buitelaar JK, Gerlach M, Faraone SV. The World Federation of ADHD Guide. Porto Alegre: Artmed; 2019;124.
- Banaschewski T, Becker K, Döpfner M, Holtmann M, Rösler M, Romanos M. Attention-Deficit/Hyperactivity Disorder. Dtsch Ärztebl Int. 2017;114:149-159. doi.org/10.3238/arztebl.2017.0149
- Steingard R, Taskiran S, Connor DF, et al. New Formulations of Stimulants: An Update for Clinicians. J Child Adolesc Psychopharmacol. 2019;29:324-339. doi.org/10.1089/cap.2019.0043
- Catalá-López F, Hutton B, Núñez-Beltrán A, et al. The pharmacological and non-pharmacological treatment of attention deficit hyperactivity disorder in children and adolescents: A systematic review with network meta-analyses of randomised trials. PloS One. 2017;12:e0180355. doi.org/10.1371/journal.pone.0180355
- Joseph N, Zhang-James Y, Perl A, Faraone SV. Oxidative Stress and ADHD: A Meta-Analysis. J Atten Disord. 2015;19:915-924. doi.org/10.1177/1087054713510354
- Nasim S, Naeini AA, Najafi M, et al. Relationship between Antioxidant Status and Attention Deficit Hyperactivity Disorder Among Children. Int J Prev Med. 2019;10:41. doi.org/10.4103/ijpvm.IJPVM_80_18
- Corona JC. Role of Oxidative Stress and Neuroinflammation in Attention-Deficit/Hyperactivity Disorder. Antioxid Basel Switz. 2020;9:E1039. doi.org/10.3390/antiox9111039
- Robberecht H, Verlaet AAJ, Breynaert A, et al. Copper and Selenium Status in Attention-Deficit/Hyperactivity Disorder (ADHD). Mol Basel Switz. 2020;25:E4440. doi.org/10.3390/molecules25194440
- Alvarez-Arellano L, González-García N, Salazar-García M, Corona JC. Antioxidants as a Potential Target against Inflammation and Oxidative Stress in Attention-Deficit/Hyperactivity Disorder. Antioxidants. 2020;9:176. doi.org/10.3390/antiox9020176
- Curpan AS, Luca A-C, Ciobica A. Potential Novel Therapies for Neurodevelopmental Diseases Targeting Oxidative Stress. Oxid Med Cell Longev. 2021;2021:6640206. doi.org/10.1155/2021/6640206
- Щулькин А.В. Современные представления об антигипоксическом и антиоксидантном эффектах мексидола. Журнал неврологии и психиатрии им. С.С. Корсакова. 2018;118(12, вып. 2):87-93.
Shchulkin AV. A modern concept of antihypoxic and antioxidant effects of mexidol. Zh Nevrol Psikhiatr im. S.S. Korsakova. 2018;118(12, Vyp. 2):87-93. (In Russ). doi.org/10.17116/jnevro201811812287 - Боголепова А.Н. Роль оксидантного стресса в развитии сосудистых когнитивных расстройств. Журнал неврологии и психиатрии им. С.С. Корсакова. 2020;120(8):133-139.
Bogolepova AN. The role of oxidative stress in the development of vascular cognitive disorders. Zhurnal Nevrologii i Psikhiatrii im. S.S. Korsakova. 2020;120(8):133-139. (In Russ). doi.org/10.17116/jnevro2020120081133 - Федин А.И., Захаров В.В., Танашян М.М . и др. Результаты международного многоцентрового рандомизированного двойного слепого плацебо-контролируемого исследования оценки эффективности и безопасности последовательной терапии пациентов с хронической ишемией мозга препаратами Мексидол и Мексидол ФОРТЕ 250 (исследование МЕМО). Журнал неврологии и психиатрии им. С.С. Корсакова. 2021;121(11):7-16.
Fedin AI, Zakharov VV, Tanashyan MM, et al. Results of the international multicenter randomized, double-blind, placebo-controlled study evaluation of the efficacy and safety of sequential therapy in patients with chronic cerebral ischemia with drugs Mexidol and Mexidol FORTE 250 (MEMO study). Journal of Neurology and Psychiatry. S.S. Korsakov. 2021;121(11):7-16. (In Russ). doi.org/10.17116/jnevro20211211117 - Чухловина М.Л., Чухловин А.А. Особенности ведения пациентов с черепно-мозговой травмой. Журнал неврологии и психиатрии им. С.С. Корсакова. 2021;121(9):145-151. doi.org/10.17116/jnevro2021121091145
Chukhlovina ML, Chukhlovin AA. Features of the patient management with traumatic brain injury. Zhurnal Nevrologii i Psikhiatrii im. S.S. Korsakova. 2021;121(9):145-151. (In Russ.). - Стаховская Л.В., Шамалов Н.А., Хасанова Д.Р . и др. Результаты рандомизированного двойного слепого мультицентрового плацебо-контролируемого в параллельных группах исследования эффективности и безопасности мексидола при длительной последовательной терапии у пациентов в остром и раннем восстановительном периодах полушарного ишемического инсульта (ЭПИКА). Журнал неврологии и психиатрии им. С.С. Корсакова. 2017;117(3, вып. 2):55-65.
Stakhovskaya LV, Shamalov NA, Khasanova DR, et al. Rezul’taty randomizirovannogo dvoĭnogo slepogo mul’titsentrovogo platsebo-kontroliruemogo v parallel’nykh gruppakh issledovaniia éffektivnosti i bezopasnosti meksidola pri dlitel’noĭ posledovatel’noĭ terapii u patsientov v ostrom i rannem vosstanovitel’nom periodakh polusharnogo ishemicheskogo insul’ta (ÉPIKA) [Results of a randomized double blind multicenter placebo-controlled, in parallel groups trial of the efficacy and safety of prolonged sequential therapy with mexidol in the acute and early recovery stages of hemispheric ischemic stroke (EPICA)]. Zh Nevrol Psikhiatr im. S.S. Korsakova. 2017;117(3 Vyp. 2):55-65. PMID: 28665371. (In Russ). doi.org/10.17116/jnevro20171173255-65 - Бархатов М.В., Носырев А.В., Дехтярь А.В., Галактионова М.Ю. Применение препарата Мексидол в комплексном лечении детей с посттравматической эпилепсией. Бюллетень экспериментальной биологии и медицины. 2006;S1:9-13.
Barkhatov MV, Nosyrev AV, Dekhtyar AV, Galaktionova MYu. The use of the drug Mexidol in the complex treatment of children with post-traumatic epilepsy. Bulletin of Experimental Biology and Medicine. 2006;S1:9-13. (In Russ). - Потапова И.С., Хромина Н.В., Протопопова М.В. Течение школьной адаптации у детей с синдромом дефицита внимания с гиперактивностью на фоне применения мексидола. Бюллетень экспериментальной биологии и медицины. 2006;S1:72-74.
Potapova IS, Khromina NV, Protopopova MV. The course of school adaptation in children with attention deficit hyperactivity disorder on the background of mexidol use. Bulletin of Experimental Biology and Medicine. 2006;S1:72-74. (In Russ). - ICD-10 International Classification of Diseases 10th Revision The global standard for diagnostic health information. https://icd.who.int/browse10/2019/en
- Wehmeier PM, Schacht A, Dittmann RW, Döpfner M. Global impression of perceived difficulties in children and adolescents with attention-deficit/hyperactivity disorder: reliability and validity of a new instrument assessing perceived difficulties from a patient, parent and physician perspective over the day. Child Adolesc Psychiatry Ment Health. 2008;2:10. doi.org/10.1186/1753-2000-2-10
- EMEA/CHMP/EWP/431734/2008 Committee for Medicinal Products for Human use (CHMP).Guideline on the clinical investigation of medicinal products for the treatment of attention deficit hyperactivity disorder (ADHD). 2010.
- Food and Drug Administration Center for Drug Evaluation and Research (CDER).Attention Deficit Hyperactivity Disorder: Developing Stimulant Drugs for Treatment Guidance for Industry. 2019.
- Swanson JM, Schuck S, Porter MM, et al. Categorical and Dimensional Definitions and Evaluations of Symptoms of ADHD: History of the SNAP and the SWAN Rating Scales. Int J Educ Psychol Assess. 2012;10:51-70.
- Busner J, Targum SD. The Clinical Global Impressions Scale. Psychiatry Edgmont. 2007;4:28-37.
- Spence SH, Barrett PM, Turner CM. Psychometric properties of the Spence Children’s Anxiety Scale with young adolescents. J Anxiety Disord. 2003;17:605-625. doi.org/10.1016/s0887-6185(02)00236-0
- Orgilés M, Fernández-Martínez I, Guillén-Riquelme A, Espada JP, Essau CA. A systematic review of the factor structure and reliability of the Spence Children’s Anxiety Scale. J Affect Disord. 2016;190:333-340. doi.org/10.1016/j.jad.2015.09.055
- Рекомендация Коллегии Евразийской экономической комиссии от 17 июля 2018 г. №11 «О Руководстве по общим вопросам клинических исследований.
Recommendation of the Board of the Eurasian Economic Commission dated July 17, 2018 No. 11 «On the Guidelines for General Issues of Clinical Research. (In Russ). - Решение Совета Евразийской экономической комиссии от 3 ноября 2016 г. №79 «Об утверждении Правил надлежащей клинической практики Евразийского экономического союза».
Decision of the Council of the Eurasian Economic Commission of November 3, 2016 No. 79 «On approval of the Rules for Good Clinical Practice of the Eurasian Economic Union». (In Russ). - Рекомендация Коллегии Евразийской экономической комиссии от 3 ноября 2020 г. №19 «О Руководстве по применению принципов биостатистики в клинических исследованиях лекарственных препаратов».
Recommendation of the Collegium of the Eurasian Economic Commission of November 3, 2020 No. 19 «On the Guidelines for the Application of Biostatistics Principles in Clinical Trials of Medicinal Products». (In Russ).
Поступила 01.03.2022
Received 01.03.2022
Принята к печати 18.03.2022
Accepted 18.03.2022
