Современные концепции лечения пациентов с сосудистой коморбидностью. Часть 1. Коррекция тканевого энергодефицита
Статьи
Опубликовано в журнале:
«КАРДИОВАСКУЛЯРНАЯ ТЕРАПИЯ И ПРОФИЛАКТИКА»; № 11(6); 2012; стр. 50-55.
Румянцева С. А.1,4*, Оганов Р. Г.2, Силина Е. В.3,5, Ступин В. А.1,4, Болевич С. Б.3, Свищева С. П.6, Орлова А. С.3, Комаров А. Н.5, Орлов В. А.3, Аброськина О. В.3, Елисеев Е. В.4, Сохова О. А.7, Богатырева М. Д.8
1Российский национальный исследовательский медицинский университет имени Н.И. Пирогова Минздрава России. Москва, Россия; 2Государственный научно-исследовательский центр профилактической медицины Минздрава России». Москва, Россия; 3Первый Московский государственный медицинский университет имени И.М. Сеченова Минздрава России. Москва, Россия; 4ГКБ № 15 имени О.М. Филатова Департамента здравоохранения г. Москвы; 5 ОАО «Реабилитационный центр для инвалидов «Преодоление». Москва, Россия; 6Пансионат для ветеранов труда № 9. Москва, Россия; 7Поликлиника № 7. Нальчик, Россия; 8Региональный сосудистый центр. Ставрополь, Россия
Первая из планируемой серии статей, в которых будут отражены различные аспекты терапии пациентов с сосудистой коморбидностью (СК), посвящена оценке роли и возможностям терапии расстройств свободнорадикальных процессов (СРП) в генезе многоочаговых сосудистых поражений.
Цель. Анализ влияния СК на частоту развития и исходы мозгового инсульта (МИ) для разработки алгоритмов терапии, направленной на коррекцию дисбаланса СРП.
Материал и методы. Проведено проспективное исследование 634 больных МИ с анализом доинсультной инвалидизации, обусловленной различной сердечно-сосудистой патологией, ее влияния на течение и исходы заболевания на стационарном и постстационарном этапах, с изучением особенностей течения СРП при разных формах сосудистой коморбидности.
Результаты. У 97% пациентов с МИ выявлена сосудистая коморбидность, приведшая у 45,3% из них к инвалидности еще до развития МИ. Обнаружены значимые различия показателей СРП, характеризующих степень тканевого энергодефицита у пациентов с ишемической болезнью сердца, инфарктом миокарда, мерцательной аритмией и сахарным диабетом, на основании оценки которых разработаны эффективные алгоритмы энергокоррегирующей терапии.
Заключение. Анализ до- и постинсультной инвалидизации и состояния профилактики повторных сосудистых событий у пациентов с сосудистым (кардиальным) анамнезом, доказывает необходимость более активной реализации современных мультидисциплинарных программ профилактики.
Ключевые слова: сосудистая коморбидность, острый инсульт, до- и постинсультная инвалидизация, свободнорадикальные процессы, энергокоррекция.
MODERN TREATMENT STRATEGIES IN PATIENTS WITH VASCULAR COMORBIDITY
PART 1. CORRECTING TISSUE ENERGY DEFICIENCY
Rumyantseva S. A.1,4*, Oganov R. G.2, Silina E. V.3,5, Stupin V A.1,4, Bolevich S. B.3, Svishcheva S. P6, Orlova A. S.3, Komarov A. N.5, Orlov V. A.3, Abroskina O. V.3, Eliseev E. V.4, Sokhova O. A.7, Bogatyreva M. D.8
1N. I. Pirogov Russian National Medical University. Moscow, Russia; 2State Research Centre for Preventive Medicine. Moscow, Russia; 3I. M. Sechenov First Moscow State Medical University. Moscow, Russia; 4O. M. Filatov Clinical Hospital No. 15; 5Rehabilitation Centre for Disabled “Preodolenie”. Moscow, Russia; 6Boarding House for Labour Veterans No. 9. Moscow, Russia; 7Polyclinic No. 7. Nalchik, Russia; 8Regional Vascular Centre. Stavropol, Russia
The first paper of the series on the treatment of patients with vascular comorbidity (VC) is focused on the role and therapeutic potential of the correction of free radical processes (FRP) as pathogenetic factors of multifocal vascular pathology.
Aim. To analyse the effects of VC on the incidence and outcomes of cerebral stroke (S), in order to create therapeutic algorithms of FRP correction.
Material and methods. This prospective study included 634 S patients. The following factors were analysed: pre-stroke disability due to various VC variants; VC effects on the clinical course, as well as in-hospital and post-discharge outcomes; and FRP specifics in various VC variants.
Results. VC was registered in 97% of S patients; in 45,3%, it resulted in pre-stroke disability. FRP parameters, reflecting the progression of tissue energy deficiency, differed significantly in patients with coronary heart disease, myocardial infarction, atrial fibrillation, and diabetes mellitus. Based on these findings, the therapeutic algorithms for effective energy deficiency correction have been created.
Conclusion. The analysis of pre- and post-stroke disability and prevention of repeat events in cardiovascular patients has demonstrated the need for a more active implementation of modern multidisciplinary preventive programs.
Key words: vascular comorbidity, acute stroke, pre- and post-stroke disability, free radical processes, energy deficiency correction.
Борьба с сердечно-сосудистыми заболеваниями (ССЗ) является одним из приоритетных направлений медицины, поскольку имея общую структуру факторов риска (ФР), они обуславливают большую часть смертности в популяции [1] и высокий процент инвалидизации населения [2]. В связи с болезнями системы кровообращения — инсульты (МИ), инфаркты миокарда (ИМ) и др., в 2011г в России впервые было признано инвалидами 349700 больных. Существующее сегодня разделение патологии единой сосудистой системы по сферам «интересов врачей» на церебральную, кардиальную и патологию периферических сосудов, является общепринятым, хотя с патофизиологической точки зрения, оно не имеет биологического смысла. Это приводит к недооценке тяжести поражения и отодвигает сроки проведения комплексной терапии и профилактики. Несмотря на наличие нескольких уровней ауторегуляции кровотока, сосудистая система головного мозга остается «легко ранимой» и подверженной воздействию основных механизмов, ведущих к развитию сосудистой патологии. Больший диаметр просвета артерий каротидного бассейна (5-7 мм) по сравнению с коронарными сосудами (3-4 мм), позволяет организму продолжительнее компенсировать атеросклеротические и гемореологические изменения в эндотелии церебральных сосудов. Эта компенсация приводит к тому, что клиническая реализация факторов этиопатогенеза МИ обычно отодвинута по времени от сроков возникновения кардиальной патологии [4].
Ишемическое повреждение является гетерогенным состоянием, но запускает его всегда критическое снижение тканевого кровотока, инициирующее каскад биохимических и молекулярных реакций, участвующих в формировании зоны ишемии. Неконтролируемое образование свободных радикалов (СР) является ключевым механизмом повреждения клеток и тканей при всех патологических процессах, вызванных тканевой ишемией и ведущих к апоптозу [5, 6]. Низкое артериальное давление (АД), повышение уровня мочевины в сыворотке крови у пациентов с диабетом (СД), гипергликемия у пациентов без СД, фибрилляция предсердий (ФП) являются клинико-лабораторными маркерами плохого прогноза в течение 3 мес. после любого перенесенного сердечно-сосудистого события (ССС), в т.ч. МИ и ИМ, границей между которыми часто становятся только особенности клинической картины в момент критического снижения кровотока в каротидном или коронарном сосуде. Доказано, что 82% больных острым МИ имеют яркий «сердечный анамнез», а у 75% — инструментально диагностируются кардиальные эмболии, в т.ч. у 56% — микроэмболы [3]. Возникновение или прогрессирование ишемической болезни сердца (ИБС) и цереброваскулярной болезни (ЦВБ) всегда сопровождается дисбалансом свободнорадикальных процессов (СРП) за счет увеличения активности повреждающего клетки и ткани перекисного окисления липидов (ПОЛ) [7]. Клинической реализацией этого повреждения является нарушение функции органов: при остром коронарном синдроме (ОКС) — это боль и снижение сердечного выброса (СВ), при МИ — нарушение сознания и очаговая симптоматика. Изменения активности нейрогуморальной системы, активация процессов ПОЛ, прогрессирование дисбаланса СРП и развитие острофазового ответа рассматриваются сегодня как первичные адаптационно-компенсаторные процессы. Одновременно с этим, выход их из-под контроля меняет характер указанных процессов с адаптационного на деструктивный [8]. Индикаторами роста дисбаланса СРП, т.е. объективным маркером степени тканевого повреждения, является уровень продукта ПОЛ — малонового диальдегида (МДА), а в качестве маркера активации защитно-адаптационных реакций — уровень антиперекисной активности плазмы (АПА) [7, 8]. Несмотря на неоднократные попытки выработки мультидисциплинарного подхода к профилактике и лечению первичных и повторных ССС, взаимопонимание по этому вопросу до сих пор не достигнуто, и каждый из профильных специалистов продолжает «тянуть одеяло на себя». До настоящего момента не проведено исследований, посвященных корреляционному анализу тяжести фоновой сердечно-сосудистой патологии, в т.ч. инвалидизирующей пациента, и риска возникновения острого МИ. Не представлено и работ по оценке уровня дисбаланса СРП у пациентов с различными формами сосудистой коморбидности (СК). В представленном цикле работ авторы попытаются объединить клиникоэпидемиологические и патофизиологические аспекты СК для разработки патогенетически направленных программ профилактики и терапии.
Цель исследования — анализ влияния СК, ставшей причиной инвалидности, на частоту развития и исходы МИ для разработки алгоритмов терапии, направленной на коррекцию дисбаланса СРП.
Материал и методы
Проведено проспективное, сравнительное исследование 634 больных (51,1% мужчин, 48,9% женщин) в возрасте 28-94 лет (средний возраст 65,48±13,44), госпитализированных с острым МИ, развившемся на фоне различных ССЗ: артериальная гипертония (АГ), ИБС, ИМ, кардиосклероз, СД. 542 пациента проходили лечение в нейрососудистых отделениях ГКБ № 15 г. Москвы, 92 — в неврологических отделениях стационаров г. Нальчика и г. Ставрополя. У 76,8% пациентов острый МИ возник впервые, у 23,3% был повторным. Во время пребывания в стационаре все пациенты были обследованы по единому протоколу, включавшему комплексный клинико-анамнестический и инструментальный мониторинг с анализом жалоб, сведения о наличии, тяжести и причине присвоения группы инвалидности до инсульта, компьютерную томографию/магнитно-резонансную томографию (КТ/ МРТ), оценку соматического состояния: АД, частоту сердечных сокращений (ЧСС), частоту дыхания (ЧДД), электрокардиограмму (ЭКГ), температуру тела, клинический и биохимический анализы крови, неврологический статус по шкале NIH-NINDS (National Institutes of Health — National Institute of Neurological Disorders and Stroke), функциональное состояние по модифицированной шкале Renkin и индексу Бартель в динамике. СРП исследовали у 449 больных с анализом уровней кислородных маркеров: ПИХЛб (показатель интенсивности хемилюминисценции лейкоцитов базальный) и ПИХЛс (показатель интенсивности хемилюминисценции лейкоцитов стимулированный зимозаном), маркера липидно-перекисного этапа СРП — МДА и показателя АПА на 1, 5, 10 и 20 сут. Наблюдение за 200 пациентами, выписанными из ГКБ №15, осуществляли в динамике через 3 и 6 мес. по тем же валидным шкалам с дополнительной оценкой уровня постинсультной инвалидизации и летальности, на дому (по данным амбулаторных карт), в доме-интернате № 9 и Центре «Преодоление» г. Москвы (по данным историй болезни). За 92 пациентами, проживающими в Кабардино-Балкарии и перенесшими острый МИ аналогичной тяжести со сходным уровнем фоновой СК, наблюдали по аналогичному протоколу в течение 3 лет неврологи г. Нальчика и г. Ставрополя.
Результаты и обсуждение
В ходе исследования выявлено, что 45,3% пациентов до поступления в стационар с острым МИ уже имели группу инвалидности, которая составляла у пациентов <50 лет — 12%, а <60 лет — 19,2%. У 75,1% пациентов с инвалидностью до МИ, была установлена вторая, 17,2% — третья, 7,7% — первая группа (рисунок 1).
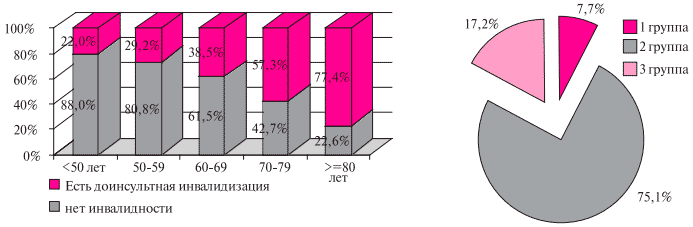
Рис. 1 Частота доинсультной инвалидности в разных возрастных группах и ее структура по степеням утраты трудоспособности.
У 21% пациентов доинсультная инвалидность была обусловлена СД 2 типа (СД-2), 30,9% — ранее перенесли МИ, у 48,1% — основанием послужили изолированные или сочетанные формы сердечнососудистой патологии. 19,3% больных острым МИ имели в анамнезе ИМ, 26,5% — мерцательную аритмию (МА); 28,4% — ИБС с явлениями стенокардии. У 61,3% больных диагностирован кардиосклероз; у 94,5% — АГ. Таким образом, у 97% больных фоном для возникновения МИ послужила СК, данные о нозологической структуре которой представлены в таблице 1. Тяжелая СК (сочетание АГ, ИБС, МА, СД) наблюдалась при повторном МИ в 3,58 раза чаще, чем при первичном (p<0,05), приводя к росту 6-месячной постинсультной летальности с 14,3% до 21,4%.
Таблица 1
Сосудистая коморбидность у больных МИ
| Фоновые заболевания у больных с инсультом | % |
| АГ | 94,5 |
| ИБС, кардиосклероз | 61,3 |
| МА | 26,5 |
| Стенокардия | 24,8 |
| МИ в анамнезе | 23,3 |
| СД | 22,3 |
| ИМ (ПИКС) | 19,3 |
| АГ+ИБС | 59,8 |
| АГ+МА | 25,8 |
| АГ+ИБС+МА | 24,8 |
| АГ+СД | 21,5 |
| АГ+ПИКС | 18,0 |
| АГ+ИБС+МА+СД | 5,8 |
| АГ+ИБС+Стенокардия+ПИКС+МА | 3,3 |
| АГ+ИБС+Стенокардия+ПИКС+МА+СД | 1,8 |
| Нет фоновой сосудистой патологии | 3,0 |
Анализ временных интервалов от момента установления группы инвалидности до развития МИ показал тенденцию к сокращению по мере роста тяжести инвалидизации, составляя у 50 % больных с 1-й группой 1 год, у 39,7% со 2-й — 3-5, а у 42,2% с 3-й группой — 7-9 лет. У пациентов с СК наиболее неблагоприятным клиническим маркером возникновения, тяжелого течения и плохого функционального исхода МИ было наличие СД и сочетания СД с АГ и МА, что согласуется с результатами других исследований [9, 10]. Такой уровень коморбидности, увеличив доинсультную инвалидизацию с 40% до 61,8%, снижал долю больных с хорошим функциональным исходом с 40,5% до 21,0% и в 1,65 раза повышал 6-месячную летальность (p<0,01). Среди пациентов без инвалидности к моменту госпитализации частота легкого МИ (<11 баллов по NIH) составила 68,0%, у имевших 3 группу — 64,7%, 2-ю — 53,4%, 1-ю — 48,1% (р<0,05); число больных с тяжелым МИ (>21 балла по NIH) увеличивалось пропорционально тяжести доинсультной инвалидизации.
У больных острым МИ был выявлен дисбаланс течения СРП, тяжесть которого достоверно и прогрессивно нарастала при наличии различных форм СК (таблица 2).
Таблица 2
Показатели СРП у больных инсультом с различными формами сосудистой коморбидности
| |
Норма (n=33) |
ЦВБ (n=308) |
ЦВБ+ИБС (n=84) | ЦВБ+ПИКС (n=22) |
ЦВБ+МА (n=31) |
ЦВБ+СД (n=136) |
| ПИХЛс, | 435,8±32,5 | 716,2±93,4 | 1106,7±107,3 | 1114,5±202,4 | 888,5±171,5 | 1280,9±191,8 |
| мВ/сек х 106 лейкоцитов | 469,90 | 530,5 | 838,75 | 881,4 | 598,80 | 1023,8 |
| р | | 0,064 | 0,006* | 0,048* | 0,458 | 0,007* |
| АПА | 4,06±0,22 | 3,39±0,19 | 3,46±0,15 | 2,92±0,24 | 3,5±0,3 | 3,54±0,32 |
| | 3,64 | 3,07 | 2,61 | 2,58 | 3,02 | 3,44 |
| р | | 0,004* | 0,033* | 0,024* | 0,151 | 0,208 |
| МДА мкмоль/л | 2,92±0,17 | 3,59±0,24 | 3,8±0,42 | 3,82±0,28 | 3,28±0,19 | 3,37±0,27 |
| | 2,75 | 3,49 | 3,78 | 3,93 | 3,33 | 3,29 |
| р | | 0,096 | 0,164 | 0,002* | 0,016* | 0,025* |
Примечание: результаты представлены в виде: первая строка (М±m) — среднее значение ± стандартная ошибка средней; вторая строка (Me) — медиана, * p<0,05 — достоверное отличие показателя от нормы (критерий Манна-Уитни).
У больных ишемическим инсультом МДА был повышен в 1,27 раза, АПА снижена в 1,07 раза. При геморрагическом инсульте ПИХЛс был повышен в 1,42 раза, МДА в 1,36 раз, АПА снижена в 1,15 раза. Рост МДА к 5 сут. (r=0,565; р<0,05), ПИХЛс на 1 (r=-0,349; р<0,05) и 10 сут. (r=-0,501; р<0,05) коррелировал с риском геморрагической трансформации при ишемическом инсульте. С ростом очага ишемии в период с 1 по 5 сут. МИ коррелировал низкий уровень АПА (r=-0,512; р<0,05) и повышенный МДА (r=0,601; р<0,05) на 1 сут. Следовательно, показатели СРП являются ранними маркерами морфологической динамики МИ. В основе формирования дезадаптационного типа реакций и прогрессирования тяжести как самого МИ, так и сопутствующей кардиальной и эндокринной патологии, лежит постепенное смещение вектора СРП-дисбаланса с кислородного на перекисный этап со снижением АПА и повышением МДА. Уровни критических значений МДА, свидетельствующие о неблагоприятном прогнозе, составляют 6,39 мкмоль/л, а АПА — 5,87 при ишемическом; 5,41 мкмоль/л и 6,09 — при геморрагическом МИ, соответственно. Присоединение различных форм СК служило дополнительным вкладом в рост СРП-дисбаланса. При ИБС выявлено нарастание депрессии АПА плазмы в 1,19 раз (p<0,05). У пациентов с постинфарктным кардиосклерозом (ПИКС) было обнаружено снижение АПА в 1,2 раза по сравнению с пациентами с ЦВБ без ИМ в анамнезе (p<0,05). У пациентов с ПИКС выявлены статистически значимые различия по ПИХЛб, МДА и АПА по сравнению со здоровыми донорами и с пациентами без ИМ в анамнезе. МДА был повышен у них в 1,29 раз (p<0,05). Активные формы кислорода, воздействуя на кардиомиоциты, могут приводить к ремоделированию миокарда и ухудшению его сократительной функции. Было изучено состояние СРП при МИ, развившемся на фоне МА. Выявлен дисбаланс кислородных этапов СРП в виде уменьшения ПИХЛб у пациентов с МА по сравнению с пациентами без МА в 1,23 раза (p<0,05). У больных МА уже на 1 сут. МИ зарегистрировано значимое различие по показателю АПА (в 1,9 раза; p<0,05). Различия уровней СРП выявлены также у пациентов с и без СД. ПИХЛс при наличии СД был выше в 2,94 раза по сравнению с нормой (p<0,05) и в 1,47 раз по сравнению с пациентами без СД (p<0,05). Показатель АПА был в 1,11 раз ниже у больных СД (p<0,05), причем на 1 сут. МИ АПА была ниже нормы у 29,2% пациентов без СД и у 37,5% с СД. Таким образом, нарастание уровней СР-дисбаланса, на фоне различных форм СК, ведет к формированию тяжелого энергозависимого тканевого апоптоза и некроза, предопределяя тяжесть течения МИ.
Максимально раннее включение энергокорректоров (сукцинатов), обладающих выраженным влиянием на течение СРП, в комплексную терапию острого МИ, в т.ч. развившегося на фоне СК, улучшают результаты лечения, увеличивая долю больных с хорошим функциональным исходом (рисунок 2).
Рис. 2 Динамика функциональных исходов МИ на фоне энергокоррегирующей терапии.
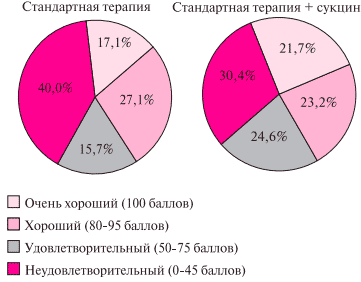
Максимально эффективной антиокислительная терапия была при тяжелом и среднетяжелом МИ, наибольшее число которых приходилось на больных с СК, на фоне снижения уровня АПА<3 и повышения МДА>4 мкмоль/л. Полученные результаты позволяют согласиться с мнением, полученным в ходе других исследований [11, 12], и рассматривать эти параметры как биохимические показания для назначения энергокорректоров у пациентов с острой церебральной и сопутствующей кардиальной патологией.
Одним из эффективных энергокорректоров, применявшихся в настоящем исследовании, был мексидол (Мексидол®, ФАРМАСОФТ НПК ООО, Россия), относящийся к антиокислителям из группы сукцинатов, обладающий широким спектром воздействия на различные механизмы регуляции метаболической активности клеток, уменьшая активацию ПОЛ и повышая активность эндогенной антиокислительной системы (АОС) организма. Мексидол улучшает и стабилизирует мозговой метаболизм за счет коррекции расстройств микроциркуляции (МЦ), улучшает реологию крови и подавляет агрегацию тромбоцитов. Препарат активизирует внутриклеточный синтез белка и нуклеиновых кислот, ферментативные процессы цикла Кребса, способствует синтезу и внутриклеточному накоплению аденозинтрифосфата (АТФ), дефицит которого в условиях ишемии и гипоксии является пусковым механизмом патоморфологических изменений в клетках мозга. Препарат назначался в дозе 250-500 мг (5-10 мл) внутривенно (в/в) струйно или капельно, 1-2 раза в сут. в течение 10 сут. Эффективность препарата была подтверждена при проведении электроэнцефалографических (ЭЭГ) исследований, при которых выявлено улучшение функциональной активности мозга по данным ЭЭГ и КСА ЭЭГ. На основании оценки тяжести СРП-дисбаланса на различных его этапах были разработаны клинико-лабораторные показания для назначения высокодозовой энергокоррегирующей терапии больным МИ, отягощенным СК (рисунок 3).
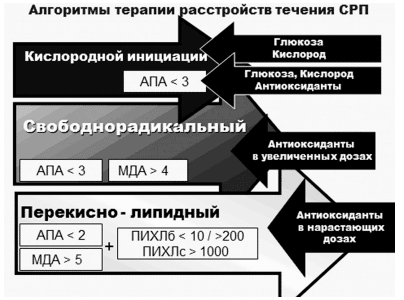
Рис. 3 Алгоритмы энергокоррегирующей терапии с использованием параметров СРП.
К таким показаниям относятся: снижение АПА <3 и повышение МДА >4 мкмоль/л. Для повышения эффективности энергокоррегирующей терапии сукцинатами предварительно проводилась оксигенотерапия, усиления фармакокинетики добивались в/в медленным введением теплого 5-10% раствора глюкозы или физиологического раствора с увеличением дозы пропорционально тяжести больных.
Заключение
У 97% пациентов с МИ выявлено наличие сосудистой коморбидности, приведшей в 45,3% к назначению группы инвалидности еще до развития МИ. Обнаружены статистически значимые различия показателей СРП, характеризующих степени тканевого энергодефицита у пациентов с различной соматической отягощенностью (ИБС, ИМ, МА, СД), разработаны показания и эффективные алгоритмы энергокоррегирующей терапии. Анализ доинсультной инвалидизации и выявленная неудовлетворительная профилактика повторных сосудистых событий (острого МИ), у пациентов с сосудистым (кардиальным) анамнезом, делает необходимой более активную реализацию в клинической практике современных сердечно-сосудистых программ профилактики заболеваний.
[Румянцева С. А.1,4 (*контактное лицо) - 1профессор кафедры неврологии ФУВ, Оганов Р. Г2 - руководитель отдела, Силина Е. В.3,5 - 3доцент кафедры патологии человека ФППО врачей, 5научный консультант, Ступин В. А. 1,4 - 1заведующий кафедрой госпитальной хирургии № 1 лечебного факультета, Болевич С. Б.3 - заведующий кафедрой патологии человека ФППО врачей, Свищева С. П.6 - заведующая 9 неврологическим отделением милосердия, Орлова А. С.3 - аспирант кафедры патологии человека ФППО врачей, Комаров А. Н.5 - главный врач, Орлов В. А.3 -аспирант кафедры патологии человека ФППО врачей, Аброськина О. В.3 - начальник отдела аспирантуры и докторантуры, Елисеев Е. В.4 - заведующий нейрореанимационным отделением, Сохова О. А.7 - невролог, Богатырева М. Д.8 - руководитель].
ЛИТЕРАТУРА
1. Oganov RG. Cardiology. Moscow: Medical Book 2006; 678 p. Russian (Оганов Р.Г. Кардиология. М.: Медицинская книга 2006; 678 с).
2. Gusev EI, Skvortsovа VI, Stakhovskaya LV. Stroke in the Russian Federation: the time of active joint action. J Neurology and Psychiatry S.S.Korsakov 2007; 8: 4-10. Russian (Гусев Е.И., Скворцова В.И., Стаховская Л.В. Проблема инсульта в Российской Федерации: время активных совместных действий. Ж неврол психиат им. С.С. Корсакова 2007; 8: 4-10).
3. Vereshchagin NV, Suslina ZA, Boldyrev AA, et al. Essays angioneurology / Under. Ed. Suslina Z.A. Moscow: Atmosphera 2005; 368 p. Russian (Верещагин Н.В., Суслина З.А, Болдырев А.А. и др. Очерки ангионеврологии. Под ред. Суслиной З.А. М.: Атмосфера 2005; 368 с).
4. Rumyantsevа SA, Stupin VA, Afanasiev VV, et al. Algorithms and therapies of diseases commonly encountered in clinical practice. Moscow: Medical Book, 2012. - 336. Russian (Румянцева С.А., Ступин В.А., Афанасьев В.В. и др. Алгоритмы и схемы терапии заболеваний, часто встречающихся в клинической практике. М.: Медицинская книга 2012; 336 с).
5. Allen CL, Bayraktutan U. Oxidative stress and its role in the pathogenesis of ischaemic stroke. Int J Stroke 2009; 4(6): 461-70.
6. Newman EJ, Rahman FS, Lees KR. Elevated serum urate concentration independently predicts poor outcome following stroke in patients with diabetes. Diabetes Metab Res Rev 2006; 22: 79-82.
7. Silina EV, Rumyantsevа SA, Bolevich SB. Laws and other free radical processes and flow prediction of ischemic and hemorrhagic stroke. J Neurology and Psychiatry S.S. Korsakov 2011; 12 (2): 36-42. Russian (Силина Е.В., Румянцева С.А., Болевич С.Б. и др. Закономерности течения свободнорадикальных процессов и прогноз ишемического и геморрагического инсульта. Ж неврол психиат им. С.С. Корсакова 2011; 12 (2): 36-42).
8. Rumyantsevа SA, Stupin VA, Afanas’ev VV, Silina EV. Critical care in clinical practice. Moscow: MedicalBook 2011; 613 p. Russian (Румянцева С.А., Ступин В.А., Афанасьев В.В., Силина Е.В. Критические состояния в клинической практике. М.: МИГ «Медицинская книга» 2011; 613 с).
9. Parfenov VA, Verbitskaya SV. New opportunities for prevention of stroke in atrial fibrillation. Medical Educationand Professional Development 2012; 1: 36-42. Russian (Парфенов В.А., Вербицкая С.В. Новые возможности профилактики инсульта при фибрилляции предсердии. Медицинское образование и профессиональное развитие 2012; 1: 36-42).
10. Gentile NT, Seftchick MW, Huynh T. Decreased mortality by normalizing blood glucose after acute ischemic stroke. Acad Emerg Med 2006; 13: 174-80.
11. Bagchi D, Sen CK, Ray SD, et al. Molecular mechanisms of cardioprotection by a novel grape seed proanthocyanidin extract. Mutat Res 2003; 523: 87-97.
12. Lankin VZ, Tihaze AK, Belenkov YN. Antioxidants in the treatment of atherosclerosis: pro et contra. Cardiology 2004; 2: 72-8. Russian (Ланкин В.З., Тихазе А.К., Беленков Ю.Н. Антиоксиданты в комплексной терапии атеросклероза: pro et contra. Кардиология 2004; 2: 72-8).
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 pharmasoft.ru
pharmasoft.ru
 pharmasoft.ru
pharmasoft.ru
