Кафедра общей хирургии лечебного факультета Российского государственного медицинского университета, Москва
Лечение острого панкреатита (ОП) - одна из наиболее важных проблем экстренной абдоминальной хирургии. Это обусловлено тем, что в последние 20- 30 лет отмечается рост числа больных ОП с 1-2 до 10-11% среди всех больных с острыми хирургическими заболеваниями органов брюшной полости, увеличение частоты деструктивных форм ОП до 27,3- 58,3% и летальности до 20-30% с возрастанием ее при деструкции поджелудочной железы (ПЖ) и инфицированных формах панкреатита до 50-80% [4]. Тяжелый ОП, несмотря на большое число исследований, успехи диагностики и интенсивной терапии, стандартизации способов хирургических операций, внедрение миниинвазивных хирургических методов, остается грозным заболеванием и большого прогресса в улучшении результатов его лечения не наблюдается. На протяжении последних 30-40 лет летальность при ОП сохраняется на одном уровне [8]. Наиболее часто ОП болеют люди молодого и среднего, т.е. трудоспособного, возраста, а среди пациентов, перенесших тяжелый ОП, 50-70% становятся инвалидами. Это свидетельствует о большой социально-экономической значимости проблемы [6].
С этиопатогенетической точки зрения ОП рассматривают наиболее часто как заболевание, основой которого является агрессия ферментативной природы [9]. Внутриацинарная активация панкреатических ферментов и развитие феномена "уклонения ферментов в кровь" сопровождается снижением энергетической эффективности окислительных процессов, повышением скорости перекисного окисления липидов и недостаточностью антиоксидантной защиты (АОЗ) [1]. Полагают, что ведущая роль в патогенезе острого панкреатита принадлежит окислительному стрессу, суть которого заключается в усилении свободнорадикальных процессов в условиях острой локальной гипоксии [2]. При этом находящиеся в неактивном состоянии внутри панкреатоцитов протеолитические и липолитические ферменты могут непосредственно в клетках или при выходе из них подвергаться атаке активных форм кислорода и переходить в активную форму. Последующее поддержание перекисного окисления липидов на уровне, значительно более высоком, чем в норме, обеспечивают сохраняющиеся в связи с интерстициальным отеком гипоксия ткани ПЖ, а также депрессия АОЗ [3].
Гипоксия смешанного генеза вследствие разобщения дыхания и окислительного фосфолирирования в митохондриях и усиления гликолитических процессов способствует развитию недостаточности энергопродуцирующих систем и дальнейшей активации процессов перекисного окисления липидов, что приводит к глубокому истощению АОЗ [5].
В связи с этим своевременная коррекция возникаюших нарушений и профилактика декомпенсации системы АОЗ организма может служить одним из способов повышения эффективности проводимой терапии при ОП [7].
В последнее время перспективное развитие в восстановлении окислительного гомеостаза получила заместительная терапия с использованием мексидола, являющегося структурным аналогом соединений, играющих важную роль в жизнедеятельности организма в качестве физиологических антиоксидантов.
Материалом настоящей работы являются результаты обследования и лечения 108 больных ОП, находившихся в клинике общей хирургии лечебного факультета РГМУ на базе хирургического стационара ГКБ №13 в период с 1997 по 2003 г. С отечным панкреатитом было 13% пациентов и 87% - с деструктивными формами острого панкреатита. Диагноз ОП и его форм, а также его разнообразных осложнений верифицирован на основании рекомендаций 9-го Всероссийского съезда хирургов.
Критериями включения больных в исследование были: верифицированный диагноз ОП, информированное согласие пациента на применение препарата, возраст от 18 до 80 лет. Критериями исключения из исследования являлось наличие у больного наряду с острым панкреатитом острого инфаркта миокарда, острого нарушения мозгового кровообращения, наличие тяжелых нарушений системы гемостаза.
Кроме стандартной клинико-лабораторной схемы обследования, проводились балльная оценка тяжести состояния пациента и объема поражения ПЖ, брюшной полости и забрюшинного пространства с использованием интегральных шкал тяжести физиологического состояния (ТФС) и индекса поражения брюшной полости (ИПБП); определение концентрации и связывающей способности альбумина сыворотки крови с помощью флюоресцентного метода, определение уровня молекул средней массы в плазме крови и моче.
В соответствии с задачами исследования были сформированы основная и контрольная группы пациентов. Мексидол в комплекс лечебных мероприятий был включен у 54 больных, которые составили основную группу. Для оценки результатов лечения была сформирована контрольная группа - 54 пациента с аналогичными формами заболевания. При лечении больных основной и контрольной групп использовалась одинаковая медикаментозная терапия по стандартной схеме, соответствующая действующим в настоящее время стандартам оказания помощи больным с острым панкреатитом. Группы были разделены на четыре подгруппы в соответствии с ТФС, оцененной по балльной шкале (табл. 1).
Основная и контрольная группы были сопоставимы по полу, возрасту, времени, прошедшему от начала заболевания до поступления в стационар, формам ОП.
В основной и контрольной группах пациенты распределились также по подгруппам - в соответствии с тяжестью состояния (в баллах).
При тяжести состояния 0-3 балла (подгруппа 1) преобладали больные с преимущественно жировой формой ацинарной деструкции и мелкоочаговым поражением ткани поджелудочной железы.
У больных с тяжестью состояния 4-7 баллов (подгруппа 2) были представлены все формы ацинарной деструкции, преимущественно с мелкоочаговым и крупноочаговым поражением поджелудочной железы.
Больные с тяжестью состояния 8-11 баллов (подгруппа 3) характеризовались тяжелым течением заболевания с преобладанием смешанной и геморрагической форм ацинарной деструкции, тотальным и субтотальным поражением ткани поджелудочной железы.
У больных с показателем состояния 12 и более баллов (подгруппа 4) тяжесть течения заболевания была наиболее выраженной, с абсолютным преобладанием геморрагической формы ацинарной деструкции. У этих больных доминировал тотальный характер поражения ткани поджелудочной железы, острый некротический панкреатит протекал в крайне тяжелой форме, с развитием явлений панкреатогенного шока, распространенного панкреатогенного перитонита, гнойных осложнений, с поражением забрюшинной клетчатки, прогрессированием явлений эндогенной интоксикации и манифестацией синдрома полиорганной дисфункции.
Статистическая обработка материала производилась с помощью прикладной статистической программы БИОСТАТ, а также встроенного "пакета анализа" среды Microsoft Excel 97.
В связи с тем что курс лечения мексидолом во всех группах имел различную продолжительность в зависимости от тяжести течения заболевания, оценка результатов лечения осуществлялась на первые сутки после отмены препарата. Аналогичные сроки были взяты для исследования в контрольной группе больных острым панкреатитом, не получавших в схеме лечения мексидол. В подгруппах с тяжестью состояния 0-3 балла это были 6-е сутки, в подгруппах с 4-11 баллами соответственно 8-е, а с тяжестью 12 и более баллов - 11-е сутки.
Анализ показал, что эффективность терапии, включающей мексидол, оказалась существенно более высокой по сравнению с традиционной комплексной терапией. Мексидол, применяемый в комплексном лечении больных острым панкреатитом, обладает выраженным терапевтическим эффектом. Использование препарата позволяет быстро купировать клинические проявления острого панкреатита, при этом к концу курс лечения наступало выраженное улучшение общего состояния пациентов. Жалобы на боли, отрыжку, рвоту у больных основной группы в среднем исчезали на 5-10-е сутки от начала лечения, в то время как у больных контрольной группы - к 8-13-му дню.
Панкреатогенная токсемия является ведущей причиной глубоких патофизиологических сдвигов при остром панкреатите. Степень тяжести токсемического синдрома у больных острым панкреатитом тем выше, чем более выражен деструктивный процесс в поджелудочной железе.
Об уровне секреторной активности поджелудочной железы у пациентов анализируемых групп мы судили по динамике показателя амилолитической активности крови. В основной группе к концу курса лечения мексидолом отмечено значительное снижение среднего уровня энзимной токсемии (табл. 2). Установлено достоверное снижение уровня амилазы крови в 5-7 раз и амилазы мочи в 6-13 раз к 6-8-м суткам. В контрольной группе также отмечалось снижение уровня аналогичных показателей, однако оно было более умеренным по сравнению с основной группой (в 1,5-5,4 раза). У больных обеих групп с тяжестью физиологического состояния 12 и более баллов наблюдалась лабораторная картина токсической ферментопатии.
Примечание. Здесь и в табл. 3-8: * - достоверность отличия от показателей, регистрируемых до лечения (р<0,05); 1 - достоверность отличия от нормальных значений (р<0,05); 2 - достоверность отличия от показателей контрольной группы (р<0,05). div>
Следовательно, применение мексидола в сочетании с традиционной терапией позволяет эффективно воздействовать на панкреатогенную токсемию у больных острым панкреатитом.
Исходя из современных представлений косвенным показателем поражения поджелудочной железы может считаться глюкоземический профиль. Динамика показателя сахара крови была исследована у всех больных. В 48% наблюдений диагностирована гипергликемия. В обеих группах пациентов отмечены случаи сахарного диабета, преимущественно 2-го типа, их частота составила в среднем 16%. При поступлении в клинику больным, как правило, назначалась инсулинотерапия, которая в ряде наблюдений была малоэффективной.
Исследования динамики глюкоземического профиля показали, что после курса лечения мексидолом в основной группе отмечено снижение уровня сахара крови в более ранние сроки, чем в контрольной группе, что указывает на корригирующее воздействие препарата на углеводный обмен при остром панкреатите.
Влияние мексидола на выраженность синдрома эндогенной интоксикации при ОП
У пациентов ОП накопление в крови токсических метаболитов среднемолекулярной массы наряду с продуктами деструкции тканей и промежуточными метаболитами выше допустимых величин ведет к функциональной печеночно-почечной недостаточности, замыкая тем самым один из порочных кругов формирования эндогенной интоксикации.
Анализ уровня молекул средней массы (МСМ) у всех пациентов на момент поступления в клинику показал статистически достоверное увеличение их содержания в плазме крови и в моче.
В основной группе с тяжестью состояния пациентов 0-3 балла к концу курса лечения мексидолом произошло снижение уровня МСМ плазмы в 1,9 раза с полной нормализацией показателя, без последующего повышения. Тогда как в аналогичной контрольной подгруппе не только не произошло снижения уровня МСМ плазмы, но и отмечено некоторое его повышение: средние значения превышали норму в 2,5 раза (табл. 3).
Таблица 3. Динамика уровня МСМ плазмы
| Подгруппы | Изменение уровня МСМ плазмы, усл. ед. |
| основная группа | контрольная группа |
| до лечения | после лечения | до лечения | после лечения |
| 1-я | 0,49±0,021 2 | 0,26±0,02*2 | 0,57±0,031 | 0,63±0,041 |
| 2-я | 0,42±0,021 2 | 0,26±0,02*2 | 0,63±0,031 | 0,53±0,03*1 |
| 3-я | 0,45±0,041 | 0,31±0,03*2 | 0,41±0,021 | 0,55±0,04*1 |
| 4-я | 0,69±0,051 | 0,42±0,03*1 | 0,71±0,041 | 0,38±0,02*1 |
В основной группе больных с тяжестью состояния 4-7 баллов по окончании курса лечения мексидолом отмечено снижение среднего уровня МСМ плазмы в 1,6 раза с достижением уровня нормальных значений. В контрольной подгруппе отмечено снижение среднего уровня МСМ плазмы в 1,2 раза, который продолжал превышать нормальные значения в 2 раза. Такие повышенные значения показателя в контрольной подгруппе сохранялись на одном уровне длительный период времени без тенденции к снижению.
В подгруппах больных с тяжестью состояния 8-11 баллов не наблюдалось отчетливых положительных результатов. В основной группе отмечено снижение уровня МСМ плазмы в 1,5 раза, в контрольной - повышение в 1,3 раза. Такие результаты можно объяснить выраженной тяжестью течения патологического процесса у данной группы больных. Острый панкреатит у пациентов третьей подгруппы протекал с развитием панкреатогенного шока, распространенного перитонита и гнойных пара-панкреатических осложнений.
В подгруппах пациентов с тяжестью состояния 12 и более баллов к концу курса лечения отмечалось снижение уровня МСМ плазмы в 1,6 раза (в основной группе) и 1,9 раза (в контрольной).
Анализ динамики МСМ плазмы в контрольной и основной группах выявил различия в течении процесса во время и после окончания курса лечения мексидолом. Отмечено, что на фоне применения мексидола уменьшалась выраженность эндогенной интоксикации. Это подтверждалось тем, что у пациентов основной группы на протяжении всего курса лечения титр МСМ был ниже, чем в контрольной.
У больных ОП, как правило, начиная с первых суток заболевания наблюдался выраженный лейкоцитоз, который в последующем имел тенденцию к нарастанию. У всех пациентов установлен высокий уровень лейкоцитов крови в первые сутки нахождения в клинике - от 9,9х109/л до 25,9х109/л. При этом у 62% больных отмечено увеличение доли незрелых форм лейкоцитов выше 10%.
В основной группе с тяжестью состояния пациентов 0-3 балла к концу курса лечения мексидолом абсолютное количество лейкоцитов крови снизилось в 1,8 раза, при этом не отмечено ни одного случая с уровнем лейкоцитов выше 12x109/л или доли незрелых форм выше 10%. В контрольной группе изменения уровня лейкоцитов за период лечения не произошло и у 30% пациентов сохранялся значительный палочкоядерный сдвиг формулы крови (табл. 4).
Таблица 4. Динамика уровня лейкоцитов крови
| Подгруппы | Изменение уровня лекоцитов, Ч109/л |
| основная группа | контрольная группа |
| до лечения | после лечения | до лечения | после лечения |
| 1-я | 13,05 ± 1,87 1 | 7,15 ± 1,24 * | 10,24 ± 1,36 | 10,39 ± 1,85 |
| 2-я | 13,5 ± 1,73 1 | 8,08 ± 1,43 * | 12,54 ± 2,1 | 10,4 ± 1,78 |
| 3=я | 15,7 ± 1,99 1 | 10,45 ± 1,7 * | 11,6 ± 1,69 | 14,7 ± 2,11 1 |
| 4-я | 14,2 ± 1,47 1 | 9,5 ± 1,49 * | 12,2 ± 1,47 1 | 12,1 ± 1,17 1 |
В основной группе пациентов с 4-7 баллами по шкале ТФС, нормальный уровень лейкоцитов крови зарегистрирован уже на 5-е сутки лечения, к концу курса лечения мексидолом произошло снижение количества лейкоцитов в 1,7 раза. В этой группе только у одного пациента после курса лечения зарегистрирован сдвиг лейкоцитарной формулы крови влево до 12%. В контрольной группе на 8-е сутки наблюдалось снижение лейкоцитов в 1,2 раза, в дальнейшем без тенденции к снижению. У половины пациентов этой группы значения лейкоцитов крови на 8-е сутки были выше 12х109/л и у 40% сохранялась высокая доля незрелых форм лейкоцитов больше 10%.
В основной группе больных с тяжестью состояния 8-11 баллов на 8-е сутки отмечено снижение уровня лейкоцитов крови в 1,5 раза. Доля больных, имевших значительный палочкоядерный сдвиг формулы крови, к концу лечения уменьшилась в 2,5 раза. Тогда как в контрольной группе у больных с тяжестью состояния 8-11 баллов, наоборот, произошло увеличение среднего уровня лейкоцитов крови в 1,3 раза и существенных изменений формулы крови не отмечалось.
В основной группе пациентов с тяжестью состояния 12 и более баллов к концу курса лечения на 11-е сутки отмечено снижение средних значений показателя в 1,5 раза. Однако при этом у 4 пациентов зарегистрирована лейкопения (уровень лейкоцитов меньше 4х109/л), что является одним из неблагоприятных показателей проявления синдрома системной воспалительной реакции. В контрольной группе при тяжести состояния больных 12 и более баллов статистически значимых результатов по изменению абсолютного количества лейкоцитов крови не получено.
С учетом приведенных данных можно сделать вывод о противовоспалительном эффекте мексидола при лечении ОП. Применение мексидола позволяет быстрее купировать системные проявления синдрома системного воспаления у больных этой категории.
Влияние мексидола на функции печени и белков крови
Одним из решающих факторов, определяющих тяжесть течения и исход ОП, является выраженность функциональных нарушений печени. У ряда пациентов развивается токсический гепатит, нередко переходящий в токсическую дистрофию печени, влекущую за собой полиорганную недостаточность, что в свою очередь обусловливает неблагоприятные исходы заболевания.
С целью изучения функциональной недостаточности печени при ОП исследована динамика показателя билирубина плазмы крови (табл. 5).
Таблица 5. Динамика уровня билирубина
| Подгруппы | Изменение уровня билирубина, мкмоль/л |
| основная группа | контрольная группа |
| до лечения | после лечения | до лечения | после лечения |
| 1-я | 21,05 ± 4,25 | 9,8 ± 0,37 * 2 | 23,85 ± 4,04 | 20,2 ± 1,18 |
| 2-я | 77,02 ± 9,54 1 | 17,07 ± 3,09 * 2 | 103,5 ± 10,1 1 | 68,3 ± 9,29 * 1 |
| 3-я | 37,5 ± 5,57 1 | 14,26 ± 2,17 * | 32,1 ± 3,89 1 | 19,5 ± 3,48 * |
| 4-я | 83,1 ± 9,67 1 2 | 19,1 ± 3,37 * 2 | 28,7 ± 3,48 | 33,2 ± 2,83 1 |
У пациентов с тяжестью состояния 0-3 балла средний уровень билирубина при поступлении находился в пределах нормы и его повышения в ходе лечения не отмечалось.
В основной группе больных с тяжестью состояния 4-7 баллов по шкале ТФС к концу курса лечения мексидолом уровень билирубина снизился в 4,5 раза. В контрольной подгруппе происходило медленное изменение показателя и за аналогичный период времени лечения средние значения уровня билирубина снизились в 1,5 раза, при этом превышали норму в 3,3 раза.
В основной группе больных с тяжестью состояния 8-11 баллов к концу курса лечения мексидолом средний уровень билирубина снизился 2,6 раза. В контрольной подгруппе к концу лечения отмечено снижение значений показателя в 1,6 раза.
В основной группе пациентов с тяжестью состояния 12 и более баллов к концу лечения средний уровень билирубина снизился в 4,3 раза. В контрольной подгруппе к концу лечения уровень билирубина повысился в 1,2 раза. Полученные результаты свидетельствуют о благоприятном воздействии мексидола на функциональное состояние печени, на что указывает динамика уровня билирубина у пациентов основной группы.
В настоящее время ведущим биохимическими маркером токсического печеночного цитолиза является АлАТ. Анализ результатов применения мексидола выявил, что у большинства больных основной группы произошло достоверное снижение уровня АлАТ на 6-11-е сутки в 1,7-3 раза (табл. 6). В контрольной группе к этому сроку во многих наблюдениях не только не произошло изменений, но и было отмечено повышение уровня изучаемого показателя.
Таблица 6. Динамика уровня АлАТ
| Подгруппы | Изменение уровня АЛАТ, е/л |
| основная группа | контрольная группа |
| до лечения | после лечения | до лечения | после лечения |
| 1-я | 156 ± 18 1 | 60,2 ± 6 * 1 2 | 204 ± 19 1 | 148 ± 8 * 1 |
| 2-я | 301 ± 14 1 | 126 ± 17 * 1 2 | 225 ± 19 1 2 | 200 ± 12 1 |
| 3-я | 384 ± 14 1 | 126 ± 7 * 1 2 | 116 ± 8 1 2 | 155 ± 12 * 1 |
| 4-я | 358 ± 13 1 | 217 ± 10 * 1 | 496 ± 14 1 2 | 216,5 ± 16 * 1 |
Таким образом установлено, что использование в качестве гапатопротекторного средства мексидола выявило высокую эффективность корригирующего воздействия препарата при токсическом поражении печени у больных острым панкреатитом. В широкой клинической практике нет эффективных и доступных медикаментозных методов коррекции функционального состояния печени, поддерживающих на необходимом уровне ее защитные функции, а также повышающих детоксикационную способность печени.
В последние годы большое внимание клиницистов привлекает роль одного из основных белков плазмы альбумина в функции детоксикации и поддержании показателей гомеостаза. Альбумин является резервной системой депонирования токсинов, компонентом антиоксидантной защиты и регулятором протеолитической активности плазмы. При тяжелых эндотоксикозах, свойственных острому панкреатиту, происходит как снижение общей концентрации альбумина, так и изменение его физико-химических свойств. Это в свою очередь препятствует обмену токсинов между сосудистым руслом и тканями, снижает объем их транспорта к органам детоксикации. По современным представлениям динамика содержания альбумина в плазме крови является высокочувствительным маркером тяжести течения эндотоксикоза и заболевания в целом, а также высокоинформативным критерием прогноза исхода заболевания.
У большинства (92%) больных ОП на момент поступления в клинику отмечена достоверная гипопротеинемия со средними значениями общего белка 57±2,0 г/л, что было связано в том числе с нарушением альбуминсинтезирующей функции печени.
В основной группе пациентов с тяжестью состояния 0-3 балла после окончания курса лечения мексидолом отмечено повышение среднего уровня концентрации альбумина в 1,4 раза, тогда как в контрольной группе за аналогичный период произошло снижение исследуемого показателя в 1,2 раза (табл. 7).
Таблица 7. Динамика альбумина общей концентрации
| Подгруппы | Общая концентрация альбумина, г/л |
| основная группа | контрольная группа |
| до лечения | после лечения | до лечения | после лечения |
| 1-я | 39,2 ± 2,7 | 53,1 ± 2,6 * 2 | 42,8 ± 2,8 | 35,7 ± 2,6 * |
| 2-я | 38,6 ± 2,6 | 47,5 ± 2,9 * 2 | 41,1 ± 2,1 | 29,6 ± 2,5 * 1 |
| 3-я | 36,4 ± 2,5 | 41,4 ± 3,1 2 | 36,1 ± 2,5 | 26,9 ± 2,3 * 1 |
| 4-я | 23,7 ± 2,3 1 | 26,2 ± 2,8 1 | 23,9 ± 2,3 1 | 21,2 ± 1,6 1 |
В основной группе больных с 4-7 баллами по шкале ТФС к концу курса лечения отмечено повышение уровня концентрации альбумина в 1,2 раза. В контрольной группе к концу лечения, напротив, наблюдалось снижение уровня показателя в 1,4 раза.
В основной группе пациентов с тяжестью состояния 8-11 баллов к концу курса лечения мексидолом средние значения концентрации альбумина увеличились в 1,2 раза. В контрольной подгруппе за аналогичный период времени средний уровень исследуемого показателя уменьшился в 1,3 раза.
В подгруппах пациентов с 12 и более баллами по шкале ТФС существенных изменений уровня концентрации альбумина не было отмечено.
Таким образом, при лечении мексидолом отмечено повышение концентрации альбумина, что в свою очередь обусловливало повышение резерва связывания альбумина. Опосредованно при повышении белковообразовательной функции печени возрастает активность репаративных процессов в организме. Следует также отметить экономическую эффективность применения мексидола, так как в основной группе снизилось количество инфузий альбумина по сравнению с контрольной.
Клинические результаты использования мексидола в комплексном лечении ОП
В основной группе пациентов с тяжестью состояния 0-3 балла осложненное течение наблюдалось в 35% случаев (табл. 8). У больных этой подгруппы при проведении контрольного УЗИ на 6-е сутки от начала лечения мексидолом зафиксировано уменьшение размеров поджелудочной железы и неоднородности ее паренхимы, сглаженность контуров. 9 (64,3%) больных выписаны из стационара с выздоровлением на 10-14-е сутки. У 5 (36%) больных развились постнекротические панкреатогенные осложнения: перипанкреатический инфильтрат - у 2 (14%), абсцесс забрюшинного пространства - у 1 (8%), ложная киста хвоста поджелудочной железы - у 2 (14%). Положительная динамика в течении заболевания с отчетливым отграничением деструктивных процессов позволила ограничиться проведением миниинвазивных хирургических методов лечения. На 15-20-е сутки 3 (22%) больным были выполнены пункции и дренирование жидкостных образований под контролем УЗИ.
Таблица 8. Осложнения у больных основной и контрольной групп
| Показатель |
Частота осложнений, % |
| основная группа |
контрольная группа |
| 1 |
2 |
3 | 4 | 1 | 2 | 3 | 4 |
| Неосложненное течение | 65 | 82 | 42 | 8 | 43 | 19 | 0 | 0 |
| Осложненное течение | 35 | 18 | 58 | 92 | 57 | 81 | 100 | 100 |
| Перипанкреатический инфильтрат | 14 | 12 | 33 | | 29 | 50 | 25 | |
| Панкреатогенный абсцесс | 7 | | 25 | 25 | 7 | 19 | 17 | 8 |
| Псевдокиста поджелудочной железы | 14 | | | | 14 | | 8 | |
| Абактериальный асцит-перитонит | | | | 8 | 7 | 6 | | 42 |
| Гнойный перитонит | | | | 17 | | | 8 | 25 |
| Флегмона забрюшинного пространства | | 6 | | 17 | | 6 | 25 | 17 |
| Аррозивное кровотечение | | | | 17 | | | | 8 |
| Внутренний дегистивный свищ | | | | 8 | | | 17 | |
Примечание. 1, 2, 3, 4 - подгруппы больных.
В контрольной подгруппе пациентов с аналогичной тяжестью состояния осложненное течение заболевания имело место в 57% случаев. В этой подгруппе 6 (43%) больных были выписаны в среднем на 18-е сутки в удовлетворительном состоянии, без осложнений. По данным УЗИ, у 7 (50%) больных стабилизация деструктивных процессов наступила к 15-м суткам. У 1 (7%) больного как исход воспалительного процесса наблюдался абсцесс сальниковой сумки, который был дренирован под контролем УЗИ на 20-е стуки. У 2 (14%) больных на 20-е сутки были диагностированы ложные кисты головки и хвоста поджелудочной железы, последние были дренированы под контролем УЗИ. У 1 (7%) больного на 5-е сутки было произведено лапароскопическое дренирование брюшной полости по поводу развития ферментативного перитонита.
В основной группе больных с тяжестью состояния 4-7 балла по шкале ТФС осложненное течение заболевания наблюдалось в 18% случаев. В этой группе у 15 (94%) больных проведено консервативное лечение, они были выписаны из стационара в среднем на 19-е сутки с выздоровлением. У 2 (12%) из них при поступлении было отмечено наличие перипанкреатических инфильтратов, которые к концу лечения мексидолом, по данным УЗИ, не визуализировались. По поводу флегмоны забрюшинной клетчатки был оперирован 1 (6%) больной. Ему была произведена люмботомия, вскрытие полости гнойника и дренирование двумя встречными дренажами с последующим осуществлением проточной санации гнойного очага антисептическими растворами, подобранными в соответствии с чувствительностью к ним бактериальной микрофлоры. Послеоперационный период протекал гладко.
В контрольной подгруппе пациентов осложненное течение было зарегистрировано в 81% наблюдений. В среднем на 26-е сутки после консервативного лечения были выписаны из стационара 11 (69%) больных. У 8 (50%) из них в среднем на 5-е сутки базисной терапии отмечено осложненное течение заболевания с развитием перипанкреатического инфильтрата. На стадии гнойных осложнений были оперированы 5 (31%) больных. У 3 (19%) больных наблюдалось развитие абсцессов хвоста поджелудочной железы, у 1 (6%) больной развилась флегмона забрюшинного пространства. У 1 (6%) больной на 5-е сутки пребывания в стационаре развилась клиническая картина ферментативного перитонита, по поводу которого была произведена санационная лапароскопия с дренированием сальниковой сумки и брюшной полости.
В основной подгруппе пациентов с тяжестью состояния 8-11 баллов осложненное течение заболевания отмечено в 58% случаев. В данной подгруппе 8 (67%) больных были выписаны из стационара в среднем на 33-е сутки, после консервативного лечения без развития панкреатогенных осложнений. У 4 (33%) больных отмечено осложненное течение заболевания - развитие перипанкреатических инфильтратов, которые имели абортивное течение на фоне лечения мексидолом к 15-20-м суткам. У 3 (25%) больных на 15-е сутки наблюдалось развитие абсцесса хвоста поджелудочной железы и множественных абсцессов забрюшинного пространства. Больным были произведены люмботомии со вскрытием и дренированием гнойных полостей, с установкой проточно-промывной системы. Послеоперационный период протекал гладко.
В контрольной подгруппе осложненное течение заболевания наблюдалось в 100% случаев. В 1 (8%) наблюдении зарегистрирован летальный исход в послеоперационном периоде, на фоне прогрессирующего синдрома эндогенной интоксикации с развитием полиорганной недостаточности. У 3 (25%) больных этой подгруппы наблюдалось развитие перипанкреатических инфильтратов в среднем на 12-е сутки. Эти пациенты получали консервативное лечение с положительным эффектом и были выписаны в среднем на 46-е сутки. Осложнения в виде абсцесса хвоста поджелудочной железы были выявлены у 2 (17%) больных на 18-е сутки пребывания в стационаре. Этим пациентам были произведены люмботомии с санацией и дренированием полости абсцесса. У 1 (8%) больного на 15-е сутки выявлена ложная киста головки поджелудочной железы, которая была дренирована под контролем УЗИ. В ранние сроки заболевания 1 (8%) больному было выполнено оперативное вмешательство (лапаротомия, санация и дренирование брюшной полости, секвестрэктомия, санация и дренирование сальниковой сумки) в связи с развитием распространенного перитонита на фоне прогрессирования некротических процессов в поджелудочной железе и нарастания эндогенной интоксикации. У 2 (16%) больных на стадии поздних гнойных осложнений выявлены внутренние дигестивные свищи, которые закрылись самостоятельно. У 2 (16%) больных этой подгруппы на стадии ранних гнойных осложнений как исход воспалительного процесса были флегмоны забрюшинного пространства. Этим пациентам произведены люмботомии с вскрытием и дренированием гнойных полостей.
В основной группе больных с тяжестью состояния 12 и более баллов осложненное течение заболевания наблюдалось в 92% случаев. У 1 (9%) пациента отмечен абсцесс сальниковой сумки, а в последующем образование оментогастрального свища. У 2 (18%) больных возникли флегмоны забрюшинного пространства, в связи с чем больным были выполнены люмботомии с санацией и дренированием гнойных полостей. Еще у 2 (18%) пациентов на 12-е сутки после операции выявлены абсцессы различной локализации, которые были вскрыты и дренированы. У всех больных с благоприятным исходом заболевания,(несмотря на развившиеся осложнения, отмечено улучшение общего состояния, исчезновение болевого синдрома в среднем к 8-м суткам от начала применения мексидола. Летальные исходы в данной подгруппе отмечены в 7 (58%) наблюдениях: 3 (28%) умерли на высоте развития панкреатогенного шока в ранние сроки заболевания; 2 (18%) - в раннем послеоперационном периоде на стадии развития панкреатогенного шока с развитием ДВС-синдрома и аррозивного кровотечения и 2 (18%) умерли на стадии развития гнойных осложнений. Во всех случаях причиной смерти были прогрессирующий эндотоксикоз и синдром полиорганной недостаточности. Диагнозы подтверждены при патологоанатомическом исследовании.
В контрольной подгруппе, несмотря на проводимое комплексное лечение, заболевание у всех больных закончилось летальным исходом. В раннем послеоперационном периоде на высоте развития панкреатогенного шока умерли 8 (67%) больных. На стадии развития гнойных осложнений 4 (33%) летальных исхода наступили вследствие прогрессирующего синдрома эндогенной интоксикации с развитием функциональных полиорганных нарушений, что подтверждено результатами аутопсии.
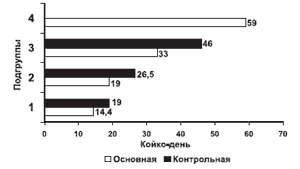
Таким образом, включение мексидола в комплекс лечебных мероприятий при остром панкреатите позволяет ускорить стабилизацию деструктивных процессов в поджелудочной железе, достигнуть быстрого отграничения воспалительного процесса в окружающих тканях, что в свою очередь позволяет снизить число обширных хирургических вмешательств. Количество обширных лапаротомий в основной группе сократилось в 2,2 раза по сравнению с контрольной группой. Последнее обстоятельство в свою очередь влияет на уровень летальности при данном заболевании (рис. 1). Произошло снижение госпитальной летальности среди больных основной группы с острым панкреатитом в 1,8 раза по сравнению с группой больных, получавших стандартный лечебный комплекс. К непосредственным результатам лечения следует также отнести снижение сроков госпитализации в среднем на 25 койко-дней среди больных с благоприятным исходом (рис. 2).
Рис. 1. Летальность в группах больных с ОП.
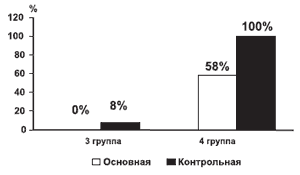
Рис. 2. Длительность стационарного лечения среди больных с благоприятным исходом ОП.
Таким образом, нами получены данные, свидетельствующие об отчетливом благоприятном действии мексидола на динамику местного патологического процесса не только в ткани поджелудочной железы, но и в парапанкреатической зоне и брюшной полости с более быстрым снижением объема поражения при некротическом панкреатите. В контрольной группе на фоне проводимого комплексного лечения в те же сроки у ряда больных отмечено прогрессирование патологического процесса в брюшной полости.
Проведенные исследования показали, что использование препаратов группы производных 3-оксипиридина в комплексе лечебных мероприятий при остром панкреатите является патогенетически обоснованным, так как позволяет в короткие сроки купировать метаболические нарушения и проявления эндогенной интоксикации, предупредить прогрессирование полиорганной недостаточности и за счет этого улучшить результаты лечения больных.
Мексидол может быть рекомендован для включения в комплексную терапию ОП при любом варианте и тяжести течения этого заболевания.
Таким образом, применение препарата мексидол в комплексной терапии ОП позволяет замедлить деструктивные процессы в ПЖ, способствует более быстрому отграничению воспалительного процесса, ускоряет сроки купирования ферментной токсемии и гипергликемии.
Мексидол обладает гепатопротекторным действием, что позволяет купировать проявления печеночного цитолиза, функциональной недостаточности гепатоцитов и метаболических нарушений у больных с ОП.
Применение препарата мексидол в комплексном лечении ОП позволяет эффективно снизить уровень токсических среднемолекулярных соединений, повысить резерв связывания альбумина, что приводит к более быстрому купированию явлений эндогенной интоксикации у пациентов.
Разработанные схемы применения мексидола в комплексной терапии имеют высокую эффективность у большинства больных ОП, однако они не могут существенно изменить течение заболевания у пациентов с необратимыми декомпенсированными системными нарушениями.
Использование препарата мексидол в комплексной терапии ОП позволяет достигнуть существенного снижения частоты осложнений, количества обширных оперативных вмешательств, летальности, а также значительно снизить сроки госпитализации больных острым панкреатитом.
Мексидол может быть рекомендован для широкого применения в клинической практике как препарат, снижающий риск неблагоприятного исхода ОП.
Назначать препарат необходимо в первые сутки начала патогенетического лечения. Вводимые дозы зависят от формы и тяжести острого панкреатита, распространенности процесса, вариантов клинического течения.
Рекомендуемые схемы лечения
1. Острый отечный (интерстициальный) панкреатит - мексидол 100 мг 3 раза в день.
2. Легкая степень тяжести (ТФС 0-3 балла) некротического панкреатита - мексидол 100-200 мг 3 раза в день.
3. Средняя степень тяжести (ТФС 4-7 баллов) некротического панкреатита - мексидол 200 мг 3 раза в день.
4. Тяжелое течение некротического панкреатита (ТФС 8-11 баллов) - мексидол в пульс-дозировке 1000 мг в первые сутки при двукратном режиме введения; далее по 300 мг 3 раза в день с постепенным снижением суточной дозы.
5. Крайне тяжелое течение некротического панкреатита (ТФС 12 и более баллов) - мексидол в стартовой дозировке 1000 мг/сут до стойкого купирования проявлений панкреатогенного шока, по стабилизации состояния по 300-400 мг 3 раза в день с постепенным снижением суточной дозировки.
Отмена препарата должна производиться постепенно, только после достижения устойчивого положительного клинико-лабораторного эффекта.
Препарат, разведенный в 400,0 мл 0,89% раствора хлорида натрия, следует вводить ежедневно. Больным с тяжестью состояния 0-3 балла возможно внутримышечное введение препарата. Пациентам с тяжестью состояния 4 балла и более предпочтительно введение препарата внутривенно капельно, это позволит быстрее купировать явления острого панкреатита.
ЛИТЕРАТУРА
1. Винник Ю.С., Петрушко С.И., Якимов С.В. Прогнозирование течения и исхода острого панкреатита с помощью нейронных сетей. Всероссийский съезд хирургов, 9-й% Материалы. Волгоград 2000; 23-24.
2. Гостищев В.К., Глушко В.А. Панкреонекроз и его осложнения, основные принципы хирургического лечения. Хирургия 2003; 3: 50-54.
3. Ермолов А.С., Титова Г.П., Гришин А.В. Анализ летальности при остром панкреатите. Городская научно-практическая конференция "Анализ летальности при остром панкреатите по материалам стационаров г. Москвы": Материалы. М: НИИ СП 2001; 17-21.
4. Затевахин И.И., Цициашвили М.Ш., Будурова М.Д. Оценка объема органных и внеорганных поражений при остром деструктивном панкреатите и ее влияние на летальность. Анн хир 2002; 1: 35-42.
5. Нестеренко Ю.А., Лаптев В.В., Михайлусов С.В. и др. Лечение панкреонекроза. Рос мед журн 2002; 1: 4-9.
6. Савельев B.C., Филимонов М.И., Гельфанд Б.Р. и др. Деструктивный панкреатит: алгоритм диагностики и лечения (проект по материалам IX Всероссийского съезда хирургов, 20-22 сентября 2000 г., Волгоград). Consilium Medicum 2001; 3: 6: 273-279.
7. Ступин И.В., Егиев В.Н. и др. Моделирование острого панкреатита. Клин хир 1989; 11: 24-26.
8. Филимонов М.И., Гельфанд Б.Р., Бурневич С.З. и др. Острый панкреатит. Под ред. В.С. Савельева . М: НЦССХРАМН 2000; 60.
9. Чадаев А.П., Буткевич А.Ц., Свиридов С.В. и др. Белки плазмы крови у больных панкреонекрозом. Хирургия 2004; 7: 15-19.
 pharmasoft.ru
pharmasoft.ru
 pharmasoft.ru
pharmasoft.ru
