Изучение влияния этилметилгидроксипиридина сукцината на эффективность нестероидных противовоспалительных препаратов при висцеральной и соматической боли в эксперименте на мышах и крысах
СтатьиЕ.А. Иванова, А.Г. Васильчук, А.И. Матюшкин, Т.А. Воронина
ФГБНУ «НИИ фармакологии им. В.В. Закусова», Москва, Россия
Резюме
Цель исследования. Изучить влияние этилметилгидроксипиридина сукцината (ЭМГПС) на противоболевой эффект неселективного ингибитора циклооксигеназы (ЦОГ) диклофенака натрия и селективного ингибитора ЦОГ-2 эторикоксиба на моделях острой висцеральной и соматической боли и оценить возможность применения ЭМГПС в комбинации с ингибиторами ЦОГ для снижения их доз с сохранением противоболевой эффективности.
Материал и методы. Изучено влияние ЭМГПС при однократном пероральном введении на противоболевые эффекты нестероидных противовоспалительных препаратов (НПВП): неселективного ингибитора ЦОГ диклофенака натрия и селективного ингибитора ЦОГ-2 эторикоксиба — на моделях острой висцеральной (тест «уксусные корчи») и соматической боли (формалиновый тест и тест механической гипералгезии при воспалении) в эксперименте на мышах и крысах.
Результаты. На модели острой висцеральной боли у мышей ЭМГПС (25—100 мг/кг) не оказывает значимого влияния на ее выраженность, но усиливает противоболевой эффект диклофенака натрия (0,5 мг/кг) и эторикоксиба (1 мг/кг). В формалиновом тесте у крыс, моделирующем боль при операционных разрезах (травма), ЭМГПС (25 мг/кг) повышает выраженность противоболевого действия ингибиторов ЦОГ (1 мг/кг) прежде всего за счет снижения боли в острую фазу, обусловленную действием формалина на афферентные нейроны. На модели механической гипералгезии у крыс, вызванной экссудативным воспалением после инъекции раствора каррагинана в лапу, ЭМГПС усиливает в большей степени эффект диклофенака, чем эторикоксиба.
Заключение. Полученные данные свидетельствуют о целесообразности клинического исследования применения ЭМГПС в комбинации с НПВП при висцеральной и соматической боли с целью оценки его способности повышать лечебный эффект НПВП.
Ключевые слова: этилметилгидроксипиридина сукцинат, нестероидные противовоспалительные препараты, висцеральная боль, соматическая боль, мыши, крысы.
Информация об авторах:
Иванова Е.А. — https://orcid.org/0000-0003-4961-2051
Васильчук А.Г. — https://orcid.org/0000-0002-9079-1322
Матюшкин А.И. — https://orcid.org/0000-0001-7640-0551
Воронина Т.А. — https://orcid.org/0000-0001-7065-469X
Автор, ответственный за переписку: Иванова Е.А. — e-mail: iwanowaea@yandex.ru
Как цитировать: Иванова Е.А., Васильчук А.Г., Матюшкин А.И., Воронина Т.А. Изучение влияния этилметилгидроксипиридина сукцината на эффективность нестероидных противовоспалительных препаратов при висцеральной и соматической боли в эксперименте на мышах и крысах. Журнал неврологии и психиатрии им. С.С. Корсакова. 2023;123(12):1—9. doi.org/10.17116/jnevro20231231211
Одними из основных средств фармакотерапии острой боли при широком спектре патологических состояний являются нестероидные противовоспалительные препараты (НПВП), общий механизм действия которых — ингибирование циклооксигеназы (ЦОГ) с последующим снижением повышенного при воспалении или повреждении ткани уровня простагландинов, за счет чего НПВП оказывают обезболивающий, противовоспалительный и жаропонижающий эффекты. Однако их прием сопровождается нежелательными явлениями (НЯ), обусловленными периферическим действием препаратов. Прежде всего это НЯ со стороны желудочно-кишечного тракта (ЖКТ), сердечно-сосудистой системы, НПВП-ассоциированные нефропатии, гепатотоксичность [1]. НПВП способны ускорить дегенерацию хряща, поэтому, облегчая хроническую ноцицептивную боль при остеоартрите, они могут негативно влиять на течение заболевания [2]. Высокий риск НПВП-ассоциированных НЯ применения НПВП ограничивает их долгосрочное использование [3].
Для уменьшения доз НПВП и повышения безопасности их применения возможно комбинирование НПВП со средствами, механизм действия которых исключает выраженное ингибирование фосфолипазы A2 и ЦОГ и направлен на иные звенья патогенеза боли. Такими средствами могут быть препараты с антиоксидантным действием, так как в каскаде арахидоновой кислоты образуются активные формы кислорода (АФК) [4], которые являются одними из альгогенов при воспалительной гипералгезии, и перехватчики АФК или соединения, имитирующие активность супе-роксиддисмутазы, которые уменьшают гипералгезию [5, 6]. АФК способны усиливать глутамат-зависимую трансдукцию: могут окислять сульфгидрильные группы транспортеров глутамата и, таким образом, инактивировать их, вследствие чего снижается захват глутамата из синаптической щели и его перенос в клетку [7—9].
Использование антиоксидантных препаратов совместно с НПВП целесообразно и с целью уменьшения вызываемых ими НЯ. С одной стороны, механизм побочного действия НПВП на слизистую оболочку ЖКТ является следствием их прооксидантного действия [10]. С другой стороны, при приеме НПВП существенно увеличен риск гибели пациентов, перенесших инфаркт миокарда [11]. Вследствие ишемии миокарда при инфаркте миокарда, нестабильной стенокардии и ишемической болезни активируется перекисное окисление липидов (ПОЛ) и повышается образование АФК, повреждающих клеточные мембраны и оказывающих цитотоксическое действие [12]. Поэтому применение в комбинации с НПВП средств, проявляющих антиоксидантные свойства, обосновано не только с целью усиления основного действия НПВП, но и для снижения риска развития НЯ со стороны ЖКТ, сердечнососудистой и других систем.
В настоящем исследовании для комбинации с НПВП был выбран антиоксидант этилметилгидроксипиридина сукцинат (ЭМГПС), который обладает мультимодальным механизмом действия, включающим его способность ингибировать ПОЛ и модифицировать фосфолипидный состав мембран [13—15], повышать активность Se-зависимой глутатионпероксидазы, снижать активность индуцибель-ной NO-синтазы, связывать супероксидный анион-ради-кал, уменьшать глутаматную эксайтотоксичность [16], улучшать энергетический статус клетки и влиять на процессы в цикле Кребса [17, 18].
Цель исследования — изучить влияние ЭМГПС на противоболевой эффект неселективного ингибитора ЦОГ диклофенака натрия и селективного ингибитора ЦОГ-2 это-рикоксиба на моделях острой висцеральной и соматической боли и оценить возможность применения ЭМГПС в комбинации с ингибиторами ЦОГ для снижения их доз с сохранением противоболевой эффективности.
Материал и методы
В работе использовали половозрелых беспородных белых мышей-самцов массой 24—29 г и крыс-самцов массой 240—280 г. из питомника филиала «Столбовая» ФГБУН «Научный центр биомедицинских технологий ФМБА России». Организацию и проведение работ осуществляли в соответствии с ГОСТ 33216-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами», ГОСТ 33215-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур» и Директивой 2010/63/EU Европейского Парламента и Совета Европейского Союза от 22.09.2010 по охране животных, используемых в научных целях. Проведение опытов одобрено Комиссией по биомедицинской этике НИИ фармакологии им. В.В. Закусо-ва (протокол №01 от 28.01.2021).
Использовали диклофенак натрия (Вольтарен, раствор для внутримышечного введения 75 мг/3 мл; «Novartis Pharma Stein AG», Швейцария); эторикоксиб (Аркоксия, таблетки, покрытые пленочной оболочкой; «Merck sharp & Dohme B.V.», Нидерланды); ЭМГПС (Мексидол, раствор для в/в введения 50 мг/мл; ООО «НПК «ФАРМАСОФТ», Россия); в качестве растворителя применяли физиологический раствор (Натрия хлорид, раствор для инфузий 0,9%; ОАО НПК «ЭСКОМ», Россия).
Висцеральную боль у мышей вызывали внутрибрюшинным введением 0,9% раствора уксусной кислоты из расчета 0,1 мл на 10 г массы тела (тест «уксусные корчи», ТУК). Введение раствора уксусной кислоты приводит к раздражению серозных оболочек, что вызывает сокращение абдоминальной мускулатуры и проявляется специфическими болевыми движениями — корчами, количество которых подсчитывали на протяжении 15 мин сразу после введения раствора уксусной кислоты [19]. О противоболевом действии препаратов судили по снижению количества корчей после их введения относительно количества корчей в контрольной группе мышей, которым вводили растворитель.
Изучение влияния ЭМГПС на выраженность противоболевого действия НПВП на модели висцеральной боли у мышей проводили в трех опытах. В первом оценивали влияние ЭМГПС на действие диклофенака натрия, во втором — на действие эторикоксиба, в третьем — на висцеральную боль per se. С целью выбора доз НПВП для применения в комбинации с ЭМГПС оценивали дозозави-симость их противоболевого эффекта: для диклофенака натрия в диапазоне доз от 0,5 до 10 мг/кг, для эторикокси-ба — от 1 до 20 мг/кг. Дозы ЭМГПС в комбинации с НПВП составляли от 12,5 до 100 мг/кг, влияние ЭМГПС per se изучали при его введении в дозах 25, 50 и 100 мг/кг. Препараты или физиологический раствор (контрольная группа) мышам вводили перорально за 1 ч до внутрибрюшинного введения 0,9% раствора уксусной кислоты.
Формалиновый тест, моделирующий боль при операционных разрезах (травмах). В заднюю лапу крыс вводили 0,1 мл 2% раствора формалина [19]. Каждые 5 мин в баллах регистрировали 4 типа поведенческих реакций: 0 — отсутствие реакции; 1 — лапа остается на горизонтальной поверхности, но животное на нее не опирается; 2 — лапа поднята; 3 — лапа облизывается, грызется или встряхивается. Подсчитывали сумму баллов в острую (0—5 мин), тоническую (20—60 мин) фазу боли и интерфазу (5—20 мин). Критерием анальгетического эффекта считали уменьшение болевых реакций в группах крыс, получавших препараты, относительно контрольной группы животных, которым вводили физиологический раствор. Изучаемые НПВП эторикоксиб и диклофенак натрия в дозах 1 и 10 мг/кг соответственно, ЭМГПС в дозе 25 мг/кг, комбинации этих НПВП (1 мг/кг) с ЭМГПС (25 мг/кг) и физиологический раствор вводили перорально за 1 ч до введения 2% раствора формалина.
При проведении теста механической гипералгезии при воспалении гипералгезию регистрировали у крыс с воспалением, вызванным введением в заднюю лапу 0,1 мл 1% раствора каррагинана [20]. О гипералгезии судили по снижению порога тактильной чувствительности, которую фиксировали через 3 и 24 ч после введения раствора каррагинана с помощью волосков фон Фрея весом от 0,06 до 23,96 г («Aesthesio Ugo Basile», Италия). Крыс помещали по отдельности в пластиковые камеры (20x10x14 см) на возвышенной решетчатой платформе с перфорациями и в течение 15 мин адаптировали в условиях покоя. Нити фон Фрея предъявляли перпендикулярно в разных местах подошвенной поверхности задних лап животных, исключая области пальцев и скакательного сустава. Для каждого волоска фон Фрея тестирование проводили 5 раз с интервалом 3 с. Определяли порог реакции, вызывающий отдергивание лапы. Эторикоксиб и диклофенак натрия в дозах 1 и 10 мг/кг, ЭМГПС в дозе 25 мг/кг, комбинации этих НПВП (1 мг/кг) с ЭМГПС (25 мг/кг) вводили перорально дважды через 2 и 23 ч после введения раствора каррагинана. Группе крыс без воспаления лапы (контрольная группа) и группе крыс «Каррагинан» (животным с отеком лапы, которым не вводили препараты) перорально в эти же сроки вводили физиологический раствор.
Статистическую обработку результатов осуществляли с помощью программы Statistica 10.0. Нормальность распределения данных проверяли критерием Шапиро— Уилка с последующей оценкой межгруппового равенства дисперсий критерием Левена. При нормальном распределении в группах и соблюдении межгруппового равенства дисперсий дальнейшую статистическую обработку проводили путем однофакторного дисперсионного анализа с последующим сравнением групп с помощью критерия Ньюмана—Кейлса и t -критерия Стьюдента. При отсутствии нормального распределения использовали критерий Кра-скела—Уоллиса. При обнаружении статистически значимых различий между группами с помощью критерия Кра-скела—Уоллиса далее проводили статистический анализ методом сравнения средних рангов для всех групп. Различия между группами считали статистически значимыми при p <0,05. Результаты представляли на рисунках, выполненных с помощью программы GraphPad Prism V. 8.4.3: при применении параметрической статистики — как среднее значение±стандартное отклонение (M±SD), непараметрической — в виде боксплотов.
Результаты
Рис. 1. Влияние диклофенака натрия (а), эторикоксиба (б), ЭМГПС (в) и их комбинаций (а, б) при однократном пероральном введении на выраженность острой висцеральной боли в тесте ТУК у мышей (M±SD).
Fig. 1. Effect of diclofenac sodium (a), etoricoxib (b), EMGPS (c) and their combinations (a, b) with a single oral administration on the severity of acute visceral pain in the TUC test in mice (M±SD).
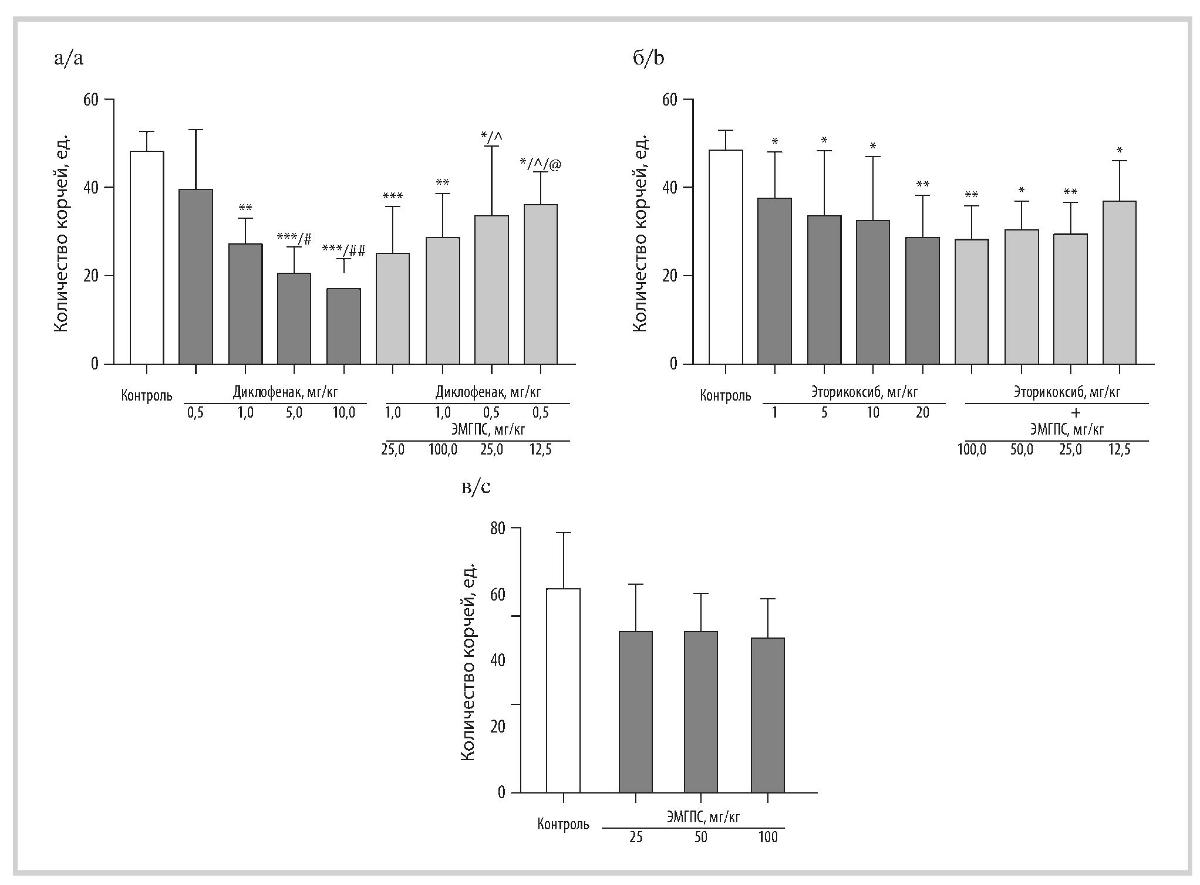
* — p<0,05,** — p<0,005, *** — p<0,0005 по сравнению с контролем; для рис. 1а: # — p<0,05, ## — p<0,005 по сравнению с группой «Диклофенак 0,5 мг/кг»; А — p <0,05 по сравнению с группой «Диклофенак 5 мг/кг»; @ — p <0,05 по сравнению с группой «Диклофенак 10 мг/кг, критерий Ньюмена—Кейлса».
* — p<0.05, ** — p<0.005, *** — p<0.0005 compared to control; for fig. 1a: # — p<0.05, ## — p<0.005 compared with the «Diclofenac 0.5 mg/kg» group; A — p<0.05 compared with the «Diclofenac 5 mg/kg» group; @ — p<0.05 compared with the «Diclofenac 10 mg/kg group, Newman—Keuls test».
 Влияние препаратов на висцеральную боль в ТУК у мышей. Висцеральная боль у мышей после внутрибрюшинного введения им 0,9% раствора уксусной кислоты проявлялась специфическими болевыми движениями — корчами, количество которых в контрольных группах варьировало от 48,3 до 62,0 (рис. 1). Диклофенак натрия оказывал дозозависимое противоболевое действие и значимо снижал болевую реакцию животных при однократном пероральном введении в дозах от 1 до 10 мг/кг, но не в дозе 0,5 мг/кг. Противоболевой эффект препарата в дозе 1 мг/кг соответствовал 43,6%, в дозе 5 мг/кг — 57,0%, в дозе 10 мг/кг — 64,6%. При этом уменьшение интенсивности висцеральной боли при введении мышам диклофенака натрия в дозах 5 и 10 мг/кг было значимо соответственно на 47,7 и 57,0% более выражено, чем в группе животных, которым его вводили в дозе 0,5 мг/кг (рис. 1, а). Применение диклофенака натрия в дозе 1 мг/кг и это-рикоксиба с ЭМГПС в дозе 25 мг/кг приводило к значимому снижению боли на 47,7%; использование этого НПВП совместно с ЭМГПС в дозе 100 мг/кг подавляло боль на 40,3%. Применение диклофенака натрия в дозе 0,5 мг/кг, в которой препарат не оказывал значимого влияния на висцеральную боль, совместно с ЭМГПС в дозах 25 и 12,5 мг/кг приводило к появлению значимого противоболевого эффекта. Комбинация диклофенака натрия в дозе 0,5 мг/кг с ЭМГПС в дозе 25 мг/кг снижала боль на 29,8%, с ЭМГПС в дозе 12,5 мг/кг — на 25,1% (см. рис. 1, а).
Влияние препаратов на висцеральную боль в ТУК у мышей. Висцеральная боль у мышей после внутрибрюшинного введения им 0,9% раствора уксусной кислоты проявлялась специфическими болевыми движениями — корчами, количество которых в контрольных группах варьировало от 48,3 до 62,0 (рис. 1). Диклофенак натрия оказывал дозозависимое противоболевое действие и значимо снижал болевую реакцию животных при однократном пероральном введении в дозах от 1 до 10 мг/кг, но не в дозе 0,5 мг/кг. Противоболевой эффект препарата в дозе 1 мг/кг соответствовал 43,6%, в дозе 5 мг/кг — 57,0%, в дозе 10 мг/кг — 64,6%. При этом уменьшение интенсивности висцеральной боли при введении мышам диклофенака натрия в дозах 5 и 10 мг/кг было значимо соответственно на 47,7 и 57,0% более выражено, чем в группе животных, которым его вводили в дозе 0,5 мг/кг (рис. 1, а). Применение диклофенака натрия в дозе 1 мг/кг и это-рикоксиба с ЭМГПС в дозе 25 мг/кг приводило к значимому снижению боли на 47,7%; использование этого НПВП совместно с ЭМГПС в дозе 100 мг/кг подавляло боль на 40,3%. Применение диклофенака натрия в дозе 0,5 мг/кг, в которой препарат не оказывал значимого влияния на висцеральную боль, совместно с ЭМГПС в дозах 25 и 12,5 мг/кг приводило к появлению значимого противоболевого эффекта. Комбинация диклофенака натрия в дозе 0,5 мг/кг с ЭМГПС в дозе 25 мг/кг снижала боль на 29,8%, с ЭМГПС в дозе 12,5 мг/кг — на 25,1% (см. рис. 1, а).
Эторикоксиб при однократном пероральном введении в диапазоне доз 1—20 мг/кг дозозависимо подавлял висцеральную боль у мышей. Препарат в дозе 1 мг/кг значимо снижал количество корчей на 22,5%, в дозе 5 мг/кг — на 33,9%, в дозе 10 мг/кг — на 36,4%, в дозе 20 мг/кг — на 43,2%. Применение эторикоксиба в дозе 1 мг/кг совместно с ЭМГПС в дозах 25—100 мг/кг усиливало выраженность противоболевого эффекта НПВП и приводило к подавлению боли на 40,1—44,2%, что было сопоставимо с эффектом эторикоксиба в дозе 20 мг/кг. Хотя при статистическом анализе с помощью критерия Ньюмена—Кейлса различий между группами комбинаций эторикоксиба (1 мг/кг) и ЭМГПС (25—100 мг/кг) не было, при попарном сравнении с помощью t-критерия Стьюдента зарегистрировано значимое (p<0,05) повышение эффективности этих комбинаций на 22,6—28,0% по сравнению с введением только эторикоксиба. Однако при применении этори-коксиба (1 мг/кг) в комбинации с ЭМГПС в дозе 12,5 мг/кг количество корчей практически не отличалось от показателя в группе мышей, которым вводили только эторикоксиб в дозе 1 мг/кг (см. рис. 1, б). ЭМГПС при однократном пероральном введении в дозах 25—100 мг/кг значимо не влиял на выраженность висцеральной боли у мышей. Вместе с тем при его применении в дозах 50 и 100 мг/кг наблюдалась тенденция к снижению количества корчей (соответственно на 19,8%, p=0,07, и 23,4%, p=0,075, t -критерий Стьюдента) (см. рис. 1, в).
Таким образом, на модели острой висцеральной боли у мышей ЭМГПС при однократном пероральном введении в дозах 25—100 мг/кг не оказывал значимого влияния на ее выраженность, но усиливал противоболевой эффект диклофенака натрия и эторикоксиба при их однократном пероральном введении в дозах 0,5 и 1 мг/кг.
Влияние препаратов на соматическую боль в формалиновом тесте у крыс. В формалиновом тесте спонтанное болевое поведение крыс после введения им 0,1 мл 2% раствора формалина характеризовалось двухфазной реакцией (рис. 2). Первая фаза, которая длилась в течение 5 мин, обусловлена действием формалина на ионный канал TRPA1 афферентных нейронов, вторая фаза начиналась с 20 мин наблюдения, и ее механизм связывают с развивающейся воспалительной реакцией и центральной сенсити-зацией [21]. Регистрируемое с 5-й по 20-ю мин снижение болевой реакции — интерфаза — объясняют результатом гиперполяризации и временной инактивации нейронов, повышение возбудимости которых и центробежное распространение формалина в коже вызывают вторую фазу болевой реакции [22].
Рис. 2. Влияние диклофенака натрия (а, б), эторикоксиба (в, г) и их комбинаций с ЭМГПС при однократном пероральном введении на формалиновую боль у крыс в острую и тоническую фазу.
Fig. 2. Effect of diclofenac sodium (a, b), etoricoxib (c, d) and their combinations with EMGPS with a single oral administration on formaldehyde pain in rats in the acute and tonic phase.
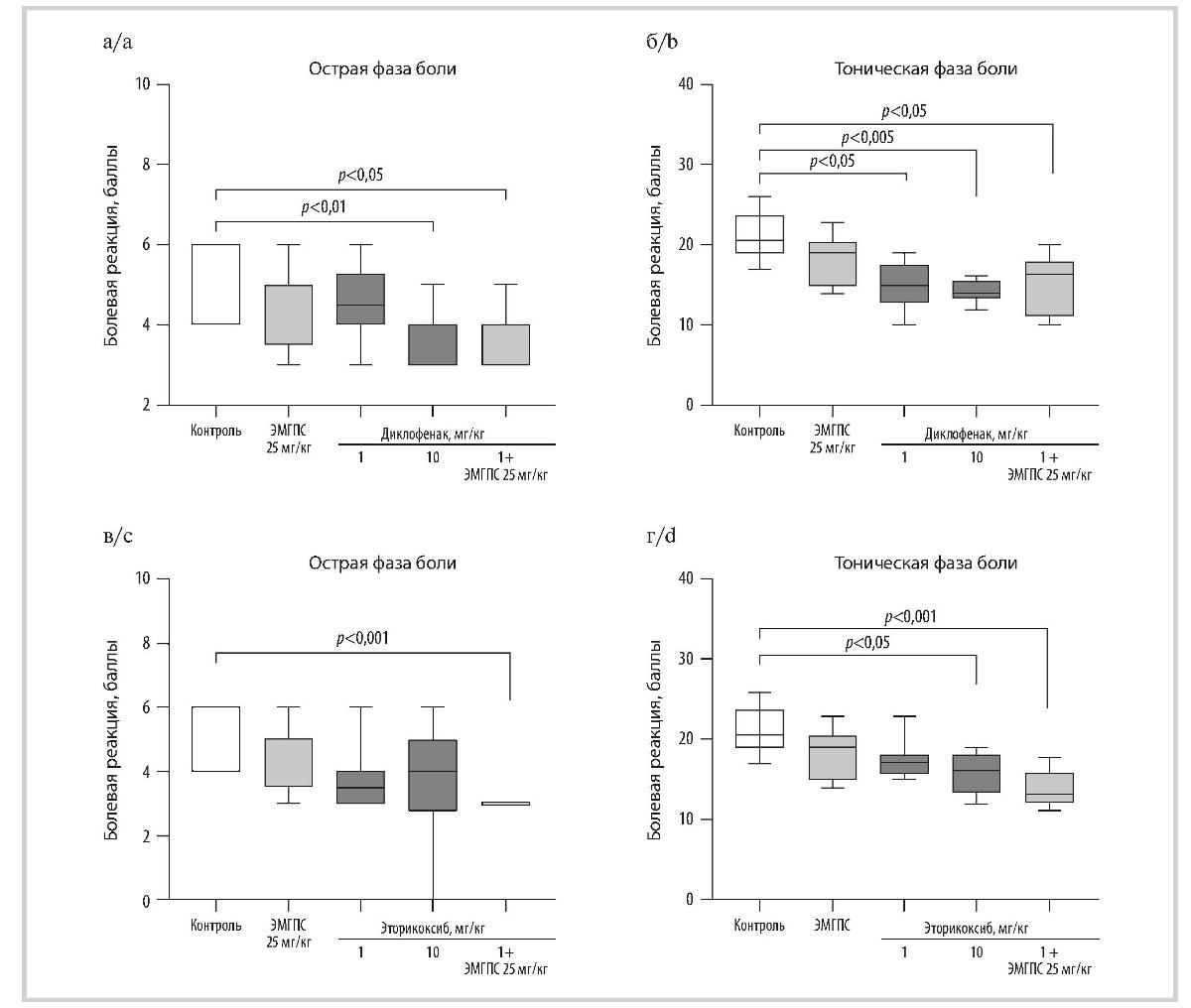
Данные представлены в виде боксплотов; статистическую обработку данных проводили с помощью критерия Краскела—Уоллиса с последующим статистическим анализом данных методом сравнения средних рангов для всех групп.
Data are presented as boxplots; Statistical processing of the data was carried out using the Kruskal—Wallis test, followed by statistical analysis of the data by comparing average ranks for all groups.
Диклофенак натрия оказывал дозозависимое противоболевое действие в формалиновом тесте у крыс. В дозе 10 мг/кг он значимо снижал количество свидетельствующих о боли спонтанных реакций крыс на 50,0% в острую фазу боли и на 31,7% в тоническую. Введение животным диклофенака натрия в меньшей дозе (1 мг/кг) приводило к значимому подавлению боли (на 26,8%) только в тоническую фазу (см. рис. 2, а, б). Эторикоксиб оказывал значимое противоболевое действие только в дозе 10 мг/кг и на 17,1% снижал количество свидетельствующих о боли спонтанных реакций крыс в тоническую фазу. На острую фазу боли препарат влияния не оказывал (см. рис. 2, в, г).
ЭМГПС при однократном пероральном введении в дозе 25 мг/кг не оказывал значимого влияния на болевое поведение крыс в формалиновом тесте. Однако его применение совместно с диклофенаком натрия или эторикоксибом в дозе 1 мг/кг усиливало выраженность противоболевого действия НПВП за счет появления у комбинаций препаратов способности снижать боль (на 50,0%) в острую фазу. Эффект комбинаций препаратов и диклофенака натрия в дозе 10 мг/кг в острую фазу формалиновой боли развивался за счет уменьшения ее длительности; болевые реакции крыс сразу после введения раствора формалина во всех опытных группах практически не различались. Применение ЭМГПС в дозе 25 мг/кг совместно с эторикоксибом в дозе 1 мг/кг еще и значимо на 23,5% усиливало противоболевой эффект НПВП в тоническую фазу боли (см. рис. 2). Значимых различий в поведении животных опытных групп во время интерфазы выявлено не было.
Влияние препаратов на соматическую боль в тесте механической гипералгезии при воспалении у крыс. При экссудативном воспалении лапы у крыс, вызванном инъекцией раствора каррагинана, развивается гипералгезия, которую регистрировали с помощью нитей фон Фрея через 3 и 24 ч после его индукции. При тактильной стимуляции порог чувствительности животных с каррагинановым отеком, которым вводили растворитель, через 3 ч после введения каррагинана составил 5 г, через 24 ч — 8 г против порога чувствительности, равного 60 г, у крыс, которым раствор каррагинана не вводили.
Диклофенак натрия в тесте механической гиперал-гезии при воспалении проявлял дозозависимый противоболевой эффект. Через 3 ч после индукции воспаления диклофенак натрия значимо увеличивал порог чувствительности животных по сравнению с группой, которой вводили раствор каррагинана и растворитель, только при введении в дозе 10 мг/кг (порог чувствительности составил 26 г). Через 24 ч порог чувствительности крыс, которым вводили диклофенак натрия в обеих изучаемых дозах (1 и 10 мг/кг), повышался до значения группы животных без отека лапы (рис. 3, а, б).
У крыс с каррагинановым отеком, которым вводили эторикоксиб в дозах 1 и 10 мг/кг, порог чувствительности при тактильной стимуляции поврежденной лапы был значимо выше по сравнению с группой животных с отеком лапы, которым вводили только растворитель, и через 3 и 24 ч после индукции воспаления составил 26 г (см. рис. 3, в, г).
ЭМГПС в дозе 25 мг/кг не влиял на порог чувствительности поврежденной лапы крыс с каррагинановым отеком при ее тактильной стимуляции. Однако его введение совместно с диклофенаком натрия в дозе 1 мг/кг приводило к повышению порога чувствительности животных по сравнению с введением только диклофенака натрия в дозе 1 мг/кг, который не оказывал на него значимого влияния. Порог чувствительности крыс, которым вводили диклофенак натрия в дозе 1 мг/кг с ЭМГПС в дозе 25 мг/кг, через 3 ч после введения флогогена составил 43 г, т.е. был в 8,6 раз выше, чем в группе крыс с отеком лапы, которым вводили только растворитель. Через 24 ч после индукции воспаления при тактильной стимуляции порог чувствительности крыс с отеком лапы, которым вводили комбинацию диклофенака натрия (1 мг/кг) с ЭМГПС (25 мг/кг), не отличался от порога чувствительности животных, которым вводили диклофенак натрия в обеих изучаемых дозах (см. рис. 3, а, б). На эффект эторикоксиба ЭМГПС (25 мг/кг) оказывал меньшее влияние. Порог чувствительности крыс, которым перорально вводили комбинацию эторикоксиба (1 мг/кг) и ЭМГПС (25 мг/кг), через 3 и 24 ч после индукции воспаления был незначимо повышен по сравнению с соответствующими значениями в группе животных, которым вводили только эторикоксиб (1 мг/кг), и составлял соответственно 43 и 60 г (см. рис. 3, в, г).
Обсуждение
Результаты проведенного экспериментального исследования свидетельствуют о том, что ЭМГПС в дозе 25 мг/кг усиливает противоболевое действие ингибиторов ЦОГ диклофенака натрия и эторикоксиба, используемых в малой дозе (1 мг/кг). Острая висцеральная боль у мышей, тоническая фаза формалиновой боли и механическая гипералгезия у крыс с отеком лапы возникают на фоне развития острого экссудативного воспаления, при котором повышено образование АФК, поэтому зарегистрированное влияние ЭМГПС на противоболевой эффект НПВП можно связать с его антиоксидантными свойствами. Острая фаза формалиновой боли обусловлена действием формалина на ионный канал TRPA1 афферентных нейронов. Ионный канал TRPA1 коэкспрес-сируется с ионным каналом TRPV1 [22], и антагонисты ионного канала TRPV1 способны снижать выраженность болевого поведения крыс в острую фазу индуцированной формалином боли [23]. Диклофенак натрия при пероральном введении в дозе 10 мг/кг, но не 1 мг/кг, подавляет формалиновую боль у крыс в острую фазу за счет влияния на ионные каналы TRPV1, так как известно, что этот НПВП снижает выраженность механической и тепловой гипералгезии, вызванной активацией этих каналов [24]. Применение ЭМГПС в дозе 25 мг/кг при введении совместно с диклофенаком натрия и эторикоксибом в дозе 1 мг/кг приводит к появлению значимого анальгетического эффекта в острую фазу формалиновой боли, что в первую очередь обусловлено его мембранотропными свойствами.
В проведенных нами ранее экспериментах показано, что на модели каррагинанового отека у мышей и крыс анти-экссудативный эффект комбинаций ЭМГПС в дозе 25 мг/кг и диклофенака натрия или эторикоксиба в дозе 1 мг/кг при однократном пероральном введении не уступает эффекту этих НПВП в дозе 10 мг/кг [25]. ЭМГПС в дозе 100 мг/кг усиливает антиэкссудативное и анальгетическое действия диклофенака натрия в дозе 5 мг/кг при однократном внутрибрюшинном введении препаратов крысам [26]. Однако при превентивном 10-дневном пероральном введении
Рис. 3. Влияние диклофенака натрия (а, б), эторикоксиба (в, г) и их комбинаций с ЭМГПС при однократном пероральном введении в тесте механической гипералгезии при воспалении у крыс через 3 (а, в) и 24 (б, г) ч после введения раствора каррагинана.
Fig. 3. The effect of diclofenac sodium (a, b), etoricoxib (c, d) and their combinations with EMGPS after a single oral administration in a test of mechanical hyperalgesia during inflammation in rats 3 (a, c) and 24 (b, d) hours after injection of carrageenan solution.
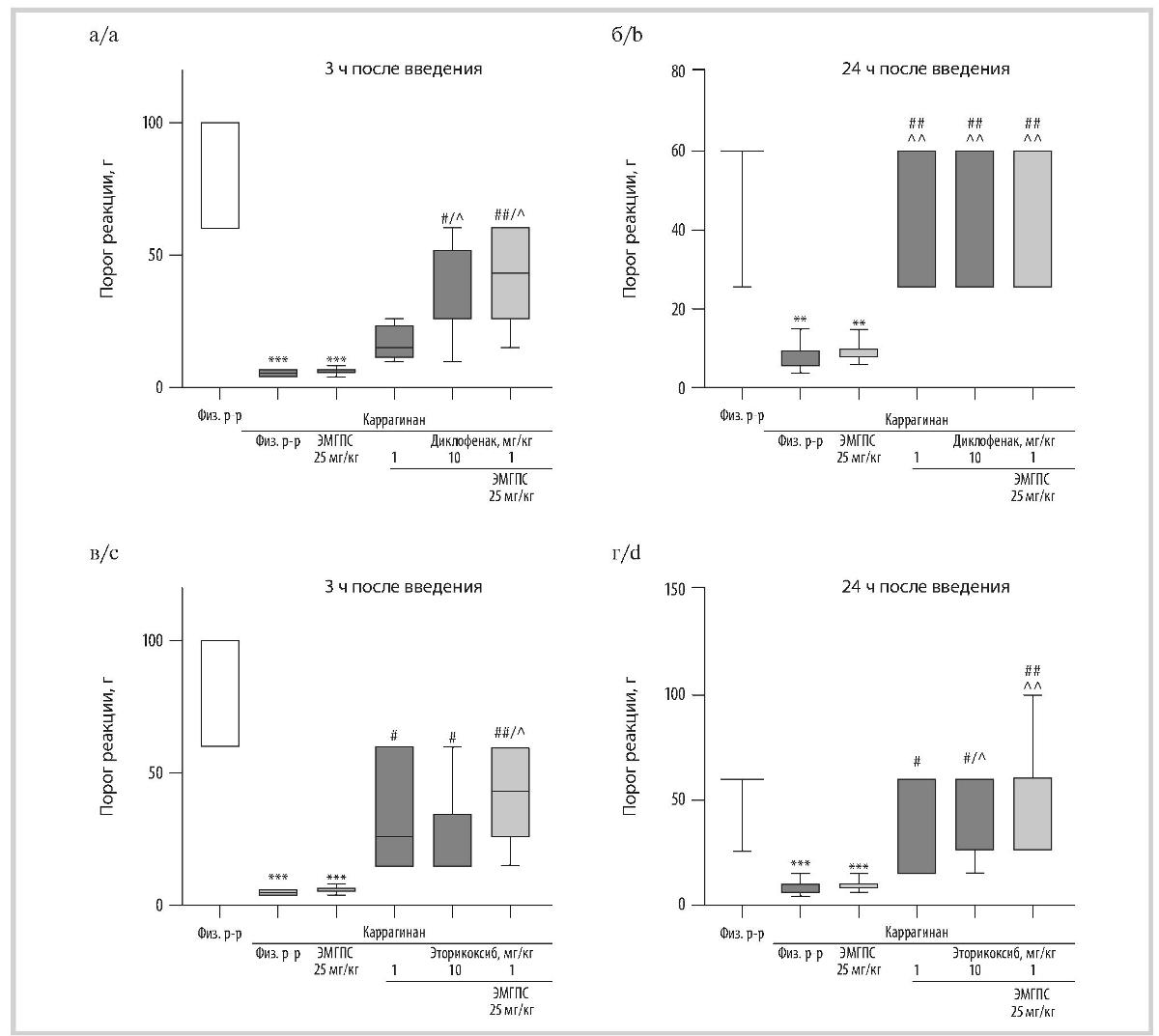
По оси ординат — порог болевой реакции в граммах (г). Данные представлены в виде боксплотов; ** — p<0,005, *** — p<0,0005 по сравнению с группой «Физиолоический раствор»; ## — p <0,005 по сравнению с группой «Каррагинан + физиологический раствор»; a — p <0,05, АА — p <0,005 по сравнению с группой «Каррагинан + ЭМГПС 25 мг/кг»; критерий Краскела—Уоллиса с последующим статистическим анализом данных методом сравнения средних рангов для всех групп.
On the ordinate — the threshold of pain reaction in grams (g). Data are presented as boxplots; ** — p<0.005, *** — p<0.0005 compared with the «Physiological solu-tion» group; ## — p<0.005 compared to the «Carrageenan + saline solution» group; A — p<0.05, AA — p<0.005 compared with the «Carrageenan + EMGPS 25 mg/kg» group; Kruskal—Wallis test followed by statistical analysis of data by comparing average ranks for all groups.
 ЭМГПС в дозе 100 мг/кг в комбинации с диклофенаком натрия в дозе 5 мг/кг усиление противовоспалительного эффекта НПВП не превышает эффект однократного сочетанного введения этих препаратов при внутрибрюшинном введении [27]. В исследованиях in vitro установлено, что диклофенак натрия оказывает дозозависимый проок-сидантный эффект в реакции Фентона, зарегистрированный хемилюминесцентным методом, а ЭМГПС в концентрации 250 или 25 мкМ совместно с диклофенаком натрия в концентрациях соответственно 50, 100 или 10 мкМ уменьшает пик хемилюминесценции, который пропорционален скорости свободнорадикальных реакций, по сравнению с использованием только НПВП, но при этом увеличивает длительность и квантовый выход хемилюминесценции [28]. Значимых изменений кинетики хемилюминесценции не происходит при применении ЭМГПС в концентрации 25 мкМ с диклофенаком натрия в концентрации 1 мкМ, что подтверждает целесообразность применения препаратов в малых дозах [28].
ЭМГПС в дозе 100 мг/кг в комбинации с диклофенаком натрия в дозе 5 мг/кг усиление противовоспалительного эффекта НПВП не превышает эффект однократного сочетанного введения этих препаратов при внутрибрюшинном введении [27]. В исследованиях in vitro установлено, что диклофенак натрия оказывает дозозависимый проок-сидантный эффект в реакции Фентона, зарегистрированный хемилюминесцентным методом, а ЭМГПС в концентрации 250 или 25 мкМ совместно с диклофенаком натрия в концентрациях соответственно 50, 100 или 10 мкМ уменьшает пик хемилюминесценции, который пропорционален скорости свободнорадикальных реакций, по сравнению с использованием только НПВП, но при этом увеличивает длительность и квантовый выход хемилюминесценции [28]. Значимых изменений кинетики хемилюминесценции не происходит при применении ЭМГПС в концентрации 25 мкМ с диклофенаком натрия в концентрации 1 мкМ, что подтверждает целесообразность применения препаратов в малых дозах [28].
Полученные данные согласуются с результатами клинических исследований. Так, применение ЭМГПС в комбинированной терапии совместно с НПВП, вазоактивными препаратами, миорелаксантами, витаминами группы B ускоряет темп снижения боли при пояснично-крестцовых радикулопатиях [29, 30, 31], остеохондрозе разных отделов позвоночника и радикулоишемии [32, 33, 34].
Заключение
Установлено, что на моделях острой висцеральной и соматической боли у мышей и крыс ЭМГПС при однократном пероральном введении в малой дозе 25 мг/кг усиливает противоболевой эффект диклофенака натрия и этори-коксиба, используемых в малой дозе 1 мг/кг. Полученные данные свидетельствуют о целесообразности клинического исследования применения ЭМГПС в комбинации с НПВП при висцеральной и соматической боли с целью оценки его способности повышать лечебный эффект НПВП.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Литература / References
1. Каратеев А.Е., Насонов Е.Л., Ивашкин В.Т. и др. Рациональное использование нестероидных противовоспалительных препаратов. Клинические рекомендации. Научно-практическая ревматология. 2018;56(1):1-29. Karateev AE, Nasonov EL, Ivashkin VT, et al. Clinical guidelines. NauchnoPrakticheskaja Revmatologija. 2018;56(1):1-29. (In Russ.). https://doi.org/10.14412/1995-4484-2018-1-29
2. Ross A, Hauser MD. Wonder why? The Acceleration of Articular Cartilage Degeneration in Osteoarthritis by Nonsteroidal Anti-inflammatory Drugs. J Prolother. 2010;2(1):305-322.
3. O’Neil CK, Hanlon JT, Marcum ZA. Adverse effects of analgesics commonly used by older adults with osteoarthritis: Focus on non-opioid and opioid analgesics. Am J Geriat Pharmacother. 2012;10(6):331-342. https://doi.org/10.1016/j.amjopharm.2012.09.004
4. Eling TE, Curtis JF. Xenobiotic metabolism by prostaglandin H synthase. Pharmacol Ther. 1992;53(2):261-273. https://doi.org/10.1016/0163-7258(92)90012-o
5. Wang ZQ, Porreca F, Cuzzocrea S, et al. A newly identified role for superoxide in inflammatory pain. J Pharmacol Exp Ther. 2004;309(3):869-878. https://doi.org/10.1124/jpet.103.064154
6. Khattab MM. TEMPOL, a membrane-permeable radical scavenger, attenuates peroxynitriteand superoxide anion-enhanced carrageenan-induced paw edema and hyperalgesia: a key role for superoxide anion. Eur J Pharmacol. 2006;548(1-3):167-173. https://doi.org/10.1016/j.ejphar.2006.08.007
7. Trotti D, Danbolt NC, Volterra A. Glutamate transporters are oxidant vulnerable: A molecular link between oxidative and excitotoxic neurodegeneration? Trends Pharm Sci. 1998;19(8):328-334. https://doi.org/10.1016/s0165-6147(98)01230-9
8. Maher P, Schubert D. Signaling by reactive oxygen species in the nervous system. Cell Mol Life Sci. 2000;57(8):1287-1305. https://doi.org/10.1007/pl00000766
9. Foran E, Trotti D. Glutamate transporters and the excitotoxic path to motor neuron degeneration in amyotrophic lateral sclerosis. Antioxidants & Redox Signaling. 2009;11(7):1587-1602. https://doi.org/10.1089/ars.2009.2444
10. Sandoval-Acuña C, Lopez-Alarcón C, Aliaga ME, Speisky H. Inhibition of mitochondrial complex I by various non-steroidal anti-inflammatory drugs and its protection by quercetin via a coenzyme Q-like action. Chem Biol Interact. 2012;199(1):18-28. https://doi.org/10.1016/j.cbi.2012.05.006
11. Gislason GH, Jacobsen S, Rasmussen JN, et al. Risk of death or reinfarction associated with the use of selective cyclooxygenase-2 inhibitors and nonselective nonsteroidal antiinflammatory drugs after acute myocardial infarction. Circulation. 2006;113(25):2906-2913. https://doi.org/10.1161/circulationaha.106.616219
12. Никольская И.Н., Хромова О.М., Ирхина И.С. и др. Сравнительная оценка клинической эффективности и безопасности препарата мексидол у больных с острым коронарным синдромом при включении в стандартную схему терапии. Кардиология и сердечно-сосудистая хирургия. 2013;6(3):37-42. Nikol’skaia IN, Khromova OM, Irkhina IS, et al. Comparative evaluation of clinical efficacy and safety of mexidol in patients with acute coronary syndrome in addition to standart regimen of treatment. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2013;6(3):37-42. (In Russ.).
13. Воронина Т.А. Мексидол: Основные нейропсихотропные эффекты и механизм действия. Фарматека. 2009;6(180):35-38. Voronina TA. Mexidol: main neuropsychotropic effects and mechanisms of action. Farmateka. 2009;6(180):35-38. (In Russ.).
14. Дюмаев К.М., Воронина Т.А., Смирнов Л.Д. Антиоксиданты в профилактике и терапии патологий ЦНС. М.: Издательство Института биомедицинской химии; 1995. Dumaev KM, Voronina TA, Smirnov LD. Antioxidants in the prevention and therapy of Central nervous system pathologies. M.: Publishing House of the Institute of Biomedical Chemistry; 1995. (In Russ.).
15. Бурлакова Е.Б., Кайране Ч.Б., Молочкина Е.М., Хохлов А.П. Модификация липидов наружной мембраны митохондрий печени мышей и кинетических параметров мембраносвязанной моноаминоксидазы in vivo и in vitro. Вопросы медицинской химии. 1984;30(1):66-72. Burlakova EB, Kairane ChB, Molochkina EM, Khokhlov AP. Membranemodulating effects of 3-hydroxypyridine derivatives. Voprosy Meditsinskoi Khimii. 1984;30(1):66-72. (In Russ.).
16. Щулькин А.В. Влияние мексидола на развитие феномена эксайтотоксичности нейронов in vitro. Журнал неврологии и психиатрии им. С.С. Корсакова. 2012;112(2):35-39. Shchulkin AV. Effect of mexidol on the development of the phenomenon of the neuronal excitotoxicity in vitro. Zhurnal Nevrologii i Psikhiatrii im. S.S. Korsakova. 2012;112(2):35-39. (In Russ.).
17. Лукьянова Л.Д. Современные проблемы адаптации к гипоксии. Сигнальные механизмы и их роль в системной регуляции. Патологическая физиология и экспериментальная терапия. 2011;(1):3-19. Lukyanova LD. Current issues of adaptation to hypoxia. signal mechanisms and their role in system regulation. Patologicheskaya Fiziologiya i Ehksperimental’naya Terapiya. 2011;(1):3-19. (In Russ.).
18. Лукьянова Л.Д. Сигнальные механизмы гипоксии. М.: РАН; 2019. Lukyanova LD. Signal’nye Mekhanizmy Gipoksii. M.: RAS; 2019. (In Russ.).
19. Воронина Т.А., Гузеватых Л.С. Методические рекомендации по изучению анальгетической активности лекарственных средств. М.: Гриф и К; 2012. Voronina TA, Guzevatykh LS. Metodicheskie rekomendatsii po izucheniyu anal’geticheskoi aktivnosti lekarstvennykh sredstv. M.: Grif and K; 2012. (In Russ.).
20. McNamara CR, Mandel-Brehm J, Bautista DM, et al. TRPA1 mediates formalin-induced pain. Proc Nat Acad Sci. 2007;104(33):13525-13530. https://doi.org/10.1073/pnas.0705924104
21. Fisher M, Carli G, Raboisson P, Reeh P. The interphase of the formalin test. Pain. 2014;155(3):511-521. https://doi.org/10.1016/j.pain.2013.11.015
22. Gouin O, L’Herondelle K, Lebonvallet N, et al. TRPV1 and TRPA1 in cutaneous neurogenic and chronic inflammation: pro-inflammatory response induced by their activation and their sensitization. Protein & Cell. 2017;8(9):644-661. https://doi.org/10.1007/s13238-017-0395-5
23. Kanai Y, Hara T, Imai A. Participation of the spinal TRPV1 receptors in formalin-evoked pain transduction: a study using a selective TRPV1 antagonist, iodoresiniferatoxin. J Pharm Pharmacol. 2006;58(4):489-493. https://doi.org/10.1211/jpp.58.4.0008
24. Nozadze I, Tsiklauri N, Gurtskaia G, Tsagareli MG. NSAIDs attenuate hyperalgesia induced by TRP channel activation. Data in Brief. 2016;6:668-673. https://doi.org/10.1016/j.dib.2015.12.055
25. Иванова Е.А., Матюшкин А.И., Васильчук А.Г., Воронина Т.А. Способность мексидола усиливать антиэкссудативное действие диклофенака натрия и эторикоксиба на модели каррагенанового отека у крыс и мышей. Вестник Московского университета. Биология. 2021;76(2):61-66. Ivanova EA, Matyushkin AI, Vasilchuk AG, Voronina TA. Ability of mexidol to enhance antiexudative effect of diclofenac sodium and etoricoxib in rats and mice with carrageenan-induced edema. Moscow University Biological Sciences Bulletin. 2021;76(2):61-66. (In Russ.). https://doi.org/10.3103/S0096392521020024
26. Иванова Е.А., Васильчук А.Г., Матюшкин А.И., Воронина Т.А. Усиление противовоспалительного и анальгетического эффекта диклофенака натрия при его применении в комбинации с мексидолом в эксперименте на грызунах. Экспериментальная и клиническая фармакология. 2020;83(7):22-26. Ivanova EA, Vasil’chuk AG, Matyushkin AI, Voronina TA. Enhancement of the anti-inflammatory and analgesic effect of diclofenac sodium in combination with mexidol. Ehksperimental’naya i Klinicheskaya Farmakologiya. 2020;83(7):22-26. (In Russ.). https://doi.org/10.30906/0869-2092-2020-83-7-22-26
27. Иванова Е.А., Васильчук А.Г., Матюшкин А.И., Воронина Т.А. Влияние комбинированного применения мексидола с диклофенаком натрия на выраженность экссудативного воспаления у крыс при превентивном десятидневном пероральном введении. Фармакокинетика и фармакодинамика. 2022;(1):14-19. Ivanova EA, Vasil’chuk AG, Matyushkin AI, Voronina TA. Effect of the combination of mexidol and diclofenac sodium on exudative inflammation in rats after ten-day preventive oral administration. Farmakokinetika i Farmakodinamika. 2022;(1):14-19. (In Russ.). https://doi.org/10.37489/2587-7836-2022-1-14-19
28. Иванова Е.А., Дмитриева С.А., Золотов Н.Н., Воронина Т.А. Влияние диклофенака натрия и его комбинаций с мексидолом на Fe2+индуцированную хемилюминесценцию. Химико-фармацевтический журнал. 2023;57(5):9-13. Ivanova EA, Dmitrieva SA, Zolotov NN, Voronina TA. The effect of diclofenac sodium and its combinations with mexidol on Fe2+-induced chemiluminescence. Pharmaceutical Chemistry Journal. 2023;57(5):9-13. (In Russ.). https://doi.org/10.30906/0023-1134-2023-57-5-9-13
29. Шатрова В.П., Месхи К.Т. Применение антиоксидантов в комплексном лечении вертеброгенных нейрососудистых синдромов. Журнал неврологии и психиатрии им. С.С. Корсакова. 2008;108(7):79-81. Shatrova VP, Meskhi KT. The use of antioxidants in the complex treatment of vertebrogenic neurovascular syndromes. Zhurnal nevrologii i psikhiatrii im. S.S. Korsakova. 2008;108(7):79-81. (In Russ.).
30. Лихачева Е.Б. Мексидол в консервативном лечении пояснично-крестцовых радикулопатий. Фарматека. 2012;6(239):83-87. Likhacheva EB. Mexidol in the conservative treatment of lumbosacral radiculopathy. Farmateka. 2012;6(239):83-87. (In Russ.).
31. Лихачева Е.Б., Шоломов И.И. Динамика клинико-иммунологических показателей в оценке эффективности применения Мексидола при пояснично-крестцовой радикулопатии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2006;106(10):52-57. Likhacheva EB, Sholomov II. Clinical and immunological assessment of efficacy of mexidol in the treatment of lumbosacral radiculopathy. Zhurnal nevrologii i psikhiatrii im. S.S. Korsakova. 2006;106(10):52-57. (In Russ.).
32. Хужахметова Д.Х. Применение Мексидола по стандартизированной схеме введения в лечении остеохондрозов позвоночника. Бюллетень экспериментальной биологии и медицины. 2012;1:219-225. Khuzhakhmetova DH. The use of Mexidol in a standardized regimen for the treatment of osteochondrosis of the spine. Byulleten’ Ehksperimental’noi Biologii i Meditsiny. 2012;1:219-225. (In Russ.).
33. Синченко О.Г. Использование антигипоксантных и нейрометаболических свойств Мексидола в лечении вертеброгенного радикулоишемического синдрома. Бюллетень экспериментальной биологии и медицины. 2012;1:60-62. Sinchenko OG. The use of antihypoxant and neurometabolic properties of Mexidol in the treatment of vertebrogenic radiculoishemic syndrome. Byulleten’ Ehksperimental’noi Biologii i Meditsiny. 2012;1:60-62. (In Russ.).
34. Андреев В.В. Комплексное лечение спондилогенных радикулоишемий с применением Мексидола. Бюллетень экспериментальной биологии и медицины. 2012;S1:63-68. Andreev VV. Complex treatment of spondylo genic radiculo-ischemia with the use of Mexidol. Byulleten’ Ehksperimental’noi Biologii i meditsiny. 2012;S1:63-68. (In Russ.).
Investigation of the effect of ethylmethylhydroxypyridine succinate on the effectiveness of non-steroidal anti-inflammatory drugs for visceral and somatic pain in mice and rats
E.A. Ivanova, A.G. Vasilchuk, A.I. Matyushkin, T.A. Voronina
Zakusov Institute of Pharmacology, Moscow, Russia
Abstract
Objective. To study the effect of ethylmethylhydroxypyridine succinate (EMHPS) on the analgesic effect of the non-selective cyclooxygenase (COX) inhibitor diclofenac sodium and the selective COX-2 inhibitor etoricoxib in models of acute visceral and somatic pain and to evaluate the possibility of using EMHPS in combination with COX inhibitors to reduce their doses while maintaining analgesic efficiency.
Material and methods. We studied the effect of EMHPS with a single oral administration on the analgesic effects of non-steroidal anti-inflammatory drugs (NSAIDs): the non-selective COX inhibitor diclofenac sodium and the selective COX-2 inhibitor etoricox-ib — on models of acute visceral (vinegar writhing test) and somatic pain (formalin test and mechanical hyperalgesia during inflammation) in an experiment on mice and rats.
Results. In a model of acute visceral pain in mice, EMGPS (25—100 mg/kg) does not have a significant effect on its severity, but enhances the analgesic effect of diclofenac sodium (0.5 mg/kg) and etoricoxib (1 mg/kg). In the formalin test in rats, which simulates pain during surgical incisions (trauma), EMGPS (25 mg/kg) increases the severity of the analgesic effect of COX inhibitors (1 mg/kg), primarily by reducing pain in the acute phase caused by the effect of formalin on afferent neurons. In a model of mechanical hyperalgesia in rats caused by exudative inflammation after injection of a carrageenan solution into the paw, EMHPS enhances the effect of diclofenac to a greater extent than etoricoxib.
Conclusion. The data obtained indicate the feasibility of a clinical study of the use of EMGPS in combination with NSAIDs for visceral and somatic pain in order to assess its ability to increase the therapeutic effect of NSAIDs.
Keywords: ethylmethylhydroxypyridine succinate, non-steroidal anti-inflammatory drugs, visceral pain, somatic pain, mice, rats.
Information about the authors:
Ivanova E.A. — https://orcid.org/0000-0003-4961-2051
Vasilchuk A.G. — https://orcid.org/0000-0002-9079-1322
Matyushkin A.I. — https://orcid.org/0000-0001-7640-0551
Voronina T.A. — https://orcid.org/0000-0001-7065-469X
Corresponding author: Ivanova E.A. — e-mail: iwanowaea@yandex.ru
To cite this article: Ivanova EA, Vasilchuk AG, Matyushkin AI, Voronina TA. Investigation of the effect of ethylmethylhydroxypyridine succinate on the effectiveness of non-steroidal anti-inflammatory drugs for visceral and somatic pain in mice and rats. S.S. Korsakov Journal of Neurology and Psychiatry = Zhurnal nevrologii i psikhiatrii imeni S.S. Korsakova. 2023;123(12):1—9. (In Russ.). doi.org/10.17116/jnevro20231231211
