Исследование раздельных и сочетанных эффектов актовегина, инфезола и мексидола при моделировании нарушений углеводного и липидного обмена в эксперименте
СтатьиАртюкова Марина Михайловна
Автореферат диссертации на соискание ученой степени кандидата медицинских наук, 2007г
Работа выполнена на кафедре поликлинической терапии и функциональной диагностики с курсом эндокринологии ГОУВПО «Мордовский государственный университет имени Н.П. Огарева»
Научный руководитель: доктор медицинских наук, профессор А.В. Зорькина
Официальные оппоненты: доктор медицинских наук, профессор, В.Л.Ковалева,
доктор биологических наук профессор В.П.Балашов
Ведущая организация: Федеральное государственное образовательное учреждение высшего профессионального образования «Российский государственный медицинский университет»
Общая характеристика работы
Актуальность темы. Несмотря на достигнутые успехи клинической медицины, метаболический синдром, включающий дислипидемию, сахарный диабет, ожирение и артериальную гипертонию, представляет собой одну из актуальнейших проблем общественного здравоохранения (Чазова И.Е., Мычка В.Б., 2004; Кобалова Ж.Д., Толкачева В.В., 2005; Клебанова Е.М., Балаболкин М.И., 2006; Haffner S.M., 2000) и значительно повышает риск развития фатальных сердечнососудистых осложнений (Смирнова Е.Н, 2000; Титов В.Н., 2001; Палферова Е.А., 2005; Laasko M., Lehto S., 1997).
Большой интерес клиницистов в последнее время привлекает проблема патогенеза и лечения неалкогольного стеатогепатоза печени (Мансуров Х.Х. с соавт., 2005, Подымова С.Д., 2006; Буеверов А., 2006; Crespo J. et al., 2001; Angulo P., 2002), который диагностируется при метаболическом синдроме (Корнеева О.Н с соавт., 2005; Кобалова Ж.Д, Толкачева В.В., 2005; Буеверов А., 2006). При этом поражение печени является и следствием и одной из существенных причин дальнейшего усугубления нарушения обмена веществ (Подымова С.Д., 1993; Артюнов А.Г. с соавт., 2005; Ройтберг Г.Е. с соавт., 2005).
Учитывая существенный вклад в патогенез метаболического синдрома оксидативного стресса (Балаболкин М.И. с соавт., 2004; Аметов А.С. с соавт., 2005; Суслова Т.Е. с соавт., 2005; Руяткина Л.А. с соавт., 2005; Memisogullari R. et al., 2003; Schrauwen P. et al., 2006), выступающего одним из наиболее значимых факторов поражения печени (Ройтберг Г.Е. с соавт., 2005; Poli G. 2000; G. Robertson et al., 2001), представляется целесообразным применение лекарственных препаратов антиоксидантного действия уже на ранних этапах формирования метаболического синдрома.
Одним из перспективных лекарственных средств является триоксипиридина сукцинат, проявляющий липидснижающее и антиоксидантное действие при сахарным диабете (Клебанова Е.М. с соавт., 2006). В то же время недостаточно изученным остается влияние на метаболические процессы в условиях их нарушения препаратов, действующих преимущественно на белковый обмен.
Работа является разделом комплексной программы исследований Мордовского государственного университета им. Н.П. Огарёва «Фармакологическая коррекция повреждений, возникающих при гипоксических, токсических и радиационных воздействиях». Номер государственной регистрации темы 01200004103.
Целью работы явилось исследование влияния мексидола, актовегина, инфезола и их комбинированного применения на некоторые биохимические показатели и структуру печени при моделировании нарушений липидного и углеводного обмена в эксперименте.
В ходе исследования решались следующие задачи:
- Изучить влияние актовегина, инфезола и мексидола на некоторые показатели обмена веществ и структуру печени при моделировании дислипидемии и гипергликемии в эксперименте.
- Исследовать гепатопротекторное действие комбинированного применения мексидола и актовегина в условиях моделирования дислипидемии и гипергликемии.
- Изучить влияние комбинированного применения мексидола и инфезола на некоторые биохимические показатели и структуру печени в условиях моделирования сочетанных метаболических нарушений.
Научная новизна:
Впервые показано, что в условиях моделирования нарушений углеводного и липидного обмена актовегин оказывает гиполипидемическое, дезинтоксикационное, антиоксидантное и гепатопротекторное действие.
Отмечено, что комбинированное применение актовегина и мексидола повышает гепатопротекторный эффект мексидола, потенцирует его липидкорригирующее и дезинтоксикационное действие в условиях моделирования нарушений липидного и углеводного обмена, а также потенцирует гипогликемический эффект мексидола при аллоксановом диабете.
Показано, что инфезол в условиях аллоксанового диабета и аллоксан-холестериновой дислипидемии оказывает гипогликемический, гиполипидемический, дезинтоксикационный эффект, ограничивает показатели цитолитического синдрома.
Впервые продемонстрировано, что комбинация инфезола и мексидола при аллоксановой гипергликемии уменьшает гепатопротекторное действие мексидола и в большей степени, чем монотерапия оксипиридина сукцинатом, угнетает холестеринсинтетическую функцию печени, снижает содержание триглицеридов и β-липопротеидов, ограничивает цитолитический синдром, но снижает антиоксидантный и дезинтоксикационный эффект мексидола.
Отмечено, что комбинированное применение мексидола и инфезола в условиях аллоксан-холестериновой дислипидемии снижает гепатопротекторный и антиоксидантный эффект мексидола, моделирует его липидрегулирующее и повышает дезинтоксикационное действие, в отличие от монотерапии мексидолом стимулирует альбуминсинтетическую функцию печени и предупреждает развитие гиперкалиемии.
Практическая ценность:
Полученные результаты открывают перспективу использования актовегина и инфезола в комплексной коррекции метаболического синдрома, обосновывают целесообразность комбинированного использования актовегина и мексидола при нарушениях липидного и углеводного обмена в клинике и являются экспериментальным обоснованием целесообразности дальнейшего изучения эффектов инфезола при метаболических нарушениях в эксперименте.
Основные положения, выносимые на защиту:
- Актовегин оказывает гиполипидемическое, цитопротекторное, дезинтоксикационное, антиоксидантное и гепатопротекторное действие при моделировании нарушений липидного и углеводного обмена в эксперименте.
- Инфезол оказывает гипогликемическое, гиполипидемическое, цитопроекторное, дезинтоксикационное действие при моделировании метаболических нарушений в эксперименте.
- Комбинированное применение актовегина и мексидола повышает гепатопротекторный и липидкорригирующий эффект мексидола при моделировании нарушений липидного и углеводного обмена в эксперименте, а также потенцирует гипогликемический эффект мексидола при аллоксановом диабете и дезинтоксикационный при аллоксановой гипергилкемии и аллоксан-холестериновой гипергликемии.
- Комбинированное применение инфезола и мексидола при моделировании нарушений углеводного обмена и сочетанных метаболических нарушений уменьшает гепатопротекторный эффект мексидола, угнетает холестеринсинтетическую функцию печени при аллоксановом диабете и повышает содержание холестерина липопротеидов высокой плотности при сочетанных метаболических нарушениях.
Апробация работы. Материалы работы были представлены на XII межрегиональной научно-практической конференции ГОУДПО «Пензенский институт усовершенствования врачей» - «Актуальные вопросы диагностики, лечения и реабилитации больных» (Пенза, 2006); XIV Российском национальном конгрессе «Человек и лекарство» (Москва, 2007); XII научной конференции молодых ученых аспирантов и студентов медицинского факультета ГОУВПО «Мордовский государственный университет имени Н.П.Огарева» - «Медицинские проблемы жизнедеятельности организма в норме, патологии и эксперименте» (Саранск, 2007); научно-практической конференции Санкт-Петербургской государственной медицинской академии им.И.И.Мечникова «Современная кардиология: наука и практика» (Санкт-Петербург, 2007).
Публикации. Основные положения диссертационного исследования представлены в 7 печатных работах, в том числе 1 в журнале, рекомендуемом ВАК.
Структура и объём диссертации. Диссертация изложена на 144 страницах компьютерного набора, состоит из введения, главы материалы и методы, четырех глав результатов собственных исследований, заключения, выводов, практических рекомендаций, списка использованной литературы, включающего 146 отечественных и 32 иностранных источника, иллюстрирована 24 таблицами, 28 рисунками.
Содержание работы
Материалы и методы исследования
Актовегин – высокоочищенный гемодиализат из крови телят, состоит из аминокислот, олигопептидов, нуклеозидов, промежуточных продуктов углеводного и жирового обмена, микроэлементов (натрия, кальция, фосфора, цинка, магния) (Сыч Ю., Зилов А., 2005). Препарат улучшает утилизацию глюкозы и кислорода, активирует процессы аэробного окисления, повышает энергетический потенциал клетки (Румянцева С.А. с соавт., 2004). Показана эффективность актовегина в комплексном лечении инфаркта миокарда (Креминская В.,М., Гурьева И.В., 2004; Бояринова Г.А. с соавт., 2005), в лечении и профилактике диабетической энцефалопатии и полинейропатии (Аметов А.С. с соавт., 2004; Моргоева Ф.Э. с соавт., 2005; Сыч Ю., Зилов А., 2005). В работе использовался в виде раствора для инъекций 10%-2мл производства Hafslund Nycomed Pharma.
Инфезол-40 – препарат для парентерального питания. В состав входит на 1 л раствора для инфузий L-валин 2,25г, L-изолейцин 2,1г, L-лейцин -2,74 г, Lлизин – 2г, L-метионин 1,75 г, L-треонин – 1,6 г, L-триптофан – 500мг, L-аланин- 4г, L-аргинин-4,55г, L-аспарагиновая кислота – 2г, глицин – 7г, L-гистидин-1,35г, L-глутаминовая кислота-5г, сорбит- 50г. А также натрий, калий, магний. Препарат способствует превращению аммиака в мочевину, связывает токсичные ионы аммония, которые образуются при катаболизме белков в печени. Производство Берлин-Хеми /Менарини Фарма Гмбх, выпуск флаконы по 100мл
Мексидол - (2-этил-6-метил-3-гидроксипиридина сукцинат) — синтетический водорастворимый антиоксидант из группы 3-оксипиридинов (Смирнов Л.Д. с соавт., 1992), оказывает ингибирующее влияние на ферментативное и неферментативное перекисное окисление липидов (Базанов Т.А., 1995), проявляет мембранопротекторное, антиангинальное, кардиопротекторное, дезагрегантное (Воронина Т.А. с соавт., 1992, 1993; Зорькина А.В., 1997; ГаленкоЯрошевский, В.П. с соавт., 2005), антиаритмическое (Галенко-Ярошевский, П.А. с соавт., 1998), нейротропное (Воронина Т.А. с соавт., 1997; 2006), противоишемическое и липидрегулирующее свойство, а также способность оказывать нормализующее действие на углеводный и энергетический обмен (Смирнов Л.Д. с соавт., 2001), поддерживает активность аэробного гликолиза при гипоксии (Лукьянова Л.Д., 1990). В работе использовался мексидол 5% раствор в ампулах (100мг) производства ООО МЦ «Эллара».
Экспериментальные исследования проводились на 176 нелинейных белых крысах обоего пола массой 200-300 гр. Крыс выращивали в стандартных условиях вивария. В ходе эксперимента метаболические нарушения воспроизводились с использованием трех экспериментальных моделей.
Модель 1. Аллоксановая гипергликемия: подопытным животным после 24 часового лишения пищи (при сохраненном доступе к воде) внутрибрюшинно однократно вводили раствор аллоксана в дозе 135 мг/кг (И.В. Мадянов, 1997; И.А. Волчегорский, 1997). Гипергликемия развивалась к 10 суткам.
Модель 2. Холестериновая дислипидемия: ежедневно в течение 20 суток, экспериментальным животным вводили масляный раствор холестерина в дозе 40 мг/кг/сут per os (Jowsufzai S.Y.K. et al., 1976). Дислипидемия развивалась к 10 суткам. Модель 3. Аллоксан-холестериновая дислипидемия: после 24-часового лишения пищи (при сохраненном доступе к воде) внутрибрюшинно однократно вводили раствор аллоксана в дозе 135 мг/кг, затем ежедневно в течение 20 сут, вводили масляный раствор холестерина в дозе 40 мг/кг/сут per os (Артемьева О.В., 2002).
Поставлено 17 экспериментальных серий (табл.1). Исследуемые препараты вводили с 11 по 20 сутки эксперимента: мексидол и актовегин внутримышечно, инфезол внутрибрюшинно. Дозы преператов рассчитывались, исходя из среднетерапевтических с учетом межвидового переноса доз (Freireich E.J., Lehan E., Rall D. Et al, 1966).
Таблица 1.
Структура экспериментального исследования
| N серии | Исследуемые препараты | n | |
| 1. Интактные | – | 7 | |
| Модель 1 | 2. Контроль | – | 12 |
| 3. | Мексидол 25 мг/кг в/м | 13 | |
| 4. | Актовегин 40 мг/кг в/м | 10 | |
| 5. | Мексидол 25 мг/кг в/м + Актовегин 40 мг/кг в/м | 12 | |
| 6. | Инфезол-40 2 мл в/б | 12 | |
| 7. | Инфезол-40 2 мл в/б+ Мексидол 25 мг/кг в/м | 12 | |
| Модель 2 | 8. Контроль | – | 12 |
| 9. | Мексидол 25 мг/кг в/м | 12 | |
| 10. | Актовегин 40 мг/кг в/м | 10 | |
| 11. | Мексидол 25 мг/кг в/м + Актовегин 40 мг/кг в/м | 10 | |
| Модель 3 | 12. Контроль | – | 10 |
| 13. | Мексидол 25 мг/кг в/м | 10 | |
| 14. | Актовегин 40 мг/кг в/м | 8 | |
| 15. | Мексидол 25 мг/кг в/м + Актовегин 40 мг/кг в/м | 8 | |
| 16. | Инфезол-40 в/б 2мл | 8 | |
| 17. | Инфезол-40 в/б 2 мл + Мексидол 25 мг/кг в/м | 10 | |
Забой животных осуществляли на 21 сутки путем декапитации после введения тиопентала натрия в дозе 40 мг/кг внутрибрюшинно.
По окончании эксперимента оценивали в плазме крови содержание глюкозы – глюкозооксидазным методом; уровень общего холестерина (ОХ) и триглицеридов (ТГ) – энзиматическим колориметрическим методом, холестерин липопротеидов высокой плотности (ХсЛПВП) – с использованием набора реагентов «HDL–CHOLESTEROL «FL–E»; концентрацию мочевины - уреазным/фенолгипохлоритным методом; концентрацию креатинина – по реакции Яффе с депротеинизацией; активность аспарагиновой (АСТ) и аланиновой (АЛТ) аминотрансфераз – методом Райтмана-Френкеля; содержание электролитов в сыворотке крови – калия(К) и натрия (Nа) по стандартной методике, прилагаемой к наборам на автоматическом анализаторе К/Nа «Ионометр ЭЦ–59». Индекс атерогенности [ИА=(ОХ – ХсЛПВП)/ХсЛПВП (усл. ед.)] рассчитывали по формуле А.Н. Климова (1977). Рассчитывали содержание холестерина липопротеидов очень низкой плотности (ХсЛПОНП=ТГ/2,2), холестерина липопротеидов низкой плотности (ХсЛПНП=ОХ-ХсЛПВП-ХсЛПОНП).
Для оценки альбуминсинтетической функции печени и степени эндотоксикоза определяли общую концентрацию альбуминов (ОКА), эффективную концентрацию альбуминов (ЭКА) с использованием набора реактивов «ЗОНД–Альбумин» на анализаторе АКЛ-01 «Зонд». Рассчитывали резерв связывания альбумина [РСА=ЭКА/ОКА)] и индекс токсичности плазмы [ИТ=ОКА/ЭКА–1] (Грызунов Ю.А., Добрецов Г.Е., 1994).
В гомогенатах печени определяли активность каталазы (Королюк М.А., 1988), уровень малонового диальдегида при спонтанном (МДА) и железоиндуцированном окислении (FeМДА) (Конюхова С.Г., 1989). Резерв липидов для перекисного окисления липидов рассчитывали по формуле [РЛПО=(FeМДАМДА)/МДА] (Кузьменко Д.И., Лаптев Б.И., 1999).
Гистологические изменения оценивали методом световой микроскопии. Материал фиксировали в 10% растворе нейтрального формалина и заключали в парафин. Срезы окрашивали гематоксилином и эозином.
Результаты экспериментов обрабатывали методами вариационной статистики на персональном компьютере с использованием программы Exel путем расчёта средних арифметических (М) и ошибок средних (m). Достоверность различий (р) между сравниваемыми вариационными рядами оценивали с помощью t-критерия Стьюдента.
Результаты исследования и их обсуждение
Моделирование аллоксановой гипергликемии приводило к росту содержания глюкозы в два раза, ОХ – на 76%, ТГ – на 141%, β-ЛП – на 65% и ХсЛПНП на 73%, росту ИА и ХсЛПОНП в 2 раза относительно данных интактной группы. О развитии цитолитического синдрома свидетельствовал рост активности АЛТ на 75%, АСТ – на 62%. Наблюдалось нарушение альбуминсинтетической функции печени. Снижение дезинтоксикационной функции печени проявилось в росте индекса токсичности плазмы крови в 12 раз, уровня креатинина – на 30%, мочевины – на 39% и развитии гиперкалиемии. Моделирование окислительного стресса подтверждалось увеличением в гомогенатах печени содержания МДА на 267% и FeМДА – на 61%. АОА и РЛПО снижались на 26% и 80%, компенсаторно возрастала активности каталазы на 59%.
При моделировании холестериновой дислипидемии у подопытных животных также увеличивалось содержание ОХ на 79%, ТГ – на 39%, ХсЛПОНП – на 41%. В 2 раза повышалось количество β-ЛП, в 2,5 раза – уровень ХсЛПНП, при этом ИА возрос на 114%. Повышалась активность маркеров цитолитического синдрома: АЛТ – на 63%, АСТ – на 32%. Индекс токсичности увеличился в 2 раза. Отмечалось повышение уровня креатинина на 39%. При этом в печени содержание МДА увеличилась на 261%, FеМДА – на 48%. АОА снижалась на 41%, РПОЛ - на 81%, активности каталазы возрастала на 114%.
На фоне аллоксан-холестериновой дислипидемии наблюдался рост ТГ на 135%, ХсЛПОНП, ОХС- на 51%, β-ЛП - на 82% и ХсЛПНП -на 57%. При сравнении с предыдущими моделями регистрировалась более выраженная гипергликемия, более низкое содержание Хс ЛПВП (на 26%) и повышение индекса атерогенности на 151%. Активность АЛТ возросла на 55%, АСТ – на 37%. Содержание общей и эффективной концентрации альбуминов снижалось на 40% и 13% соответственно. Резерв связывания альбуминов уменьшался на 32%, а индекс токсичности вырос почти в 6 раз. Отмечалось повышение уровня мочевины на 28%. В печени наблюдалось нарастание МДА более чем в 2 раза, активация каталазы на 50%, снижение: АОА на 26%, РЛПО – на 67% (р<0,001).
По сравнению с интактными животными при моделировании метаболических нарушений наблюдалось повреждение дольковой и балочной структуры печени за счет очагов некроза гепатоцитов.
Производное 3-оксипиридина мексидол проявил гепатопротекторное действие в условиях всех трех использованных в данном исследовании моделей метаболических нарушений, ограничивая грубые изменения гепатоцитов: предотвращалось нарушение балочной структуры печени (особенно на модели №1), не наблюдалось кариопикноза, снижался ядерный полиморфизм, уменьшалось количество некротизированных гепатоцитов.
Одним из механизмов реализации гепаторотекторного эффекта мексидола явилось антиоксидантное действие препарата: в условиях аллоксановой гипергликемии в ткани печени содержание МДА снижалось на 70% (р<0,001), FeМДА – на 36% (р<0,001) по сравнению с контрольной группой. В условиях холестериновой дислипидемии уровень МДА в ткани печени снижался на 61% (р<0,005), Fe-МДА – на 41% (р<0,001). На модели сочетанных метаболических нарушений (№3) МДА снижался на 36% (р<0,005). Кроме того, на фоне введения мексидола при моделировании аллоксановой гипергликемии улучшалась альбуминсинтетическая функция печени: рост общей концентрации альбуминов составил 62% (р<0,05). Уменьшение выраженности эндотоксикоза при введении мексидола проявилось на фоне аллоксановой гипергликемии в росте эффективной концентрации альбуминов на 218% (р<0,005), резерва связанного альбумина – на 99% (р<0,05), снижении индекса токсичности на 91% (р<0,001) и уровня креатинина – на 17% (р<0,05). На фоне моделирования аллоксан-холестериновой дислипидемии отмечалось снижение индекса токсичности на 48% (р<0,05). При этом, отмечалось увеличение калия в плазме крови в условиях моделирования холестериновой дислипидемии и аллоксан-холестериновой дислипидемии на 26% и 23% (р<0,05).
Нарушение липидного обмена играют значимую роль в патогенезе сахарного диабета (Козлов С.Г., Лякишев А.А., 2002; Соколик В.В. с соавт., 2005; Steiner G., 1999; MrEneny J. et al. 2000; Memisogullari R. et al., 2003). Гиполипидемическое действие мексидола проявилось в условиях всех трех использованных моделей метаболических нарушений: при аллоксановой гипергликемии в снижении ОХ на 20% (р<0,05), s-ЛП – на 35% (р<0,005), ХсЛПНП –на 61% (р<0,005), ИА на 78% (р<0,005) и росте ХсЛПВП на 58% (р<0,01) (рис.8). При моделировании холестериновой дислипидемии (рис.4) применение мексидола позволило снизить содержание ОХ на 18% (р<0,01), β-ЛП – на 52% (р<0,001), уровень ИА – на 63% (р<0,005) и повысить ХсЛПВП на 87% (р<0,01). При введении мексидола на фоне аллоксан-холестериновой дислипидемии (модель №3) отмечалось снижение ОХ и β-ЛП на 33% (р<0,05), ХсЛПНП – на 43% (р<0,05). Индекс атерогенности снизился на 49% (р<0,001).
При этом, введение мексидола в условиях модели №1 и №3 снижало уровень гипергликемии на 48% (р<0,05), хотя на фоне холестериновой дислипидемии, напротив, наблюдался рост содержания сахара в сыворотке крови на 35% (р<0,005).
Актовегин в изученной дозе также оказал гепатопротекторное действие, более значимое в условиях моделирования холестериновой дислипидемии, где сохранялось балочное строение долек, ограничивались дистрофические изменения гепатоцитов и ядерный полиморфизм (но явления кариолизиса не предотвращались). В условиях аллоксановой гипергликемии и аллоксан-холестериновой дислипидемии нарушение балочной структуры печени было менее выраженным, чем в контроле, уменьшалось количество некротизированных гепатоцитов и выраженность лимфогистиоцитарной инфильтрации портальных трактов.
Оксидативному стрессу придается большое значение в патогенезе неалкогольного стеатогепатоза при метаболических нарушениях (Pera N. et al., 1999; G. Robertson et al., 2001). При введении актовегина на фоне аллоксановой гипергликемии снижалось накопление вторичных продуктов ПОЛ в ткани печени: МДА – с 13,91Ѓ}0,88 до 4,66Ѓ}0,34 ммоль/л (p<0,001) и FеМДА – с 20,78Ѓ}1,36 ммоль/л до 15,64Ѓ}0,93 ммоль/л (p<0,01). РЛПО и АОА повышались, активность каталазы снижалась (рис.1). На фоне холестериновой дислипидемии содержание МДА в ткани печени при введении актовегина также уменьшалось (рис.1). Наблюдался рост РЛПО и снижение активности каталазы. При аллоксан-холестериновой дислипидемии отмечалось снижение содержания МДА (с 8,36Ѓ}0,57 до 3,81Ѓ}0,26ммоль/л, р<0,001) и FeМДА (с 15,30Ѓ}1,11 до 6,20Ѓ}0,81 ммоль/л, р<0,001), снижалась активности каталазы и АОА (рис.1).
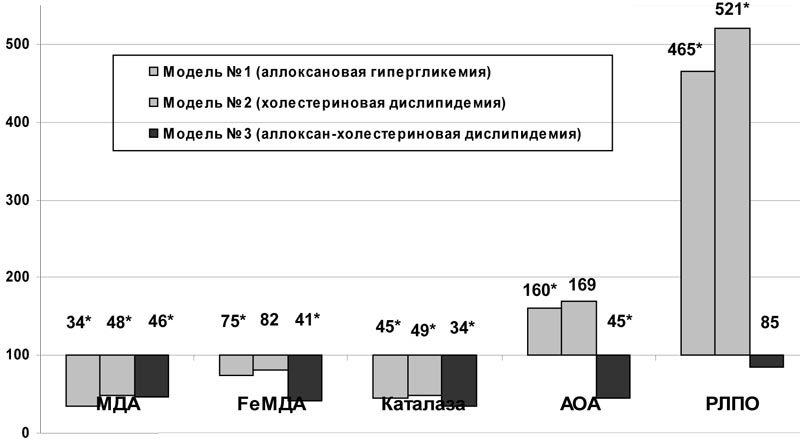
Рис.1. Влияние актовегина на некоторые показатели ПОЛ и антиоксидантной защиты ткани печени при моделировании нарушений углеводного и липидного обмена (в % к данным соответствующей контрольной группы); * - достоверность различия р<0,05 по сравнению с данными контроля.
Актовегин проявил мембранопротекторный эффект на модели аллоксанхолестериновой дислипидемии, снижая активность АЛТ – на 58% (р<0,001), АСТ – на 41% (р<0,001).
Кроме того, введение актовегина улучшало альбуминсинтетическую функцию печени при аллоксановой гипергликемии: общая концентрация альбуминов повысилась на 62% (р<0,005). А снижение эндотоксикоза проявилось в увеличении эффективной концентрации альбуминов на 302% (р<0,001), резерва связывания альбуминов – на 88% (р<0,001) и снижении индекса токсичности на 87% (р<0,001), а также в уменьшении концентрации мочевины на 35% (р<0,05). Следует также отметить, что на фоне введения актовегина в условиях аллоксановой гипергликемии предотвращалось развитие гиперкалиемии (с 5,310,28 ммоль/л в соответствующей контрольной группе до 4,00,15 ммоль/л, р<0,05),
При аллоксан-холестериновой дислипидемии актовегин привел к росту эффективной концентрации альбуминов на 57% (р<0,001), резерва связывания альбуминов – на 34% (р<0,01), снижению индекса токсичности в три раза (р<0,001), а концентрации мочевины – на 35% (р<0,05). Однако при этом наблюдался рост креатинина на 50% (р<0,01). При моделировании холестериновой дислипидемии актовегин в изученной дозе не влиял на показатели эндотоксикоза, но при этом наблюдался рост содержания калия на 11% (р<0,05).
Липидрегулирующее действие актовегина проявилось в условиях всех трех моделей метаболических нарушений: на фоне аллоксановой гипергликемии снижались уровни ТГ и ХсЛПОНП на 59% (р<0,01), β-ЛП - на 35% (р<0,005), ХсЛПНП - на 52%, индекса атерогенности - на 77% (р<0,005) (рис.2). Фракция ХсЛПВП увеличилась на 78% (p<0,001). При моделировании холестериновой дислипидемии ОХ снижался на 11% (р<0,05), ТГ – на 34% (р<0,05), s-ЛП – на 50% (р<0,001), ХсЛПОНП – на 32% (р<0,05) и ХсЛПНП – на 69% (р<0,05). При этом наблюдался рост величины антиатерогенной фракции холестерина – ХсЛПВП на 171% (р<0,001) и снижение индекса атерогенности на 87% (р<0,001) (рис.2). По сравнению с мексидолом в изученных дозах на фоне введения актовегина в условиях данной модели дислипидемии был отмечен более выраженный рост ХсЛПВП (р<0,05) и снижение ИА (р<0,05). Коррекция актовегином при аллоксан-холестериновой дислипидемии привела к увеличению ХсЛПВП и снижению ТГ в 2 раза (р<0,001), уменьшению ХсЛПОНП на 48% (р<0,005), βЛП – на 33% (р<0,05), ИА – на 72% (р<0,001) (рис.2).
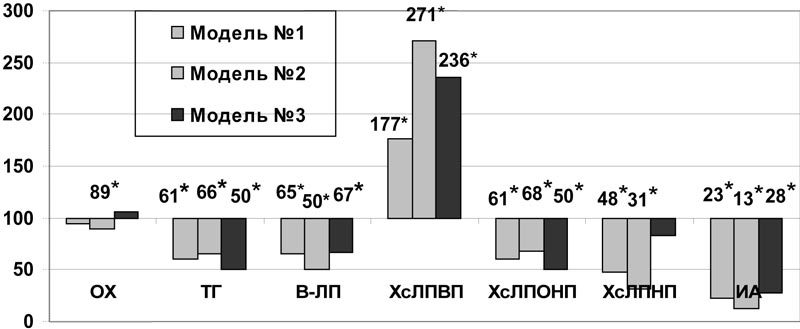
Рис.2. Влияние актовегина на некоторые показатели липидного обмена в плазме крови при моделировании нарушений углеводного и липидного обмена (в % к данным соответствующей контрольной группы); * - достоверность различия р<0,05 по сравнению с данными контроля.
Актовегин в условиях моделирования аллоксановой гипергликемии и аллоксан-холестериновой дислипидемии не предотвращал роста содержания глюкозы в плазме крови, а в условиях холестериновой дислипидемии приводил к повышению ее уровня на 56% (р<0,05).
Введение инфезола в изученной дозе не оказало существенного влияния на структуру печени в условиях аллоксановой гипергликемии и аллоксан-холестериновой дислипидемии: уменьшалось только плазматическое пропитывание стенок сосудов и выраженность лимфогистиоцитарной инфильтрации, но повреждение балочной структуры печени и самих гепатоцитов не предотвращалось, прослеживались очаговые центролобулярные и парциальные некрозы, не снижалась полиморфность ядер.
Следует отметить, что позитивным эффектом при курсовом введении инфезола явилось значительное снижение уровня гликемии в условиях аллоксанового диабета – на 40% (р<0,01), в условиях аллоксан-холестериновой дислипидемии - на 62% (р<0,001). Кроме того, введение инфезола привело к снижению активности АЛТ и АСТ на 41% и 32% (р<0,05) при аллоксановой гипергликемии и АЛТ на 47% (р<0,001) при аллоксан-холестериновой дислипидемии. Уменьшалась и выраженность эндогенной интоксикации. Так, на фоне аллоксановой гипергликемии повышался уровень резерва связывания альбуминов на 88% (р<0,001), снижался индекс токсичности на 87%(р<0,001) и уровень мочевины в плазме крови – на 42% (р<0,005). При моделировании сочетанных метаболических нарушений увеличился резерв связывания альбуминов на 25% (р<0,05), снижалась концентрация мочевины на 11% (p<0,01).
Введение инфезола оказало значительное влияние на показатели липидного обмена: на фоне аллоксановой гипергликемии снижались не только ОХ, ТГ, β-ЛП, ХсЛПОНП (р<0,001) и ХсЛПНП (р<0,05)), но и антиатерогенная фракция - ХсЛПВП - на 43% (р<0,05). Рост индекса атерогенности при этом не предотвращался (рис. 3). Более благоприятным оказалось влияние препарата на показатели липидного обмена плазмы крови при моделировании аллоксан-холестериновой дислипидемии, где на фоне снижения ТГ (р<0,001), β-ЛП (р<0,001), ХсЛПНП (р<0,05), ХсЛПОНП (р<0,001) наблюдался рост ХсЛПВП в 2,8 раза (р<0,001), что привело к достоверному снижению индекса атерогенности на 84% (р<0,001) (рис.3).
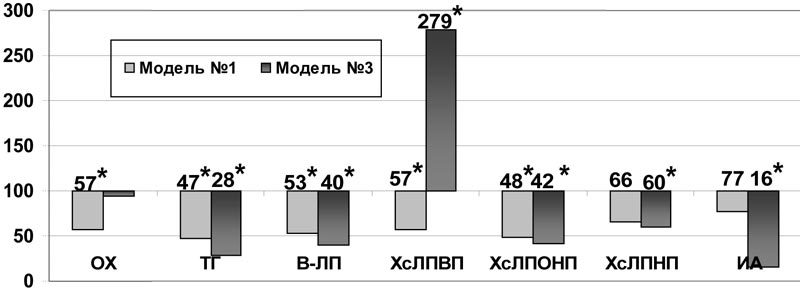
Рис.3. Влияние инфезола на некоторые показатели липидного обмена в плазме крови при моделировании нарушений углеводного и липидного обмена (в % к данным соответствующей контрольной группы); * - достоверность различия р<0,05 по сравнению с данными контроля.
Однако, при этом на фоне введения инфезола не снижалось накопление вторичных продуктов ПОЛ в ткани печени, а при моделировании сочетанных метаболических нарушений, напротив, отмечался рост уровня ТБК-реагирующих продуктов (р<0,05). Активность каталазы в ткани печени на фоне аллоксановой гипергликемии при этом снижалась на 54% (р<0,001), АОА увеличилась в 2,8 (р<0,001), а РЛПО – в 5,5 (р<0,05).
На следующем этапе исследования мы оценили эффекты сочетанного применения препаратов на фоне моделирования метаболических нарушений. Комбинированное введение актовегина и мексидола в значительной степени предотвращало повреждение структуры печени, что проявилось в сохранности дольковой и балочной структуры печени и уменьшении дистрофических изменений гепатоцитов в условиях всех трех моделей. При этом развитие некрозов гепатоцитов на фоне аллоксановой гипергликемии предотвращалось, а в условиях холестериновой дислипидемии и аллоксан-холестериновой дислипидемии количество некротизированных гепатоцитов значительно уменьшалось, ограничивался полиморфизм их ядер и выраженность лимфогистиоцитарной инфильтрации портальных трактов.
При комбинации актовегина и мексидола на фоне аллоксановой гипергликемии несомненно позитивным моментом явилось усиление гипогликемического эффекта мексидола на 23% (с 8,06±0,42 до 6,22±0,40 ммоль/л, р<0,05) (рис.4). Кроме того, в отличие от монотерапии мексидолом, в большей степени снижалась активность АЛТ, АСТ и содержание креатинина (р<0,05) (рис. 4).
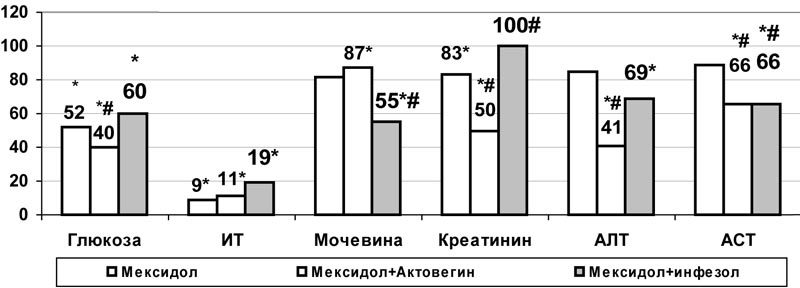
Рис.4. Влияние комбинированного применения мексидола с актовегином и инфезолом на содержание глюкозы и некоторые показатели эндотоксикоза в плазме крови белых крыс при аллоксановой гипергликемии (в % к данным соответствующей контрольной группы); * - достоверность различия р<0,05 по сравнению с данными контроля, #- по сравнению с показателями монотерапии мексидолом.
Антиоксидантное действие мексидолом в печени при комбинации с актовегином не повышалось: изученные в данной работе показатели ПОЛ и антиоксидантной защиты печени не отличались от результатов с монотерапией мексидолом. Не было достоверных отличий и в показателях липидного обмена (рис.7), а также в величине индекса токсичности (рис.4) и резерва связывания альбумина, хотя общая и эффективная концентрация альбумина были ниже на 48% (р<0,05) и 47% (р<0,05) соответственно.
В условиях моделирования холестериновой дислипидемии при комбинированном введении актовегина и мексидола активность трансаминаз, а также показатели свойств альбумина не отличались от данных монотерапии мексидолом, но наблюдалось более высокое (на 30%, p<0,005) содержание глюкозы в плазме крови подопытных животных по сравнению с введением только мексидола. Но при этом, в отличие от монотерапии, предотвращалось развитие гиперкалиемии (4,28±0,19 ммоль/л по сравнению с 5,35±0,32 ммоль/л при введении мексидола, р<0,05). В условиях этой модели использование комбинации препаратов повышало эффективность липидкорригирующего действия мексидола по сравнению с монотерапией: еще больше увеличивалось содержание ХсЛПВП (на 56%, р<0,05), снижалось содержание ХсЛПНП (в 5 раз, р<0,001) и ИА (в 5 раз, р<0,001) (рис. 5). Следует особо подчеркнуть, что при этом содержание ХсЛПНП и величина ИА была достоверно ниже и показателей при монотерапии актовегином на 71% и 49% соответственно (р<0,05).

Рис.5. Влияние комбинированного применения мексидола с актовегином на некоторые показатели липидного обмена плазмы крови при холестериновой дислипидемии (в % к данным контрольной группы); * - достоверность различия р<0,05 по сравнению с данными контроля, #- по сравнению с показателями монотерапии мексидолом
Комбинированное применение актовегина и мексидола на фоне холестериновой дислипидемии по сравнению с монотерапией производным 3-оксипиридина привело к повышению FeМДА на 69% (р<0,05), активности каталазы – на 62% (р<0,05), АОА – на 133% (р<0,001) и РЛПО – в 2,5 раза (р<0,001). Причем, активность каталазы и АОА превышали и данные с введением актовегина на 29% и 47% соответственно (р<0,05).
Наиболее интересным с точки зрения перспектив для дальнейшего клинического применения было комбинированное введение актовегина и мексидола в условиях моделирования сочетанных метаболических нарушений. В отличие от монотерапии мексидолом наблюдалось уменьшение активности АЛТ на 37% от уровня контрольной группы (р<0,05).
Кроме того, при комбинированном использовании актовегина и мексидола в большей степени, чем при монотерапии мексидолом, повышалась альбуминсинтетическая функции печени: общая концентрация альбумина возросла на 20% (р<0,05) (рис.6). А также уменьшалась степень эндогенной интоксикации: наблюдалось более выраженное снижение индекса токсичности (в 2 раза, р<0,05) и более значительный рост эффективной концентрации альбумина – на 36% (р<0,05), резерва связанного альбумина – на 12% (р<0,05) по сравнению с монотерапией производным 3-оксипиридина. В отличие от использования с целью коррекции только мексидола, комбинированное применение препаратов позволило снизить уровень креатинина (на 36%, р<0,05) и калия (на 9%, р<0,05), полностью предотвратив развитие гиперкалиемии (рис.6).
Показатели ПОЛ и антиоксидантной защиты в ткани печени при этом в основном не отличались от данных монотерапии мексидолом, ниже был только уровень FeМДА на 24% (р<0,05). Потенцирования гипогликемического эффекта также не наблюдалось: содержание глюкозы в плазме крови не отличалось от данных группы с введением только мексидола. Но при этом на фоне комбинированного использования мексидола и актовегина в условиях моделирования сочетанных нарушений липидного и углеводного обмена, по сравнению с монотерапей мексидолом, снижалось содержание ТГ на 43% (р<0,05), ХсЛПОНП на 46% (р<0,05). В большей степени (на 89%) возрастал уровень ХсЛПВП (р<0,01) и снижался индекс атерогенности (р<0,001) (рис.6).
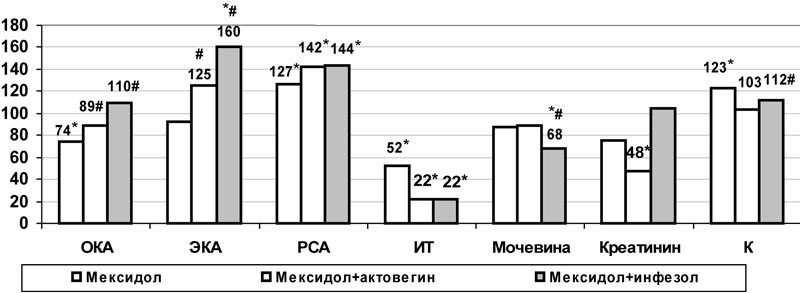
Рис. 6. Влияние комбинированного применения мексидола с актовегином и инфезолом на некоторые показатели эндотоксикоза плазмы крови при моделировании сочетанных нарушений углеводного и липидного обмена (в % к данным контрольной группы); * - достоверность различия р<0,05 по сравнению с данными контроля, #- по сравнению с данными монотерапии мексидолом.
Таким образом, комбинированное применение актовегина и мексидола оказывает значительное корригирующее воздействие на ряд биохимических показателей при сочетанных метаболических нарушениях.
В отличие от комбинации с актовегином, сочетанное использование инфезола и мексидола не привело к усилению гепатопротекторного эффекта мексидола. В условиях моделирования аллоксановой гипергликемии только несколько ограничивалось нарушение балочной структуры печени, не предотвращались дистрофические и некротические изменения гепатоцитов, не ограничивался полиморфизм их ядер и лимфогистиоцитарная пролиферация. В условиях аллоксан-холестериновой дислипидемии нарушение балочного строения печени не предотвращалось, регистрировались крупные очаги некрозов. Наблюдался выраженный полиморфизм ядер гепатоцитов, кариолизис, сохранялась лимфогистиоцитарная инфильтрация.
При этом в изменении лабораторных показателей наблюдались отдельные позитивные эффекты. Так, комбинация инфезола и мексидола в условиях моделирования аллоксановой гипергликемии в большей степени снижала активность АСТ, чем монотерапия мексидолом (р<0,05), и не влияла на гипогликемический эффект производного 3-оксипиридина (рис.3). Но содержание МДА в печени при этом было в 2,5 раза (р<0,001), а FeМДА – на 75% выше, чем на фоне монотерапии (р<0,05). Содержание мочевины снижалось в большей степени (р<0,05), но уровень креатинина оказался выше (р<0,05) (рис.3). Менее выраженным, чем при монотерапии мексидолом, оказалось и влияние комбинации препаратов на показатели свойств альбуминов: общая концентрация альбуминов была на 27% (р<0,05), эффективная концентрация - на 44%, резерв связанного альбумина – на 27% (р<0,05) ниже, чем при монотерапии производным 3-оксипиридина.
Следует отметить, что позитивным эффектом применения комбинации инфезола и мексидола, по сравнению с введением только мексидола, в условиях модели №1 явилось более значительное снижение содержания ОХ (на 36%, р<0,05), ТГ (на 57%, р<0,05) s-ЛП (на 57%, р<0,05). Но одновременное снижение содержания ХсЛПВП (р<0,05), свидетельствующее об угнетении холестеринсинтетической функции печени, привело к росту ИА и ХсЛПНП по сравнению с введением только производного 3-оксипиридина (рис.7).
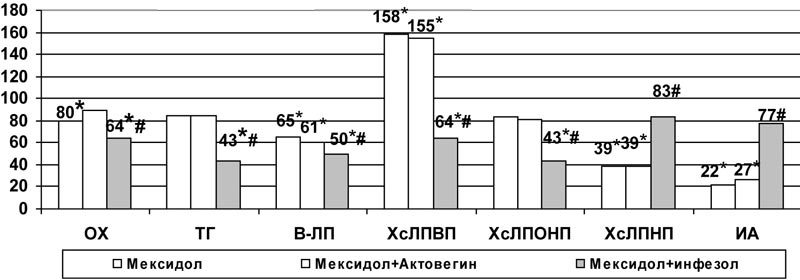
Рис.7. Влияние комбинированного применения мексидола с актовегином и инфезолом на показатели липидного обмена плазмы крови при аллоксановой гипергликемии (в % к данным контрольной группы); * - достоверность различия р<0,05 по сравнению с данными контроля, #- по сравнению с показателями монотерапии мексидолом
В условиях аллоксан-холестериновой дислипидемии на фоне введения комбинации инфезола и мексидола по сравнению с монотерапией мексидолом, несмотря на рост ОХ (на 89%, р<0,001) и β-ЛП (на 23%, р<0,05), содержание ТГ и ХсЛПОНП снижалось на 23% (р<0,05), индекс атерогенности – на 69% (р<0,001) за счет роста ХсЛПВП на 150% (р<0,001) (рис.8). Положительным моментом по сравнению с монотерапией мексидолом был рост общей концентрации альбуминов на 48%, а также дальнейшее снижение выраженности эндогенной интоксикации (рис.6) за счет повышения ЭКА на 74% (р<0,01), РСА на 13% (р<0,001) и снижения содержание мочевины на 22% (р<0,05). В отличие от введения мексидола (р<0,05) не наблюдалось и роста содержания калия в плазме крови (рис.6).
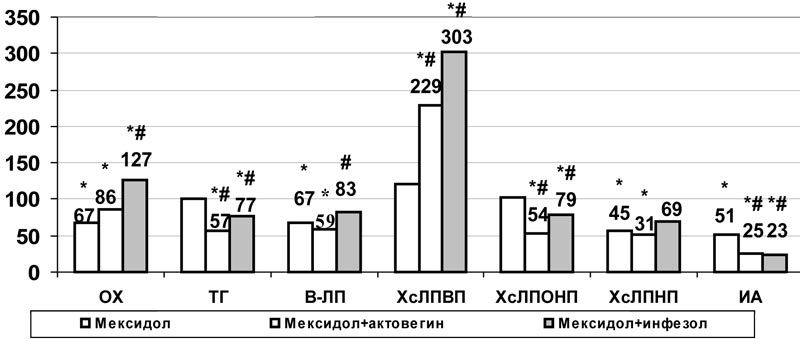
Рис. 8. Влияние комбинированного применения мексидола с актовегином и инфезолом на некоторые показатели липидного обмена плазмы крови при моделировании сочетанных нарушений углеводного и липидного обмена (в % к данным контрольной группы); * - достоверность различия р<0,05 по сравнению с данными контроля, #- по сравнению с показателями монотерапии мексидолом
Однако, негативным эффектом при использовании комбинации инфезола и мексидола на фоне аллоксан-холестериновой дислипидемии явился рост активности цитолитических ферментов не только по сравнению с монотерапией мексидолом, но даже с данными контроля: АЛТ более, чем в 2 раза (р<0,001) и АСТ на 14%. В гомогенатах печени при этом отмечался рост МДА и FeМДА также не только по сравнению с монотерапией (р<0,001), но и по сравнению с контролем (на 41% и 62% соответственно, р<0,005). Активность каталазы и АОА не отличались, а РЛПО был ниже серии с применением производного 3оксипиридина на 65% (р<0,005).
Таким образом, наибольшую эффективность на фоне моделирования сочетанных метаболических нарушений показала комбинация актовегина и мексидола.
Выводы
- При моделировании нарушений липидного обмена актовегин (40 мг/кг) оказывает гиполипидемическое действие, ограничивает структурные повреждения печени и уменьшает выраженность эндогенной интоксикации.
- В условиях моделирования сочетанных нарушений липидного и углеводного обмена актовегин в изученной дозе проявляет гиполипидемическое, гипогликемическое, цитопротекторное, дезинтоксикационное и антиоксидантное действие и уменьшает структурные повреждения печени.
- Комбинированное применение актовегина и мексидола повышает гепатопротекторный, гиполипидемический и дезинтоксикационный эффект мексидола при моделировании нарушений липидного, углеводного обмена и сочетанных метаболических нарушений. В условиях моделирования аллоксановой гипергликемии потенцирует гипогликемическое, антиоксидантное действие мексидола и предупреждает гиперкалиемию.
- Инфезол в изученной дозе в условиях аллоксановой гипергликемии и аллоксан-холестериновой дислипидемии не ограничивает структурные повреждения печени, но снижает холестеринсинтетическую функцию печени, оказывает гипогликемическое, дезинтоксикационное действие и снижает активность цитолитического синдрома.
- Комбинированное применение инфезола и мексидола снижает антиоксидантный эффект мексидола в ткани печени и его гепатопротекторное действие, уменьшает холестеринсинтетическую функцию печени при аллоксановом диабете и повышает содержание холестерина липопротеидов высокой плотности и общего холестерина при сочетанных нарушениях липидного и углеводного обмена.
Практические рекомендации
Целесообразно дальнейшее клиническое исследование комбинированного применения мексидола и актовегина для коррекции сочетанных метаболических нарушений липидного и углеводного обмена и повышения гиполипидемического и гепатопротекторного эффекта мексидола. Целесообразно дальнейшее экспериментальное исследование гепатопротекторного, гиполипидемического и гипогликемического действия инфезола, а также липидрегулирующего эффекта комбинированного применения инфезола и мексидола при сочетанных нарушениях липидного и углеводного обмена.
Список работ, опубликованных по теме диссертации
- Хоронеко С.Е., Артюкова М.М. Морфологические аспекты адаптации организма в условиях гиперхолестеринении.// Материалы XII межрегиональной научно-практической конференции ГОУ ДПО «Пензенский институт усовершенствования врачей Федерального агентства по здравоохранению и социальному развитию» - «Актуальные вопросы диагностики, лечения и реабилитации больных» -- Пенза – 20 октября 2006 г. – С.305-307.
- Артюкова М.М., Ершкова Н.Г., Горожанин С.В., Киселева О.М., Зорькина А.В. Влияние мексидола и актовегина на некоторые метаболические показатели при нарушении углеводного обмена в эксперименте. //XIV Российский национальный конгресс «Человек и лекарство» Сборник материалов конгресса (тезисы докладов) - Москва 2007. - С.794.
- Зорькина А.В., Хоронеко С.Е., Артюкова М.М. Влияние мексидола и актовегина на структуру печени белых крыс при моделировании аллоксан – холестериновой дислипидемии. // Медицинские науки- №4 (16) – 2006 .- С. 30-31.
- Ивлиева Е.Н., Бин Хатабин Х.А.А., Артюкова М.М. Коррекция метаболических нарушений лекарственными препаратами и соединениями с антиоксидантным типом действия при экспериментальных дислипидемиях. // Медицинские проблемы жизнедеятельностим организма в норме, патологии и эксперименте: материалы XII научной конференции молодых ученых аспирантов и студентов медицинского факультета Мордов. гос. ун-та. Выпуск 7.- Саранск Изд-во Мордов. Ун-та, 2007.– С.40-42.
- Зорькина А.В., Ямашкина Е.И.. Артюкова М.М., Столярова В.В.Влияние мексидола и актовегина на некоторые биохимические показатели при индуцированном метаболическом синдроме //Материалы научнопрактической конференции, «Современная кардиология: наука и практика» Вестник Санкт-Петербургской государственной медицинской академии им. И.И.Мечникова. -2007, №2 (2), Приложение. - С. 66-67.
- Зорькина А.В., Артюкова М.М., Бин Хатабин Х.А., Юдина Н.Д. Новые возможности в регуляции метаболического синдрома // Вестник восстановительной медицины. -2007, №4. –С.41-45.
- Исследование влияния мексидола и актовегина на некоторые биохимические показатели при комбинированном нарушении углеводного и липидного обмена в эксперименте //Медицинские науки. –2007, №4.-С.14-16.
