Таурин в лечении неалкогольной жировой болезни печени
Статьи
Л. А. Звенигородская, Т. В. Нилова
Московский клинический научно-практический центр Проведено двойное слепое плацебоконтролируемое клиническое исследование, в котором оценивалась клиническая эффективность таурина у больных с неалкогольной жировой болезнью печени (НАЖБП) и сахарным диабетом типа 2 (СД2).
Результаты показали, что препарат влияет на обмен липидов и углеводов, а также является типичным гепатопротектором.
Ключевые слова: неалкогольная жировая болезнь печени, таурин, комплексное медикаментозное лечение
Taurine in non-alcoholic fatty liver disease treatment
L. A. Zvenigorodskaya, T. V. Nilova
Moscow Clinical Scientific and Practical Center In double-blind, placebo-controlled clinical trial taurine clinical efficacy in patients with non-alcoholic fatty liver disease and diabetes mellitus type 2 was evaluated.
The results of this study have shown effects of taurine on lipid and carbohydrate metabolism and also that taurine is a typical hepatoprotector.
Key words: non-alcoholic fatty liver disease, taurine, complex conservative prevention
Патогенез неалкогольной жировой болезни печени. Подходы к лечению
Неалкогольная жировая болезнь печени (НАЖБП) в настоящее время признана самым распространенным в популяции заболеванием и представляет собой поражение печени, включающее жировую дистрофию с воспалением и повреждением гепатоцитов – неалкогольным стеатогепатитом (НАСГ) и фиброзом с возможностью перехода в цирроз. НАЖБП в 75 % случаев протекает на фоне ожирения, дислипидемии, артериальной гипертонии, сахарного диабета типа 2 (СД2) или нарушением толерантности к глюкозе [1–3]. Указанные патологические процессы являются факторами риска сердечно-сосудистых заболеваний и атеросклероза. В патогенезе немаловажную роль играет нарушение микрофлоры толстой кишки и, как следствие, повышение содержания продуктов жизнедеятельности микроорганизмов (короткоцепочечные жирные кислоты, эндотоксин, оксид азота) [4–6]. Биопсия печени – наиболее специфичный и чувствительный диагностический метод выявления заболевания; когда нет возможности провести пункционную биопсию печени, для раннего выявления воспаления при НАЖБП можно использовать определение маркеров воспаления – оксида азота и эндотоксина [7].
В настоящее время для лечения больных НАЖБП используют препараты, сочетающие в себе антиоксидантную защиту, стабилизацию мембран гепатоцитов, противовоспалительную терапию [8].
Терапия НАЖБП включает следующие группы препаратов:
- гепатопротекторы (эссенциальные фосфолипиды, урсодезоксихолевая кислота, препараты липоевой кислоты, орнитин, таурин);
- другие гиполипидемические средства (липостабил), (ω-3 триглицериды – эйканол);
- антиоксиданты (витамины – аевит и др.);
- антибактериальные препараты (для санации толстой кишки: рифаксимин, метронидазол, макролиды и др.);
- пребиотики (бифидобактерии и лактобактерии) и пробиотики (пищевые волокна и др.).
Надо отметить, что в терапии НАЖБП недооцененным остается таурин. Между тем, представляя собой естественный метаболит, таурин обладает гепатопротекторным, антиоксидантным, гиполипидемическим и гипогликемическим эффектами.
Общие сведения
Таурин – жизненно необходимая сульфоаминокислота, являющаяся конечным продуктом обмена серосодержащих аминокислот (метионина, цистеина, цистеамина) [9, 10]. Молекула таурина состоит из 2 атомов углерода, сульфоновой группы (SO3H) и аминогруппы (NH2). Биологический синтез таурина недостаточен для поддержания у человека тех биохимических процессов, в которых он задействован. Основным источником таурина являются мясные и рыбные продукты. При дефиците таурина в питании или в результате каких?либо иных причин (ишемия, сахарный диабет, стресс, травма и др.) страдают все виды обмена веществ любой клетки любого органа. Например, недостаточность таурина в печени ведет к нарушению желчевыделения, образованию камней, изменению обмена холестерина и липидов. Известно, что таурин, соединяясь с холевой кислотой, участвует во всасывании жиров и жирорастворимых витаминов.
Таурин может соединяться с атомом хлора, источник которого – гипохлорная кислота нейтрофилов. В этом виде таурин служит окислителем и является компонентом в борьбе против бактериальной инфекции. В митохондриях хлораминотаурин влияет на сборку белков дыхательной цепи и проявляет свойства антиоксиданта. Это же соединение таурина с хлором уменьшает воспалительный сигнал в клетках животных через ингибирование активации нуклеарного фактора k-би. В свободном виде таурин также выполняет жизненно важные для животной клетки функции – регуляцию осмотического давления и ионов кальция.
Роль таурина в физиологии печени
Таурин участвует в регуляции желчевыделения. Как мы помним, первичные желчные кислоты (холевая и хенодезоксихолевая) синтезируются в гепатоцитах печени из холестерина. Вторичные желчные кислоты (дезоксихолевая, литохолевая, урсодезоксихолевая, аллохолевая и др.) образуются из первичных желчных кислот в толстой кишке. В желчи желчного пузыря желчные кислоты присутствуют главным образом в виде конъюгатов – парных соединений с глицином и таурином. Продуктом конъюгации желчных кислот с таурином являются таурохолевая, таурохенодезоксихолевая и тауродезоксихолевая кислоты. Конъюгация желчных кислот обеспечивает их устойчивость в отношении выпадения в осадок при низких значениях рН в желчных протоках и двенадцатиперстной кишке. Важнейшая роль желчных кислот в пищеварении заключается в том, что с их помощью происходит всасывание целого ряда гидрофобных веществ: холестерина, жиров, жирорастворимых витаминов, растительных стероидов. При отсутствии желчных кислот всасывание вышеперечисленных компонентов пищи практически невозможно.
Поступление в кишечник таурохолевой кислоты снижает количество E. coli в слепой кишке [11]. Кроме того, тауроконъюгаты желчных кислот обладают холеретическим действием и предупреждают холестаз в отличие от желчных кислот, конъюгированных с глицином [12, 13]. В эксперименте in vitro гликолитохолевая кислота легко осаждается кальцием, чего не наблюдается с тауролитохолевой кислотой [14]. Таким образом, таурин необходим для повышения текучести желчи, увеличения продукции желчных кислот и предупреждения холестаза [15, 16].
При диффузных заболеваниях печени таурин увеличивает кровоток, улучшает микроциркуляцию и уменьшает выраженность цитолиза [1]. Показана его эффективность в отношении влияния на углеводный и липидный обмен. Антиоксидантное, гипогликемирующее, детоксицирующее действие таурина и его способность к выведению холестерина дает возможность применять его для лечения НАЖБП. На фоне приема таурина при хронической сердечной недостаточности больные отмечают исчезновение одышки, чувствуют прилив сил, увеличение трудоспособности, улучшение общего состояния. У больных с артериальной гипертонией препарат умеренно снижает артериальное давление (АД), при сахарном диабете (CД) уменьшает инсулинорезистентность, защищает b-клетки поджелудочной железы, оказывает гипогликемическое действие, не вызывая при этом гипогликемии.
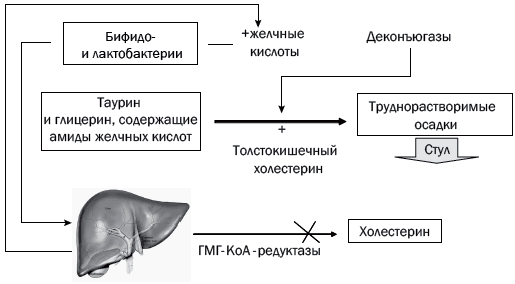
Рис. 1. Схема выведения холестерина
Взаимодействие желчных кислот и энтеробактерий
В процессах деконъюгации комплексов желчных кислот с таурином и глицином активно участвуют ферменты различных бактерий. В норме дезоксихолевая и хенодезоксихолевая кислоты при участии секреторного IgA, влияющего на антимикробную активность этих кислот, подавляют рост патогенных и условно-патогенных микроорганизмов даже в физиологических концентрациях [18]. При нарушении энтерогепатической циркуляции желчных кислот создается их значительный дефицит в кишечнике. В тонкой кишке недостаток желчных кислот изменяет работу всего пищеварительно-транспортного конвейера, способствует развитию нарушений всасывания и переваривания пищи – синдрома нарушенного пищеварения. В толстой кишке нехватка желчных кислот (помимо многочисленных метаболических нарушений) приводит к снижению «стерилизующих» и нутритивных свойств желчи. В результате – прогрессирование дисбиоза в толстой кишке, брожение, дисфункция баугиниевой заслонки и усиление микробной контаминации тонкой (подвздошной) кишки, с одной стороны, с другой – поступление через систему воротной вены с кровью в печень повышенного количества эндотоксина грамотрицательной микрофлоры. Важным и крайне необходимым условием восстановления энтерогепатической циркуляции желчных кислот является нормализация процессов синтеза желчи в печени и адекватного поступления ее в кишечник (табл. 1) [19]. Желчегонные свойства таурина в связи с этим также могут оказывать дополнительный эффект при лечении НАЖБП.
Таблица 1. Показатели обмена веществ у пациентов до начала исследования
| Показатель | Значение нормы | Первая группа,
принимавшая таурин | Вторая группа,
принимавшая плацебо |
| Белок | 66–87 г/л | 73,69±1,19 | 74,10±1,33 |
| Билирубин | 3,4–21 мкмоль/л | 15,39±1,84 | 18,14±1,98 |
| Глюкоза | 4,1–6,4 ммоль/л | 7,33±0,45 | 7,14±0,36 |
| АЛТ | 5–34 Ед/л | 51,48±8,90 | 37,33±10,84 |
| АСТ | 5–31 Ед/л | 39,13±6,53 | 31,67±5,47 |
| ЩФ (щелочная фосфатаза) | 30–120 Ед/л | 80,70±4,7 | 79,50±5,26 |
| ГГТП | 7–38 Ед/л | 67,86±17,56 | 52,91±6,35 |
| Мочевина | 1,7–8,3 ммоль/л | 5,22±0,39 | 5,23±0,47 |
| Холестерин | 1,4–5,2 мкмоль/л | 7,27±0,33 | 6,18±0,27 |
| ХС-ЛПНП | 2,1–3,3 мкмоль/л | 4,70±0,23 | 3,97±0,26 |
| ХС-ЛПВП | 1,1–2,3 ммоль/л | 1,37±0,12 | 1,27±0,10 |
| ТГ | 0,0–1,7 мкмоль/л | 2,43±0,21 | 2,01±0,09 |
| СРБ | мг/л | 7,23±0,30 | 7,56±0,50 |
Целью исследования было изучение фармакодинамических показателей метаболитов оксида азота (NO) и бактериального эндотоксина в результате трехмесячного курса фармакотерапии таурином у больных НАЖБП и СД2, сопоставление содержания оксида азота и эндотоксина у больных НАЖБП с СД2 с биохимическими показателями крови.
Материал и методы
В двойное слепое плацебо-контролируемое исследование было включено 40 больных, страдающих НАЖБП и СД2 (30 женщин и 10 мужчин), средний возраст которых составил 56,35±8,75 года. Верификацию диагноза проводили по данным клинических, биохимических, инструментальных методов исследования. Индекс массы тела больных был увеличен на 30–35 %, у некоторых – до 40 %. Все больные получали терапию по поводу сахарного диабета метформина гидрохлоридом, по поводу артериальной гипертензии – амлодипином и эналаприлом. Методом случайных чисел пациентов разделили на 2 группы. 1-я группа получала таурин (Дибикор, ООО «ПИК-ФАРМА») в дозе 0,5 г 2 раза в день за 20 мин до еды в течение 3 мес. 2-я, контрольная, группа дополнительно к основному лечению получала плацебо-таурин.
Уровень метаболитов оксида азота в сыворотке крови определяли экспресс-методом для биологических жидкостей с использованием ванадия хлорида (Германия) [20]. Уровень эндотоксина определяли ЛАЛ-тестом (США). Статистическую обработку данных проводили с использованием программы «Биостат».
Результаты
У больных НАЖБП отмечено повышение аминотрансфераз АЛТ и АСТ, а также гамма-глютамилтранспептидазы (ГГТП) у 35 больных. По показателям липидного спектра у обследованных больных также наблюдалось повышенное содержание общего холестерина, холестерина ЛПНП и триглицеридов (см. табл. 1). Как видно из таблицы, по некоторым показателям группы отличались. Повышение АСТ и АЛТ, а также общего холестерина и триглицеридов было более выражено в 1-й группе, билирубина и С-реактивного белка (СРБ) – во 2-й. По данным УЗИ выявлена жировая дистрофия печени у всех больных.
Уровень метаболитов оксида азота в 1-й группе до лечения был увеличен в 6,8 раза и составлял 220,70±14,27 мкмоль/л. Норма – 32,15±0,51 мкмоль/л (p=0,001). Во 2-й группе, получавшей плацебо, уровень метаболитов был несколько ниже, составил 160,50±8,87 мкмоль/л и был увеличен в 5 раз. В результате фармакотерапии таурином содержание метаболитов снизилось на 44 %, или на 97 мкмоль/л. В группе контроля (плацебо) снижение метаболитов оксида азота составило 25 %, или 39 мкмоль/л.
У больных НАЖБП уровень эндотоксина был увеличен в 7 раз (n=34) (норма – 0,29±0,05 Е/Эмл) и составлял 2,20±0,04 Е/Эмл. В результате проведения курса лечения с включением таурина содержание эндотоксина снизилось до 0,90±0,01 Е/Эмл (p=0,001). В группе плацебо (вторая группа) изменения были также статистически значимы, уровень эндотоксина достиг 1,80±0,05 Е/Эмл. Фармакотерапия больных НАЖБП с включением таурина снижает активность маркеров воспаления.
Достоверное увеличение продукции сывороточного эндотоксина сопровождалось ростом синтеза оксида азота и находилось в прямой корреляционной зависимости (коэффициент корреляции равен 0,625.) Лечение таурином сопровождалось улучшением биохимических показателей крови, улучшением общего самочувствия больных. Уровень метаболитов оксида азота снижался параллельно уровню АЛТ, АСТ и ГГТП. Изменения показателей обмена веществ приведены в табл. 2.
Таблица 2. Изменения показателей обмена веществ после курса лечения в группах таурина и плацебо, %
| Показатели | Первая группа + таурин, ? % | Вторая группа + плацебо, ? % |
| Белок | 1,05 | –0,75 |
| Билирубин | –14,90 | –21,90 |
| Глюкоза | –7,40 | 1,30 |
| АЛТ | –35,90* | –18,30 |
| АСТ | –31,50* | –16,70 |
| ЩФ | –1,74 | 4,60 |
| ГГТП | –6,49* | –11,38 |
| Мочевина | 9,00 | 9,94 |
| Холестерин | –9,10 | 3,40 |
| ХС-ЛПНП | –10,20 | 2,30 |
| ХС-ЛПВП | 0 | 17,30 |
| ТГ | –6,58 | –5,97 |
| СРБ | –28,10 | –17,98 |
При данной выборке пациентов достоверно статистические изменения (снижение) наблюдали в 1-й группе по показателям АСТ, АЛТ, ГГТП. Остальные изменения были недостоверны. Наблюдалось достоверное снижение веса с 91,32±3,5 до 87,42±3,06; p=0,001. Во 2-й группе наблюдалась тенденция ухудшения – возрастание ЩФ, уровня гликемии, общего холестерина, ХС-ЛПНП. В 1-й группе ХСЛПВП не изменился, во 2-й – вырос на 17,3 %.
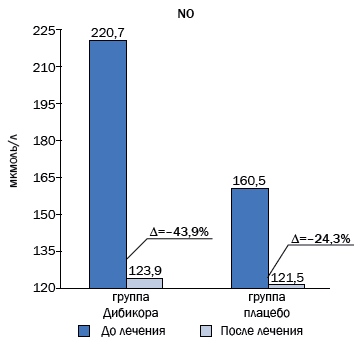
Рис. 2. Снижение уровня метаболитов NO на фоне фармакотерапии таурином и плацебо
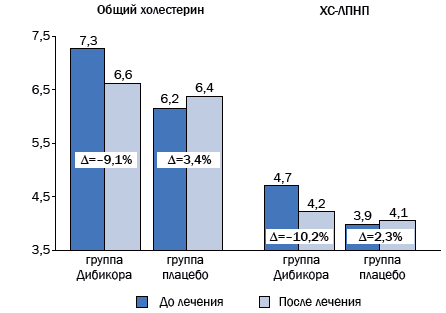
Рис. 3. Динамика липидного спектра крови после 3-месячного курса терапии таурином
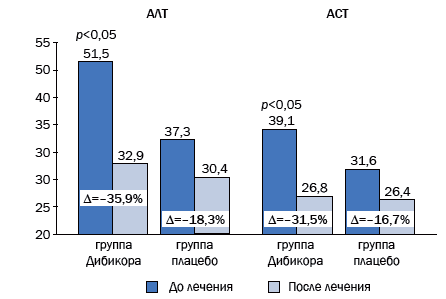
Рис. 4. Динамика показателей биохимического анализа крови у больных, получавших таурин
Обсуждение
Показано, что в 1-й и 2-й группах после лечения наблюдаются положительные изменения со стороны печеночных ферментов. Присоединение к терапии НАЖБП препарата Дибикор (таурин) способствует более выраженному уменьшению активности ферментов печени: АСТ (p<0,05), АЛТ (p<0,05), ЩФ, ГГТП (p<0,05). В первой и второй группах практически не наблюдались изменения со стороны белка. Падение билирубина было значительнее во второй группе (–21,9 % против –14,9).
Со стороны углеводного обмена не было зафиксировано статистически достоверных изменений ни в одной из групп. Но в 1-й группе, принимавшей таурин, уровень глюкозы натощак упал с 7,33±0,45 до 6,79±0,28 ммоль/л, а во 2-й группе увеличился с 7,14±0,36 до 7,23±0,44 ммоль/л. Такая же тенденция сохранялась для показателей липидного обмена (табл. 3). Так, в 1-й группе с таурином уровень холестерина снизился с 7,27 до 6,60 мкмоль/л, во 2-й группе вырос с 6,18 до 6,39. ХС-ЛПНП уменьшился с 4,70 до 4,22, во 2-й группе вырос с 3,97 до 4,06 мкмоль/л. ХС-ЛПВП в группе с таурином не изменился, во 2-й группе вырос с 1,27 до 1,49 мкмоль/л. Надо отметить, что до исследования в обеих группах уровень последнего показателя укладывался в норму.
Таблица 3. Влияние таурина и таурина-плацебо на показатели липидного обмена
| Показатели | Норма | Первая группа
+ таурин ?, %,
до исследования | первая группа
+ таурин ?, %, через
3 месяца | Вторая группа,
плацебо ?, %,
до исследования | Вторая группа,
плацебо ?, %,
через 3 месяца |
| Холестерин | 1,4-5,2 мкмоль/л | 7,27±0,33 | 6,61±0,31 | 6,18±0,27 | 6,39±0,26 |
| ХС-ЛПНП | 2,1-3,3 мкмоль/л | 4,70±0,23 | 4,22±0,25 | 3,97±0,26 | 4,06±0,30 |
| ХС-ЛПВП | 1,1-2,3 ммоль/л | 1,37±0,12 | 1,37±0,10 | 1,27±0,10 | 1,49±0,12 |
| ТГ | 0,0-1,7 мкмоль/л | 2,43±0,21 | 2,27±1,50 | 2,01±0,09 | 1,89±0,09 |
По уровню падения эндотоксина группа с таурином практически в 2 раза превосходила 2-ю группу. Как известно, эндотоксемия обладает патогенными свойствами при болезнях печени. Столь внушительная разница влияния таурина на эндотоксин подразумевает стабилизацию течения НАЖБП на более высоким уровне.
Настоящее исследование, целью которого явилось изучение гепатопротекторных свойств таурина, не единственное. В исследованиях доктора Лосевой и соавт. был оценен таурин (Дибикор) в терапии неалкогольной жировой болезни печени (НАЖБП) в стадии стеатогепатита (НАСГ). Больные были разделены на 2 группы. Все они получали терапию, включавшую рекомендации по питанию, эссенциальные фосфолипиды, силимарин, метформин, витамины, а пациенты второй группы (n=20) дополнительно принимали таурин по 0,5 г 2 раза в день за 20 мин до еды. Стандартное лечение приводило к желаемым результатам. Так, достоверно снизились показатели АЛТ, АСТ, ГТТП в 2 группах, но неизменно цифры, которые были достигнуты при добавлении к лечению таурина, всегда были ниже (АЛТ – 0,610 против 0,516; АСТ – 0,45 против 0,40 мкмоль/л; ГТТП – 29,31 против 25,10 ЕД/л). Изменения ЩФ были недостоверны в контрольной группе и статистически значимы в группе с таурином (246,25 против 229,40 ЕД/л).
Подобная тенденция сохранялась и для других показателей (липидного обмена, индекса массы тела, артериального давления) [21]. Автор делает заключение, что таурин может быть включен в схемы терапии НАСГ, положительно влияя на динамику печеночных проб и весовых показателей.
Как уже было сказано, НАЖБП – вид стеатоза печени (жировой гепатоз), возникающий у людей, не злоупотребляющих алкоголем, связанный с инсулинорезистентностью и метаболическим синдромом. Но прием некоторых лекарственных препаратов (кортикостероидов, антиаритмических препаратов, противоопухолевых, нестероидных противовоспалительных препаратов, синтетических эстрогенов, некоторых антибиотиков и др.) может способствовать повреждению гепатоцитов и появлению НАЖБП.
Гепатопротекторный эффект таурина был показан также на фоне приема антимикотических антибиотиков [22]. Эффект Дибикора значительно превосходил препарат сравнения силибинин.
Доктор Романова, изучив добавление таурина к комплексной терапии больных с синдромом диспепсии в сочетании с ожирением, считает, что таурин в перспективе, вероятно, можно будет рассматривать как один из препаратов выбора на этапах первичной и вторичной профилактики синдрома диспепсии, ожирения и метаболического синдрома [23].
Таурин с наилучшей стороны показал себя в эксперименте с таким гепатотоксическим препаратам, как ацетаминофен (парацетомол) [24]. Это вещество, как известно, при передозировке увеличивает в плазме уровень аспартаттрансаминазы, аланинаминотрансферазы и щелочной фосфатазы, вызывает фрагментацию ДНК и некроз гепатоцитов. Введение таурина до, одновременно или час спустя после ацетаминофена приводит к значительному улучшению функционального состояния печени: снижению гепатоцеллюлярного выброса ферментов, устранению апоптоза и некроза гепатоцитов.
Таким образом, Дибикор, обладая всеми присущими таурину свойствами, показал себя регулятором обмена липидов, как препарат, влияющий на углеводный обмен, как типичный гепатопротектор. Безусловно, требуется дополнительное изучение этих эффектов на большем количестве пациентов и с увеличением продолжительности терапии.
Сведения о ведущем авторе
Звенигородская Лариса Арсентьевна – доктор медицинских наук, руководитель научно-клинического отделения сочетанной патологии органов пищеварения ЦНИИ гастроэнтерологии, Москва
Литература
- Лазебник Л. Б., Звенигородская Л. А. Метаболический синдром и органы пищеварения. – М., 2009. – 182 с.
- Урсова Н. И. Жировая дистрофия печени при метаболическом синдроме в практике врача-педиатра // Лечащий врач. – 2010. – № 1. – С. 14–17.
- Ивашкин В. Т. Ядерные рецепторы и патология печени // Рос. журн. гастроэнтерол., гепатол., колопроктол. – 2010. – № 4. – С. 7–15.
- Титов В. Н., Дугин С. Ф. Синдром транслокации, ЛПС бактерий нарушение биологической реакции воспаления // Клин. лаб. диагностика. – 2010. – № 4. – С. 21–37.
- Шварц В. Воспаление как фактор патогенеза ИР и СД 2 типа // Тер. арх. – 2009. – № 10. – С. 74–80.
- Покровский В. И., Виноградов Н. А. Оксид азота, его физиологические и патофизиологические свойства // Тер. арх. – 2005. – № 1. – С. 82–87.
- Нилова Т. В., Звенигородская Л. А., Черкашова Е. А. Диагностическое значение оксида азота и эндотоксина при НАЖБП // Экспер. и клин. гастроэнтерол. – 2010. – № 7. – С. 38–42.
- Бурневич Э. З., Щаницына С. Е. Современные подходы к лечению НАЖБП // Клин. фармакол. и тер. – 2006. – № 3. Гепат. форум. – С. 15–20.
- Boucknooghe T., Remacle C., Reusens B. Is taurine a functional nutrient? // Curr. Opin. Clin. Nutr. Metab. Care. – 2006. – Vol. 9. – P. 728–733.
- Birdsall T. C. Therapeutic applications of taurine // Altern. Med. Rev. – 1998. – Vol. 3. – P. 128–136.
- Ogata Y., Nishi M., Nakayama H. Role of bile in intestinal barrier function and its inhibitory effect on bacterial translocation in obstructive jaundice in rats // J. Surg. Res. – 2003. – Vol. 115, N 1. – P. 18–23.
- Matern S., Marschall H. Metabolism and Conjugation of Bile Acids in Man. – Munich, 1995. – P. 128–135.
- Wasserhess P., Becker M., Staab D. Effect of taurine on synthesis of neutral and acidic sterols and fat absorption in preterm and full-term infants // Am. J. Clin. Nutr. – 1993. – Vol. 58. – P. 349–353.
- Invernizzi P., Setchell K., Crosignani A. Differences in the metabolism and disposition of ursodeoxycholic acid and of its taurine-conjugated species in patients with primary biliary cirrhosis // Hepatology. – 1999. – Vol. 29. – P. 320–327.
- Sheibak L., Sheibak V., Nefedov L. 11 Noordwijker hoult Camerino Simposium. – Netherland, 11–15 May 1997. – P. 68.
- Sunami Y., Tazuma S., Kajiyama G. Gallbladder dysfunction enhances physical density but not biochemical metastability of biliary vesicles // Dig. Dis. Sci. – 2000. – Vol. 45. – P. 2382–2391.
- Петров В. И., Недогода С. В., Елизарова Е. П. и др. Средство для лечения хронических диффузных заболеваний печени. Патент РФ № 2024256, 1994.
- Tazume S., Yamaoka T., Hashimoto K., Sasaki S. Intestinal flora and bile acide metabolism. Quantitative analysis of bile acide metabolites in each step of rejection of shigella organisms // J. Germfree Life Gnotobiol. – 1978. – Vol. 8, N. 2. – P. 61–67.
- Савельев В. С., Петухов В. А. Перитонит и эндотоксиновая агрессия. – М., 2012. – 326 с.
- Метельская В. А., Гуманова Н. Г. Скрининг-метод определения уровня метаболитов оксида азота в сыворотке крови // Клин. лаб. диагностика. – 2005. – № 6. – С. 15–18.
- Лосева Н. В., Моисеенко Е. Е. Опыт применения препарата Дибикор в комплексной терапии неалкогольной жировой болезни печени // Фарматека. – 2010. – № 13. – С. 63–67.
- Сизова О. С., Ших Е. В. Возможности таурина в коррекции гепатотоксического действия противогрибковых препаратов у больных онихомикозом // Медицинский совет. Гастроэнтерология. – 2012. – № 9. – С. 30–35.
- Романова М. М., Бабкин А. П. Анализ эффективности комплексной терапии больных с синдромом диспепсии в сочетании с ожирением // Лечащий врач. – 2013. – № 7. – С. 2–4.
- Das J., Ghosh J., Manna P., Sil P. C. Acetaminophen induced acute liver failure via oxidative stress and JNK activation: protective role of taurine by the suppression of cytochrome P450 2E1 // Free Radic. Res. – 2010 Mar. – Vol. 44, N 3. – P. 340–355.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 pikfarma.ru
pikfarma.ru






