Применение препарата таурин в комплексной терапии кардиоваскулярной и гастроинтестинальной форм диабетической автономной нейропатии при сахарном диабете 2 типа
Статьи
Опубликовано в журнале:
«Сибирский медицинский журнал»; № 6; 2007; стр. 15-18.
Д.А. Кириченко
(Ростовский государственный медицинский университет, ректор — проф. В.Н. Чернышов, кафедра эндокринологии с курсом детской эндокринологии ФПК и ППС, зав. — д.м.н. С.В. Воробьев)
Резюме. С целью изучения эффективности дибикора при диабетической автономной нейропатии (ДАН) было обследовано 89 больных сахарным диабетом 2 типа с ДАН. После трехмесячного курса лечения улучшение субъективных проявлений ДАН произошло у 53% больных, получавших таурин, и у 64% и 65% получавших его комбинации, соответственно, с тиогаммой и мильгаммой. Положительная динамика кардиоваскулярных тестов отмечалась у 51,7% больных, получавших таурин, по сравнению с 70% и 67% при комбинированном лечении. Сократительная функция желчного пузыря, по данным УЗИ, также претерпевала положительные изменения. При кардиоваскулярной и при гастроинтестинальной формах ДАН преимущества имела комбинированная терапия.
Ключевые слова: сахарный диабет 2 типа, диабетическая автономная нейропатия, таурин.
THE APPLICATION OF TAURIN PREPARATION IN THE COMPLEX THERAPY OF CARDIOVASCULAR AND GASTROINTESTINAL FORMS OF DIABETIC AUTONOMIC NEUROPATHY IN PATIENTS WITH DIABETES MELLITUS TYPE 2
D.A. Kirichenko
(Rostov State Medical University)
To study the efficacy of taurin in diabetic autonomic neuropathy (DAN) 89 patients with diabetes mellitus type 2 and DAN were examined. After three months long treatment the improvement of symptoms of DAN occurred in 53% patients in the taurin group and in 64% and 65% in taurin with tiogamma and taurin with milgamma groups. Positive changes of cardiovascular tests were found in 51.7% patients in the taurin group, compared to 70% and 67% in the groups received its combinations with tiogamma and milgamma. Gallbladder function studied by ultrasound also improved in all the groups. Both in cardiovascular and gastrointestinal forms of DAN the combinations of taurin with tiogamma or milgamma had an advantage.
Диабетическая автономная нейропатия (ДАН) — относительно малоизученное позднее осложнение сахарного диабета (СД). Ее проявления разнообразны и неспецифичны, что затрудняет ее своевременную диагностику. Выделяют кардиоваскулярную, урогенитальную, гастроинтестинальную и некоторые другие формы ДАН, в зависимости от преобладающих симптомов [1,4]. Многие автономные расстройства, такие, как эректильная дисфункция, нарушение распознавания гипогликемии, нарушения моторики желудочно-кишечного тракта, переваривания и всасывания, оказывают серьезное влияние на качество жизни больных, течение и прогноз СД [3,9,10]. Доказана их роль в патогенезе диабетических ангиопатий, микроальбуминурии, повышении риска смерти от сердечно-сосудистых осложнений [7,11].
Появление стойкой клиники ДАН часто свидетельствует о длительной декомпенсации СД, а также о фатальном поражении нервных волокон [1,3]. Поэтому лечение нейропатии представляется более эффективным именно на ранней, доклинической стадии, когда повреждение нервной ткани обратимо.
Ранняя диагностика разработана в основном для кардиоваскулярной формы ДАН, имеющей ряд электрофизиологических признаков, по которым судят и о наличии автономной нейропатии в целом [4]. Также возможна функциональная диагностика расстройств моторики желудочно-кишечного тракта (ЖКТ), например, ультразвуковым методом.
В последнее время изучается эффективность таурина при СД, так, выявлено его положительное воздействие на липидный обмен и нормализующее влияние на компенсацию углеводного обмена [6]. Поэтому представляется целесообразным исследование его возможностей при диабетической нейропатии.
Цель исследования — изучение терапевтических возможностей препарата таурин при комплексной терапии кардиоваскулярной и гастроинтестинальной форм ДАН.
Материалы и методы
Под наблюдением находились 89 больных (52 женщины и 37 мужчин) 37-72 лет с СД 2 типа и ДАН.
Всех больных тестировали по шкале NSC (Neuropathy Symptoms and Changes) [5]. Диагноз ДАН (по наличию кардиоваскулярной формы) и инструментальная стадия поражения вегетативных нервных волокон определялись методом кардиоваскулярного тестирования — пяти стандартных проб по D. Ewing [2]. Для выявления гастроинтестинальной формы ДАН исключались сопутствующие заболеваний ЖКТ и проводилось ультразвуковое исследование моторной функции желчного пузыря — измерение его объема натощак и спустя 45 минут после желчегонного завтрака [8].
Для статистической обработки данных был использован t-тест попарных сравнений. Критический уровень значимости при проверке гипотез p<0,05.
Больные были поделены на три группы, сходные по клинике, степени тяжести и уровню компенсации СД и отличающиеся патогенетической терапией нейропатии. Все больные получали таурин (дибикор, ПИК-фарма ООО) 500 мг/сут в два приема, у первой группы (29 человек) это был единственный препарат, назначенный в качестве метаболической терапии. Вторая и третья группы (по 30 человек) получали также, соответственно, α-липоевую кислоту (тиогамма, Wцrwag Pharma GmbH) 600 мг/сут по стандартной схеме (внутривенно капельно в течение двух недель с последующим переходом на пероральный прием) и бенфотиамин per os в дозе 300 мг/сут в составе препарата мильгамма Wцrwag Pharma GmbH) — по 1 драже 3 раза в сутки. Курс лечения во всех группах составлял 3 месяца.
Результаты и обсуждение
Кардиоваскулярные нарушения встречались у 35% обследованных. Главным из них была липотимия: потемнение в глазах, ощущение легкости в голове при резком переходе в вертикальное положение, головокружение. У 38% больных с такими жалобами снижение систолического АД в ортостатическом тесте не было диагностически значимым. Постоянная тахикардия встречалась реже, у 13,5 % обследованных.
Признаки гастроинтестинальной формы ДАН встречались у 56% больных. Наиболее распространенными были изжога, отрыжка, чувство дискомфорта в эпигастрии или в правом подреберье, чуть реже наблюдались легкая тошнота после еды, запоры, неустойчивый стул. Более тяжелые симптомы (персистирующая диарея, тошнота с рвотой непереваренной пищей), фиксируемые в шкале NSC, встречались в единичных случаях, у больных с длительной неадекватной компенсацией углеводного обмена.
Наиболее тяжелые автономные симптомы (стойкая диарея, фиксированная тахикардия) наблюдались только у больных с грубым поражением нервных волокон (патологические результаты в большинстве из пяти тестов по D. Ewing, в том числе с измерением АД). У больных с несомненным и начальным поражением симптомы были немногочисленными и легкими.
Основным инструментальным признаком гастроинтестинальной формы ДАН была дискинезия желчевыводящих путей (ДЖВП) по гипокинетическому типу (у 76,4%). У 8% больных была выявлена ДЖВП по гиперкинетическому типу. У остальных больных сократимость желчного пузыря не выходила за нормальные границы 50-70%. Четкой связи данных УЗИ с клиникой гастроинтестинальной формы ДАН не отмечалось: среди больных, не предъявлявших жалоб, ДЖВП были распространены достаточно широко (у 65%).
После трехмесячного курса терапии улучшение самочувствия и уменьшение количества и выраженности жалоб отметили 55% больных, получавших таурин в качестве монотерапии, и, соответственно, 66,7% и 64% больных, получавших его в сочетании с тиогаммой или мильгаммой. Лучше всего на лечение реагировали липотимия и легкие желудочно-кишечные расстройства. Более тяжелые симптомы (тахикардия покоя, диарея), связанные с серьезным повреждением нервных волокон, не исчезли, но уменьшилась их выраженность по шкале NSC.
Улучшение показателей кардиоваскулярных тестов произошло у 51,7% больных первой группы по сравнению с 70% и 67% во второй и третьей группах. Ответ на терапию был более заметным в результатах ЭКГ-тестов, изменения показатели АД-тестов были менее выраженными, преимущества имела комбинированная терапия (табл. 1).
Таблица 1
Данные кардиоваскулярного тестирования до и после лечения
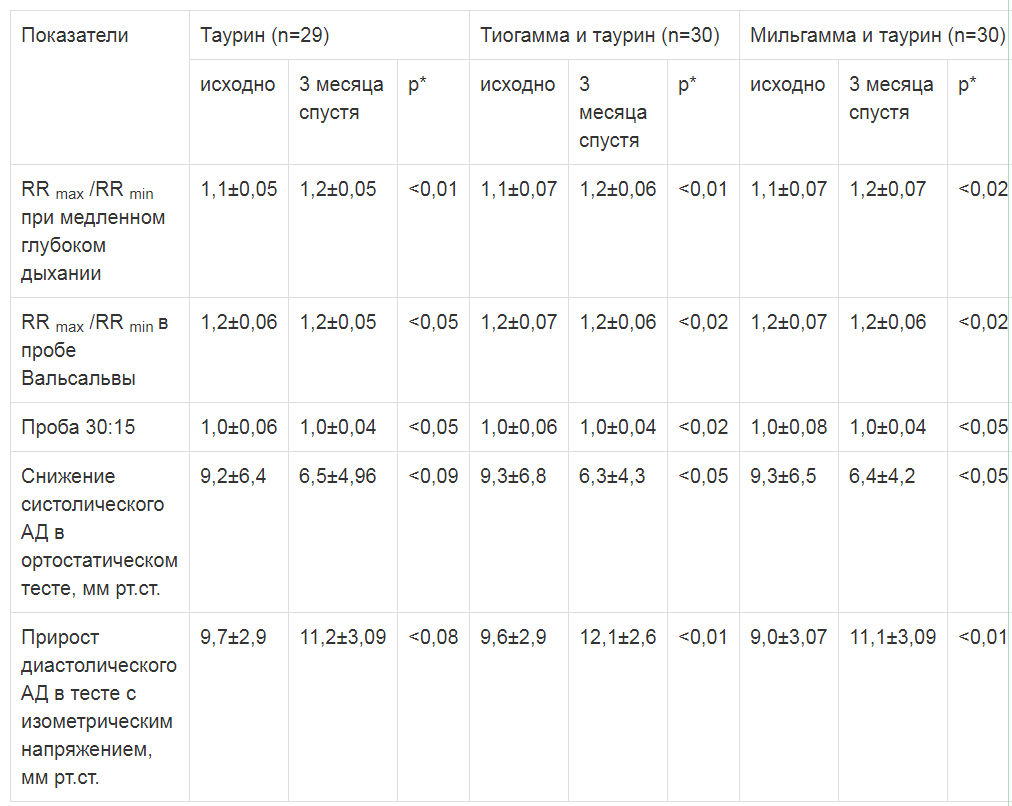
Во всех группах в конце курса лечения уменьшился объем желчного пузыря натощак, возросла его сократимость и, таким образом, снизилась частота ДЖВП по гипокинетическому типу (табл. 2). Во второй и третьей группах эти изменения были более выраженными по сравнению с монотерапией таурином. У немногочисленных больных с ДЖВП по гиперкинетическому типу произошла нормализация моторной функции желчного пузыря при всех вариантах терапии. Толщина стенки желчного пузыря также несколько уменьшилась во всех группах без существенных различий, однако это изменение не было достоверным.Примечание: *- достоверность различий с исходными показателями.
Таблица 2
Функция желчного пузыря до и после лечения
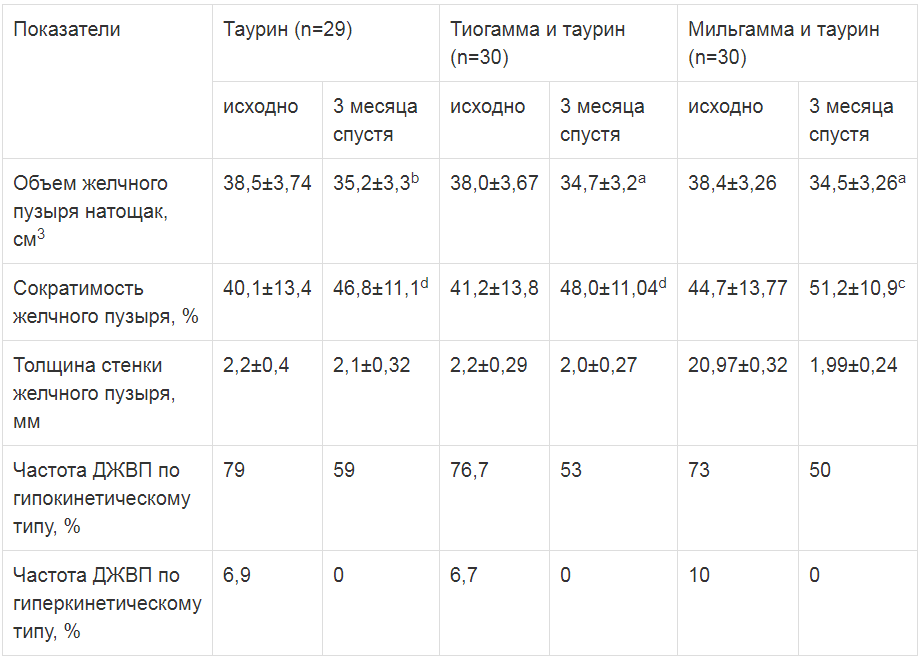
За период наблюдения не отмечалось отрицательной динамики кардиоваскулярных тестов и ультрасонографической картины.Примечание. Достоверность различий с исходными показателями a при р<0,005, ь при р<0,01, с при р<0,02, d при р<0,05.
Все три варианта терапии нейропатии хорошо переносились, серьезных нежелательных эффектов за период наблюдения не отмечалось.
Таким образом, таурин оказывает положительное влияние на клинические и инструментальные проявления кардиоваскулярной и гастроинтестинальной форм ДАН, однако его эффективность выше в сочетании с препаратами α-липоевой кислоты и бенфотиамина. В связи с этим, возможно его применение при автономной нейропатии, в том числе, на субклинической стадии. При более выраженной вегетативной дисфункции целесообразно включать его в патогенетическую терапию а-липоевой кислотой и бенфотиамином. Различия в эффективности сочетаний таурина с тиогаммой или мильгаммой несущественны.
ЛИТЕРАТУРА
1. Бондарь И.А., Демин А.А., Королева Е.А. Диабетическая автономная нейропатия. — Новосибирск, 2006.
2. Верткин А.Л., Ткачева О.Н., Подпругина Н.Г и др.// Клиническая фармакология и терапия. — 2004. — Т. 13, №4. - С.39-43.
3. Дедов И.И, Шестакова М.В. Сахарный диабет (Руководство для врачей). — М., 2003.
4. Котов С.В., Калинин А.П., Рудакова И.Г. Диабетическая нейропатия. — М., 2000.
5. Строков И.А., Новосадова М.В., Баринов А.Н. и др.// Неврологический журнал. — 2000. — № 5. — С.14-19.
6. Шестакова М.В., Чугунова Л.А., Шамхалова М.Ш. // Сахарный диабет. — 2007. — № 1. — С.30-31.
7. Cohen J.A., Estacio R.O., Lundgren R.A., et al. // Auton. Neurosci. — 2003. — Vol. 108, № 1-2. — P.73-78.
8. Gaur C, Mathur A., Agarwal A., et al. // J. Assoc. Physicians. India. — 2000. — Vol. 48, № 6. — P.603-605.
9. Maleki D., Locke G.R., Camilleri M., et al. // Arch. Intern. Med. - 2000. - Vol. 160, № 18. - P.2808-2816.
10. Perusicova J. // Vnitr. Lek. - 2004. - Vol. 50, № 5. - E338-343.
11. Pourmoghaddas A., Hekmatnia A. // Mol. Cell. Biochem. -2003. Vol. 249, № 1-2. - P.125-128.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 pikfarma.ru
pikfarma.ru

 pikfarma.ru
pikfarma.ru
