Диагностика и лечение неалкогольной жировой болезни печени у пациентов с сахарным диабетом типа 2: современный взгляд на проблему
Статьи
Опубликовано в журнале:
« Эндокринология: новости, мнения, обучение » №3, 2016. А.С. Аметов, М.А. Прудникова
ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва
В статье представлен анализ современных данных литературы, посвященных клиническим аспектам диагностики и лечения неалкогольной жировой болезни печени (НАЖБП) у пациентов с сахарным диабетом типа 2. Приводятся данные об эффективности метаболической терапии НАЖБП с использованием таурина. Антиоксидантное, метаболическое и гепатопротективное действие препарата нашло подтверждение в целом ряде клинических и экспериментальных исследований.
Ключевые слова: неалкогольная жировая болезнь печени, сахарный диабет типа 2, таурин
В течение двух последних десятилетий распространенность неалкогольной жировой болезни печени (НАЖБП) непрерывно растет. В настоящее время НАЖБП является одной из основных причин хронического синдрома цитолиза и самым распространенным заболеванием печени во всем мире. Согласно прогнозам экспертов, к 2020 г. НАЖБП станет основной причиной трансплантации печени во всем мире [1].
В США и западных странах от этого заболевания страдает около 20% населения, в восточных странах НАЖБП поражает от 12 до 24% общей популяции [2]. Согласно результатам наблюдательного исследования DIREG (2007), в России около 27% обратившихся пациентов имели жировую дегенерацию печени [3].
Поскольку механизмы развития НАЖБП патогенетически тесно связаны с нарушениями углеводного и жирового метаболизма, распространенность заболевания у пациентов с подобными нарушениями существенно отличается от таковой в общей популяции. Так, у людей с ожирением частота выявления НАЖБП достигает 90% [4], у пациентов с сахарным диабетом типа 2 (СД2) – 70% [5].
Дополнительными факторами, увеличивающими риск развития жировой дегенерации печени, являются пожилой и старческий возраст, мужской пол, этническая принадлежность к латиноамериканской расе, гипертриглицеридемия, прием ряда лекарственных препаратов (глюкокортикоидов, нестероидных противовоспалительных средств, синтетических эстрогенов, тетрациклинов и др.), синдром мальабсорбции, липодистрофии и др.
Тем не менее реальная распространенность НАЖБП не может быть оценена в связи с отсутствием точных неинвазивных методов диагностики [6].
Сахарный диабет типа 2 и неалкогольная жировая болезнь печени
Как было указано, у пациентов с СД2 более высокий риск развития НАЖБП, неалкогольного стеатогепатита и фиброза/цирроза печени, чем у пациентов без нарушений углеводного обмена [7].
Более того, есть и обратная связь: в исследовании 2016 г. подтвержденный диагноз НАЖБП был ассоциирован с достоверным увеличением вероятности развития СД2 (р Cмертность у пациентов с НАЖБП и СД в 3 раза превышает таковую у лиц с НАЖБП без диабета [10].
Интересно, что у пациентов с СД2 есть взаимосвязь между показателями гликемии и активностью стеатогепатита. Согласно результатам японского исследования 2014 г., ухудшение гликемического контроля напрямую коррелировало с выраженностью фиброза печени [11].
Cуществует немало подтверждений тому, что НАЖБП вне зависимости от наличия СД2 и/или метаболического синдрома является независимым фактором риска развития сердечно-сосудистых заболеваний [12, 13]. По всей видимости, эта взаимосвязь обусловлена увеличением продукции про-атерогенных медиаторов (С-реактивного белка, фибриногена и ингибитора активатора плазминогена 1) в патологически измененной ткани печени [13].
Так, в исследовании, продлившемся 6,5 года и включавшем около 2000 пациентов, НАЖБП приводила к двукратному увеличению риска сердечно-сосудистых событий независимо от наличия других факторов риска [13].
Согласно данным Ekstedt и соавт., риск смерти у лиц с НАЖБП за 14-летний период наблюдения в 2 раза превышает таковой в общей популяции [14].
Таким образом, НАЖБП тесно связана с СД2, отягощает течение последнего и существенно увеличивает сердечнососудистые риски у данной категории пациентов.
Этиология и патогенез
НАЖБП является хроническим, непрерывно прогрессирующим заболеванием и включает целый спектр состояний, связанных с жировой дегенерацией печени: от стеатоза до стеатогепатита и цирроза [15].
Основной гипотезой развития НАЖБП в течение многих лет является теория двух ударов. Первый удар: инсулинорезистентность, синтез избыточного количества триглицеридов в печени, избыточное образование и повышенное окисление свободных жирных кислот и, как следствие, развитие стеатоза печени [16]. Второй удар: усиление перекисного окисления липидов, активация окислительного стресса с накоплением активных форм кислорода и повышение продукции провоспалительных цитокинов [17].
Патогенетически развитие НАЖБП тесно связано с метаболическим синдромом и СД2. Одним из ключевых нарушений в обоих случаях является инсулинорезистентность, которая в свою очередь приводит к нарушению печеночной продукции глюкозы и обмена липидов в печени [18] (см. рисунок).
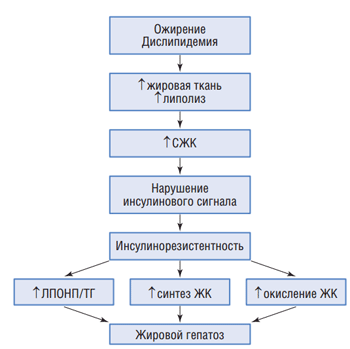
Патогенетические механизмы развития неалкогольной жировой болезни печени [4]
ЖК – жирные кислоты, СЖК – свободные жирные кислоты, ЛПОНП – липопротеины очень низкой плотности, ТГ – триглицериды.
Следует отметить, что повышение уровня глюкозы обеспечивает дополнительный субстрат для синтеза триглицеридов в печени. Этому также способствует нарушение образования липопротеинов очень низкой плотности, сопровождающее состояние инсулинорезистентности. Есть также сведения, что важную роль в патогенезе НАЖБП играет нарушение микробного сообщества в толстой кишке.
НАЖБП характеризуется повреждением гепатоцитов, воспалением и фиброзом печеночной ткани, которые закономерно ведут к циррозу, печеночной недостаточности и развитию гепатоцеллюлярной карциномы [19].
Скрининг
В настоящее время проведение скрининговых обследований, направленных на выявление НАЖБП у пациентов с СД2, признано нецелесообразным. Обследование инициируют только при повышении печеночных трансаминаз или других признаков заболевания печени [22].
Для выявления кандидатов на биопсию печени среди лиц с ожирением существует несколько общепринятых шкал, одной из них является шкала HAIR (акроним Hypertension, ALT и Insulin Resistance).
Данный счетный инструмент используется у лиц с индексом массы тела (ИМТ)≥35 кг/м2, при этом оцениваются следующие параметры:
1) гипертония - 1 балл;
2) АЛТ>40 ммоль/л - 1 балл;
3) индекс инсулинорезистентности >5,0 - 1 балл.
Наличие 2 признаков указывает на 80-процентную вероятность НАЖБП, выявление 3 признаков подтверждает диагноз НАЖБП [23].
Шкала BAAT используется для определения необходимости биопсии печени у лиц с отклонениями в лабораторных показателях печеночной функции.
Исследуемые параметры:
1) ИМТ≥28 кг/м2 - 1 балл;
2) возраст ≥50 лет - 1 балл;
3) уровень AЛТ≥2 норм - 1 балл;
4) содержание триглицеридов ≥1,7 ммоль/л (150 мг/дл) -1 балл.
Оценка 0-1 позволяет с высокой степенью достоверности исключить септальный фиброз или цирроз печени [24].
Индекс стеатоза печени (FLI - fatty liver index) был разработан G. Bedogni и соавт. [28].
FLI рассчитывается по формуле:
FLI = (е0,953 х loge (триглицериды) + 0,139 х (ИМТ) + 0,718 х loge (ГГТП) + 0,053 х (окружность талии) - 15,745)/
(1 + е0,953 х loge (триглицериды) + 0,139 х (ИМТ) + 0,718 х loge (ГГТП) + 0,053 х (окружность талии) - 15,745) х 100,
где ИМТ - индекс массы тела, ГГТП - гамма-глютамилтран-спептидаза.
Результат от 30 до 60 указывает на высокую вероятность наличия НАЖБП. Индекс стеатоза является точным инструментом оценки риска НАЖБП у пациентов с нарушениями углеводного обмена, что подтверждают результаты недавних исследований [26].
Шкала оценки фиброза при неалкогольной жировой болезни печени (NAFLD fibrosis score)
Показатель рассчитывается по формуле:
-1,675 + 0,037 - возраст (годы) + 0,094 - ИМТ (кг/м2) + 1,13 х гипергликемия натощак (или СД)* + 0,99 х АСТ/АЛТ - 0,013 х количество тромбоцитов (х109/л) - 0,66 х альбумин (г/дл),
где ИМТ - индекс массы тела, АСТ - аспартатаминотрансфераза, АЛТ - аланинаминотрансфераза.
* При наличии одного из вариантов нарушения углеводного обмена индекс равен 1, в противном случае – 0.
Значение индекса фиброза 1,455 и ниже позволяет исключить наличие выраженного фиброза печени, показатель >0,676 свидетельствует в пользу F3 стадии фиброза [27].
Клиническая картина
Чаще всего НАЖБП протекает бессимптомно, однако у части пациентов могут отмечаться общая слабость, повышенная утомляемость, боль или ощущение тяжести в правом подреберье. Признаки портальной гипертензии возникают только на стадии цирроза.
Диагностика
НАЖБП - это, как правило, диагноз-исключение. В первую очередь при диагностике НАЖБП необходимо исключить пациентов с избыточным потреблением алкоголя.
Лабораторное исследование
Развитие НАЖБП сопровождается увеличением содержания печеночных ферментов [20], активность которых тесно связана с плазменными уровнями ингибитора активатора плазминогена 1 [21]. Наиболее характерным лабораторным проявлением неалкогольного стеатогепатита является умеренное повышение (не более 4 раз от верхней границы референсного интервала) АЛТ и/или АСТ.
Однако уровни трансаминаз не позволяют определить стадию и степень активности заболевания. Их использование ограничено рутинной диагностикой жировой дегенерации печени [28].
При прогрессировании болезни отмечаются лабораторные признаки, характерные для цирроза печени: гипоальбуминемия, гипербилирубинемия, тромбоцитопения. Развитие НАЖБП сопровождается также повышением уровня триглицеридов и снижением уровня холестерина липопротеинов высокой плотности.
Состояние инсулинорезистентности подтверждают определением глюкозы и инсулина натощак с последующим расчетом индекса инсулинорезистентности (Homeostasis model assessment: insulin resistance - HOMA IR).
Ультразвуковое исследование
Ультразвуковое исследование (УЗИ) органов брюшной полости - самый простой и наиболее часто используемый метод диагностики НАЖБП в реальной клинической практике. У этого метода целый ряд преимуществ: низкая стоимость, высокая доступность, отсутствие лучевой нагрузки.
Ультразвуковыми признаками НАЖБП являются гепато-спленомегалия, гиперэхогенность паренхимы печени, нечеткость сосудистого рисунка и косвенные признаки формирования портальной гипертензии.
Тем не менее у УЗИ есть ряд ограничений: 1) с его помощью невозможно определить стадию НАЖБП; 2) точность обследования зависит от квалификации врача УЗ-диагностики; 3) у лиц с выраженным ожирением визуализация органов может быть затруднена [29].
В настоящее время получила широкое распространение модификация метода: ультразвуковая эластография печени. Однако и ее применение у людей с ожирением ограничено.
Компьютерная томография печени
При проведении компьютерной томографии на наличие НАЖБП указывают следующие признаки:
- снижение рентгенологической плотности печени на 3-5 HU;
- снижение рентгенологической плотности печени относительно плотности селезенки;
- повышение плотности внутрипеченочных сосудов по сравнению с плотностью печеночной ткани.
Компьютерная томография печени не превосходит УЗИ по точности диагностики НАЖБП [30].
Пункционная биопсия печени
Пункционная биопсия печени является «золотым стандартом» диагностики НАЖБП.
Данный метод позволяет определить стадию заболевания, степень активности неалкогольного стеатогепатита и определить прогноз заболевания.
Однако широкое использование данной диагностической опции ограничено инвазивным характером процедуры, возможностью ошибок и осложнений.
В число показаний к биопсии печени входят: 1) признаки фиброза печени по данным эластометрии; 2) отсутствие положительной динамики печеночных проб, несмотря на успешное снижение массы тела у лиц с ожирением; 3) немотивированная слабость у пациентов с признаками жирового гепатоза [28].
Лечение
Модификация образа жизни
Основным методом лечения и профилактики НАЖБП является достижение и поддержание нормальной массы тела.
Наиболее эффективной и безопасной терапевтической опцией в этом случае является модификация образа жизни: соблюдение диеты с ограничением животных жиров и легкоусвояемых углеводов в сочетании с увеличением физической активности.
Заслуживает внимания тот факт, что лицам с НАЖБП или высоким риском ее развития следует уменьшить или вообще избегать употребления алкоголя [33].
Показателем эффективности терапии является снижение веса на 7–10% от исходного. Безопасным считается снижение массы тела на У пациентов с НАЖБП снижение массы тела ассоциировано с улучшением сывороточных уровней инсулина, показателей функции печени и качества жизни [32].
Медикаментозная терапия
В основном медикаментозная терапия НАЖБП направлена на коррекцию метаболических нарушений, уменьшение выраженности окислительного стресса и хронического воспаления.
Для лечения жировой дегенерации печени в различное время предлагалось использовать: 1) омега-3, 6, 9 полиненасыщенные жирные кислоты; 2) статины; 3) различные анти-оксиданты (витамин Е); 4) инсулиносенситайзеры (метформин и тиазолидиндионы); 5) препараты урсодезоксихолевой кислоты; 6) гепатопротекторы; 7) фитотерапию (препараты на основе расторопши); 8) глицирризиновую кислоту.
Однако «золотого стандарта» терапии НАЖБП не существует до сих пор. В связи с этим чрезвычайно актуален поиск новых методов лечения НАЖБП в целом и у пациентов с СД2 в частности. Представляется перспективным применение метаболической терапии НАЖБП с использованием таурина.
Таурин в терапии неалкогольной жировой болезни печени
Таурин (2-аминоэтансульфоновая кислота) был открыт в 1827 г. в качестве составляющей бычьей желчи. Это соединение обнаруживается во всех жизненно важных органах человека: мозге, сердце, почках и т.д. Недостаток таурина в свою очередь ассоциирован с развитием различных патологических процессов.
Таурин поступает с пищей и синтезируется в печени из метионина и цистеина [37]. В растительном мире таурин практически не встречается, исключение составляют красные водоросли.
Восполнить дефицит таурина за счет изменения характера питания практически невозможно. Все способы синтеза таурина из цистеина требуют участия коферментной формы витамина В6 [38].
Таурин обладает целым рядом эффектов, потенциально способных приводить к улучшению структурного и функционального состояния печени у пациентов с НАЖБП. Во-первых, 2-аминоэтансульфоновая кислота обладает способностью уменьшать интенсивность окислительного стресса, перехватывая свободные радикалы (в том числе уменьшать перекисное окисление липидов) [34, 35].
Во-вторых, внутриклеточный таурин вступает во взаимодействие с фосфолипидами клеточных мембран, изменяя их проницаемость. Иначе говоря, препарат способен улучшать фосфолипидный состав мембран печени [36].
В-третьих, таурин обладает гиполипидемическим действием, которое, по крайней мере отчасти, обусловлено усилением биотрансформации холестерина в желчные кислоты. Повышение образования желчных кислот в свою очередь ускоряет выведение холестерина из организма [37].
В-четверых, таурин препятствует развитию фиброза печени посредством подавления активации звездчатых клеток, продуцирующих коллаген, а также препятствуя его накоплению путем снижения уровней тканевого ингибитора метал-лопротеиназ-1 и коллагена IV типа [38].
Кроме всего перечисленного, препарат обладает дезинтоксикационным и сахароснижающим действием [41].
Гепатопротективное действие таурина было подтверждено в целом ряде экспериментальных и клинических исследований.
В клеточной модели таурин статистически значимо уменьшал накопление триглицеридов и апоптотические процессы в гепатоцитах при инкубировании с пальмитатом. Кроме того, на фоне терапии препаратом уменьшался стресс эндоплазматического ретикулума, снижались интенсивность перекисного окисления липидов и образование активных форм кислорода в условиях липотоксичности [49].
В мышиных моделях препарат оказывал мощное защитное действие при острых и хронических повреждениях печени, вызванных различными токсическими агентами (доксорубицином, ацетаминофеном) [43, 44].
У крыс с циррозом печени, индуцированным тиоацетамидом, таурин оказывал аналогичный эффект [45]. В составе комплексной антиоксидантной терапии препарат оказался эффективным и при поражениях печени, вызванных тетрахлорметаном [46, 47].
Любопытно, что у грызунов таурин уменьшал выраженность дегенеративных изменений печени, вызванных приемом этанола. По всей видимости этот эффект также был обусловлен влиянием на окислительный стресс, снижением выработки воспалительных и фиброгенных медиаторов [48].
Широко известно, что включение таурина в схему лечения пациентов с СД2 оказывает благотворное влияние на показатели основного метаболизма. В частности, согласно данным Т.И. Северинова и соавт., добавление таурина к базисной терапии больных с СД2 уже спустя 3 мес после начала лечения приводило к статистически значимому улучшению параметров углеводного, липидного и пуринового обмена [41].
М.Е. Стаценко и соавт. доказали наличие гепатопротективного действия препарата в когорте пациентов с хронической сердечной недостаточностью и СД2. У пациентов, получавших таурин спустя 16 нед наблюдения, отмечался ряд достоверных изменений показателей функционального состояния печени (см. таблицу).
Таблица.
Динамика показателей функционального состояния печени у больных с хронической сердечной недостаточностью и сахарным диабетом типа 2 при приеме таурина в составе комбинированной терапии [43]
| Показатель | Базисная терапия, Δ, % | Базисная терапия + таурин Δ, % | р |
|---|
| Индекс стеатоза, усл. ед | -3,2 | -23,57 | <0,05 |
| Индекс фиброза, усл. ед. | 1,56 | - 29,51 | <0,05 |
| АЛТ, ед/л | -6,6 | -42,98 | <0,05 |
| ACT, ед/л | -7,2 | -28, 43 | <0,05 |
| Активность щелочной фосфатазы, ед/л | -3,57 | -27,6 | <0,05 |
| Активность ГГТП, ед/л | -10,8 | -46,4 | <0,05 |
| Примечание. АЛТ – аланинаминотрансфераза, АСТ – аспартатаминотрансфераза, ГГТП – гамма-глютамилтранспептидаза. |
Было высказано предположение, что гепатопротективное действие таурина отчасти может быть обусловлено уменьшением тяжести хронической сердечной недостаточности и улучшением центральной гемодинамики [42].
Улучшение параметров основного обмена в сочетании с гепатопротективным действием указывают на целесообразность включения таурина в схему терапии НАЖБП при СД2 у коморбидных больных. Высокий профиль безопасности препарата открывает широкие перспективы его использования в качестве метаболической терапии при сочетанной патологии.
Сведения об авторах:
Аметов Александр Сергеевич – доктор медицинских наук, профессор, заведующий кафедрой эндокринологии ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва
Прудникова Марина Александровна – младший научный сотрудник, врач-эндокринолог, кафедра эндокринологии ГБОУ ДПО «Российская медицинская академия последипломного образования» Минздрава России, Москва
Литература
1. Silaghi CA, Silaghi H, Colosi HA, Craciun AE, Farcas A, Cosma DT, Hancu N, Pais R, Georgescu CE. Prevalence and predictors of non-alcoholic fatty liver disease as defined by the fatty liver index in a type 2 diabetes population Clujul Medical 2016 Vol. 89 no.1: 82-88
2. Scorletti E, Calder PC, Byrne CD. Non-alcoholic fatty liver disease and cardiovascular risk: metabolic aspects and novel treatments. Endocrine 2011; 40: 332-43
3. Ивашкин В.Т. , Драпкина О.М., Маев И.В., Трухманов А.С., Блинов Д.В., Пальгова Л.К., Цуканов В.В., Ушакова Т.И. Распространенность неалкогольной жировой болезни печени у пациентов у пациентов амбулаторно-пликлинической практики в Российской федерации : результаты исследования DIREG 2 Российский журнал гастроэнтерологии, гепатологии, колопроктологии.- 2015.-№6.-С.31-41.
4. Ozturk ZA and Kadayifci A Insulin sensitizers for the treatment of non-alcoholic fatty liver disease World J Hepatol. 2014 Apr 27; 6(4): 199–206.
5. Stefan N, H ring HU. The metabolically benign and malignant fatty liver. Diabetes 2011; 60:2011-7
6. Trivedi I, Rinella ME. NAFLD and cardiovascular disease: can the real association be determined? Curr Hepatology Rep 2014; 13: 130-41
7. El-Serag H.B., Tran T., Everhart J.E. Diabetes increases the risk of chronic liver disease and hepatocellular carcinoma. Gastroenterology. 2004;126(2):460–468 , Hossain N., Afendy A., Stepanova M. Independent predictors of fibrosis in patients with nonalcoholic fatty liver disease. Clin. Gastroenterol. Hepatol. 2009;7(11):1224–1229.
8. K r j m ki AJ, Bloigu R, Kauma H, Kes niemi YA, Koivurova OP, Perki m ki J, Huikuri H, Ukkola O. Non-alcoholic fatty liver disease with and without metabolic syndrome: Different long-term outcomes. Metabolism. 2016 Jul 1. pii: S0026-0495(16)30061-0. doi: 10.1016/j. metabol.2016.06.009.
9. Zelber-Sagi S, Lotan R, Shibolet O, Webb M, Buch A, Nitzan-Kaluski D, Halpern Z, Santo E, Oren R. Non-alcoholic fatty liver disease independently predicts prediabetes during a 7-year prospective follow-up. Liver Int. 2013 Oct;33(9):1406-12. doi: 10.1111/liv.12200.
10. Younossi Z.M., Gramlich T., Matteoni C.A., Boparai N., McCullough A.J. Nonalcoholic fatty liver disease in patients with type 2 diabetes. Clin. Gastroenterol. Hepatol. 2004;2(3):262–265.
11. Nakahara T, Hyogo H, Yoneda M, Sumida Y, Eguchi Y, Fujii H, Ono M, Kawaguchi T, Imajo K, Aikata H, Tanaka S, Kanemasa K, Fujimoto K, Anzai K,Saibara T, Sata M, Nakajima A, Itoh Y, Chayama K, Okanoue T; Japan Study Group of Nonalcoholic Fatty Liver Disease.Type 2 diabetes mellitus is associated with the fibrosis severity in patients with nonalcoholic fatty liver diseasein a large retrospective cohort of Japanese patients. J Gastroenterol. 2014 Nov;49(11):1477-84. doi: 10.1007/s00535-013-0911-1. Epub 2013 Nov 26.
12. Harikrashna B. Bhatt and Robert J. Smith Fatty liver disease in diabetes mellitus Hepatobiliary Surg Nutr. 2015 Apr; 4(2): 101–108.
13. Targher G, Bertolini L, Poli F, Rodella S, Scala L, Tessari R, Zenari L, Falezza G. Nonalcoholic Fatty Liver Disease Is Independently Associated With an Increased Incidence of Cardiovascular Events in Type 2 Diabetic Patients Diabetes Care 2007 Aug; 30(8): 2119-2121
14. Ekstedt M., Franzten L.E., Mathiesen ULet al. long-term follow up of patients with NAFLD and elevated liver enzymes. Hepatology.- 2006.-№44.- С.865-873.
15. Choudhury J., Sanyal A.J. Clinical aspects of fatty liver disease. Semin. Liver Dis. 2004; 24:349–362.
16. Day CP. Non-alcoholic steatohepatitis (NASH): where are we now and where are we going? Gut. 2002; 50:585–588. 17. Chitturi S, Farrell GC. Etiopathogenesis of nonalcoholic steatohepatitis. Semin Liver Dis. 2001; 21:27–41
18. Pardina E, Ferrer R, Rossell J, Baena-Fustegueras J A, Lecube A, Fort JM, et al/ Diabetic and dyslipidaemic morbidly obese exhibit more liver alterations compared with healthy morbidly obese BBA Clin. 2016 Jun; 5: 54–65.
19. Wilfred de Alwis N.M., Day C.P. Genetics of alcoholic liver disease and nonalcoholic fatty liver disease. Semin. Liver Dis. 2007;27:44–54
20. Luyckx F.H., Lefebvre P.J., Scheen A.J. Non-alcoholic steatohepatitis: association with obesity and insulin resistance, and influence of weight loss. Diabete Metab. 2000;26:98–106
21. Asplund-Carlson A., Hamsten A., Wiman B., Carlson L.A. Relationship between plasma plasminogen activator inhibitor-1 activity and VLDL triglyceride concentration, insulin levels and insulin sensitivity: studies in randomly selected normo- and hypertriglyceridaemic men. Diabetologia.
22. George Boon-Bee Goh,Mangesh R. Pagadala, Jaividhya Dasarathy,Aynur Unalp-Arida, Ruth Sargent,Carol Hawkins,Achuthan Sourianarayanane,Amer Khiyami,Lisa Yerian Rish K. Pai,Srinivasan Dasarathy,and Arthur J. McCullough Clinical spectrum of non-alcoholic fatty liver disease in diabetic and non-diabetic patients BBA Clin. 2015 Jun; 3: 141–145.
23. Ratziu V, Giral P, Charlotte F, Bruckert E, Thibault V, Theodorou I, et al. Liver fibrosis in overweight patients. Gastroenterology 2000; 118: 1117-23
24. Anty R, Iannelli A, Patouraux S, Bonnafous S, Lavallard VJ, SenniBurattiet M, et al. A new composite model including metabolic syndrome, alanine aminotransferase and cytokeratin-18 for the diagnosis of non-alcoholic steatohepatitis in morbidly obese patients. Aliment Pharmacol Ther 2010; 32: 1315-2
25. Bedogni G, Bellentani S, Miglioli L, Masutti F, Passalacqua M, Castiglione A, Tiribelli C. The Fatty Liver Index: a simple and accurate predictor of hepatic steatosis in the general population. BMC Gastroenterol. 2006 Nov 2;6:33.]
26. Silaghi CA, Silaghi H, Colosi HA, Craciun AE, Farcas A, Cosma DT, Hancu N, Pais R, Georgescu CE. Prevalence and predictors of non-alcoholic fatty liver disease as defined by the fatty liver index in a type 2 diabetes population Clujul Medical 2016 Vol. 89 no.1: 82-88
27. Angulo P, Hui JM, Marchesini G, Bugianesi E, George J, Farrell GC, Enders F, Saksena S, Burt AD, Bida JP, Lindor K, Sanderson SO, Lenzi M, Adams LA, Kench J, Therneau TM, Day CP. The NAFLD fibrosis score: a noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology. 2007 Apr;45(4):846-54
28. Российское общество по изучению печени Методические рекомендации для врачей Диагностика и лечение неалкогольной жировой болезни печени. Под редакцией академика РАН, профессора В. Т. Ивашкина Москва.- 2015
29. Комшилова К.А., Трошина Е.А. Ожирение и неалкогольная жировая болезнь печени: метаболические риски и их коррекция Ожирение и метаболизм. 2015;12(2):35-39
30. Permutt Z, Le TA, Peterson MR, Seki E, Brenner DA, Sirlin C, et al. Correlation between liver histology and novel magnetic resonance imaging in adult patients with non-alcoholic fatty liver disease - MRI accurately quantifies hepatic steatosis in NAFLD. Aliment Pharmacol Ther 2012; 36: 22.
31. Andersen T, Gluud C, Franzmann MB, et al. Hepatic effects of dietary weight loss in morbidly obese subjects. J Hepatol 1991; 12:224-9.
32. Hickman IJ, Jonsson JR, Prins JB, et al. Modest weight loss and physical activity in overweight patients with chronic liver disease results in sustained improvements in alanine aminotransferase, fasting insulin, and quality of life. Gut 2004; 53:413-9.
33. Ekstedt M, Franz n LE, Holmqvist M, et al. Alcohol consumption is associated with progression of hepatic fibrosis in non-alcoholic fatty liver disease. Scand J Gastroenterol 2009;44:366-74.
34. Резван В.В., Васильева И.С. Роль метаболической терапии в современной кардиологии Кардиология. -2016.-№5.-С.45-49.
35. M. Re k Mas, B. Comert, K Oncu, S.A. Vural, C. Akay, I. Tasci, E. Ozkomur, M. Serdar, N. Mas, G. Alcigir, N. Yener. The effect of taurine treatment on oxidative stress in experimental liver fibrosis. Hepatology Research 2004, 28(4):207-215.
36. McCarty M.F. Complementary vascularprotective actions of magnesium and taurine: a rationale for magnesium taurate. Med Hypothes 1996; 46: 89-100.
37. Yanagita T. Han S.Y, Hu Y. Nagao K. Kitajima H. Murakami S. Taurine reduces the secretion of apolipoprotein B 100 and lipids in Hep G2 cells. Lipids Health Dis 2008.- №7.-С.38.
38. S.L. Devi, P. Viswanathan, C.V. Anuradha Regression of liver fibrosis by taurine in rats fed alcohol: effects on collagen accumulation, selected cytokines and stellate cell activation Eur. J. Pharmacol., 647 (1) (2010), pp. 161–170
39. Ито Т., Шаффер С.У.Азума Ю. Целесообразность применения таурина при сахарном диабете и его осложнениях Эндокринология: новости, мнения, обучение 2013. -№1.-С.99- 110.
40. Аметов А.С., Доскина Е.В., Новые возможности лечения пациента с сахарным диабетом и Сердечной недостаточностью: обощенный российский опыт. Медицинский совет. -2016.-№3.
41. Северина Т.И., Попкова Е.Н., Трельская Н.Ю., Емельянов В.В. Клиническая и метаболическая эффективность препарата Дибикор у больных сахарным диабетом 2 типа. Фарматека. _2011.-№5.- С.126-129.
42. Стаценко М.Е., Туркина С.В., Шилина Н.Н., Поражение печени у больных с хронической сердечной недостаточностью ишемического генеза и сахарным диабетом 2 типа – коварный тандем: возможности дополнительной органопротективной терапии. Consilium Medicum .-2016.-№5.- С.8-14
43. Nagai K, Fukuno S, Oda A, Konishi H. Protective effects of taurine on doxorubicin-induced acute hepatotoxicity through suppression of oxidative stress and apoptotic responses. Anticancer Drugs. 2016 Jan; 27(1):17-23.
44. Reza Heidari, Akram Jamshidzadeh et al. Effect of Taurine on Chronic and Acute Liver Injury: Focus on Blood and Brain Ammonia. Toxicology Reports, 2016
45. Balkan J, Doru-Abbasolu S, Kanbali O et al. Taurine has a protective effect against thioacetamide-induced liver cirrhosis by decreasing oxidative stress. Hum Exp Toxicol 2001; 20: 251–4. 18
46. Ashraf M. Abdel-Moneim et al. Radical-Scavenging, Anti-Inflammatory/Anti-Fibrotic and Hepatoprotective Actions of Taurine and
47. Miyazaki T, Karube M, Matsuzaki Y, Ikegami T, Doy M, Tanaka N, Bouscarel B.Taurine inhibits oxidative damage and prevents fibrosis in carbon tetrachloride-induced hepatic fibrosis. J Hepatol. 2005 Jul; 43(1):117-25.
48. Shanmugam Lakshmi Devi, Periyaswamy Viswanathan, Carani V. Anuradha. Regression of liver fibrosis by taurine in rats fed alcohol: Effects on collagen accumulation, selected cytokines and stellate cell activation. European journal of pharmacology, 2010, 647(1-3):161-70
49. Gentile CL, Nivala AM, Gonzales JC et al. Experimental evidence for therapeutic potential of taurine in the treatment of nonalcoholic fatty liver disease. Am J Physiol Regul Integr Comp Physiol 2011; 301 (6): R1710–R1722. 17.
50. Ozturk ZA and Kadayifci A Insulin sensitizers for the treatment of non-alcoholic fatty liver disease World J Hepatol. 2014 Apr 27; 6(4): 199–206.
51. Stefan N, H ring HU. The metabolically benign and malignant fatty liver. Diabetes 2011; 60:2011-7
52. Trivedi I, Rinella ME. NAFLD and cardiovascular disease: can the real association be determined? Curr Hepatology Rep 2014; 13: 130-41
53. El-Serag H.B., Tran T., Everhart J.E. Diabetes increases the risk of chronic liver disease and hepatocellular carcinoma. Gastroenterology. 2004;126(2):460–468 , Hossain N., Afendy A., Stepanova M. Independent predictors of fibrosis in patients with nonalcoholic fatty liver disease. Clin. Gastroenterol. Hepatol. 2009;7(11):1224–1229.
54. K r j m ki AJ, Bloigu R, Kauma H, Kes niemi YA, Koivurova OP, Perki m ki J, Huikuri H, Ukkola O. Non-alcoholic fatty liver disease with and without metabolic syndrome: Different long-term outcomes. Metabolism. 2016 Jul 1. pii: S0026-0495(16)30061-0. doi: 10.1016/j. metabol.2016.06.009.
55. Zelber-Sagi S, Lotan R, Shibolet O, Webb M, Buch A, Nitzan-Kaluski D, Halpern Z, Santo E, Oren R. Non-alcoholic fatty liver disease independently predicts prediabetes during a 7-year prospective follow-up. Liver Int. 2013 Oct;33(9):1406-12. doi: 10.1111/liv.12200.
56. Younossi Z.M., Gramlich T., Matteoni C.A., Boparai N., McCullough A.J. Nonalcoholic fatty liver disease in patients with type 2 diabetes. Clin. Gastroenterol. Hepatol. 2004;2(3):262–265.
57. Nakahara T, Hyogo H, Yoneda M, Sumida Y, Eguchi Y, Fujii H, Ono M, Kawaguchi T, Imajo K, Aikata H, Tanaka S, Kanemasa K, Fujimoto K, Anzai K,Saibara T, Sata M, Nakajima A, Itoh Y, Chayama K, Okanoue T; Japan Study Group of Nonalcoholic Fatty Liver Disease.Type 2 diabetes mellitus is associated with the fibrosis severity in patients with nonalcoholic fatty liver diseasein a large retrospective cohort of Japanese patients. J Gastroenterol. 2014 Nov;49(11):1477-84. doi: 10.1007/s00535-013-0911-1. Epub 2013 Nov 26.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 pikfarma.ru
pikfarma.ru

 pikfarma.ru
pikfarma.ru
