Возможности применения гепатопротекторов в комбинированной терапии онихомикозов
Статьи
Опубликовано в журнале:
«Русский медицинский журнал», 2014, №6, с. 1-6 Профессор Е.В. Ших, к.м.н. О.С. Сизова, к.м.н. А.А. Махова
ГБОУ ВПО «Первый МГМУ имени И.М. Сеченова» Минздрава России
Гепатотоксичность противогрибковых препаратов как фактор, ограничивающий их применение
Поражение кожи и ее придатков грибковой инфекцией остается одной из наиболее важных проблем дерматологии. По данным мировой литературы, грибковыми инфекциями поражен каждый 4-й житель планеты. В нашей стране инфицированность патогенными грибами составляет в среднем 30–40% [1, 2].
Наиболее часто встречающейся формой грибковых инфекций является онихомикоз. По данным ВОЗ (1992), микозами стоп страдает от 11,5 до 18% населения. Это заболевание приводит к разрушению ногтевой пластинки, что, в свою очередь, ведет к появлению тревоги, пониженной самооценке, снижению работоспособности [3, 4].
В настоящее время на вооружении микологов имеется широкий выбор противогрибковых препаратов системного и наружного действия в различных лекарственных формах (мази, кремы, растворы, лаки, пудра). Однако проблема лечения больных онихомикозом по-прежнему остается актуальной, т. к. нередко наблюдаются рецидивы заболевания, что может быть связано и с недостаточной продолжительностью курса терапии, которая часто ограничена в связи с гепатотоксическим действием противогрибковых препаратов.
Для оценки переносимости и профиля безопасности в отношении функции печени наиболее часто используемых системных противогрибковых препаратов, применяемых для лечения инвазивных грибковых инфекций, учеными из Тайваня и США был выполнен систематический обзор и метаанализ рандомизированных контролируемых исследований. Результаты проведенного анализа были опубликованы в номере Antimicrobial Agents and Chemotherapy (март, 2010).
Проанализировано 39 исследований с общим числом включенных пациентов более 8000. Частота прекращения лечения из-за развития нежелательных лекарственных реакций и возникновения поражений печени варьировала в значительной степени в зависимости от использованной противогрибковой терапии. Объединенный риск прекращения лечения из-за развития нежелательных лекарственных реакций был максимальным для итраконазола (18,8%), амфотерицина В (13,4%) и вориконазола (9,5%), а минимальным – для каспофунгина (3,8%), микафунгина (3,6%) и флуконазола (2,2%). Выявлено, что у 4,5% пациентов лечение итраконазолом было прекращено из-за развития гепатотоксичности через 3–6 курсов лечения. Более того, у 17,4% больных, пролеченных итраконазолом, отмечалось повышение сывороточного уровня печеночных ферментов через 3 мес. лечения, которое не потребовало прекращения лечения, но вызвало необходимость снижения дозы препарата. В группах больных, у которых применялись флуконазол и эхинокандины, повышение сывороточного уровня печеночных ферментов составило 2,0 и 9,3% соответственно.
В работах других авторов описаны случаи тяжелой гепатотоксичности при применении итраконазола, включая острую и фатальную печеночную недостаточность, наблюдавшуюся у пациентов, которые ранее имели заболевание печени, лечились в связи с системными заболеваниями и/или применяли гепатотоксичные препараты. У некоторых пациентов не было явных факторов риска со стороны печени. Случаи гепатотоксичности при применении итраконазола наблюдаются на протяжении первого месяца лечения, в т. ч. и первых недель [5, 6]. В связи с этим встает вопрос о проведении противогрибковой терапии под прикрытием лекарственных препаратов, обладающих гепатопротекторным действием.
Метаболизм противогрибковых препаратов
Все антифунгальные азолы метаболизируются с использованием системы цитохрома Р450. Системой цитохрома Р450 обозначают группу гемсодержащих изоферментов (CYP), находящихся на мембране гладкого эндоплазматического ретикулума, главным образом в печени и тонкой кишке.
Все препараты по отношению к системе цитохрома Р450 можно разделить на 3 группы: субстраты, индукторы и ингибиторы этой системы.
Субстратами являются препараты, метаболизирующиеся под каталитическим действием ферментов системы цитохрома Р450.
Ингибиторы Р450 – это препараты, которые подавляют метаболизм Р450-субстратов; процесс носит конкурентный и обратимый характер – как только происходит отмена ингибитора, метаболизм возвращается к нормальному.
Индукторы Р450 – препараты-индукторы увеличивают количество изоферментов Р450 in vivo. Этот процесс связан с активацией синтеза ферментов. В отличие от действия ингибиторов индукция длится несколько дней даже после отмены индуцирующего препарата.
Доказано, что все противогрибковые препараты метаболизируются с помощью цитохрома CYP3А4, и сами являются не только субстратом, но и ингибитором этого цитохрома. То есть чем дольше они применяются, тем ниже активность цитохрома CYP3А4, выше концентрация противогрибковых препаратов и сильнее выражена их гепатотоксичность.
Итраконазол метаболизируется в печени с образованием активных метаболитов, в т. ч. гидроксиитраконазола. Препарат является ингибитором изоферментов CYP3A4, CYP3A5 и CYP3A7. Итраконазол имеет двойной путь выведения: почками в течение 1 нед. (35% в виде метаболитов, 0,03% – в неизмененном виде) и через кишечник (3–18% в неизмененном виде). Препарат можно назначать 1 р./сут. Тем не менее, высокие дозы итраконазола (более 400 мг/сут), которые применяются при тяжелых микотических процессах и при пульс-терапии, целесообразно назначать в 2 приема. Вследствие липофильности препарата его концентрация в коже может быть в 10, а в печени – в 10–20 раз выше, чем в плазме крови. Биодоступность итраконазола может значительно варьировать: она максимальная, когда препарат назначают вместе с приемом пищи [7].
Итраконазол в основном расщепляется ферментом CYP3A4. В связи с этим изменение активности этого фермента может повлиять на эффективность и безопасность длительного применения итраконазола.
Механизмы гепатопротекторного действия таурина
Гепатопротекторы – разнородная группа лекарственных средств, препятствующих разрушению клеточных мембран и стимулирующих регенерацию гепатоцитов. К гепатопротекторам относятся лекарственные средства, обладающие способностью повышать устойчивость гепатоцитов к воздействию различных повреждающих агентов, усиливающие их детоксицирующую (обезвреживающую) функцию посредством повышения активности ферментных систем и/или мембраностабилизирующего действия, а также способствующие восстановлению функциональной активности гепатоцитов после воздействия на них различных повреждающих факторов.
Лекарственные средства, применяемые для лечения заболеваний печени, обладают разными фармакологическими механизмами защитного действия. Гепатопротекторное действие большинства препаратов связывают с ингибированием ферментативного перекисного окисления липидов, с их способностью нейтрализовать различные свободные радикалы, оказывая при этом антиоксидантный эффект. Другие препараты являются «строительным материалом» липидного слоя клеток печени, оказывают мембраностабилизирующий эффект и восстанавливают структуру мембран гепатоцитов. Третьи индуцируют микросомальные ферменты печени, повышают скорость синтеза и активность этих ферментов, способствуют усилению биотрансформации веществ, активируют метаболические процессы, что способствует быстрому выведению из организма чужеродных токсичных соединений. Четвертые препараты обладают широким спектром биологической активности, содержат комплекс витаминов и незаменимых аминокислот, повышают устойчивость организма к воздействию неблагоприятных факторов, уменьшают токсические эффекты, в т. ч. и после принятия алкоголя и др. [8].
Большой интерес для клиницистов в последнее время представляет таурин (рис. 1), который является естественным продуктом обмена серосодержащих аминокислот: цистеина, цистеамина, метионина. Таурин – жизненно необходимая сульфоаминокислота, которая была найдена практически у всех видов животных. В растительном мире это вещество не встречается. Исключение составляют красные водоросли. Так как синтез таурина у людей ограничен, существует необходимость дополнительного его употребления.
Рис. 1. Химическая формула таурина
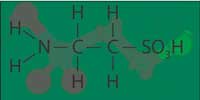
Во 2-й половине ХХ в. в научной литературе было опубликовано большое количество работ, посвященных эффектам таурина. Благоприятное лечебное действие было обнаружено при кардиоваскулярных заболеваниях, гликозидных интоксикациях, гиперхолестеринемии, при заболеваниях печени, в т. ч. лекарственных, алкоголизме [9].
Результаты экспериментальных исследований показали, что реперфузионная ишемия печени обусловлена не только ее травмой, но и эндоксемией, которая усугубляет Hir-индуцированные повреждения печени и дисфункцию или даже может быть причиной печеночной недостаточности. Применение таурина приводило к защите печени от ишемии и реперфузии. Эти данные подчеркивают потенциальную возможность использования таурина для защиты печени от эндотоксина, вызванного травмой, особенно после Hir-индуцированного повреждения печени. Гепатопротекторное действие таурина, установленное в этой серии экспериментов, можно объяснить его противовоспалительным, антиокислительным и антиапоптотическим эффектами.
Проведено исследование влияния низкобелковой диеты на экспрессию генов у мышей. Оказалось, что такая диета затрагивает 2013 генов в печени и 967 генов скелетных мышц. Регуляция таурином воздействует на гены в печени, регулирующие метаболизм жирных кислот, окислительное фосфорилирование и цикл трикарбоновых кислот в скелетных мышцах. Авторы делают вывод, что уменьшение поступления белка при гестации приводит к дефициту массы при рождении, которая связана со значительным изменением генной экспрессии. Эти эффекты значительно уменьшаются при добавлении в рацион таурина. Таким образом, таурин является ключевым компонентом в метаболическом фетальном программировании.
Кроме того, таурин защищает гепатоциты при различных воздействиях: при диете с высоким содержанием холестерина, при отравлении эндотоксином, этанолом, 4-хлористым углеродом, циклоспорином. Таурин уменьшает пролиферацию, оксидативный стресс и фиброгенез.
Назначение таурина может быть эффективным способом метаболической профилактики и коррекции нарушений функций печени при возможной передозировке парацетамола. Дополнительное введение таурина препятствует цитотоксическому действию высоких доз парацетамола, способствует выведению метаболитов парацетамола из организма, поддерживает функционирование эндогенных систем детоксикации и способствует сохранению пула глутатиона. Одновременно таурин оптимизирует изменение внутриклеточного объема за счет регулирования уровня Ca2+ в гепатоцитах, способен подавлять процессы перекисного окисления липидов, стабилизировать мембранную проницаемость и транспорт ионов. Таурин, участвуя в фосфорилировании некоторых регуляторных и мембранных белков, изменяет их конформацию и, как следствие, структурно-функциональные свойства мембран клеток. Таким образом, мембраностабилизирующие, антиоксидантные и гепатопротекторные свойства позволяют рассматривать таурин в качестве средства для профилактики и лечения CYP2E1-ассоциированных повреждений печени, в т. ч. при передозировке парацетамола [10].
Полученные в эксперименте данные о положительном влиянии таурина на функцию печени послужили основанием для создания лекарственных препаратов, обладающих гепатопротекторным действием. Одним из таких новых перспективных препаратов на основе таурина является отечественный препарат Дибикор. Доказано, что Дибикор обладает гепатопротекторными свойствами при дислипидемиях различного генеза; заболеваниях печени, протекающих с жировой инфильтрацией гепатоцитов; хронических интоксикациях печени, вызванных CCl4, гликозидами и другими лекарствами (лекарственное поражение печени). Оба эти показания взаимосвязаны, т. к. при нормализации функции гепатоцитов восстанавливается обмен жиров и липидный профиль.
Опыт применения Дибикора у больных хроническим персистирующим гепатитом показал, что прием препарата в дозе 0,5 г 2 р./сут приводил к значительному улучшению печеночного кровотока и уменьшению цитолитического воспалительного синдрома [11–14].
Аналогичные результаты были получены сотрудниками Волгоградского медицинского университета, которые показали, что после курса терапии Дибикором длительностью 21 день в дозе 1 г/сут отмечалось значительное клиническое улучшение у больных, страдающих хроническим активным гепатитом. Предшествующая гормональная терапия (преднизолон 40 мг/сут) к клинико-лабораторному улучшению не привела: сохранялись высокая активность ферментов и снижение печеночного кровотока [15].
Данные экспериментальных исследований, результаты применения Дибикора в клинике подтверждают наличие у таурина гепатопротекторных эффектов и расширяют возможности его клинического применения.
Результаты собственных исследований гепатопротекторного действия таурина при длительном применении противогрибковых препаратов
Под наблюдением находилось 104 больных онихомикозом, обратившихся за медицинской помощью в микологический кабинет кожно-венерологического диспансера № 15 Юго-Восточного округа г. Москвы. Характеристика больных представлена в таблице 1.
Таблица 1. Характеристика больных онихомикозом, включенных в исследование
| Показатели |
Абс. |
% |
| Количество больных |
104 |
100 |
| мужчины |
60 |
57,7 |
| женщины |
44 |
42,3 |
| Средний возраст, лет |
57,54±9,8 |
– |
| Масса тела, кг |
82,6±7,6 |
– |
| Рост, см |
171,2±11,0 |
– |
| Анамнестическая длительность онихомикоза, мес. |
|
|
| 0–12 |
44 (24 муж., 20 жен.) |
42,3 |
| 13–60 |
18 (14 муж., 4 жен.) |
17,3 |
| 61–120 |
12 (6 муж., 6 жен.) |
11,5 |
| более 120 |
30 (16 муж., 14 жен) |
28,8 |
| Ср. анамнестическая длительность онихомикоза, мес. |
65,3±15,8 |
– |
| Поражение ногтевых пластинок пальцев стоп |
80 (44 муж., 36 жен.) |
76,9 (42,3/34,6) |
| Поражение ногтевых пластинок пальцев кистей |
4 (4 жен.) |
3,8 (3,8) |
| Поражение ногтевых пластинок пальцев стоп и пальцев кистей |
20 (16 муж., 4 жен.) |
19,2 (15,4/3,8) |
| Гипертрофический тип поражения |
70 (36 муж., 34 жен.) |
67,3 |
| Нормотрофический тип поражения |
34 (10 муж., 24 жен.) |
32,7 |
Согласно дизайну исследования все пациенты были разделены на 3 группы в зависимости от вида применяемой лекарственной терапии. 34 больных онихомикозом получали в качестве антимикотической терапии монотерапию итраконазолом (группа 1), 34 больных – комбинацию итраконазола и таурина (группа 2), 36 больных – комбинацию итраконазола и экстракта плодов расторопши пятнистой (группа 3).
Группы больных, получавших различную терапию онихомикоза, были сопоставимы по основным клинико-демографическим параметрам.
В качестве антимикотического средства использовался итраконазол, в качестве гепатопротекторов – таурин и экстракт плодов расторопши пятнистой.
Итраконазол – антимикотический препарат широкого спектра действия, применялся в виде пульс-терапии по 200 мг 2 р./сут после еды в течение 7 дней с перерывом в 21 день. Длительность лечения составила от 2 до 9 туров терапии.
Дибикор (таурин, ООО «ПИК-ФАРМА», Россия) – естественный продукт обмена серосодержащих аминокислот: цистеина, цистеамина, метионина, назначался в комбинации с итраконазолом, разовая доза составляла 500 м г, суточная – 1000 мг, кратность приема – 2 р./сут за 20 мин до приема пищи.
Экстракт плодов расторопши пятнистой в таблетках, назначался в комбинации с итраконазолом, разовая доза составляла 100 мг, суточная – 300 мг, кратность приема – 3 р./сут.
Оценка динамики клинических проявлений онихомикоза проводилась на основании ежемесячных осмотров пациентов. Положительным эффектом фармакотерапии считалось отрастание от проксимального края неизмененного ногтя бледно-розового цвета.
Исследование ногтевых пластинок на наличие микотического поражения производилось всем больным в клинической лаборатории КВД № 15 методом прямой микроскопии с использованием 10% раствора гидроксида калия. Контрольные микроскопические исследования материала с ногтевых пластин больных онихомикозом проводились по достижению клинического излечения с троекратным повтором с интервалом в 3 мес.
Оценка динамики биохимических показателей функции печени проводилась до начала терапии и после окончания каждого тура лечения. В динамике изучались показатели: АСТ (N=0–40 Ед./л), АЛТ (N=0–40 Ед./л), общего белка (N=65–85 г/л), альбумина (N=35–53 г/л), билирубина общего (N=3,4–20,5 мкмоль/л), билирубина прямого (N?3,4 мкмоль/л), щелочной фосфотазы (ЩФ) (N=0–115 Ед./л), ?-глютамилтранспептидазы (ГГТ) (N=0–38 Ед./л).
В качестве признака биохимического цитолитического синдрома рассматривалось повышение в плазме крови уровня аминотрансфераз в 1,5–3 раза; биохимического холестатического синдрома – повышение уровня ЩФ более 3-х норм, ГГТ – более 5.
Эффективность проводимой системной терапии итраконазолом у больных онихомикозом составила 100% и не зависела от выбора гепатопротектора. Средняя длительность системной терапии онихомикоза была сопоставимо одинакова во всех группах и составила 6,21±1,3; 6,40±1,1 и 6,28±1,2 туров для больных, получавших итраконазол, комбинацию «итраконазол + таурин» и комбинацию «итраконазол + экстракт плодов расторопши пятнистой» соответственно. Большинству больных онихомикозом (77,6%) потребовалось 5–8 туров итраконазола, продолжительность лечения составила от 5 до 8 мес. Более того, 12 (11,5%) больных нуждались в более длительной терапии: 9 турах итраконазола. Это, вероятно, связано с наличием у этих больных сопутствующих заболеваний: сахарный диабет у 5 больных, облитерирующий атеросклероз нижних конечностей – у 4-х больных, варикозное расширение вен нижних конечностей – у 6 больных. Все пациенты имели длительный анамнез онихомикоза.
На фоне проводимой монотерапии итраконазолом и итраконазолом в сочетании с экстрактом плодов расторопши пятнистой у больных онихомикозом после 6 тура лечения отмечалось гепатотоксическое действие итраконазола, проявляющееся в биохимических признаках цитолиза и холестаза. В группе больных, получавших итраконазол в сочетании с таурином, независимо от длительности проводимой терапии, достоверных биохимических признаков цитолиза и холестаза выявлено не было.
Итраконазол является одновременно и субстратом, и ингибитором изофермента цитохрома Р450 3А4 (CYP3A4). В связи с этим при длительном применении азолов в результате самоингибирования и изменения активности Р450 3А4 возможно изменение концентрации в плазме крови. Существует предположение, что гепатотоксический эффект азолов может быть связан с повышением концентрации препарата в плазме крови.
В нашем исследовании равновесная концентрация итраконазола в плазме крови больных онихомикозом находилась в диапазоне терапевтических значений (2–10 мкг/мл) независимо от проводимой терапии. К концу периода наблюдения концентрация итраконазола в плазме крови в группах больных, получавших монотерапию итраконазолом (6,1±0,6 мкг/мл) и комбинацию «итраконазол + экстракт плодов расторопши пятнистой» (4,8±0,8 мкг/мл), статистически достоверно превышала этот показатель в группе больных, находившихся на терапии «итраконазол + таурин» (3,0±0,4 мкг/мл).
Влияние гепатопротекторов на активность CYР450 3А4
Как показывают собственные результаты, полученные в эксперименте, таурин нивелирует ингибирование CYР450 3А4 и, возможно за счет этого, устраняет повреждающее действие итраконазола на печень. Одним из возможных гепатопротекторных эффектов таурина в случае одновременного применения с азолами является удержание концентрации итраконазола в плазме крови на уровне, не оказывающем повреждающего действия.
Экспериментальные данные подтверждают отсутствие у экстракта плодов расторопши пятнистой влияния на активность CYР450 3А4, в связи с этим можно предположить наличие более высокой плазменной концентрации итраконазола, что объясняет наличие более выраженного гепатотоксического эффекта у пациентов, принимавших комбинацию препаратов «итраконазол + экстракт плодов расторопши пятнистой» по сравнению с комбинацией «итраконазол + таурин». Гепатопротекторное действие экстракта плодов расторопши пятнистой продемонстрировано в эксперименте на моделях токсического поражения печени у крыс, вызванного введением тетрахлорметана. В остром эксперименте при разовом введении тетрахлорметана назначение флавоноидов расторопши сопровождалось отчетливым снижением степени выраженности цитолиза и холестаза. В хроническом эксперименте с тетрахлорметаном введение экстракта плодов расторопши пятнистой также способствовало значительному снижению выраженности цитолиза и холестаза.
Возможным объяснением гепатопротекторного действия экстракта плодов расторопши пятнистой является его способность стимулировать синтез белков и поддерживать процесс регенерации гепатоцитов. Кроме того, экстракт плодов расторопши пятнистой обладает выраженными желчегонными свойствами. Нами получены экспериментальные данные путем проведения электрохимических исследований по изучению влияния итраконазола и гепатопротекторов на активность CYР450 3А4. Результаты представлены в таблице 2 [16].
Таблица 2. Средние значения катодного каталитического тока под влиянием различных комбинаций субстратов, ингибиторов, модуляторов CYP450 3А4
| № |
Система |
Значение тока, ?А |
Значение тока, % |
р |
| 1 |
3А4 |
-0,622±0,121 |
100 |
- |
| 3А4 + диклофенак |
-0,742±0,114 |
120,5 |
<0,05 |
| 2 |
3А4 |
-1,092±0,212 |
100 |
- |
| 3А4 + итраконазол |
-1,120±0,198 |
104,2 |
- |
| 3 |
3А4 |
-0,913±0,209 |
100 |
- |
| 3А4 + итраконазол |
-0,833±0,167 |
91,2 |
- |
| 3А4 + итраконазол + диклофенак |
-0,827±0,234 |
90,6 |
- |
| 4 |
3А4 |
-0,915±0,200 |
100 |
- |
| 3А4 + таурин |
-0,985±0,199 |
107,7 |
<0,05 |
| 3А4 + таурин + итраконазол |
-1,205±0,261 |
131,7 |
<0,05 |
| 3А4 + итраконазол + таурин |
-0,933±0,167 |
102,0 |
<0,05 |
| 5 |
3А4 |
-0,915±0,164 |
100 |
- |
| 3А4 + итраконазол |
-0,933±0,178 |
102,0 |
- |
| 3А4 + итраконазол + таурин |
-1,271±0,302 |
139,0 |
<0,05 |
| 6 |
3А4 |
-0,838±0,109 |
100 |
- |
| 3А4 + экстракт плодов расторопши пятнистой |
-0,894±0,311 |
106,7 |
- |
| 3А4 + экстракт плодов расторопши пятнистой + итраконазол |
-0,868±0,276 |
103,6 |
- |
Результаты экспериментального изучения влияния итраконазола на электрохимическую активность CYР450 3А4 показали, что при добавлении итраконазола к DDAB/Au/P450 3А4 электроду не наблюдается увеличения катодного каталитического тока. Так, среднее значение тока DDAB/Au/P450 составило -0,913±0,209 ?А (100%), при добавлении итраконазола к DDAB/Au/P450 3А4 электроду – 0,833±0,167 ?А (91,2%). Полученные результаты исследования можно объяснить проявлением не только субстратных, но и ингибирующих свойств итраконазола по отношению к цитохрому Р450 3А4.
Ингибирующее действие итраконазола (в концентрации 10 мкМ) в присутствии 50 мкМ таурина существенно снижается. Основной вывод, который можно сделать на основании проведенных экспериментов, – таурин снижает ингибирующий эффект итраконазола. Результаты электрохимического анализа показали, что экстракт плодов расторопши пятнистой не оказывает существенного влияния на активность цитохрома Р450 3А4.
Таким образом, можно предположить, что за счет регуляторного влияния таурина на активность CYP3А4 можно существенно снизить гепатотоксичность противогрибковых азолов, в частности итраконазола.
Заключение
Отличительной особенностью таурина по сравнению с другими веществами с гепатопротекторным действием является наличие индуцирующего действия на изофермент цитохрома Р450 3А4.
Все противогрибковые препараты метаболизируются с помощью цитохрома CYP3А4 и сами являются не только субстратом, но и ингибитором этого цитохрома. То есть чем дольше они применяются, тем ниже активность цитохрома, выше концентрация противогрибковых азолов и сильнее их повреждающее действие на печень.
Противогрибковые азолы (итраконазол, флуконазол, кетоконазол и др.) применяются очень широко для лечения противогрибковых заболеваний, эффективность их доказана, однако назначение препаратов данной группы лимитирует развитие побочных эффектов, наиболее серьезным из которых является их сильная гепатотоксичность. Поэтому вместе с противогрибковыми препаратами назначают гепатопротекторы. При этом необходимо учитывать, что гепатопротекторы различаются по влиянию на активность цитохрома CYP3А4: не изменяют (например, экстракт плодов расторопши пятнистой); угнетают (например, флумецинол) и активируют (например, таурин).
Результаты проведенного нами исследования позволили подтвердить предположение о том, что за счет регуляторного влияния гепатопротекторов (таурин) на активность CYP3А4 можно существенно снизить гепатотоксичность противогрибковых азолов при их длительном применении.
ЛИТЕРАТУРА
1. Васенова В.Ю., Бутов Ю.С. Некоторые аспекты эпидемиологии, патогенеза и терапии они-хомикозов // Рос. журн. кожн. и вен. бол. 2005. № 3. С. 42–44.
2. Дубенский В.В. Современный взгляд на проблему онихомикозов // Клиническая дерматология и венерология. 2004. № 3. С. 11–15.
3. Лещенко В.М. Современные антимикотики в дерматологии // Consilium medicum. 2004. С. 186–191.
4. Новоселов В.С., Новоселов А.В. Рациональные подходы к терапии поверхностных микозов // Consilium Medicum, приложение «Дерматология». 2007. № 1. С. 24–27.
5. Курдина М.И., Иваников И.О., Сюткин В.Е. Системные антимикотики при дерматомикозах и патологии гепатобилиарной системы. Пособие для врачей. М., 2004. 156 с.
6. Минушкин О.Н. Некоторые гепатопротекторы в лечение заболеваний печени // Лечащий врач. 2002. № 6. С. 55–58.
7. Кукес В.Г., Фисенко В.П., Стародубцев А.К. и др. Метаболизм лекарственных препаратов; под ред. В.Г . Кукеса, В.П. Фисенко. М.: Палея-М, 2001.
8. Буеверов А.О. Место гепатопротекторов в лечении заболеваний печени // Болезни органов пищеварения. 2001. № 2. С. 16–18.
9. Miyazaki T., Bouscarel B., Ikegami T. et al. The protective effect of taurine against hepatic damage in a model of liver disease and hepatic stellate cells // Adv. Exp. Med. Biol. 2009. Vol. 643. P. 293–303.
10. Горецкая М.В., Шейбак В.М. Гепатопротекторные свойства таурина при интоксикации парацетамолом // Известия Национальной академии наук Белоруссии. 2013. № 3. С. 96–101.
11. Chen S.W., Chen Y.X., Shi J. et al. The restorative effect of taurine on experimental nonalcoholic steatohepatitis // Dig. Dis .Sci. 2006. Vol. 51 (12). P. 2225–2234.
12. Chen W., Matuda K., Nishimura N., Yokogoshi H. The effect of taurine on cholesterol degradation in mice fed a high-cholesterol diet // Life Sci. 2004. Vol. 74 (15). P. 1889–1898.
13. Dincer S., Ozenirler S., Oz E. et al. The protective effect of taurine pretreatment on carbon tet-rachloride-induced hepatic damage--a light and electron microscopic study // Amino Acids. 2002. Vol. 22 (4). P. 417–426.
14. Yildirim Z., Kilic N., Ozer C. et al. Effects of taurine in cellular responses to oxidative stress in young and middle-aged rat liver // Ann. N. Y. Acad. Sci. 2007. Vol. 1100. P. 553–561.
15. Савельева И. Возможность применения Дибикора в гастроэнтерологии // Медицинский вестник. 03.10.2008. № 31.
16. Ших Е.В., Махова А.А.Экспериментальное обоснование возможности регуляции активности CYР450 3А4 таурином с целью оптимизации фармакотерапии антибиотиками-макролидами // Биомедицина. 2013. № 4. C. 169–173.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 pikfarma.ru
pikfarma.ru

 pikfarma.ru
pikfarma.ru
