Влияние таурина на частоту распространения нарушений сердечного ритма, дисперсию интервала QT у пациентов c сердечной недостаточностью вследствие постинфарктного кардиосклероза
Статьи
Результаты сравнительного, рандомизированного исследования
Опубликовано в журнале:
«Кардиоваскулярная терапия и профилактика»; № 11(1); 2012; стр. 65-70.
Гордеев И.Г., Покровская Е.М.*, Лучинкина Е.Е.
ГБОУ ВПО Российский национальный исследовательский медицинский университет им. Н.И.Пирогова Минздравсоцразвития России. Москва, Россия
Цель. Изучить влияние терапии таурином на частоту распространения нарушений сердечного ритма, дисперсию интервала QT у пациентов с хронической сердечной недостаточностью (ХСН) вследствие постинфарктного кардиосклероза (ПИКС).
Материал и методы. В исследование включены 40 пациентов, перенесших инфаркт миокарда (ИМ) с фракцией выброса левого желудочка (ФВ ЛЖ) < 45 % и ХСН II-III функциональных классов (ФК) по NYHA. Пациенты были распределены в две группы (гр.): основную (ОГ) составили 20 пациентов, у которых к стандартной терапии ХСН добавлен таурин, 20 пациентам контрольной гр. (ГК) проводилась стандартная терапия ХСН. Гр. были сопоставимы по основным клинико-анамнестическим характеристикам. Продолжительность лечения составила 3 мес. Для оценки влияния таурина на частоту нарушений сердечного ритма, дисперсию интервала QT до начала лечения и через 3 мес. терапии, исследуемые гр. были разделены на подгруппы в зависимости от ФК ХСН. Дисперсия интервала QT оценивалась посредством регистрации ЭКГ в 12 отведениях; количество нарушений сердечного ритма с помощью суточного мониторирования ЭКГ по Холтеру.
Результаты. Применение таурина у пациентов с ХСН, обусловленной ПИКС, оказывает положительное воздействие на динамику показателя дисперсии интервала QT, количество нарушений сердечного ритма.
Заключение. Таурин целесообразно включать в состав комплексного лечения больных с ХСН II и III ФК NYHA, после перенесенного ИМ.
Ключевые слова: хроническая сердечная недостаточность, таурин, дисперсия интервала QT, нарушения ритма сердца.
TAURINE EFFECTS ON THE OCCURRENCE OF CARDIAC ARRHYTHMIAS AND QT INTERVAL DISPERSION IN PATIENTS WITH POSTINFARCTION CARDIOSCLEROSIS AND CHRONIC HEART FAILURE: A COMPARATIVE RANDOMISED STUDY
Gordeev I.G., Pokrovskaya E.M.*, Luchinkina E.E.
N.I. Pirogov Russian National Medical University. Moscow, Russia
Aim. To study the effects of taurine therapy on the occurrence of cardiac arrhythmias and QT interval dispersion among patients with post-infarction cardiosclerosis (PICS) and subsequent chronic heart failure (CHF).
Material and methods. The study included 40 patients with previous myocardial infarction (MI), left ventricular ejection fraction (LVEF) <45 %, and Functional Class (FC) II-III CHF (NYHA). The participants were randomised into two groups: the main group (MG) included 20 patients receiving standard CHF treatment and taurine, while the control group (CG; n=20) was administered standard CHF treatment only. Both groups were comparable by the main clinical and anamnestic parameters. The therapy phase lasted 3 months. The analysis of taurine effects on the occurrence of cardiac arrhythmias and QT interval dispersion was performed in the subgroups defined according to the CHF FC. QT interval dispersion was assessed by 12-lead electrocardiography (ECG), while the arrhythmia occurrence was assessed by Holter ECG monitoring. The examined parameters were measured at baseline and after 3 months of the therapy.
Results. In PICS patients with CHF, taurine demonstrated beneficial effects on the dynamics of QT interval dispersion and cardiac arrhythmia occurrence.
Conclusion. Taurine could be included in the complex treatment of PICS patients with FC II-III CHF.
Key words: Chronic heart failure, taurine, QT interval dispersion, cardiac arrhythmias.
Актуальность
В настоящее время хроническая сердечная недостаточность (ХСН) остается актуальной проблемой современной медицины. Разработка новых методов диагностики и лечения СН обусловили определенный прогресс в этой отрасли знаний, однако, несмотря на достигнутые успехи, количество госпитализаций по поводу заболевания не уменьшается, а смертность в течение года вследствие ХСН остается высокой [1]. Кроме того, у пациентов с ХСН риск внезапной смерти (ВС) в 5 раз выше, чем в популяции [2].
Наиболее частой причиной развития ХСН является ишемическая болезнь сердца (ИБС). У больных, перенесших инфаркт миокарда (ИМ), она является одной из ведущих причин инвалидизации и смертности [3-5].
Важнейшее место в структуре летальных исходов у подобных пациентов отводится внезапной сердечной смерти (ВСС), основной причиной которой служат злокачественные нарушения желудочкового сердечного ритма (НЖР). Они в сочетании со снижением сократительной способности левого желудочка (ЛЖ) значительно повышают риск летального исхода [6,7].
Оптимизация терапии ХСН продолжает оставаться важнейшей проблемой современной кардиологии. Зачастую, даже при назначении комбинации препаратов основных рекомендованных классов, не удается достичь должного результата, что послужило основанием для поиска новых лекарственных препаратов, обладающих выраженной активностью на метаболическом уровне [8,9]. Одним из таких препаратов является таурин — конечный продукт обмена содержащих серу аминокислот [10-12].
Целью исследования явилось изучение влияния терапии таурином на распространенность нарушений сердечного ритма, дисперсию интервала QT (dQT) у пациентов c СН вследствие постинфарктного кардиосклероза (ПИКС).
Материал и методы
В исследование включали мужчин и женщин в возрасте 40-70 лет, перенесшие ИМ, осложнившийся развитием ХСН II-III функциональных классов (ФК) по классификации Нью-Йоркской ассоциации сердца (NYHA) и фракцией выброса (ФВ) < 45 %. Диагноз заболевания устанавливался на основании жалоб, данных анамнеза, клинической картины и результатов лабораторно-инструментальных методов исследования.
После подписания информированного согласия пациенты случайным методом были распределены на 2 группы (гр.) — основную гр. (ОГ) составили 20 пациентов, которым к стандартной терапии, рекомендованной для лечения ИБС и ХСН, был добавлен таурин (Дибикор, Пик-фарма, Россия), суточная доза 750 мг, двукратный прием. 20 больным контрольной гр. (ГК) проводилась стандартная терапия. Продолжительность лечения составила 3 мес. Всего в исследование включены 40 пациентов.
На момент включения в исследование все пациенты получали стандартную терапию, рекомендованную для лечения ИБС и ХСН, включавшую в себя ингибиторы ангиотензин-превращающего фермента (ИАПФ), Р-адреноблокаторы β-АБ), антагонисты альдостерона, дезагреганты, статины, а также тиазидные (тД) и петлевые диуретики (пД), антагонисты кальциевых каналов (АК), нитраты.
Гр. были сопоставимы по основным клинико-анамнестическим характеристикам, тяжести сопутствующей патологии и по назначенной терапии (таблица 1).
Таблица 1
Распределение больных по полу и возрасту
| возраст / пол | 40-50 | 51-56 | 57-65 | 66-70 |
| Мужчины | 3 | 6 | 7 | 6 |
| Женщины | 1 | 3 | 6 | 8 |
| Итого | 4 | 9 | 13 | 14 |
С целью изучения влияния таурина на динамику dQT, частоту нарушений сердечного ритма исследуемые гр. были разделены на подгруппы в зависимости от ФК ХСН. В 1 подгруппу включен 21 пациент с ХСН II ФК, во 2 подгруппу — 19 пациентов с ХСН III ФК по NYHA. ФК ХСН определяли согласно критериям NYHA.
Интервал QT измеряли на поверхностной ЭКГ (Shiller, Switzerland), зарегистрированной в 12 отведениях. Корригированный интервал QT рассчитывали на основе формулы Bazett H. Интервал QT измерялся вручную от начала комплекса QRS до окончания зубца T, которое определялось как точка возврата зубца T к изолинии TP; при наличии волны U интервал QT измерялся до наиболее глубокой точки между T и U. В случаях невозможности точного определения зубца T отведение исключалось из анализа. В каждом отведении измерялись три последовательных цикла, интервал QT рассчитывался как среднее из полученных значений. Не менее 8 отведений, из них, как минимум, 4 грудных, требовалось для расчета dQT dQT определялась как разница между наибольшим и наименьшим значениями интервала QT в любом из 12 отведений; корригированную дисперсию интервала QT (QTc) _ как разницу между QT c max и QT c min. Производился расчет dQT на каждом визите пациентов в клинику.
Количество нарушений сердечного ритма оценивалось посредством суточного мониторирования (СМ) ЭКГ по Холтеру и проводилось с использованием холтеровских мониторов и компьютерной программы, разработанной фирмой Shiller (Switzerland) на первом и последнем визитах.
Статистическую обработку полученных результатов производили c применением приложения Excel из программного пакета Office 2007 (Microsoft, США) для операционной системы Windows, а также с помощью программного пакета Biostat. Выявление статистически значимых межгрупповых различий средних величин клинических, лабораторных, инструментальных, гемодинамических показателей производилось с применением критерия Стьюдента с определением статистической значимости для а=0,05 с последующим графическим представлением результатов.
Результаты
При рассмотрении динамики dQT у пациентов с ХСН II ФК NYHA на фоне ПИКС отмечено ее достоверное снижение в ОГ.
Исходно, по показателю dQT обе гр. были сопоставимы. Среднее значение данной величины в подгруппе пациентов ОГ составляло 80±21,4 мсек, ГК - 85,5±35,9 мсек.
После курса 3-месячной терапии у пациентов ОГ зарегистрировано достоверное уменьшение показателя dQT на 28,1 % и ее значение составило 57,5±12,8 мсек (р=0,026). В ГК пациентов было отмечено уменьшение данного показателя на 4,3 % до 81,8±30,3 мсек, однако эта динамика не являлась достоверной (рисунок 1).
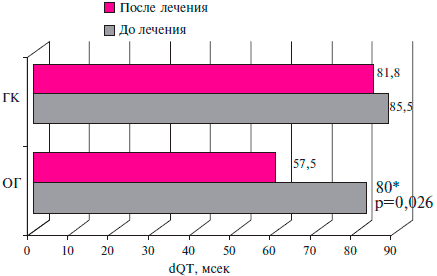
Рис. 1 Влияние таурина на dQT у больных ПИКС и СН II ФК ХСН по NYHA.
Проанализирована dQT у пациентов с ХСН III ФК NYHA на фоне ПИКС. Среднее значение данной величины до лечения в ОГ составило 82±28,9 мсек, ГК - 70±16,7 мсек (р>0,05).
На фоне проводимой терапии выявлена тенденция к ее уменьшению у пациентов ОГ на 14,6 %, в отличие от увеличения данной величины на 4,8 % в ГК (рисунок 2). Полученные данные статистически недостоверны.
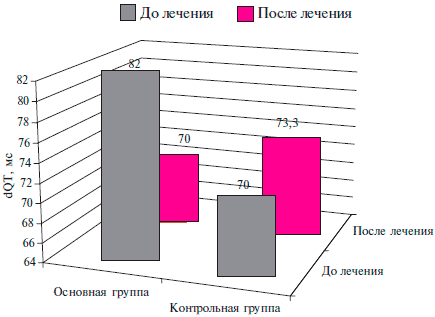
Рис. 2 Влияние таурина на dQT у больных ПИКС и СН III ФК ХСН по NYHA.
У больных с ХСН II ФК на фоне ПИКС на момент рандомизации в среднем регистрировалось 105,1±13,3 желудочковых экстрасистол (ЖЭС) в ОГ, 492±64,3 в ГК (р>0,05).
До назначения таурина у 5 пациентов ОГ были зафиксированы эпизоды желудочковой аллоритмии, у 7 — парные ЖЭС, у 1 пациента зарегистрировано 4 эпизода желудочковой тахикардии (ЖТ).
В начале исследования парная ЖЭС по данным СМ ЭКГ регистрировалась у 2 больных ГК, эпизоды желудочковой аллоритмии у 9 пациентов. Эпизодов ЖТ в ГК выявлено не было.
На фоне 3-месячной терапии таурином у пациентов ОГ отмечалось достоверное уменьшение количества ЖЭС на 88 % до 12,1±4,7 (р=0,042) в сравнении с пациентами ГК (рисунок 3), у которых количество ЖЭС уменьшилось на 23,5 %, и составило 376,2±47,3 (р=0,64).
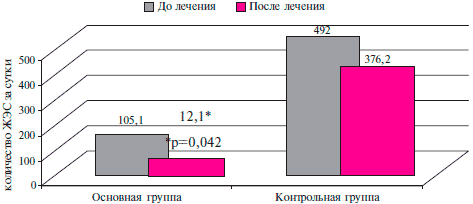
Рис. 3 Влияние таурина на количество ЖЭС у больных ПИКС и СН II ФК ХСН (NYHA).
После проведенной терапии парные ЖЭС регистрировались у 2 пациентов ОГ. Эпизодов желудочковой аллоритмии и ЖТ зарегистрировано не было.
В конце периода наблюдения отмечалось небольшое увеличение количества пациентов с парной ЖЭС и эпизодами желудочковой аллоритмии, получавших стандартную терапию, в частности: парная ЖЭС регистрировалась у 5 больных, эпизоды желудочковой аллоритмии у 11 пациентов. Эпизодов ЖТ не выявлено.
По данным холтеровского мониторирования (ХМ) ЭКГ среднее количество наджелудочковых ЭС (НЖЭС) до лечения у пациентов ОГ и ГК составило 598,6±81,9 и 516±84,2 соответственно. Гр. были сопоставимы по данным значениям. У 7 пациентов ОГ и 9 пациентов ГК было выявлено наличие эпизодов наджелудочковой тахикардии (НЖТ).
После окончания лечения было зафиксировано достоверное уменьшение количества НЖЭС на 58,6 % до 248,1±76 (р=0,04) у пациентов, которым к стандартной терапии был добавлен таурин. В ГК также была выявлена тенденция к уменьшению количества НЖЭС на 8,2 %, что составило 474±77,9 (рисунок 4), однако такое изменение не являлось достоверным.
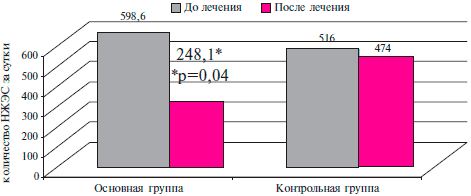
Рис. 4 Влияние таурина на количество НЖЭС у больных ПИКС и СН II ФК ХСН по NYHA.
На фоне проведенной терапии, количество пациентов с выявленной НЖТ уменьшилось до 3 в ОГ, до 7 в ГК.
Исходно, по данным СМ ЭКГ у пациентов с ХСН III ФК, обусловленной ПИКС, в среднем зарегистрировано 924± 163,7 ЖЭС у пациентов ОГ и 268±79,7 ЖЭС у больных ГК (р>0,05).
У 9 пациентов ОГ и 6 пациентов ГК были зафиксированы эпизоды желудочковой аллоритмии, у 11 больных ОГ и 13 ГК — парные ЖЭС. У 2 пациентов в ОГ и 1 пациента в ГК до лечения зарегистрированы эпизоды ЖТ.
Добавление таурина к стандартной терапии ХСН и ИБС приводило к достоверному снижению количества ЖЭС на 70,5 % до 272,9±89,3 через 3 мес. наблюдения у пациентов ОГ (р=0,028) (рисунок 5).
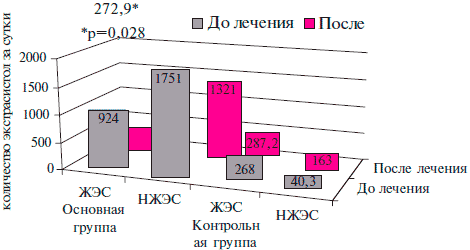
Рис. 5 Влияние таурина на динамику показателей нарушений сердечного ритма у больных ПИКС и СН III ФК ХСН по NYHA.
В ГК был зафиксирован прирост количества ЖЭС на 7,2 % до 287,2±84,5, однако данная динамика недостоверна (р=0,66).
Через 3 мес. наблюдения парные ЖЭ регистрировались у 5 пациентов ОГ, 9 пациентов ГК, эпизоды желудочковой аллоритмии у 3 пациентов ОГ, 3 пациентов ГК. Эпизоды ЖТ отсутствовали в обеих гр.
Среднее количество НЖЭС до лечения у пациентов ОГ и ГК составило 1751±576,3 и 40,3±8,8, соответственно. После курса лечения была зафиксирована тенденция к уменьшению количества этого показателя на 24,6 % до 1321±790,2 в ОГ, к увеличению данного показателя на 33,7 %, что составило 163±35,1 в ГК. Данные изменения были недостоверны.
На момент включения в исследование у 10 человек ОГ и 1 больного ГК было выявлено наличие эпизодов НЖТ.
В конце периода наблюдения отмечалось уменьшение количества пациентов с эпизодами НЖТ в ОГ до 4-х. В ГК зафиксировано увеличение количества пациентов с данными нарушениями ритма до 2 пациентов.
Обсуждение
Полученные в ходе исследования результаты согласуются с имеющимися литературными данными о положительном влиянии таурина на динамику dQT, частоту нарушений сердечного ритма.
Показано, что dQT обусловлена в основном изменениями конечного отрезка интервала QT и отражает, таким образом, негомогенность процессов реполяризации [13-16]. Феномен dQT в настоящее время еще не получил окончательного и однозначного объяснения, однако, по данным многих исследований, увеличение dQT может служить маркером нестабильности электрофизиологических свойств миокарда и ассоциируется с повышенным риском возникновения опасных аритмий у больных с ХСН, перенесших ИМ [15,17-19].
По результатам проводимых ранее исследований получены данные, что при наличии клинически значимой СН (II-IV ФК по Killip) у больных с ПИКС отмечалось существенное увеличение dQT по сравнению с больными без клинических проявлений СН [20,21].
В ряде исследований наблюдалась также зависимость dQT и от большинства эхокардиографических (ЭхоКГ) показателей, характеризующих функцию ЛЖ. Так, пациенты с нормальной ФВ ЛЖ (>55 %) имели достоверно меньшие значения dQT, чем больные со сниженной сократительной функцией ЛЖ, а наличие аневризмы ЛЖ приводило к существенному и статистически значимому увеличению dQT [22]. Однако в других статьях отмечается отсутствие связи между dQT и ФВ ЛЖ у больных с ХСН [22-26].
В настоящей работе было установлено, что применение таурина у пациентов с ХСН II ФК NYHA на фоне ПИКС приводит к достоверному уменьшению dQT в сравнении с пациентами ГК и оказывает положительное воздействие на динамику данного показателя у пациентов с ХСН III ФК NYHA, получавших стандартную терапию.
Следует отметить, что на фоне приема таурина, в подгруппе пациентов с ХСН II ФК ст. уменьшения dQT была достоверно выше, чем в подгруппе пациентов с ХСН III ФК NYHA.
Полученные в ходе исследования результаты свидетельствуют о выраженной негомогенности процессов реполяризации в миокарде у пациентов с более выраженной клинической картиной ХСН, что совпадает с данными литературы, и свидетельствуют о лучшем восстановлении dQT на фоне приема таурина, у больных с разной степенью выраженности ХСН.
В настоящее время изучено два патогенетических механизма аритмий при синдроме удлиненного интервала QT (СУQT). Первый механизм “внутри-сердечных нарушений” реполяризации миокарда, а именно, повышенная чувствительность миокарда к аритмогенному эффекту катехоламинов. Второй патофизиологический механизм — дисбаланс симпатической иннервации [17,18,20,22].
Известно, что ишемия и ХСН сопровождаются выбросом катехоламинов в кровь, что в свою очередь ведет к перегрузке ионами кальция и к последующей дегенерации сердечной мышцы [27]. Таурин способствует нормализации внутриклеточного содержания ионов калия и стабилизации мембранного потенциала (МП). Из данных, установленных ранее, известно, что таурин участвует в регуляции многих функций. На центральную нервную систему (ЦНС) он оказывает тормозящее влияние, иногда сильнее, чем гамма-аминомасляная кислота (ГАМК). Кроме того, он тормозит освобождение норадреналина из пресинаптических окончаний адренергических волокон [10,12].
Известно, что в основе нарушений ритма сердца лежит нарушение образования импульса либо нарушение его проведения. Электрическая активность необходима для работы сердца. Именно электрический импульс, пришедший к кардиомиоциту (КМЦ), запускает его сокращение, для чего необходимо повышение внутриклеточной концентрации кальция, а в ряде патологических ситуаций, таких как ишемия, могут возникнуть изменения процессов его метаболизма [27].
Нарушение метаболизма кальция рассматривается как один из ведущих механизмов ослабления сократительной функции сердца. Процессы возбуждения миокарда тесно связаны с его сокращением, а ионы кальция играют решающую роль в цикле систола-диастола [27].
Доказано, что наиболее интенсивно и многозначно таурин влияет на активность кальция, регулируя его внутриклеточное распределение, способствуя, при необходимости иммобилизации дополнительных количеств кальция в определенных участках мембраны, чем снижает порог возбудимости, т. к. ограничивает проницаемость мембран для натрия. По экспериментальным данным было установлено, что таурин устраняет экстрасистолы [28-30].
Таким образом, можно предположить, что увеличение содержания ионизированного кальция наблюдается при применении таурина, способствуя усилению инотропного ответа КМЦ [29,30]. В этой связи, способность таурина предотвращать потерю калия миокардом можно рассматривать как один из этапов лечения ХСН на фоне ИБС.
В печени из таурина образуются активные метаболиты: карбамилтаурин, фосфотауроциамин, изотионовая кислота [10,12,29]. Последняя, в свою очередь, может контролировать возбудимость клеточной мембраны посредством аккумуляции катионов, т. к. она является сильным анионом. Исходя из этого, механизм изменения электрической активности сердечной мышцы под действием таурина можно представить следующим образом: проникая внутрь КМЦ, таурин превращается в изотионувую кислоту, которая, как анион, способствует удержанию внутриклеточных ионов калия, что ведет к стабилизации МП [29,30]. Стабилизация МП в свою очередь способствует нормализации ритма сердца.
К относительным ограничениям настоящего исследования можно отнести проведение его в одном центре, а также небольшую выборку пациентов. Несмотря на это, полученные результаты указывают на целесообразность дальнейшего изучения этой проблемы и необходимость проведения более масштабных исследований в этом направлении.
Выводы
Применение таурина у пациентов с ХСН II ФК NYHA, обусловленной ПИКС, приводит к достоверному уменьшению dQT, у пациентов с ХСН III ФК NYHA, обусловленной ПИКС, оказывает положительное воздействие на динамику данного показателя.
Применение таурина у больных с ХСН II ФК NYHA и ПИКС позволяет достоверно снизить количество НЖР и наджелудочковых нарушений ритма по данным СМ ЭКГ.
Добавление таурина пациентам с ХСН III ФК NYHA на фоне ПИКС позволяет достоверно снизить количество НЖР по данным СМ ЭКГ и положительно влияет на наджелудочковые нарушения ритма у данной группы пациентов.
Таурин целесообразно включать в состав комплексного лечения больных с ХСН II и III ФК NYHA после перенесенного ИМ с целью уменьшения нарушений ритма сердца и предотвращения фатальных аритмий.
ЛИТЕРАТУРА
1. Национальные рекомендации по диагностике и лечению хронической сердечной недостаточности. Ж Серд недостат 2010; 11(1): 57.
2. Лопатин Ю.М. Бисопролол и снижение риска внезапной смерти: еще один аргумент в пользу начала терапии больных с хронической сердечной недостаточностью p-адреноблокаторами. РМЖ 2007; 4: 305.
3. Арутюнов Г.П., Розанов А.В. Неосложненный острый инфаркт миокарда с элевацией сегмента ST. Современные стандарты диагностики и лечения. Сердце 2005; 4, № 2(20): 60-71.
4. Аронов Д.М., Лупанов В.П. Диагностика и лечение хронической ишемической болезни сердца. Качество жизни. Медицина 2003; 2: 16-24.
5. Агеев Ф.Т., Даниелян М.О., Мареев В. Ю. и др. Больные с хронической сердечной недостаточностью в российской амбулаторной практике: особенности контингента, диагностики и лечения (по материалам исследования ЭПОХА-О-ХСН). Ж Серд недостат 2004; 5 (1): 4-7.
6. Дощицин В.Л. Лечение больных с желудочковыми аритмиями. РМЖ 2001; 9(18): 736-42.
7. Бузиашвили Ю.И., Хананашвили Е.М., Сигаев И.Ю., Шуваев И.П. Прогностическая значимость динамики вариабельности сердечного ритма у больных ишемической болезнью сердца до и после операции аортокоронарного шунтирования. Кардиоваск тер профил 2002; 3: 47-54.
8. Люсов В.А. Применение ингибиторов АПФ при лечении хронической сердечной недостаточности. Фармацевт вест 2009, раздел кардиология.
9. Шахнович P.M. Оптимизация энергетического метаболизма у больных ишемической болезнью сердца. РМЖ 2001; 9(15): 622-8.
10. Елизарова Е.П., Ходжакулиев Б.Г., Заволовская Л.И., Черногубова Е.В. Фармакокинетика таурина. Кардиология 1995; 4: 69-70.
11. Casey RG, Chen G, Joyce M, et al. Taurine reduces high glucose induced leukocyte-endothelial interactions via down-regulation of ICAM-1. J Anat 2002; 200(5): 525-526. doi: 10.1046/j.1469-7580.2002.00047_9.x. Copyright © Anatomical Society of Great Britain and Ireland 2002
12. Елизарова Е.П., Копелевич В.М. О клинических эффектах препарата дибикор при сердечной недостаточности, гликозидной интоксикации и сахарном диабете типа 1,2 и о таурине. Методическое пособие по таурину 2004; 5-29.
13. Макарычева О.В., Васильева Е.Ю., Радзевич А.Э., Шпектор А.В. Динамика дисперсии интервала Q-T при остром инфаркте миокарда и ее прогностическое значение. Кардиология 1998; 7: 43-6.
14. Никитин Ю.П., Кузнецов А.А. Дисперсия интервала Q-T. Кардиология 1998; 5: 58-63.
15. Федулаев Ю.Н., Корочкин И.М., Федосеева О.С. Корреляция степени поражения коронарного русла, дисперсии интервала QT и продолжительности ишемии миокарда у больных ИБС с эпизодами безболевой ишемии миокарда. Кардиоваск терапия профил 2006; 5; 6 (приложение): 396
16. Федулаев Ю.Н., Казанцев А.П., Щелкунова И.Г. и др. Дистанционная методика оценки результатов суточного мониторирования ЭКГ в выявлении преходящей ишемии миокарда. Организационные и прогностические аспекты. Мед вест МВД 2007; 3: 25-7.
17. Bogun F, Chan K, Harvey M, et al. QT dispersion in nonsustained ventricular tachycardia and coronary artery disease. Am J Cardiol 2001; 77: 256-9.
18. Day CP, McComb JM, Campbell RWF. QT dispersion: an indicator of arrhythmia risk in patients with long QT intervals. Br Heart J 1990; 63: 342-4.
19. Gabrielli F, Balzotti L, Bandiera A. Q-T dispersion variability and myocardial viability in acute myocardial infarction. Int J Cardiol 1997; 61: 61-7.
20. Chauhan VS, Tang AS. Dynamic changes of QT interval and QT dispersion in non-Q-wave and Q-wave myocardial infarction. J Electrocardiol 2001; 34: 109-17.
21. De Bruyne M, Hoes A, Kors J, et al. Prolonged QT interval predicts cardiac and all-cause mortality and morbidity in the elderly. Eur Heart J 2002; 20: 278-84.
22. Barr CS, Naas A, Freeman M, et al. QT dispersion and sudden unexpected death in chronic heart failure. Lancet 2002; 343: 327-9.
23. Люсов В.А. Инфаркт миокарда (вчера, сегодня, завтра). Москва 1999; 5-6.
24. Чиквашвили Д.И., Сокирка Г.М., Руда М.Я. Сравнительная прогностическая значимость комплекса клинико-инструментальных показателей у больных, перенесших острый инфаркт миокарда. Результаты многофакторного анализа по данным 2-летнего проспективного наблюдения. Кардиология 1995; 9: 40-4.
25. Acute coronary syndromes. Ed. Е. Topol. Raven Press 2001, p.560.
26. Ahnve S. QT prolongation in acute myocardial infarction. Eur Heart J 2003; 6: Suppl D: 85-95/
27. Шпектор А.В., Васильева Е.Ю. Кардиология — клинические лекции. Москва 2008; 319-30.
28. Read WO, Welty JD. Taurine as a regulation of cell potassium in the heart. In: Electrolytes and Cardiovascular Diseases. Ed. E.Bajusz. Basel: S.Korger 1965; 70-85.
29. Jacobsen JG, Smith LH. Biochemistry and physiology of taurine and taurine derivatives. Physiol Rev 1968; 48:424-511.
30. Burgen ASU, Terroux KG. Taurine Role in Cardiology and Cardiac Arrhythmias. Circulation 1974; 34-5.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 pikfarma.ru
pikfarma.ru







