Мишени метаболического тандема: неалкогольная жировая болезнь печени и сахарный диабет 2-го типа
Статьи
Опубликовано в журнале:
«Медицинский совет» №20, 2017
Л.А. Звенигородская, д.м.н., профессор, А.М. Мкртумян, д.м.н., профессор, М.В. Шинкин, Т.В. Нилова, к.ф .н., А.В. Петраков, к.м.н.
Московский клинический научно-практический центр им. А.С. Логинова Департамента здравоохранения г. Москвы
Неалкогольная жировая болезнь печени (НАЖБП), по прогнозам Всемирной организации здравоохранения, к 2020 г. будет занимать 1-е место в структуре заболеваний печени. Трансплантация печени у пациентов с циррозом в исходе НАЖБП в настоящее время занимает 2-е место после циррозов печени вирусной этиологии.
Согласно современным взглядам, НАЖБП представляет собой поражение печени, включающее жировую дистрофию, жировую дистрофию с воспалением и возможностью исхода в цирроз. Причинно-следственная связь НАЖБП и СД является предметом многочисленных дискуссий. Связующим патогенетическим звеном одного и другого заболевания является инсулинорезистентность. Реализация инсулинорезистентности осуществляется, прежде всего, на уровне гепатоцита. До настоящего времени не существует стандартной терапии НАЖБП. Коррекция массы тела, изменение пищевой аддикции, физическая активность – наиболее эффективные меры, предупреждающие развитие НАЖБП и сахарного диабета. Ни один из лекарственных препаратов, применяемых в лечении НАЖБП, не имеет доказательной базы по влиянию на гистологическую картину НАЖБП.
Ключевые слова: неалкогольная жировая болезнь печени, сахарный диабет 2-го типа, комплексное медикаментозное лечение, таурин.
Metabolic tandem targets: non-alcoholic fatty liver disease and type 2 diabetes mellitus
L.A. Zvenigorodskaya, MD, Prof., А.M. Mkrtumyan, MD, Prof., M.V. Shinkin, T.V. Nilova, PhD, A.V. Petrakov, PhD in medicine
Loginov Moscow Clinical Scientific Centre of th e Moscow Department of Healthcare
According to the World Health Organization estimates, non-alcoholic fatty liver disease (NAFLD) will be ranked number one in the liver diseases pattern by 2020. Liver transplantation in patients with cirrhosis as the outcome of NAFLD currently ranks next to the viral liver cirrhosis.
According to current concepts, NAFLD is a liver disease defined as fatty dystrophy, fatty degeneration with inflammation and possible outcome in cirrhosis. The causal relationship between NAFLD and diabetes mellitus is the subject of numerous discussions. Insulin resistance is the binding pathogenetic link between one and the other disease. First of all, insulin resistance is carried out at the level of hepatocyte. Until now, there is no standard therapy for NAFLD. Correction of body weight, changes in food addiction, physical activity is the most effective measures to prevent the development of NAFLD and diabetes mellitus. None of the drugs used for the treatment of NAFLD has evidence base for the effect on the histological pattern of NAFLD.
Keywords: non-alcoholic fatty liver disease, type 2 diabetes mellitus, complex medication, taurine.
Неалкогольная жировая болезнь печени (НАЖБП) в настоящее время признана самым распространенным заболеванием в гепатологии, а также является одним из ключевых факторов риска сердечно-сосудистых заболеваний и их осложнений [1]. По данным эпидемиологического исследования DIREG 1 и DIREG 2, в России у 37,3% пациентов, обратившихся к врачам общей практики по различным причинам, была выявлена НАЖБП. Распространенность неалкогольной нецирротической жировой болезни печени прогрессивно возрастала по мере увеличения возраста пациентов с 2,90% (12–17 лет) до 42,96% (60–69 лет). Максимальная распространенность неалкогольного стеатоза отмечена в возрастной группе 70–80 лет (34,26%), неалкогольного стеатогепатита – у пациентов 50–59 лет (10,95%) [2].
По определению трех Европейских ассоциаций (Европейской ассоциации по изучению печени, Евро пейской ассоциации по изучению сахарного диабета и Европейской ассоциации по изучению ожирения) (2016) [3] НАЖБП характеризуется избыточным накоплением в печени жира, ассоциированным с резистентностью к инсулину, и определяется наличием стеатоза в более чем 5% гепатоцитов согласно гистологическому анализу или более 5,6% по данным оценки жировой фракции методом протонного магнитного резонанса (1H-MRS), или количественного анализа жир/вода при проведении селективной магнитно-резонансной томографии (МРТ). При этом НАЖБП включает в себя два различных патологически процесса с различными прогнозами: неалкогольный стеатоз и неалкогольный стеатогепатит; последний охватывает широкий спектр различных по тяжести заболеваний, включая фиброз, цирроз печени и гепатоцеллюлярную карциному.
В 75% случаев НАЖБП протекает на фоне ожирения, дислипидемии, артериальной гипертонии, сахарного диабета 2-го типа или нарушения толерантности к глюкозе.
Основными факторами риска, выявленными в популяции больных НАЖБП в России, были артериальная гипертензия (69,9%), абдоминальное ожирение (56,2%), гиперхолестеринемия (68,8%), сахарный диабет 2-го типа встречался у 23,1% пациентов [4]. Наличие факторов риска НАЖБП зарегистрировано у 92,4% пациентов, включенных в исследование DIREG 2 [2].
Неалкогольная жировая болезнь печени в настоящее время признана самым распространенным заболеванием в гепатологии, а также является одним из ключевых факторов риска сердечно-сосудистых заболеваний и их осложнений
В настоящее время не вызывает сомнений тесная взаимосвязь НАЖБП и высокого риска ССЗ. При этом у пациентов с НАЖБП, наряду с большей распространенностью традиционных факторов риска развития ССЗ (ожирение, метаболический синдром, инсулинорезистентность), имеют место и другие факторы: увеличение толщины перикардиального жира, эндотелиальная дисфункция, утолщение комплекса интима-медиа, С-реактивный белок, гиперлипидемия, артериальная гипертензия. Более того, продемонстрировано, что НАЖБП служит предиктором ССЗ независимо от других факторов риска, опосредуя многократное повышение риска развития сердечнососудистой смертности [5]. Присутствие НАЖБП коррелирует с риском развития дисфункции левого желудочка, гипертрофических изменений, хронической сердечной недостаточности (ХСН) и частоты встречаемости аритмических осложнений (фибрилляции предсердий) [6]. М. Ekstedt и соавт. (2006) показали, что 14-летний риск смерти от ССЗ у пациентов с неалкогольным стеатогепатитом был вдвое выше, чем в общей популяции [7], а наличие фиброза печени у пациентов с НАЖБП (по данным расчета индекса фиброза печени NFS) коррелирует с кардиоваскулярным риском, по данным оценки Framingham Risk Score [8], и смертностью как общей, так и в связи с кардиоваскулярными событиями [9].
Причинно-следственная связь НАЖБП и СД 2-го типа давно является предметом многочисленного обсуждения среди эндокринологов и гастроэнтерологов.
Данные когортного исследования Dongfeng-Tongji, которое продолжалось с 2008 до октября 2013 г. (4,60 ± 0,60 года) и включало 18 111 участников, показало, что риск развития СД 2-го типа у пациентов с умеренно выраженными проявлениями НАЖБП достоверно возрастает по сравнению с пациентами без НАЖБП (HR: 1,88 [95% ДИ: 1,63–2,18] и 2,34 [1,85–2,96] соответственно). Парал лельный анализ, включающий 12 435 участников, имеющих СД 2-го типа, без признаков НАЖБП, продемонстрировал, что риск развития поражения печени у пациентов с нарушениями уровня глюкозы натощак и сахарным диабетом составлял 1,35 (95% ДИ: 1,16–1,57) и 1,40 (95% ДИ: 1,22–1,62) соответственно по сравнению с участниками, чей уровень глюкозы в плазме натощак был менее 6,1 ммоль/л [10]. Это позволило определить взаимосвязь между данными заболеваниями как двунаправленную. НАЖБП не только чаще встречается среди пациентов с СД 2-го типа, но эти пациенты имеют более высокий риск развития тяжелого заболевания печени по сравнению с пациентами без диабета [11]. Присутствие НАЖБП может значимо ухудшать контроль метаболических показателей у пациентов с сахарным диабетом, с одной стороны, с другой – наличие сахарного диабета 2-го типа у пациентов с НАЖБП увеличивает риск развития более тяжелого поражения печени. По данным многоцентрового исследования, включающего 1 365 пациентов НАЖБП, которым проводилось гистологическое исследование пунктата печени, установлено, что ухудшение контроля глюкозы у пациентов с НАЖБП положительно коррелировало со стадией фиброза, более того, наиболее значимой эта корреляция была у лиц женского пола. Проведенный в этом исследовании многофакторный анализ определил возраст пациента и СД 2-го типа как наиболее значимые факторы риска развития фиброза печени [12]. По данным Nakahara T. et al (2014), распространенность НАСГ и различной степени выраженности фиброза у пациентов СД 2-го типа достигала 22,6/34,1/26,7/14,5/2,1 (%) (стадии 0/1/2/3/4) у пациентов мужского пола и 16,2/31,7/23,9/ 21,6/6,6 (%) у женщин [12], а по данным Angulo P. (2002), НАСГ присутствовал у 12,2% по сравнению с 4,7% среди пациентов без диабета, а среди пациентов с СД 2-го типа и ожирением – 21–40% [13]. Риск смерти от заболевания печени для пациентов с СД 2-го типа и НАЖБП в 22 раза выше по сравнению с 2–3-кратным увеличением риска смерти для пациентов с НАЖБП без диабета [14].
Таким образом, не вызывает сомнения целесообразность скрининга НАЖБП у пациентов с СД 2-го типа. «Золотым стандартом» диагностики НАЖБП является пункционная биопсия печени. Чаще всего у пациентов с СД 2-го типа отмечаются морфологические изменения в виде жировой дистрофии (рис. 1), в 20–81% случаев выявляются и воспалительные (рис. 2). В 16% случаев у больных с СД 2-го типа и НАЖБП на фоне воспалительной инфильтрации отмечается пролиферация дуктул, что является ранним диагностическим маркером поражений билиарного тракта у больных с НАЖБП (рис. 3).
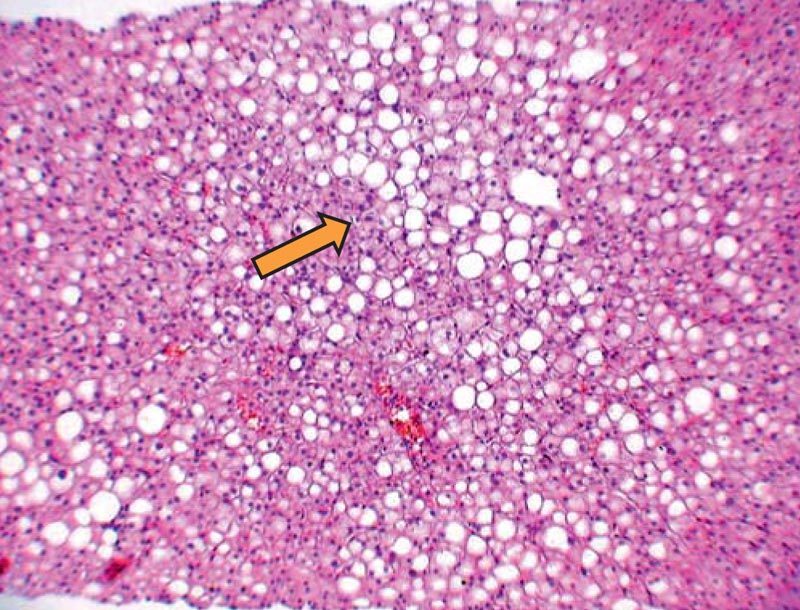
Рисунок 1. Тотальная жировая дистрофия гепатоцитов больного с СД 2-го типа. Окраска гематоксилином и эозином. Увеличение ×120
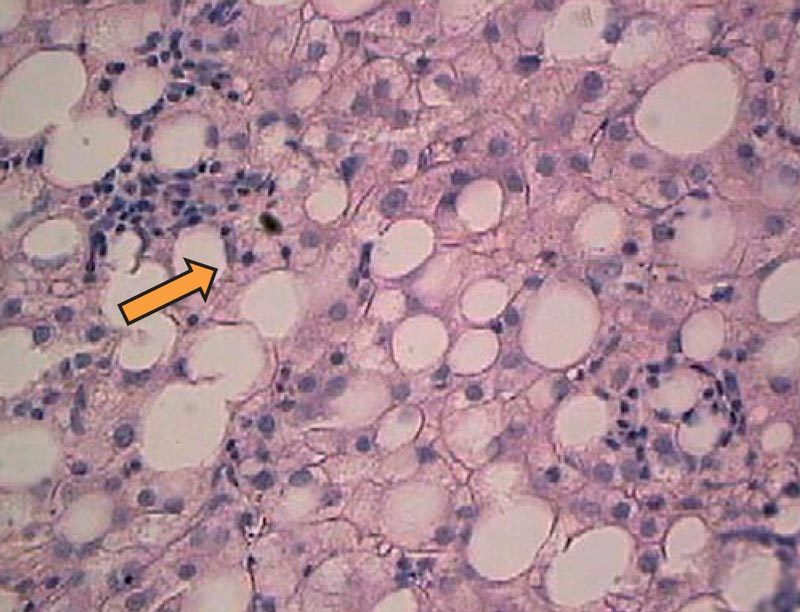
Рисунок 2. Внутридольковые смешанноклеточные инфильтраты у больного с СД 2-го типа. Окраска гематоксилином и эозином. Увеличение ×500
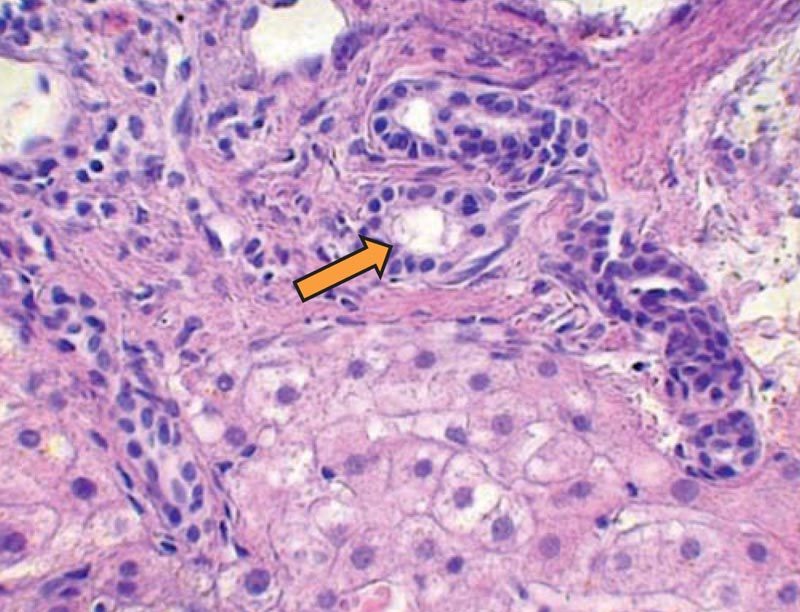
Рисунок 3. Пролиферация дуктул, перигепатоцеллюлярный фиброз на фоне жировой дистрофии печени у больного с СД 2-го типа. Увеличение ×500
Основными факторами риска, выявленными в популяции больных НАЖБП в России, были артериальная гипертензия (69,9%), абдоминальное ожирение (56,2%), гиперхолестеринемия (68,8%), сахарный диабет 2-го типа встречался у 23,1% пациентов
В прогрессировании НАЖБП и развитии фиброза печени участвуют различные факторы роста, стимулирующие хроническое воспаление и фиброгенез путем усиления образования коллагена и соединительной ткани в печени: трансформирующий фактор роста-β (TGF-β), инсулиноподобный фактор роста (IGF-1), тромбоцитарный фактор роста (PDGF). Важное значение в развитии НАЖБП играют гены, участвующие в метаболизме глюкозы и липидов, а полиморфизм гена PNPLA3 (patatin-like phospholi-pase domain containing 3), кодирующего синтез белка адипонутрина, участвующего в транспорте СЖК, может способствовать повышению риска развития НАЖБП независимо от наличия ожирения. Особую роль в патогенезе НАЖБП занимает метаболизм желчных кислот. Снижение синтеза и нарушение транспорта желчных кислот связано с повреждением мембран гепатоцитов, ингибированием ферментных систем и воспалением. Желчные кислоты (ЖК) являются продуктом метаболизма холестерина. Эти стероидные монокарбоновые кислоты являются производным холановой кислоты, образуются в гладком эндоплазматическом ретикулуме гепатоцитов и являются секретом эпителиальных клеток печени. Биосинтез ЖК является одним из важных путей выведения холестерина. Пул ЖК представлен у человека примерно в равных количествах высокогидрофобными желчными кислотами: холевой, хенодезоксихолевой, дезоксихолевой. Первичные ЖК конъюгируются с глицином и таурином, что повышает их гидрофильность. ЖК являются активаторами ядерных рецепторов, регулирующих экспрессию генов, участвующих в секреции, транспорте и метаболизме первичных ЖК, холестерина и триглицеридов в гепатоцитах и плазме [15]. При СД 2-го типа и инсулинорезистентности (ИР) эндокринная функция желчных кислот нарушается, уменьшается абсорбция ЖК, что увеличивает жировую инфильтрацию печени, нарушается метаболизм липидов, происходит накопление ТГ и липопротеинов низкой плотности в печени и плазме. Развивается билиарная недостаточность, приводящая к уменьшению количества желчи и циркулирующих желчных кислот, развитию жировой болезни печени и холелитиазу.
Присутствие НАЖБП может значимо ухудшать контроль метаболических показателей у пациентов с сахарным диабетом, с одной стороны, с другой – наличие сахарного диабета 2-го типа у пациентов с НАЖБП увеличивает риск развития более тяжелого поражения печени
Важная роль в патогенезе НАЖБП и СД 2-го типа принадлежит дефициту таурина. Таурин – жизненно необходимая сульфоаминокислота, являющаяся конечным продуктом обмена серосодержащих аминокислот (метионина, цистеина, цистеамина) [16]. Молекула таурина состоит из двух атомов углерода, сульфоновой группы (SO3H) и аминогруппы (NH2). Биологический синтез таурина не достаточен для поддержания у человека тех биохимических процессов, в которых он задействован. Основным источникам таурина являются мясные и рыбные продукты. При дефиците таурина в питании или в результате каких-либо иных причин (ишемия, сахарный диабет, стресс, травма и др.) страдают все виды обмена веществ любой клетки любого органа. Например, недостаточность таурина в печени ведет к нарушению желчевыделения, образованию камней, изменению обмена холестерина и липидов. Отмечен гипохолестеринемический эффект таурина при его использовании в питании пациентов с ожирением [17].
На фоне приема таурина при ХСН у больных с СД, ожирением больные отмечают исчезновение одышки, увеличение трудоспособности, улучшение общего состояния
Показано, что таурин необходим в реализации эффектов секреции и чувствительности к инсулину [18], профилактике реализации эффектов гепатотоксичности и лечении неалкогольной жировой болезни печени (НАЖБП) [16]. Активно обсуждаются потенциальные возможности этой незаменимой аминокислоты в профилактике и лечении осложнений СД [19], что связывают, во-первых, с его способностью модифицировать процессы гликирования. В эксперименте продемонстрировано, что таурин ингибирует образование продуктов гликирования белков, в частности фруктозамина и гликированного гемоглобина (НвА1с) [20]. Во-вторых, таурин способствует снижению содержания перекисных продуктов (в т. ч. малонового альдегида, HClO-), которые вызывают окислительную модификацию липопротеинов низкой плотности (ЛПНП) [21]. Воздействуя на процессы фосфорилирования, хлортаурин способствует снижению продукции фактора некроза опухоли-α, синтеза оксида азота в макрофагах и образования пероксинитрита. Поэтому результаты экспериментального исследования C.L. Gentile et al. (2011) [16], свидетельствующие о возможности таурина снижать выраженность стресса эндоплазматического ретикулума, окислительного стресса, активность каспазы-3 и апоптоз гепатоцитов, проявления хронического системного воспаления в гепатоцитах, подавление аккумуляции триглицеридов (ТГ) в гепатоцитах, позволяют рассматривать его как перспективный препарат для профилактики и лечения НАЖБП.
Интересны литературные данные, свидетельствующие о том, что на фоне приема таурина при ХСН с СД, ожирением больные отмечают исчезновение одышки, увеличение трудоспособности, улучшение общего состояния. Кроме того, авторами исследования отмечено, что включение таурина (Дибикора) в состав базисной терапии ХСН и СД 2-го типа достоверно увеличивает толерантность к физическим нагрузкам и уменьшает ФК ХСН, способствует снижению уровня Nt-proBNP и значимо уве личивает фракцию выброса левого желудочка, оказывает позитивное влияние на выраженность диастоличе ской дисфункции. Дибикор у больных с ХСН и СД 2-го типа значимо улучшает нарушенную функцию печени; обладает антифибротическим эффектом, достоверно уменьшая содержание коллагена IV типа в крови. Более того, 16-недельная терапия Дибикором у пациентов с ХСН и СД 2-го типа оказывает благоприятное дей ствие на углеводный и липидный обмен: достоверно снижаются уровень глюкозы натощак, HbA1c, ИР, а также уровни холестерина липопротеинов низкой плотности и триглицеридов [15, 26].
Лечение больных с НАЖБП проводится препаратами, сочетающими в себе антиоксидантную защиту, стабилизацию мембран гепатоцитов, обеспечивающую противовоспалительную активность, гиполипидемическую терапию и ИР
В настоящее время строго регламентированных схем лечения НАЖБП не представлено. Во всех рекомендациях подчеркивается, что только изменение образа жизни является наиболее доказательным способом влияния на стадии стеатоза печени [3]. При этом ни один лекарственный препарат не получил одобрения FDA как средство лечения НАЖБП с доказательной оценкой его влияния на гистологическую картину.
Ведение пациента необходимо начинать с общих рекомендаций по режиму питания и физической активности, особенно на фоне ожирения и сахарного диабета. Снижение массы тела (500–1000 г в неделю) и нормализация углеводного обмена сопровождаются положительной динамикой клинико-лабораторных показателей и уменьшением индекса гистологической активности. В отличие от этого быстрая потеря веса может привести к ухудшению течения заболевания. При неэффективности этих методов могут быть использованы фармакологические препараты, используемые для лечения морбидного ожирения. В некоторых случаях при наличии показаний возможно применение хирургических методов лечения ожирения.
Согласно рекомендациям Европейской ассоциации по изучению заболеваний печени (European Association for the Study of the Liver, EASL), Европейской ассоциации по изучению диабета (European Association for the Study of Diabetes, EASD), Европейской ассоциации по изучению ожирения (European Association for the Study of Obesity, EASO) фармакотерапия должна назначаться пациентам с НАСГ, особенно лицам с выраженным фиброзом печени (≥ F2). Пациентам с менее выраженной формой НАЖБП, однако с наличием маркеров, способствующих прогрессии заболевания (сахарный диабет, метаболический синдром, устойчивое повышение АЛТ), также может потребоваться назначение фармакотерапии и обязательная коррекция веса [3].
Лечение больных с НАЖБП проводится препаратами, сочетающими в себе антиоксидантную защиту, стабилизацию мембран гепатоцитов, обеспечивающую противовоспалительную активность, гиполипидемическую терапию и ИР. При этом подчеркивается, что метформин не влияет на гистологическую картину НАСГ, а пиоглитазон (но не розиглитазон) при длительном приеме (более 2 лет) хотя и улучшает гистологическую картину печени (за исключением фиброза), что ассоциируется с изменениями уровня АЛТ и инсулинорезистентности, не может быть рекомендован в рутинной практике для лечения НАЖБП в связи с его побочными эффектами – увеличением массы тела, увеличением частоты переломов костей у женщин и частым формированием застойной сердечной недостаточности. Витамин Е в дозе 800 мг/сут демонстрирует положительное влияние на гистологическую картину печени, однако существуют опасения по поводу долгосрочной безопасности его использования, что связано с риском увеличения общей смертности, геморрагического инсульта и рака простаты у мужчин старше 50 лет. В Европейских рекомендациях отмечено, что витамин Е с осторожностью может быть использован в цирротической стадии НАСГ у пациентов, не страдающих сахарным диабетом, но необходимы дальнейшие исследования, прежде чем точные рекомендации могут быть сделаны. В этих же рекомендациях в качестве цитопротекторного препарата обсуждается урсодезоксихолевая кислота (УДХК). Использование УДХК в течение 2 лет сопровождается улучшением показателей аминотрансфераз, безопасно, но не доказано влияние УДХК на показатели гистологической активности НАСГ.
В лечении больных с НАЖБП применяются препараты S-аденозилметионина. По механизму действия S-аденозил метионина, который является донором метильных групп и предшественником глютатиона, важного внутриклеточного антиоксиданта, можно предположить, что это является доказательной базой для его применения при НАЖБП. В ряде работ отечественных и зарубежных авторов показано снижение уровня трансаминаз и уменьшение выраженности стеатоза у больных с НАЖБП на фоне приема S-аденозилметионина [23]. В Российских рекомендациях по диагностике и лечению НАЖБП [24, 25] обсуждаются возможности и других цитопротективных препаратов – эссенциальных фосфолипидов, силимарина. В связи с тем, что у больных с НАЖБП в подавляющем большинстве случаев (80%) имеется различная степень выраженности дислипидемии, целесообразно применение статинов [3]. Однако их использование возможно для лечения дислипидемии при стеатозе и неалкогольном стеатогепатите, если уровень трансаминаз не превышает 3 норм.
В настоящее время строго регламентированных схем лечения НАЖБП не представлено. Во всех рекомендациях подчеркивается, что только изменение образа жизни является наиболее доказательным способом влияния на стадии стеатоза печени
Патогенетически обоснованным и перспективным, как это было указано выше, у пациентов с НАЖБП и СД 2-го типа является применение таурина (препарат Дибикор, ОАО «ПикФарма», Россия), не только обладающего гепатопротективным, гиполипидемическим, гипогликемизирующим действием, но и нормализующего циркуляцию ЖК препаратом [26, 27], имеющим дополнительные органопротективные свойства, которые опосредуют его использование именно у пациентов с НАЖБП и СД 2-го типа. Так, в работе Звенигородской Л.А. [28] было проведено исследование фармакодинамических показателей метаболитов оксида азота (NO) и бактериального эндотоксина в результате трехмесячного курса фармакотерапии таурином у больных НАЖБП и СД 2-го типа, сопоставление содержания оксида азота и эндотоксина у больных НАЖБП с СД 2 с биохимическими показателями крови. Показано, что включение таурина в комплексное лечение сопровождалось снижением исходно многократно повышенного содержания эндотоксина, активности маркеров воспаления. Отмечено, что уровень метаболитов оксида азота снижался параллельно уровню аланиновой, аспарагиновой аминотрансфераз и гаммаглутамилтранспептидазы.
Включение таурина в комплексное лечение сопровождалось снижением исходно многократно повышенного содержания эндотоксина, активности маркеров воспаления
Таким образом, поиски новых возможностей использований цитопротективных препаратов в лечении НАЖБП продолжаются. Следует надеяться, что каждый из них займет достойное место в лечении этого заболевания и, более того, будет разработан алгоритм дифференцированного применения их в коморбидных в НАЖБП патологиях.
Литература
- Younossi ZM, Koenig AB, Abdelatif D, Fazel Y, Henry L, Wymer M. Global epidemiology of nonalcoholic fatty liver disease-Meta-analytic assessment of prevalence, incidence, and outcomes. Hepatology, 2016, 64(1): 73-84.
- Ивашкин В.Т., Драпкина О.М., Маев И.В. и др. Распространенность неалкогольной жировой болезни печени у пациентов амбулаторнополиклинической практики в Российской Федерации: результаты исследования DIREG 2. РЖГГК, 2015, 6: 31–41.
- European Association for the Study of the Liver (EASL). European Association for the Study of Diabetes (EASD), European Association for the Study of Obesity (EASO). EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. J Hepatol, 2016, 64(6): 1388–1402.
- Драпкина О.М., Ивашкин В.Т. Эпидемио логические особенности неалкогольной жировой болезни печени в России. (Результаты открытого многоцентрового проспективного исследования – наблюдения DIREG L 01903). РЖГГК, 2014, 4: 32-38.
- Dam-Larsen S, Becker U, Franzmann MB et al. Final results of a long-term, clinical follow-up in fatty liver patients. Scandinavian Journal of Gastroenterology, 2009, 44(10): 1236-43.
- Ballestri S, Lonardo A, Bonapace S et al. Risk of cardiovascular, cardiac and arrhythmic complications in patients with nonalcoholic fatty liver disease. World J Gastroenterol, 2014, 20(7): 1724–1745.
- Ekstedt M, Franzen LE, Mathiesen UL et al. Long-term follow-up of patients with NAFLD and elevated liver enzymes. Hepatology, 2006, 44: 865–873.
- Dogan S, Celikbilek M, Yilmaz YK et al. Asso ciation between liver fibrosis and coronary heart disease risk in patients with nonalcoholic fatty liver disease. Eur J Ga- stroenterol Hepatol, 2015, 27(3): 298–304.
- Kim D, Kim WR, Kim HJ, Terry M. Therneau. Association between noninvasive fibrosis markers and mortality among adults with nonalcoholic fatty liver disease in the United States. Hepatology, 2013, 57(Issue4): 1357–1365.
- Yaru Li, Jing Wang, Yuhan Tang, Xu Han, et al. Bidirectional association between nonalcoholic fatty liver disease and type 2 diabetes in Chinese population: Evidence from the Dongfeng – Tongji cohort study. PLoS ONE, 2017, 12(3): e0174291.
- Williams KH, Shackel NA, Gorrell MD, McLennan SV, Twigg SM. Diabetes and nonalcoholic fatty liver disease: a pathogenic duo. Endocr Rev, 2013, 34(1): 84-129.
- Nakahara T, Hyogo H, Yoneda M, Sumida Y et al. Type 2 diabetes mellitus is associated with the fibrosis severity in patients with nonalcoholic fatty liver diseaseмin a large retrospective cohort of Japanese patients. J Gastroenterol., 2014, 49(11): 1477-84.
- Angulo P. Nonalcoholic fatty liver disease. N Engl J Med., 2002, 346(16): 1221-31.
- Younossi ZM, Gramlich T, Matteoni CA, Boparai N, McCullough AJ. Nonalcoholic fatty liver disease in patients with type 2 diabetes. Clin Gastroenterol Hepatol,. 2004, 2(3): 262-5.
- Звенигородская Л.А., Петраков А.В., Нилова Т.В. и др. Роль желчных кислот в регуляции липидного и углеводного обмена у больных неалкогольной жировой болезнью печени и сахарным диабетом 2 типа. Экспериментальная и клиническая гастроэнтерология, 2016, 11(135): 31-34.
- Gentile С, Nivala A, Gonzales J, Pfaffenbach K, et al. Experimental evidence for therapeutic potential of taurine in the treatment of nonalcoholic fatty liver disease. Am J Physiol Regul Integr Comp Physiol., 2011, 301(6): 1710–R1722.
- Murakami Sh. Role of taurine in the pathogenesis of obesity. Mol. Nutr. Food Res., 2015, 59: 1353–1363.
- Nandhini AT. Anuradha C.V. Taurine modulates kallikrein activity and glucose metabolism in insulin resistant rats. Amino Acids, 2002, 22(1): 27–38.
- Takashi I, Schaffer S, Azuma J. The potential usefulness of taurine on diabetes mellitus and its complications. Amino Acids, 2012, 42(5): 1529–1539.
- Nandhini T.A., Anuradha C.V. Inhibition of lipid peroxidation, protein glycation and elevation of membrane ion pump activity by taurine in RBC exposed to high glucose. Clin Chim Acta, 2003, 336, 129–135.
- Pennathur S, Heinecke JW. Oxidative stress and endothelial dysfunction in vascular disease. Curr Diab Rep., 2007, 7: 257–264.
- Стаценко М.Е., Туркина С.В., Шилина Н.Н. и др. Гепатопротекторные и метаболические свой ства таурина при его использовании у пациентов с хронической сердечной недостаточностью и сахарным диабетом 2-го типа. РМЖ, Кардиология 2015, 5: 1-5.
- Quentin M. Anstee, Christopher P. Day. S-adenosyl methionine (SAMe) therapy in liver disease: A review of current evidence and clinical utility. Journal of Hepatology, 2012, 57(5) : 1097- 1109.
- Клинические рекомендации по диагностике и лечению неалкогольной жировой болезни печени Российского общества по изучению печени и Российской гастроэнтерологической ассоциации. РЖГГК, Гепатология, 2016, 2: 1–42.
- Неалкогольная жировая болезнь печени: клиника, диагностика, лечение (рекомендации для терапевтов, 2-я версия). Экспериментальная и клиническая гастроэнтерология, 2017, 2(138): 22–37.
- Лосева Н.В., Моисеенко Е.Е. Опыт применения препарата Дибикор в комплексной терапии неалкогольной жировой болезни печени. Фарматека, 2010, 13: 63–67.
- Недосугова Л. В. Место дибикора в комплексной терапии сахарного диабета. Фарматека, 2008, 7: 22-27.
- Звенигородская Л. А., Нилова Т.В. Таурин в лечении неалкогольной жировой болезни печени. Эндокринология: новости, мнения, обучения, 2014, 3: 7 с.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 pikfarma.ru
pikfarma.ru





