Метаболическая терапия в комплексном лечении сердечно-сосудистых осложнений сахарного диабета типа 2
Статьи
Опубликовано в журнале:
Эндокринология: новости, мнения, обучение. №2 2017
Аметов А.С., Прудникова М.А.
ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва
В статье рассматриваются эпидемиологические и патогенетические аспекты метаболической терапии сахарного диабета типа 2 и его осложнений. Приводятся доводы в пользу возможности включения препаратов, содержащих аминокислоту таурин, в комплексное лечение сахарного диабета типа 2.
Ключевые слова:
сахарный диабет, сердечно-сосудистые заболевания, таурин
Metabolic therapy in the complex treatment of cardiovascular complications of type 2 diabetes mellitus
Ametov A.S., Prudnikovа M.A.
Russian Medical Academy of Continuous Professional Education, Moscow
Authors of the article present the epidemiological and pathogenic aspects of the metabolic therapy of type 2 diabetes mellitus and its complications; argue for the possibility of including drugs with taurine in the complex treatment of type 2 diabetes.
Keywords:
diabetes mellitus, cardiovascular diseases, taurine
Прогрессирующий рост распространенности сахарного диабета типа 2 (СД2) продолжился и во втором десятилетии XXI в. К 2015 г. численность заболевших превысила 415 млн человек.
Согласно данным государственного регистра, основной причиной смерти больных СД2 являются сердечно-сосудистые заболевания (ССЗ), от них умирают 72,6% больных [1]. В целом риск смерти среди пациентов с СД в 1,5–3 раза выше, чем в общей популяции [2].
Причин, по которым больные с СД2 в большей степени подвержены развитию ССЗ, несколько. Так, одной из них, несомненно, является нарушение соотношения в поставках энергетического субстрата (глюкозы) и его утилизации в кардиомиоцитах. Снижение гликолитической активности в сердечной мышце приводит к накоплению промежуточных продуктов катаболизма глюкозы [3], которые запускают ряд патологических процессов, нарушая нормальный энергетический обмен, способствуя активации окислительного стресса и накоплению конечных продуктов гликирования [4, 5]. В экспериментальных условиях было показано, что одной из причин кардиопатии при СД является митохондриальная дисфункция [6].
Развитие сердечной недостаточности у пациентов с СД опосредовано нарушениями регуляции сердечных сократительных белков в условиях хронической гипергликемии, снижением чувствительности к Ca2+ [7] и активацией окислительного стресса.
Накопление активных форм кислорода (АФК), в свою очередь, способствует фиброзу и гипертрофии сердечной мышцы, что приводит к кардиальной дисфункции и развитию фатальных сердечно-сосудистых событий. Также окислительный стресс способствует развитию острого повреждения сердца в период ишемии-реперфузии и ремоделированию желудочков, приводя к развитию застойной сердечной недостаточности – основной причины смерти пациентов с СД2.
Помимо прочего, окислительный стресс также нарушает нормальную чувствительность миокарда к Ca2+, увеличивает апоптоз кардиомиоцитов и инициирует порочный цикл производства активных форм кислорода.
Еще одним фактором, способствующим развитию ССЗ у пациентов с СД, является неалкогольная жировая болезнь печени (НАЖБП), распространенность которой у данной категории пациентов достигает 75% [8]. В исследованиях было показано, что НАЖБП тесно и независимо от других факторов риска связана с различными маркерами субклинического атеросклероза, тяжестью коронарного склероза [9–12], что, по всей видимости, обусловлено как сопутствующими инсулинорезистентностью и метаболическим синдромом, так и активацией окислительного стресса и системного хронического воспаления у таких больных [13].
Очевидно, что столь сложный многофакторный патогенез сердечно-сосудистой патологии, ассоциированной с СД2, предполагает назначение комплексной терапии, влияющей на различные звенья ее развития. Перспективным в свете вышеописанного выглядит использование препаратов, содержащих аминокислоту таурин, обладающую целым рядом свойств, благотворно влияющих на течение СД2 и его осложнений.
Внутриклеточный таурин играет значительную роль в поддержании нормальной сократительной функции и жизнеспособности кардиомиоцитов. Другими словами, таурин является аминокислотой, практически незаменимой для нормальной функции человеческого сердца. Его физиологические функции включают осморегуляцию, противовоспалительное действие, стабилизацию клеточных мембран, регуляцию окислительного стресса, влияние на ионный транспорт и регуляцию синтеза митохондриальных белков, физиологическое ингибирование ангиотензина II, эндотелиотропные свойства с положительным влиянием на реактивность сосудов.
Впервые благотворное влияние таурина на состояние сердечно-сосудистой системы было показано на животной модели артериальной гипертензии еще в 1963 г. [14, 15]. В настоящее время эти данные подтверждены обширными эпидемиологическими исследованиями [в частности Cardiovascular Diseasesand Alimentary Comparison (CARDIAC) Study] [16, 17], в которых препарат в суточной дозе 1,5–6 г демонстрировал позитивное влияние на кардиоваскулярные исходы при хорошей переносимости [18].
В эксперименте было показано, что таурин эффективен в плане профилактики артериальной гипертензии, инсульта и атеросклеротического эндартериита [19, 20]. Кроме того, есть данные, подтверждающие, что таурин эффективен для предупреждения развития НАЖБП [21]. Ниже будут рассмотрены частные аспекты влияния таурина на патогенетические аспекты развития макроангиопатий и сердечно-сосудистые исходы при СД2.
Антиоксидантные свойства таурина
Механизм антиоксидантной активности таурина до сих пор остается предметом активного изучения. Таурин является естественным поглотителем хлорноватистого аниона (OCl–), в результате чего образуется хлорамин таурина. Как таурин, так и хлорамин таурина обладают целым рядом физиологических защитных эффектов [22], включающих подавление генерации активных форм кислорода в митохондриальной цепи транспорта электронов и снижение интенсивности хронического неспецифического воспаления.
Хлорамин таурина модифицирует холестерин липопротеидов низкой плотности (ЛПНП) таким образом, что они становятся в большей степени подвержены фагоцитозу собственными макрофагами. Кроме того, в животной модели введение таурина в течение 4 нед было ассоциировано с повышением концентрации гомоцистеина [23, 24].
В нескольких исследованиях показано, что таурин предотвращает образование малонового диальдегида, продукта перекисного окисления липидов [25]. Также таурин предотвращает аутоокисление адреналина в адренохром, вещество, способствующее прогрессии сердечной недостаточности [26].
Хлорамин таурина также является мощным противовоспалительным средством [27], ингибирующим образование простагландина Е2, фактора некроза опухоли альфа, интерлейкина-6 и синтазы оксида азота в макрофагах [28].
Сосудистые эффекты таурина
В настоящее время известно, что таурин функционирует как регулятор внутриклеточного гомеостаза кальция, выступая в качестве естественного антагониста кальция в кардиомиоците [29], тем самым оказывая протективное действие на сердечную мышцу у пациентов с хронической сердечной недостаточностью (ХСН).
Это приобретает особое значение, если принять во внимание, что кальцийзависимые сигнальные белки (такие как кальциневрин и кальмодулин-зависимая киназа) играют важную роль в развитии гипертрофии миокарда и прогрессии сердечной недостаточности [30].
В настоящее время также подтверждено, что таурин предотвращает норадреналин-индуцированную активацию НАДФ-оксидазы [31]. Также было показано, что введение таурина предотвращает некроз клеток и накопление кальция, индуцированные изопреналином [32].
В эксперименте с использованием животной модели артериальной гипертензии таурин продемонстрировал антигипертензивное действие, которое, по всей видимости, опосредуется целым рядом механизмов, включающих влияние на центральную нервную систему (в том числе активность гипоталамуса и секрецию вазопрессина), модуляцию барорецепторного рефлекса и снижение симпатической активности (см. рисунок).
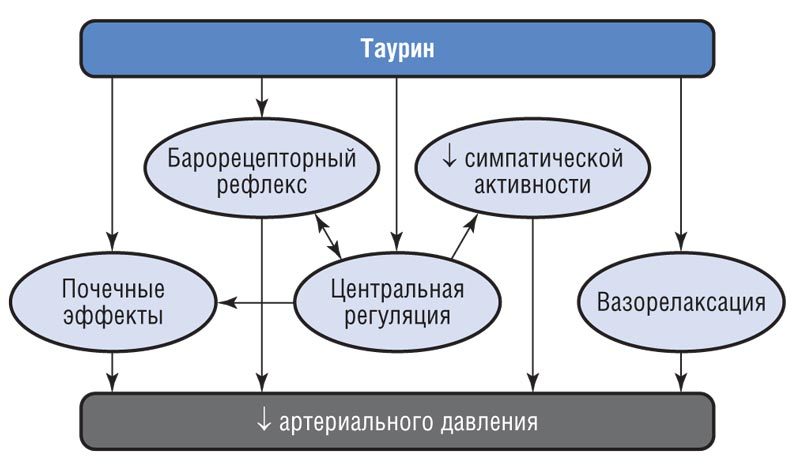
Механизмы, лежащие в основе антигипертензивной активности таурина [33]
Влияние таурина на липотоксичность
В экспериментальных исследованиях на животных моделях также было показано, что добавление в пищу таурина подавляет развитие гиперхолестеринемии и способствует уменьшению жировых отложений в брыжеечных артериях [34].
По всей видимости, данное свойство препарата обусловлено повышением образования желчных кислот и активацией 7α-гидроксилазы [35]. Кроме того, таурин влияет на экспрессию рецепторов липооксигеназы-1 [36]. Таурин включен в Национальные рекомендации Всероссийского научного общества кардиологов «Кардиоваскулярная профилактика», раздел «Гиполипидемическая терапия у пациентов с сахарным диабетом» [37].
В исследованиях с участием здоровых добровольцев гиполипидемический эффект таурина проявлялся уже через 3 нед приема препарата в дозе 6 мг/сут [38].
Таурин и метаболизм глюкозы
Существует несколько возможных механизмов, благодаря которым таурин может оказывать благотворное влияние на показатели гликемии: протекция по отношению к β-клеткам поджелудочной железы, повышение чувствительности к инсулину, инсулиноподобное действие, уменьшение всасывания глюкозы в желудочно-кишечном тракте и улучшение ее утилизации в периферических тканях [39, 40].
В животной модели таурин улучшал передачу сигналов инсулина, способствуя лучшему захвату глюкозы сердечной мышцей [41].
В клинических исследованиях у пациентов на фоне компенсации углеводного обмена при добавлении таурина также отмечалось снижение потребности в инсулине на 2–17 ЕД/сут [42]. Улучшение показателей гликемии на фоне приема таурина сочеталось с уменьшением инсулинорезистентности по индексу НОМА (Homeostasis Mode lAssessment of Insulin Resistance) на 20–35%, причем чем выше были исходные нарушения, тем отчетливее прослеживалась положительная динамика [42].
Влияние таурина на церебральные сосуды
Одним из вероятных механизмом развития инсульта является хроническое неспецифическое воспаление, протекающее в сосудистой стенке [43]. Таурина хлорамин оказывает нейтрализующее действие на радикалы, продуцируемые воспалительными клетками [44], способствует выживанию сосудистых клеток и регенерации сосудистой стенки [36].
Также прием таурина способствует уменьшению концентрации высокочувствительного С-реактивного белка, надежного маркера ишемического инсульта и ишемической болезни сердца (ИБС) [45]. Уменьшение интенсивности локального воспаления под влиянием приема таурина способствует нормализации функции церебральных сосудов и также может быть значимым для профилактики инсульта [46].
У животной модели употребление в пищу таурина было ассоциировано со снижением риска инсульта с 80 до 10% [19]. Употребление таурина в сочетании с бессолевой диетой в тех же условиях снижало риск развития инсульта до 0% [47].
Таурин и патология коронарных сосудов
Мультицентровое эпидемиологическое исследование CARDIAC включило около 100 мужчин и 100 женщин в возрасте от 48 до 56 лет, выбранных случайным образом из каждой группы населения и приглашенных к участию в диспансеризации. Целью данного исследования являлась оценка влияния содержания микронутриентов на артериальное давление и сердечно-сосудистую смертность.
Согласно полученным данным, была показана значимая отрицательная корреляция между смертностью от инсульта с поправкой на возраст и содержанием таурина в пище [49]. Поскольку японцы ежедневно употребляют в пищу рыбу и морепродукты, уровни суточной экскреции таурина у представителей данной популяции оказались крайне высокими и впоследствии эти данные были исключены из последующего анализа.
Однако даже после этого высокие уровни таурина в моче были тесно ассоциированы со значительным снижением сердечно-сосудистых рисков независимо от этнической принадлежности и наследственности. Результаты, полученные в исследовании CARDIAC, показывают, что потребление таурина приводит к снижению риска развития ССЗ [48].
В отечественном исследовании у больных с постинфарктным кардиосклерозом прием таурина в дозе 750 мг/сут в течение 3 мес приводил к снижению частоты нарушений сердечного ритма (уменьшению количества желудочковых экстрасистол на 45%, снижению частоты наджелудочковых нарушений ритма сердца на 56,9%). Более того, указанные изменения сохранялись в течение 3 мес после окончания приема препарата [49].
Роль таурина в механизмах ишемии-реперфузии
Стоит упомянуть, что таурин обладает антиапоптозной активностью [50], однако этот эффект имеет ограниченное значение в контексте ишемии-реперфузии в сердце, так как апоптозом в данных условиях обусловлено лишь около 4% общей гибели кардиомиоцитов. По всей видимости, основной точкой приложения таурина в данном случае также является окислительный стресс.
В этом плане представляет интерес исследование Hanna и соавт. [51], в котором было показано, что добавление таурина в питьевую воду в течение 6 мес защищало сердце от образования АФК в период ишемии-реперфузии [52].
Сравнительно недавно Jong и соавт. [53] показали, что истощение запасов внутриклеточного таурина приводит к увеличению митохондриального производства АФК. Таким образом, логично предположить, что поддержание нормального уровня таурина в митохондриях обеспечивает более эффективный ток электронов в митохондриальной дыхательной цепи, блокируя образование АФК, основного повреждающего фактора в условиях ишемииреперфузии [54]. Кроме того, терапия таурином активирует протеинкиназу В посредством модуляции процесса фосфорилирования [55].
В числе прочего в 2007 г. Ueno и соавт. показали, что лечение таурином во время реперфузии защищает ишемическое сердце от реперфузионного повреждения, улучшая сократительную функцию, снижая высвобождение креатинкиназы и перекисное окисление липидов [56].
Применение таурина при хронической сердечной недостаточности
Первые данные о том, что таурин способствует улучшению сократительной функции миокарда, были опубликованы более 20 лет назад. В 1985 г. Azuma и соавт. [57] показали, что лечение таурином способствует значительному уменьшению симптомов застойной сердечной недостаточности.
Более того, в другом исследовании тех же авторов, датированном 1992 г. [29], ежедневный прием таурина в дозе 3 г на протяжении 6 нед способствовал значительному улучшению сердечного выброса у пациентов с застойной сердечной недостаточностью, вторичной по отношению к ишемической или дилатационной идиопатической кардиопатии.
Ito и соавт. продемонстрировали значение таурина в физиологической функции кардиомиоцитов: у мышей с нарушенным транспортом таурина отмечалось уменьшение толщины стенки желудочков, снижался сердечный выброс и возрастало число генетических маркеров сердечной недостаточности [30]. В эксперименте таурин показал свою способность уменьшать апоптоз кардиомиоцитов и повышать выживаемость миоцитов при взаимодействии с норэпинефрином [31].
Применение таурина приводило к умеренному снижению АД и ЧСС, улучшению процессов реполяризации миокарда и диастолической функции левого желудочка с достоверным позитивным влиянием на показатели качества жизни пациентов при хорошей переносимости препарата [58].
Применение таурина в составе комплексной терапии больных с хронической сердечной недостаточностью (ХСН) стало предметом целого ряда отечественных исследований. Так, в одном из них на фоне приема таурина в дозе 250 мг 2 раза в день в течение 3 мес у пациентов, перенесших протезирование клапанов сердца и коронарное шунтирование, достоверно увеличивалась фракция выброса левого желудочка (ЛЖ), уменьшились индекс массы миокарда ЛЖ и сывороточные уровни триглицеридов. Во всех группах пациентов, принимавших таурин, достоверно улучшалось качество жизни [59].
В другом исследовании, включившем пациентов, перенесших инфаркт миокарда с фракцией выброса ЛЖ <45% и ХСН II–III функционального класса (ФК) по классификации NYHA, на фоне 3-месячной терапии таурином в дозе 750 мг/сут отмечалось снижение ФК ХСН на 45%, а также достоверное улучшение глобальной сократимости миокарда ЛЖ, уменьшение показателя dQT на 20,5%, зафиксирована тенденция к уменьшению количества наджелудочковых нарушений ритма сердца, в отличие от увеличения данного показателя в группе базисной терапии [60].
Кроме того, были получены сведения, что таурин увеличивает толерантность к физической нагрузке у больных с ХСН по данным велоэргометрии: по объему выполненной работы – на 25–29,4% (р<0,05), по пороговой мощности – на 22,8–24,1% (р<0,05) [42].
В недавнем исследовании М.Е. Стаценко и соавт. показали, что включение таурина в базисную терапию ХСН и СД2 в течение 16 нед не доказывает позитивного влияния на выраженность диастолической дисфункции. Частота выявления диастолической дисфункции II степени у больных с ХСН и СД2 в группе принимающих таурин снижалась на 32,2% vs 27% в группе контроля (р>0,05). Кроме того, у пациентов, принимавших таурин в составе комбинированной терапии, отмечалось уменьшение содержания маркера синтеза коллагена 1-го типа, специфичного для фиброза сердца, что может свидетельствовать об уменьшении прогрессирования образования фиброза в сердце под влиянием таурина [61].
В другом исследовании, проведенном той же группой ученых, было показано, что таурин в дозе 500 мг 2 раза в сутки обладает эндотелиопротекторными свойствами при его использовании в составе комбинированной терапии ХСН у больных СД2. Положительные изменения при этом отмечались как на уровне микроциркуляторного русла (достоверно при спастическом типе нарушений), так и в артериальных сосудах эластического типа. На фоне приема таурина отмечалось статистически значимое увеличение уровня NO в крови и одновременное снижение секреции эндотелина-1 [62].
В исследовании, включившем 117 больных ИБС, осложненной ХСН II–III ФК по классификации NYHA, у 64% пациентов, получавших таурин, отмечалось улучшение клинического состояния, проявляющееся в уменьшении одышки, утомляемости и сердцебиения при физической нагрузке [63]. Кроме того, прием препарата в течение 12 мес сопровождался достоверным снижением уровня галектина-3 (биомаркера, который, по мнению большинства исследователей, позволяет оценивать прогноз у больных ХСН), в среднем по группе на 18%. Авторы отмечают, что подобная положительная динамика концентрации галектина-3 в крови не привела к уменьшению летальности пациентов в течение года наблюдения, но сопровождалась снижением частоты госпитализаций по сравнению с контрольной группой [64].
Следует подчеркнуть, что таурин отличается хорошей переносимостью и отсутствием побочных явлений. В клинических исследованиях был показан высокий профиль безопасности таурина при введении в дозах 3–6 г/сут, при этом так и не было обнаружено уровня, оказывающего токсическое действие [64].
Таким образом, применение таурина в составе комплексной терапии нарушений углеводного обмена и диабетических макроангиопатий, согласно данным многочисленных исследований, способствует нормализации углеводного, жирового обмена, состояния сердечной мышцы и сосудистой стенки, что в совокупности значительно улучшает течение сосудистой патологии, сопутствующей СД2.
Сведения об авторах
Аметов Александр Сергеевич – доктор медицинских наук, профессор, заведующий кафедрой эндокринологии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва
Прудникова Марина Александровна – врач-эндокринолог, младший научный сотрудник кафедры эндокринологии ФГБОУ ДПО «Российская медицинская академия непрерывного профессионального образования» Минздрава России, Москва
Литература
- Кудрякова С.В., Сунцов Ю.И. Некоторые данные регистра сахарного диабета // Пробл. эндокринологии. 1994. Т. 40. № 1. С. 4–6.
- Асфандиярова Н.С. Смертность при сахарном диабете 2 типа // Сахарный диабет. 2015. Т. 18. № 4. С. 12–21.
- Brahma M.K., Pepin M.E., Wende A.R. My sweetheart is broken: role of glucose in diabetic cardiomyopathy // Diabetes Metab. J. 2017. Vol. 41, N 1. P. 1–9.
- Giacco F., Brownlee M. Oxidative stress and diabetic complications // Circ. Res. 2010. Vol. 107. P. 1058–1070.
- Ma H., Li S.Y., Xu P., Babcock S.A. et al. Advanced glycation endproduct (AGE) accumulation and AGE receptor (RAGE) up-regulation contribute to the onset of diabetic cardiomyopathy // J. Cell. Mol. Med. 2009. Vol. 13. P. 1751–1764.
- Tocchetti C.G., Caceres V., Stanley B.A., Xie C. et al. GSH or palmitate preserves mitochondrial energetic/redox balance, preventing mechanical dysfunction in metabolically challenged myocytes/hearts from type 2 diabetic mice // Diabetes.2012. Vol. 61. P. 3094–3105.
- Ramirez-Correa G.A., Ma J., Slawson C., Zeidan Q. et al. Removal of abnormal myofilament O-GlcNAcylation restores Ca2+ sensitivity in diabetic cardiac muscle // Diabetes. 2015. Vol. 64. P. 3573–3587.
- Lonardo A., Bellentani S., Argo C.K., Ballestri S. et al. Epidemiological modifiers of non-alcoholic fatty liver disease: focus on high-risk groups // Dig. Liver Dis. 2015. Vol. 47. P. 997–1006.
- Lonardo A., Ballestri S., Targher G., Loria P. Diagnosis and management of cardiovascular risk in nonalcoholic fatty liver disease // Expert Rev. Gastroenterol. Hepatol. 2015. Vol. 9. P. 629–650.
- Ballestri S., Lonardo A., Bonapace S., Byrne C.D. et al. Risk of cardiovascular, cardiac and arrhythmic complications in patients with non-alcoholic fatty liver disease // World J. Gastroenterol. 2014. Vol. 20. P. 1724–1745.
- Oni E.T., Agatston A.S., Blaha M.J., Fialkow J. et al. A systematic review: burden and severity of subclinical cardiovascular disease among those with nonalcoholic fatty liver; should we care? // Atherosclerosis. 2013. Vol. 230. P. 258–267.
- Targher G., Day C.P., Bonora E. Risk of cardiovascular disease in patients with nonalcoholic fatty liver disease // N. Engl. J. Med. 2010. Vol. 363. P. 1341–1350.
- Lonardo A., Sookoian S., Pirola C.J., Targher G. Non-alcoholic fatty liver disease and risk of cardiovascular disease // Metabolism. 2016. Vol. 65. P. 1136–1150.
- Okamoto K., Aoki K. Development of a strain of spontaneously hypertensive rats // Jpn. Circ. J. 1963. Vol. 27. P. 282–293
- Okamoto T., Yamori Y., Nagaoka A. Establishment of the strokeprone spontaneously hypertensive rat (SHR) // Circ. Res. 1974. Vol. 34/35. P. 143–153.
- Yamori Y., Strasser T. Hypertension and biological dietary markers in urine and blood: a progress report from the CARDIAC study group. In: New horizons in preventing cardiovascular diseases. Amsterdam: Elsevier, 1989. P. 111–126.
- Yamori Y., Nara Y., Mizushima S., Murakami S. et al. Gene-environment interaction in hypertension, stroke and atherosclerosis in experimental models and supportive findings from a worldwide cross-sectional epidemiological survey: a WHO-CARDIAC study // Clin. Exp. Pharmacol. Physiol. Suppl. 1992. Vol. 20. P. 43–52.
- Yamori Y., Taguchi T., Hamada A., Kunimasa K. et al. Taurine in health and diseases: consistent evidence from experimental and epidemiological studies // J. Biomed. Sci. 2010. Vol. 17, Suppl. 1. P. S6.
- Nara Y., Yamori Y., Lovenberg W. Effect of dietary taurine on blood pressure in spontaneously hypertensive rats // Biochem. Pharmacol. 1978. Vol. 27. P. 2689–2692.
- Yamori Y., Nara Y., Ikeda K., Mizushima S. Is taurine a preventive nutritional factor of cardiovascular diseases or just a biological marker of nutrition? // Adv. Exp. Med. Biol. 1996. Vol. 403. P. 623–629.
- Chen S.W., Chen Y.X., Shi J., Lin Y., Xie W.F. The restorative effect of taurine on experimental nonalcoholic steatohepatitis // Dig. Dis. Sci. 2006. Vol. 51. P. 2225–2234.
- Zulli A. Taurine in cardiovascular disease // Curr. Opin. Clin. Nutr. Metab. Care. 2011. Vol. 14, N 1. P. 57–60.
- Zulli A., Lau E., Wijaya B.P. et al. High dietary taurine reduces apoptosis and atherosclerosis in the left main coronary artery: association with reducedCCAAT/enhancer binding protein, homologous protein and total plasmahomocysteine but not lipidemia // Hypertension. 2009. Vol. 53. P. 1017–1022.
- Panzenboeck U., Raitmayer S., Reicher H. et al. Effects of reagent and enzymatically generated hypochlorite on physicochemical and metabolic properties of high density lipoproteins // J. Biol. Chem. 1997. Vol. 272. P. 29711–29720.
- Oudit G.Y., Trivieri M.G., Khaper N., Husain T. et al. Taurine supplementation reduces oxidative stress and improves cardiovascular function in an ironoverload murine model // Circulation. 2004. Vol. 109. P. 1877– 1885.
- Dhalla N.S., Adameova A., Kaur M. Role of catecholamine oxidation in sudden cardiac death // Fundam. Clin. Pharmacol. 2010. Vol. 24. P. 539–546.
- Schuller-Levis G.B., Park E. Taurine and its chloramine: modulators of immunity // Neurochem. Res. 2004. Vol. 29. P. 117–126.
- Marcinkiewicz J., Grabowska A., Bereta J., Stelmaszynska T. Taurine chloramine, a product of activated neutrophils, inhibits in vitro the generation of nitricoxide and other macrophage inflammatory mediators // J. Leukoc. Biol. 1995. Vol. 58. P. 667–674.
- Azuma J., Sawamura A., Awata N. Usefulness of taurine in chronic congestive heart failure and its prospective application // Jpn. Circ. J. 1992. Vol. 56. P. 95–99.
- Ito T., Kimura Y., Uozumi Y. et al. Taurine depletion caused by knocking out the taurine transporter gene leads to cardiomyopathy with cardiac atrophy // J. Mol. Cell. Cardiol. 2008. Vol. 44. P. 927–937.
- Li Y., Arnold J.M., Pampillo M. et al. Taurine prevents cardiomyocyte death by inhibiting NADPH oxidase-mediated calpain activation // Free Radic. Biol. Med. 2009. Vol. 46. P. 51–61.
- Shiny K.S., Kumar S.H., Farvin K.H., Anandan R., Devadasan K. Protective effect of taurine on myocardial antioxidant status in isoprenalineinduced myocardial infarction in rats // J. Pharm. Pharmacol. 2005. Vol. 57. P. 1313–1317.
- Abebe W., Mozaffari M.S. Role of taurine in the vasculature: an overview of experimental and human studies // Am. J. Cardiovasc. Dis. 2011. Vol. 1, N 3. P. 293–311.
- Murakami S., Yamagishi I., Asami Y., Ohta Y. et al. Hypolipidemic effect of taurine in stroke-prone spontaneously hypertensive rats // Pharmacology. 1996. Vol. 52. P. 303–313.
- Yokogoshi H., Mochizuki H., Nanami K., Hida Y. et al. Dietary taurine enhances cholesterol degradation and reduces serum and liver cholesterol concentrations in rats fed a high-cholesterol diet // J. Nutr. 1999. Vol. 129. P. 1705–1712.
- Sun Jang J., Piao S., Cha Y.N., Kim C. Taurine chloramine activates Nrf2, increases HO-1 expression and protects cells from death caused by hydrogen peroxide // J. Clin. Biochem. Nutr. 2009. Vol. 45. P. 37–43.
- Кардиоваскулярная профилактика: Национальные рекомендации ВНОК // Кардиоваскулярная терапия и профилактика. Прил. 2. 2011. Т. 10, № 6. scardio.ru/rekomendacii/rekomendacii_rko nacionalnye_rekomendacii_po_kardiovaskulyarnoy_profilaktike.
- Mizushima S., Nara Y., Sawamura M., Yamori Y. Effects of oral taurine supplementation on lipids and sympathetic nerve tone // Adv. Exp. Med. Biol. 1996. Vol. 403. P. 615–622.
- Das J., Roy A., Sil P.C. Mechanism of the protective action of taurine in toxin and drug induced organ pathophysiology and diabetic complications: a review // Food Funct. 2012. Vol. 3, N 12. P. 1251–1264.
- El Mesallamy H.O., El-Demerdash E., Hammad L.N., El Magdoub H.M. Effect oftaurine supplementation on hyperhomocysteinemia and markers of oxidativestress in high fructose diet induced insulin resistance // Diabetol. Metab. Syndr. 2010. Vol. 2. P. 46.
- Das J., Vasan V., Sil P.C. Toxicol. Taurine exerts hypoglycemic effect in alloxan-induced diabetic rats, improves insulin-mediated glucose transport signaling pathway in heart and ameliorates cardiac oxidative stress and apoptosis // Appl. Pharmacol. 2012. Vol. 258. P. 296–308.
- Аметов А.С., Солуянова Т.Н. Таурин в лечении сахарного диабета // Мед. совет. 2011. № 1–2. С. 54–58.
- Tagami M., Tsukada T., Kubota A., Nara A., Yamori Y. Immunocytochemical study of cerebral perforating arteries in patients with cerebral infactions // Acta Histochem Cytochem.1993. Vol. 26. P. 109–115.
- Schuller Levis G.B., Park E. Taurine and its chloramine: modulators of immunity. Neurochem Res. 2004. Vol. 29. P. 117–126.
- Ouellet V., Weisnagel S.J., Marois J., Bergeron J. et al. Dietary cod protein reduces plasma C-reactive protein in insulin-resistant men and women // J. Nutr. 2008. Vol. 138. P. 2386–2391.
- Yamori Y., Liu L., Mori M., Sagara M. et al. Taurine as the nutritional factor for the longevity of the Japanese revealed by a world-wide epidemiological survey // Adv. Exp. Med. Biol. 2009. Vol. 643. P. 13–25.
- Yamori Y. Predictive and preventive pathology of cardiovascular diseases // Acta Pathol. Jpn. 1989. Vol. 39. P. 683–705.
- Yamori Y., Liu L., Mizushima S., Ikeda K., Nara Y. Male cardiovascular mortality and dietary markers in 25 population samples of 16 countries // J. Hypertens. 2006. Vol. 24. P. 1499–1505.
- Васильева И.С., Резван В.В. Психосоматический статус больных с постинфарктным кардиосклерозом при включении при включении в комплексное лечение таурина // Архивъ внутренней медицины. 2016. Спецвып. С. 111–116.
- Takatani T., Takahashi K., Uozumi Y., Shikata E. et al. Taurine inhibits apoptosis by preventing formation of the Apaf-1/caspase-9 apoptosome // Am. J. Physiol. 2004. Vol. 287. P. 949–953.
- Hanna J., Chahine R., Aftimos G., Nader M. et al. Protective effect of taurine against free radical damage in the rat myocardium // Exp. Toxicol. Pathol. 2004. Vol. 56. P. 189–194.
- Schaffer S.W., Jong C.J., Ito T., Azuma J. Effect of taurine on ischemia-reperfusion injury // Amino Acids. 2014. Vol. 46. N 1. P. 21–30. doi: 10.1007/s00726-012-1378-8.
- Jong C.J., Azuma J., Schaffer S. Mechanism underlying the antioxidant activity of taurine: prevention of mitochondrial oxidant production // Amino Acids. 2012. Vol. 42. P. 2223–2232.
- Milei J., Ferreira R., Llesuy S., Forcada P. et al. Reduction of reperfusion injury with preoperative rapid intravenous infusion of taurine during myocardial revascularization // Am. Heart. J. 1992. Vol. 123. P. 339– 345.
- Takatani T., Takahashi K., Uozumi Y., Matsuda T. et al. Taurine prevents the ischemiainduced apoptosis in cultured neonatal rat cardiomyocytes throughAkt/caspase-9 pathway // Biochem. Biohys Res. Commun. 2004. Vol. 316. P. 484–489
- Ueno T., Iguro Y., Yotsumoto G., Fukumoto Y. et al. Taurine at early reperfusion significantly reduces myocardial damage and preserves cardiac function in the isolated rat heart // Resuscitation. 2007. Vol. 73. P. 287–295.
- Azuma J., Sawamura A., Awata N., et al. Therapeutic effect of taurine incongestive heart failure: a double-blind crossover trial // Clin. Cardiol. 1985. Vol. 8. P. 276–282.
- Нечаева Г.И., Друк И.В., Ряполова Е.А. Эффективность и переносимость таурина у пациентов с сахарным диабетом 2-го типа и диастолической дисфункцией левого желудочка // Поликлиника. 2015. № 1–2. С. 58–62.
- Аверин Е.Е. Опыт применения таурина на этапе реабилитации больных после кардиохирургических вмешательств // Сердечная недостаточность. 2014. Т. 15, № 4. С. 224–231.
- Покровская Е.М., Волов Н.А., Васильева И.С., Гордеев И.Г., Павликова Е.П. Новые возможности лечения пациентов c сердечной недостаточностью вследствие постинфарктного кардиосклероза // Мед. совет. 2012. № 12. С. 18–23.
- Стаценко М.Е., Туркина С.В., Шилина Н.Н. Поражение печени у больных с хронической сердечной недостаточностью ишемического генеза и сахарным диабетом типа 2 – коварный тандем: возможности дополнительной органопротективной терапии // Consilium Medicum. 2016. № 18 (5). С. 103–109.
- Стаценко М.Е., Туркина С.В., Шилина Н.Н., Винникова А.А. Эндотелиопротекторные свойства таурина у больныхс хронической сердечной недостаточностью и сахарным диабетом 2 типа // Кардиоваскулярная терапия и профилактика. 2016. Т. 15. № 2. С. 38–44.
- Абдурагимов С.А., Теплова Н.В., Волов Н.А., Софрина С.Л., Беневская М.А. Таурин в комплексной терапии больных хронической сердечной недостаточностью с сохраненной фракцией выброса // Фарматека. 2016. № 13 (326). С. 49–54.
- Shao A., Hathcock J.N. Risk assessment for the amino acids taurine, L-glutamine and L-arginine // Regul. Toxicol. Pharmacol. 2008. Vol. 50. P. 376–399.
References
- Kudryakova S.V., Suntsov Yu.I. Some data from the diabetes register. Problemy endokrinologii [Problems of Endocrinology]. 1994; 40 (1): 4–6. (in Russian)
- Asfandiyarova N.S. A review of mortality in type 2 diabetes mellitus. Sakharnyy diabet [Diabetes Mellitus]. 2015; 18 (4): 12–21. (in Russian)
- Brahma M.K., Pepin M.E., Wende A.R. My sweetheart is broken: role of glucose in diabetic cardiomyopathy. Diabetes Metab J. 2017; 41 (1): 1–9.
- Giacco F., Brownlee M. Oxidative stress and diabetic complications. Circ Res. 2010; 107: 1058–70.
- Ma H., Li S.Y., Xu P., Babcock S.A., et al. Advanced glycation endproduct (AGE) accumulation and AGE receptor (RAGE) up-regulation contribute to the onset of diabetic cardiomyopathy. J Cell Mol Med. 2009; 13: 1751–64.
- Tocchetti C.G., Caceres V., Stanley B.A., Xie C., et al. GSH or palmitate preserves mitochondrial energetic/redox balance, preventing mechanical dysfunction in metabolically challenged myocytes/hearts from type 2 diabetic mice. Diabetes. 2012; 61: 3094–105.
- Ramirez-Correa G.A., Ma J., Slawson C., Zeidan Q., et al. Removal of abnormal myofilament O-GlcNAcylation restores Ca2+ sensitivity in diabetic cardiac muscle. Diabetes. 2015; 64: 3573–87.
- Lonardo A., Bellentani S., Argo C.K., Ballestri S., et al. Epidemiological modifiers of non-alcoholic fatty liver disease: focus on high-risk groups. Dig Liver Dis. 2015; 47: 997–1006.
- Lonardo A., Ballestri S., Targher G., Loria P. Diagnosis and management of cardiovascular risk in nonalcoholic fatty liver disease. Expert Rev Gastroenterol Hepatol. 2015; 9: 629–50.
- Ballestri S., Lonardo A., Bonapace S., Byrne C.D., et al. Risk of cardiovascular, cardiac and arrhythmic complications in patients with non-alcoholic fatty liver disease. World J Gastroenterol. 2014; 20: 1724–45.
- Oni E.T., Agatston A.S., Blaha M.J., Fialkow J., et al. A systematic review: burden and severity of subclinical cardiovascular disease among those with nonalcoholic fatty liver; should we care? Atherosclerosis. 2013; 230: 258–67.
- Targher G., Day C.P., Bonora E. Risk of cardiovascular disease in patients with nonalcoholic fatty liver disease. N Engl J Med. 2010; 363: 1341–50.
- Lonardo A., Sookoian S., Pirola C.J., Targher G. Non-alcoholic fatty liver disease and risk of cardiovascular disease. Metabolism. 2016; 65: 1136–50.
- Okamoto K., Aoki K. Development of a strain of spontaneously hypertensive rats. Jpn Circ J. 1963; 27: 282–93.
- Okamoto T., Yamori Y., Nagaoka A. Establishment of the strokeprone spontaneously hypertensive rat (SHR). Circ Res. 1974; 34/35: 143–53.
- Yamori Y., Strasser T. Hypertension and biological dietary markers in urine and blood: a progress report from the CARDIAC study group. In: New horizons in preventing cardiovascular diseases. Amsterdam: Elsevier, 1989: 111–26.
- Yamori Y., Nara Y., Mizushima S., Murakami S., et al. Geneenvironment interaction in hypertension, stroke and atherosclerosis in experimental models and supportive findings from a worldwide cross-sectional epidemiological survey: a WHO-CARDIAC study. Clin Exp Pharmacol Physiol. Suppl. 1992; 20: 43–52.
- Yamori Y., Taguchi T., Hamada A., Kunimasa K., et al. Taurine in health and diseases: consistent evidence from experimental and epidemiological studies. J Biomed.Sci. 2010; 17, Suppl. 1: S6.
- Nara Y., Yamori Y., Lovenberg W. Effect of dietary taurine on blood pressure in spontaneously hypertensive rats. Biochem Pharmacol. 1978; 27: 2689–92.
- Yamori Y., Nara Y., Ikeda K., Mizushima S. Is taurine a preventive nutritional factor of cardiovascular diseases or just a biological marker of nutrition? Adv Exp Med Biol. 1996; 403: 623–629.
- Chen S.W., Chen Y.X., Shi J., Lin Y., Xie W.F. The restorative effect of taurine on experimental nonalcoholic steatohepatitis. Dig Dis Sci. 2006; 51: 2225–34.
- Zulli A. Taurine in cardiovascular disease. Curr Opin Clin Nutr Metab Care. 2011; 14 (1): 57–60.
- Zulli A., Lau E., Wijaya B.P., et al. High dietary taurine reduces apoptosis and atherosclerosis in the left main coronary artery: association with reducedCCAAT/enhancer binding protein, homologous protein and total plasmahomocysteine but not lipidemia. Hypertension. 2009; 53: 1017–22.
- Panzenboeck U., Raitmayer S., Reicher H., et al. Effects of reagent and enzymatically generated hypochlorite on physicochemical and metabolic properties of high density lipoproteins. J Biol Chem. 1997; 272: 29711–20.
- Oudit G.Y., Trivieri M.G., Khaper N., Husain T., et al. Taurine supplementation reduces oxidative stress and improves cardiovascular function in an ironoverload murine model. Circulation. 2004; 109: 1877–85.
- Dhalla N.S., Adameova A., Kaur M. Role of catecholamine oxidation in sudden cardiac death. Fundam Clin Pharmacol. 2010; 24: 539–46.
- Schuller-Levis G.B., Park E. Taurine and its chloramine: modulators of immunity. Neurochem Res. 2004; 29: 117–26.
- Marcinkiewicz J., Grabowska A., Bereta J., Stelmaszynska T. Taurine chloramine, a product of activated neutrophils, inhibits in vitro the generation of nitricoxide and other macrophage inflammatory mediators. J Leukoc Biol. 1995; 58: 667–74.
- Azuma J., Sawamura A., Awata N. Usefulness of taurine in chronic congestive heart failure and its prospective application. Jpn Circ J. 1992; 56: 95–9.
- Ito T., Kimura Y., Uozumi Y., et al. Taurine depletion caused by knocking out the taurine transporter gene leads to cardiomyopathy with cardiac atrophy. J Mol Cell Cardiol. 2008; 44: 927–37.
- Li Y., Arnold J.M., Pampillo M., et al. Taurine prevents cardiomyocyte death by inhibiting NADPH oxidase-mediated calpain activation. Free Radic Biol Med. 2009; 46: 51–61.
- Shiny K.S., Kumar S.H., Farvin K.H., Anandan R., Devadasan K. Protective effect of taurine on myocardial antioxidant status in isoprenaline-induced myocardial infarction in rats. J Pharm Pharmacol. 2005; 57: 1313–7.
- Abebe W., Mozaffari M.S. Role of taurine in the vasculature: an overview of experimental and human studies. Am J Cardiovasc Dis. 2011; 1 (3): 293–311.
- Murakami S., Yamagishi I., Asami Y., Ohta Y., et al. Hypolipidemic effect of taurine in stroke-prone spontaneously hypertensive rats. Pharmacology. 1996; 52: 303–13.
- Yokogoshi H., Mochizuki H., Nanami K., Hida Y., et al. Dietary taurine enhances cholesterol degradation and reduces serum and liver cholesterol concentrations in rats fed a high-cholesterol diet. J Nutr. 1999; 129: 1705–12.
- Sun Jang J., Piao S., Cha Y.N., Kim C. Taurine chloramine activates Nrf2, increases HO-1 expression and protects cells from death caused by hydrogen peroxide. J Clin Biochem Nutr. 2009; 45: 37–43.
- Cardiovascular Prevention: National Recommendations. Kardiovaskulyarnaya terapiya i profilaktika [Cardiovascular Therapy and Prevention]. Suppl. 2. 2011; 10 (6). scardio.ru/rekomendacii rekomendacii_rko/nacionalnye_rekomendacii_po_kardiovaskulyarnoy_ profilaktike. (in Russian)
- Mizushima S., Nara Y., Sawamura M., Yamori Y. Effects of oral taurine supplementation on lipids and sympathetic nerve tone. Adv Exp Med Biol. 1996; 403: 615–22.
- Das J., Roy A., Sil P.C. Mechanism of the protective action of taurine in toxin and drug induced organ pathophysiology and diabetic complications: a review. Food Funct. 2012; 3 (12): 1251–64.
- El Mesallamy H.O., El-Demerdash E., Hammad L.N., El Magdoub H.M. Effect oftaurine supplementation on hyperhomocysteinemia and markers of oxidativestress in high fructose diet induced insulin resistance. Diabetol Metab Syndr. 2010; 2: 46.
- Das J., Vasan V., Sil P.C. Toxicol. Taurine exerts hypoglycemic effect in alloxan-induced diabetic rats, improves insulin-mediated glucose transport signaling pathway in heart and ameliorates cardiac oxidative stress and apoptosis. Appl Pharmacol. 2012; 258: 296–308.
- Ametov A.S., Soluyanova T.N. Taurine in the treatment of diabetes mellitus. Meditsinskiy sovet [Medical Advice]. 2011; (1–2): 54–8. (in Russian)
- Tagami M., Tsukada T., Kubota A., Nara A., Yamori Y. Immunocytochemical study of cerebral perforating arteries in patients with cerebral infactions. Acta Histochem Cytochem. 1993; 26: 109–15.
- Schuller Levis G.B., Park E. Taurine and its chloramine: modulators of immunity. Neurochem Res. 2004; 29: 117–26.
- Ouellet V., Weisnagel S.J., Marois J., Bergeron J., et al. Dietary cod protein reduces plasma C-reactive protein in insulin-resistant men and women. J Nutr. 2008; 138: 2386–91.
- Yamori Y., Liu L., Mori M., Sagara M., et al. Taurine as the nutritional factor for the longevity of the Japanese revealed by a world-wide epidemiological survey. Adv Exp Med Biol. 2009; 643: 13–25.
- Yamori Y. Predictive and preventive pathology of cardiovascular diseases. Acta Pathol Jpn. 1989; 39: 683–705.
- Yamori Y., Liu L., Mizushima S., Ikeda K., Nara Y. Male cardiovascular mortality and dietary markers in 25 population samples of 16 countries. J Hypertens. 2006; 24: 1499–505.
- Vasilieva I.S., Rezvan V.V. Psihosomaticheskoy status of patients with postinfarction cardiosclerosis when included in complex treatment taurine. Arkhiv vnutrenney meditsiny [Archive of Internal Medicine]. 2016; Special is: 111–6. (in Russian)
- Takatani T., Takahashi K., Uozumi Y., Shikata E., et al. Taurine inhibits apoptosis by preventing formation of the Apaf-1/caspase-9 apoptosome. Am J Physiol. 2004; 287: 949–53.
- Hanna J., Chahine R., Aftimos G., Nader M., et al. Protective effect of taurine against free radical damage in the rat myocardium. Exp Toxicol Pathol. 2004; 56: 189–94.
- Schaffer S.W., Jong C.J., Ito T., Azuma J. Effect of taurine on ischemiareperfusion injury. Amino Acids. 2014; 46 (1): 21–30. doi: 10.1007/ s00726-012-1378-8.
- Jong C.J., Azuma J., Schaffer S. Mechanism underlying the antioxidant activity of taurine: prevention of mitochondrial oxidant production. Amino Acids. 2012; 42: 2223–32.
- Milei J., Ferreira R., Llesuy S., Forcada P., et al. Reduction of reperfusion injury with preoperative rapid intravenous infusion of taurine during myocardial revascularization. Am Heart J. 1992; 123: 339–45.
- Takatani T., Takahashi K., Uozumi Y., Matsuda T., et al. Taurine prevents the ischemiainduced apoptosis in cultured neonatal rat cardiomyocytes throughAkt/caspase-9 pathway. Biochem Biohys Res Commun. 2004; 316: 484–9.
- Ueno T., Iguro Y., Yotsumoto G., Fukumoto Y., et al. Taurine at early reperfusion significantly reduces myocardial damage and preserves cardiac function in the isolated rat heart. Resuscitation. 2007; 73: 287–95.
- Azuma J., Sawamura A., Awata N., et al. Therapeutic effect of taurine incongestive heart failure: a double-blind crossover trial. Clin Cardiol. 1985; 8: 276–82.
- Nechaeva G.I., Druk I.V., Ryapolova E.A. Efficacy and tolerability of taurine in patients with type 2 diabetes mellitus and left ventricular diastolic dysfunction. Poliklinika [Polyclinic]. 2015; (1–2): 58–62. (in Russian)
- Аverin Е.Е. Experience of using taurine during rehabilitation of patients after cardiac surgery Serdechnaya nedostatochnost’ [Russian Heart Failure Journal]. 2014; 15 (4): 224–31. (in Russian)
- Pokrovskaya E.M., Volov N.A., Vasil’eva I.S., Gordeev I.G., Pavlikova E.P. New possibilities of treatment of patients with heart failure due to postinfarction cardiosclerosis. Meditsinskiy sovet [Medical Advice]. 2012; (12): 18–23. (in Russian)
- Statsenko M.E., Turkina S.V., Shilina N.N. Liver involvement in patients with chronic heart failure of ischemic origin and type 2 diabetes mellitus is a cunning tandem: the possibilities of additional organoprotective therapy. Consilium Medicum. 2016; (5): 103–9. (in Russian)
- Statsenko M.E., Turkina S.V., Shilina N.N., Vinnikova A.A. Endothelium protecting properties of taurin in chronic heart failure with type 2 diabetes. Kardiovaskulyarnaya terapiya i profilaktika [Cardiovascular Therapy and Prevention]. 2016. Т. 15. № 2. С. 38–44. (in Russian)
- Abduragimov S.A., Teplova N.V., Volov N.A., Sofrina S.L., Benevskaya M.A. Taurine in the complex treatment of patients with chronic heart failure with preserved ejection fraction // Farmateka [Pharmateca]. 2016; (13): 49–54. (in Russian)
- Shao A., Hathcock J.N. Risk assessment for the amino acids taurine, L-glutamine and L-arginine. Regul Toxicol Pharmacol. 2008; 50. P. 376–99.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 pikfarma.ru
pikfarma.ru



