Протективная ишемия в кардиологии. Формы кондиционирования миокарда
Статьи
Опубликовано в журнале:
«Кардиоваскулярная терапия и профилактика», 2011, 10(1)
В.П. Лупанов1*, А.В. Максименко2
1 - Институт клинической кардиологии им. А.Л. Мясникова;
2 - Институт экспериментальной кардиологии ФГУ Российский кардиологический научно-производственный комплекс Минздравсоцразвития. Москва, Россия
В обзоре рассмотрены феномены ишемического прекондиционирования, кондиционирования и посткондиционирования миокарда у больных ишемической болезнью сердца и молекулярные механизмы, лежащие в их основе. Показано значение кондиционирования (протективных ишемий) миокарда в клинических исследованиях и перспективность их дальнейшего развития.
Ключевые слова: прекондиционирование, посткондиционирование, ишемическая болезнь сердца, поражение миокарда от ишемии/реперфузии.
Protective ischemia in cardiology. Myocardial conditioning forms
V.P. Lupanov1*, A.V. Maksimenko2
1 L.A. Myasnikov Research Institute of Clinical Cardiology;
2Institute of Experimental Cardiology, Russian Cardiology Scientific and Clinical Complex. Moscow, Russia
The review describes the phenomena of ischemic myocardial preconditioning, conditioning, and postconditioning, as well as the relevant molecular mechanisms, in patients with coronary heart disease. The role of conditioning (protective ischemia) in clinical trials and its potential for further research are demonstrated.
Key words: Preconditioning, postconditioning, coronary heart disease, myocardial ischemia-reperfusion injury.
Представление о прекондиционировании в клиническую кардиологию пришло из экспериментальных лабораторий, изучающих состояние сердца в период после ишемии. После быстрой и кратковременной ишемии у экспериментальных животных последующее ишемическое воздействие и реперфузия могут вызывать меньшую степень поражения миокарда, чем без начального эпизода ишемии.
Мurry С.Е. с соавт. [1] в 1986г. на сердцах собак, находящихся под наркозом, неожиданно обнаружили, что повторные короткие эпизоды региональной ишемии адаптируют миокард к ишемии. Это проявлялось в поддержании уровня аденозинтрифосфатом (АТФ) в миокарде и отсутствии признаков развития инфаркта миокарда (ИМ) у 6 из 7 собак. В других опытах было показано, что предварительно проведенные четыре 5-минутных окклюзии коронарных артерий (КА) с интервалами для реперфузии в течение 5 мин, привели при последующей длительной 40-минутной ишемии (при лигировании КА) к по сравнению с его размерами у контрольной группы (КГ) без предшествующих повторных коротких эпизодов ишемии. Сейчас считается, что этот механизм может быть полезен частично в предотвращении оглушенности кардиомиоцитов (КМЦ) и ИМ.
Авторы этих исследований впервые назвали данный феномен ишемическим прекондиционированием и оценили его как кардиопротективный механизм, в частности, в отношении развития ишемических поражений миокарда во время реперфузий [1-3]. Последние могут вызывать "реперфузионное" поражение, увеличивающее ишемическое. Поэтому в дальнейшем под ишемическим поражением подразумевается воздействие на миокард ишемии/реперфузии, включая развитие постишемической сократительной дисфункции миокарда, гибель его клеток, нарушения микроциркуляции (МЦ) и перфузии тканей, а также реперфузионные желудочковые аритмии [4-6]. В дальнейшем этот феномен был отмечен у человека [2-6].
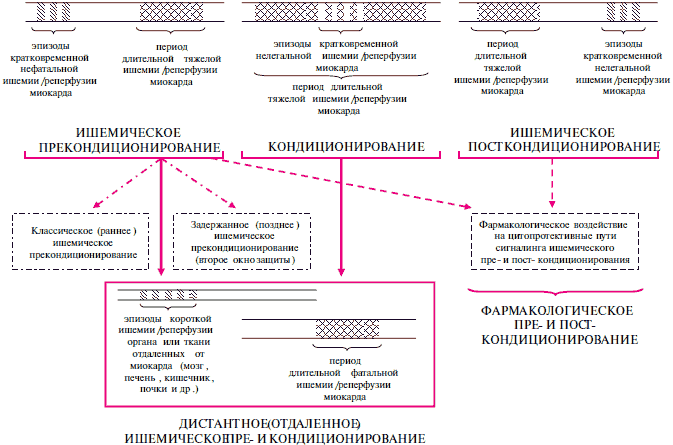
Последующие исследования показали, что "кондиционирование" (приспособительная подготовка) сердца к противодействию поражающим эффектам, вызванным ишемией и реперфузией, может быть обусловлено применением разных механических и фармакологических подходов [5,6]. Индуцирование эпизодов короткой нелетальной ишемии и реперфузии миокарда до, во время или даже после периода продолжительной тяжелой миокардиальной ишемии способно существенно снизить поражение сердца. Отмеченные явления (как уже частично упоминалось) получили названия ишемического прекондиционирования (ИПРК), кондиционирования (ИК) и посткондиционирования (ИПСК), соответственно (рисунок 1) [6,7].
Прекондиционирование миокарда. Механизмы локального ИПРК включают 3 последовательных этапа: триггерную стадию, стадию внутриклеточной передачи сигнала и стадию реализации защитного эффекта. Триггерная стадия характеризуется накоплением в миокарде биологически активных веществ (аденозина, брадикинина, катехоламинов и др.), связывающихся со специфическими рецепторами на сарколемме КМЦ и запускающих внутриклеточный каскад передачи сигнала. Внутриклеточная передача сигнала осуществляется путем активации связанных с G-белками протеин-киназ. Наконец, реализация защитного эффекта предполагает осуществление гипотетической клеточной энергосберегающей программы, молекулярные механизмы которой пока остаются неизвестными. Конечным эффектом ИПРК считались митохондриальные чувствительные к АТФ калиевые каналы, активация которых непосредственно ведет к росту устойчивости миокарда к ишемии. Однако этот взгляд в последнее время подвергается серьезной критике, поэтому конечный эффектор кардио-протективных воздействий до сих пор не установлен [8].
Таким образом, механизмы ИПРК связаны с изменением эффективности метаболических путей и поддержкой ионного гомеостаза в ишемизированных КМЦ. Они запускаются образованием целого ряда триггеров: аденозина, брадикинина, оксида азота (N0), свободных радикалов кислорода и др. [9,10], взаимодействующих с рецепторами КМЦ и сосудистого эндотелия или прямо влияющих на активность ферментов. Это приводит к активации разных путей проведения внутриклеточного сигнала (сигналинга), в которых участвуют медиаторы и вторичные посредники ИПРК. Наиболее типичными из них являются L -изоформа протеинкиназы С и АТФ-зависимые К+ - каналы. Как правило, в результате ИПРК улучшается энергетическое состояние ишемизированных КМЦ, уменьшается их перегрузка ионами Ca2+, снижается повреждение митохондриальных мембран и сарколеммы [11]. Это обеспечивает лучшее выживание миокарда в условиях сниженного обеспечения энергетическими субстратами и кислородом [12,13].
Фармакологическое пре- и пост- кондиционирование миокарда. Оказалось, что реперфузия миокарда в ходе ИПРК или ИПСК воздействует на сходные метаболические пути сигналинга, включая рецепторы клеточной поверхности, разнообразные протеинкиназные каскады, как киназный путь, защищающий от реперфузионного поражения (reperfusion injury salvage kinase /RISK/ pathway), передачу сигнала благодаря окислительно-восстановительным реакциям, поры митохондриальной проницаемости [14]. Отмеченное заключение опирается, в основном, на данные, полученными на животных и с клеточными моделями [14-16]. В отличие от них у человека имеется смешанный, более сложный характер миокардиального поражения. Ишемическая болезнь сердца (ИБС) человека представляет собой комплекс нарушений, вызванных или связанных с известными факторами риска, включая гипертонию, гиперлипидемию, диабет, инсулиновую резистентность, атеросклероз, сердечную недостаточность (СН), а также старение организма как важное условие изменений [17]. При этих заболеваниях и старении патологические процессы базируются на фундаментальных молекулярных изменениях, которые могут сами по себе влиять на развитие поражения от ишемии/реперфузии и на кардиопротективные эффекты. В таких условиях наблюдаемые механизмы поражения: избыточное образование реакционно-способных форм кислорода и азота, ингибирование АТФ-чувствительных калиевых каналов, сниженная экспрессия коннексина-43, сигнального трансдъюсера и активатора транскрипции 3 и др., могут разрушать общие цито-протективные пути сигналинга. Их защита сходна с кардиопротекторными эффектами ИПРК и ИПСК. Это обосновывает новые цели для фармакологических агентов, способных развивать и усиливать эффекты ИПРК и ИПСК, выступать в качестве средств адъювантной (смежной) терапии для современных реперфузионных стратегий, таких как тромболизис и первичная коронарная ангиопластика (КАГ) [7,17,18]. Лекарство применяется как триггер или активатор сигналинга, связанного с эндогенной кардиопротекцией, формируя направление фармакологического пре- или пост- кондиционирования (рисунок 1).
Прекондиционирование в клинике. В клинических условиях прекондиционирование напоминает феномен "прохождения через боль" [19,20]. Иногда больные при нагрузочных пробах испытывают стенокардию, но продолжают нагрузку. Через какое-то время боль прекращается. Утренний приступ стенокардии может не повториться при той же нагрузке в течение дня.
Возникает соблазнительная идея доводить больных до стенокардии, надеясь, что вследствие ИПРК последующие приступы не возобновятся.
Безусловно, в этом есть какой-то смысл, но полностью повторить эксперимент Миггу С.Е. у человека невозможно даже в слабой степени из-за невозможности безопасной неинвазивной дозировки ишемии миокарда, да и не у каждого человека, вероятно, феномен ИПРК воспроизводится. В противном случае врачи не наблюдали бы больных с множественными эпизодами стенокардии в течение сут.
Феномен разминки. Доказательством существования прекондиционирования является тот факт, что у больных со стенокардией напряжения при повторных нагрузочных пробах часто развивается феномен разминки или разогревания (warm-up), т. е. повышение порога переносимости физической нагрузки при повторной нагрузке через несколько минут (например, через 10 мин) после положительной пробы с первой ФН [21-24]. Это, по-видимому, обусловлено увеличением коронарного кровотока вследствие изменения просвета коронарного сосуда в месте критического стеноза и/или расширения (активации) коронарных коллатералей [25], а также, возможно, снижением потребности миокарда в кислороде вследствие уменьшения сократимости миокарда, тренирующим эффектом ФН и ИПРК при повторной ФН [26]. Феномен "разминки" отмечается в случаях, когда пациент прекращает нагрузку в связи с приступом стенокардии, но затем, когда он вновь испытывает ФН, приступ больше не развивается. Нередко это наблюдается ранним утром во время подъема больного с постели, а затем, в течение дня, самочувствие его улучшается.
Встречаются и другие термины, например "first-hob angina" (первично спрятанная стенокардия), "first-effort" (стенокардия первичного напряжения), когда после кратковременного отдыха и стихания приступа стенокардии можно продолжить ФН, при этом симптомы либо отсутствуют, либо являются минимальными. Феномен "разминки" иногда описывают как проявление коронарной вазодилатации, возможно связанной с сопутствующим открытием коллатералей, поддерживающих ишемизированный миокард [25]. "Разминка" представляет собой феномен адаптации, что подтверждается инвазивными исследованиями, которые показывают, что первый эпизод стенокардии создает условия для резистентности к последующей ишемии [27]. Это резистентность выражается в менее тяжелых клинических проявлениях или в меньших изменениях сегмента ST, уменьшении продукции лактата миокардом и снижении потребления кислорода с соответственно более низким "двойным произведением" (ДП) при второй нагрузке по сравнению с первой [19,20,28].
В исследовании [29] у 12 больных ИБС (средний возраст 51,7±2,5 года) со стенокардией напряжения II-III функционального класса (ФК) по классификации Канадской ассоциации кардиологов оценивалось влияние дипиридамола на феномен ИПРК миокарда. Парные велоэргометрические (ВЭМ) пробы (1-я и 2-я) проводились с 15-минутным интервалом между ними. Через 72 ч парные ВЭМ-пробы (3-я и 4-я) выполнялись по тому же протоколу, но через 60 мин после приема внутрь дипиридамола в дозе 75 мг. До и после приема дипиридамола отмечались достоверные изменения показателей, характеризующие повышение ишемического порога при проведении повторной пробы. Это проявилось увеличением продолжительности нагрузки, максимальной частоты сердечных сокращений (ЧСС), ДП - ЧСС • систолическое артериальное давление (САД), уменьшением максимальной депрессии сегмента ST и количества отведений электрокардиограммы (ЭКГ) с депрессией сегмента ST >1 мм, что характеризовало наличие феномена ИПРК при проведении первой и второй пары нагрузочных проб. Однако дополнительный прием дипиридамола увеличивал мощность выполненной нагрузки с 82,4±10,5 до 96,4±10,1 Вт (р=0,033) и прироста продолжительности нагрузки с 34±15 до 81±17 с (р=0,034), уменьшение времени восстановления сегмента ST до исходного уровня с 367±45 до 254±30 с (р=0,032). При проведении 4-й пробы по сравнению со 2-й было зарегистрировано достоверно меньшее количество отведений ЭКГ, в которых уровень депрессии сегмента ST>1 мм (2,6±0,4 и 3,4±0,5; р=0,045). Полученные результаты свидетельствуют о повышении толерантности миокарда к ишемии при повторных ВЭМ-пробах, проведенных на фоне приема дипиридамола, и характеризуют потенцирующее влияние этого препарата на феномен ИПРК у обследованных больных ИБС. Этот эффект может быть обусловлен увеличением эндогенного накопления аденозина, который способствует активации внутриклеточных механизмов развития феномена фармакологического ИПРК у больных ИБС [30-32].
Рис. 1 Схематическое представление разных форм кондиционирования миокарда механическими и фармакологическими средствами.
В другом исследовании тех же авторов [33] изучалось влияние нитроглицерина (Нг) на феномен ИПРК у 20 больных ИБС со стабильной стенокардией II-III ФК при проведении парных нагрузочных проб на тредмиле. При сублингвальном приеме Нг отмечались достоверные изменения параметров, что характеризовалось повышением толерантности миокарда к ишемии. Однако лишь исходно, на чистом фоне, при проведении второй нагрузочной пробы на тредмиле по сравнению с первой обнаружены: достоверное увеличение ДП и числа метаболических единиц (МЕ), достоверное уменьшение максимальной депрессии сегмента ST и времени восстановления до исходного уровня. Отмечалась также тенденция к увеличению продолжительности нагрузки и времени достижения максимальной депрессии сегмента ST. Это характеризовало наличие феномена ИПРК у обследованных больных. При сравнении тех же показателей парного нагрузочного теста на фоне приема нитроглицерина (параметры 3-го и 4-го тестов) достоверные различия отсутствовали. Таким образом, Нг оказывает положительное влияние на выраженность и переносимость ишемии миокарда у больных ИБС, однако его прием может негативно влиять на феномен ИПРК при проведении парных тредмил-тестов. По мнению авторов, упраздняя феномен ИПРК, прием Нг, может способствовать снижению уровня естественной адаптации миокарда к ишемии, что заставляет более сдержанно относиться к рекомендациям в отношении профилактического сублингвального приема препарата непосредственно перед ФН. Однако "пожалев" нереализованный феномен ИПРК, авторы тем самым обрекают больных стенокардией, не принявших вовремя Нг, на заведомое получение серьезных осложнений.
У больных с острым ИМ (ОИМ), имевших предшествующий приступ стенокардии напряжения, по сравнению с такими же больными с ОИМ без предшествующего приступа стенокардии напряжения отмечались лучшие исходы заболевания во время пребывания в больнице и меньшие размеры ИМ, оцениваемые по активности МВ-фракции креатинфосфокиназы. Очевидно, что при этом возникает быстрая метаболическая адаптация миокарда, улучшающая переносимость последующих эпизодов ишемии в течение 1-2 ч., т. е. процесс весьма напоминающий классическое ИПРК [34-37].
В работе [38] разработан метод растознавания синдрома прекондиционирования при помощи суточного мониторирования (СМ) ЭКГ и выявления двух ишемических эпизодов, разделенных интервалом не более 60 мин. Однако процедура выявления довольно трудоемка и не всегда спонтанные эпизоды укладываются в заданный интервал времени [39,40].
Клинически показано, что предшествующие развитию ИМ приступы стенокардии (прединфарктная стенокардия) могут оказать протективное действие на миокард, если они возникают в течение 24-48 ч перед ОИМ, что весьма напоминает кардио-протективный эффект отдаленного ИПРК в экспериментах на животных. Кардиопротективная роль прединфарктной стенокардии, помимо миокардиального ИПРК, может объясняться и рядом других механизмов, в частности раскрытием коллатералей для циркуляции в них крови и повышенной чувствительностью к тромболизису.
Известно также, что больные с предшествующей стенокардией напряжения в анамнезе могут лучше переносить ОИМ, чем больные, не имевшие ранее приступов стенокардии: у первых развивается ИМ меньшего размера, менее выражено повышение активности маркерных ферментов во время ОИМ, лучше сохраняется функциональное состояние миокарда после ИМ, реже развивается тяжелая СН и угрожающие для жизни аритмии в связи с реперфузией миокарда, ниже смертность от сердечно-сосудистых причин в период пребывания больных в стационаре и через 1-5 лет после выписки из него [41].
Таким образом, ИПРК способно вызвать уменьшение размера ОИМ, улучшать восстановление сократимости сохраненных участков миокарда в ближайшие минуты-часы после прекращения его длительной ишемии, уменьшать частоту развития аритмий, вызываемых ишемией или реперфузией [42], снизить выраженность апоптоза в миокарде (в эксперименте), поддержать коронарный резерв, ослабить образование тромбоцитарных тромбов (в эксперименте).
Хорошо известные феномены прохождения через боль и стартовой стенокардии, нередко наблюдаемые в рамках клинической картины хронической формы ИБС, тоже по своей сути являются ИПРК миокарда [12,43, 44].
Полученные разными авторами результаты свидетельствуют об отсутствии положительной динамики при повторном тестировании у больных с тяжелой патологией сердечно-сосудистой системы (ССС). Подчеркивается, что эффект ИПРК не проявляется и у пациентов >70 лет [40] в связи с истощением адаптационных процессов.
Таким образом, эффект ИПРК прослеживается и на уровне коронарного кровообращения, на сократительной функции миокарда, а также на динамике вариабельности сердечного ритма, что свидетельствует о нейрогуморальных влияниях [45]. У пациентов, подвергающихся электростимуляции предсердий и коронарной ангиопластике (КАП), как правило, электрокардиографическое и функциональные ответы на второй пейсинговой тест или повторное раздувание баллончика более сглажены, что указывает на меньшую ишемическую реакцию[46].
Окна защиты прекондиционированием миокарда. Следует заметить, что стандартное ИПРК (в виде одного или более коротких эпизодов нефатальной миокардиальной ишемии и реперфузии) обнаруживает бифазный характер кардиопротекции [47]. Первая фаза проявляется почти сразу же вслед за ИПРК и продолжается 1-2 ч, после которых ее эффект снижается (это называют классическим или ранним ИПРК). Вторая фаза кардиопротекции появляется на 12-24 ч позже и продолжается 48-72 ч (ее называют "второе окно защиты" /the second window of protection, SWOP/ и задержанное или позднее ИПРК). Эффекты задержанного ИПРК проявляются вполне заметно, но они не столь велики как при классическом ИПРК (рисунок 1). Несмотря на некоторое сходство механизмов раннего и позднего ИПРК, одно из основных различий между ними связано с необходимостью для последнего осуществления белкового синтеза (de novo) дистальных медиаторов как iN0S (индуцибельная NO-синтаза) и C0X-2 (циклооксигеназа-2), опосредующих кардиопротективный эффект на 24 ч позже проведения ИПРК. Трудность предсказания наступления губительной миокардиальной ишемии сокращает клиническое использование раннего и позднего ИПРК. Контролирование тяжелой ишемии ограничивается случаями планируемого наступления острого миокардиального ишемическо-реперфузионного поражения, как аортокоронарное шунтирование (АКШ), трансплантация сердца и КАП [47].
Согласно гипотезе о роли N0 в развитии отдаленного (позднего) ИПРК, в механизмах его развития имеют значение две различные формы NO-синтазы (N0S): зависимая от кальция эндотелиальная (eNOS), которая инициирует ИПРК в первый день, и независимая от кальция стимулированная изоформа NO-синтазы (iNOS), генерирующая N0 для защиты от ишемии во второй день. Такая гипотеза, основанная на ряде экспериментальных данных, патофизиологически объясняет механизм поздней стадии ИПРК и согласуется с клиническим опытом широкого применения нитратов для защиты миокарда от ишемии [48].
Таким образом, если одна или несколько кратковременных адаптирующих окклюзий КА отделены от длительной ишемии более продолжительным сроком (от 12 до 72 ч), защитный эффект вновь начинает проявляться [49]. В реализации механизмов второго окна защиты выделяют триггерный этап, осуществляемый аденозином, свободными радикалами кислорода, и, возможно, эндотелиальной NO-синтазой [13,50]. Далее идет каскад передачи сигнала, реализуемый внутриклеточными киназами, такими как тирозинкиназа, активируемая митогенами протеинкиназы и особенно протеинкиназа С. Механизмы второго окна ИПРК связаны с активацией белкового синтеза или модификацией функциональной активности белков на посттрансляционном уровне. Показано, что второе окно защиты ассоциировано с повышенной активностью миокардиальной супероксиддисмутазы, циклооксигеназы, индуцибельной NO-синтазы, индуцибельного белка теплового шока HSP72 и др. индуцированных стрессом белков с цитопротективными свойствами [8].
Механические и фармакологические средства прекондиционирования миокарда.
Целесообразность использования ИПРК при кардиохирургических операциях была продемонстрирована Yellon D. соавт. [51]. Эти авторы показали, что два 3-минутных пережатия аорты, разделенные 2 мин реперфузии, осуществленные до кардиоплегической остановки миокарда, способствуют лучшему сохранению фонда адениннуклеотидов в ткани левого желудочка по сравнению лежащих в их основе обычной кардиоплегией.
В последствии энергосохраняющие эффекты ИПРК и его способность уменьшать миокардиальный ацидоз при операциях на сердце были подтверждены и другими исследователям [52].
Аденозин вызывает дилатацию КА, ослабляет выраженность коронароспазма и восстанавливает содержание макроэргических фосфатов в КМЦ; аденозин может снижать постнагрузку на миокард и ЧСС, способствует снижению потребности миокарда в кислороде. Препарат обладает антиагрегационными свойствами, улучшает перфузию МЦ русла пораженного миокарда. Внутрикоронарное введение аденозина перед транслюминальной КАП способно повысить толерантность миокарда к последующей ишемии, вызываемой раздуванием баллончика [53,54].
В лечении стабильной стенокардии в последнее время изучаются препараты активаторы калиевых каналов. Никорандил открыватель (активатор) АТФ-зависимых калиевых каналов, обладает выраженным антиангинальным и вазодилатационным эффектами (нитратоподобное венодилатирующее действие), что позволяет применять его в клинике для коррекции ишемизированного миокарда [55]. Препарат оказывает кардиопротективное действие по типу ИПРК. Он снижает тромбообразование в коронарных сосудах, открывает АТФ-зависимые калиевые каналы, полностью воспроизводя защитный эффект ИПРК, подготавливает сердце к ишемии: содействует энергосбережению сердечной мышцы, предотвращает необратимые клеточные изменения в ней. Для профилактики стенокардии никорандил обычно назначают в дозе 20 мг 2 раза в сут. Перекрестная толерантность с нитратами отсутствует. Практически никорандил не влияет действия на ЧСС, систему проведения и сократительную способность миокарда, на липидный обмен и метаболизм глюкозы. Полагают, что помимо антиангинальных свойств, никорандил обладает кардиопротективной активностью. Активаторы калиевых каналов включены Европейским обществом кардиологов в алгоритм медикаментозной терапии стабильной стенокардии.
В плацебо-контролируемое исследование IONA (the Impact Of Nicorandil in Angina) [56], проведенном в Великобритании, были включены 5126 пациентов со стабильной стенокардией и высоким риском неблагоприятных исходов, длительность наблюдения составила в среднем 1,6±0,5 лет. Пациенты были случайным образом разделены на гр., которые получали стандартную терапию ИБС, а в дополнение плацебо или никорандил (10 мг 2 раза в сут. с постепенным повышением дозы до 20 мг 2 раза в сут. через 2 нед.) и наблюдались 12-36 мес. При добавлении никорандила к стандартной ангиангинальной терапии было отмечено значительное снижение у больных стабильной стенокардией риска развития основных сердечно-сосудистых исходов (смерти от сердечно-сосудистых заболеваний, ОИМ и экстренной госпитализации в связи с ухудшением течения стенокардии) на 17-31 %. Однако этот результат был в основном связан со снижением частоты госпитализаций по поводу стенокардии.
Сравнительный анализ никорандила и изосорбида мононитрата выявил приблизительно равную эффективность указанных лекарственных препаратов.
Влияние никорандила на сердечно-сосудистые события и прогноз больных ИБС изучалось в многоцентровом совместном проспективном, наблюдательном исследовании JCAD (Japanese Coronary Artery Disease) [57]. Всего были включены 2 558 больных, средний период наблюдения равнялся 2,7 года. Первичная "конечная точка" наблюдения (смерть от всех причин) была достоверно ниже на 35 % - отношение шансов (ОШ) 0,65 (р=0,008) в гр. никорандила по сравнению с ГК. Отмечено также значимое снижение вторичных "конечных точек" наблюдения, включающих сердечную смерть (56 %), фатальный ИМ (56 %), церебральную или васкулярную смерть (71 %) и застойную СН (33 %) в гр. никорандила, без увеличения числа смертей от других некардиоваскулярных причин. Таким образом, лечение никорандилом снижало число смертей от всех причин и рекомендуется большинству больных ИБС.
Никорандил в 2009г зарегистрирован как анти-ангинальное средство в России, где препарат воспроизведен по оригинальной методике под названием Коронель (ПИК-ФАРМА, Россия). Препарат может использоваться для купирования приступов стабильной стенокардии (сублингвально по 10-20 мг). У больных ИБС со стабильной стенокардией напряжения II-III ФК Коронель в дозе 20 мг 3 раза в сут., открывая АТФ-зависимые калиевые каналы, значимо воспроизводит защитный эффект ИПРК. В результате лечения уменьшается количество приступов стенокардии, снижается выраженность ангинозных болей, повышается толерантность к ФН, улучшается качество жизни пациентов [58]. Антиангинальный и антиишемический эффекты Коронеля можно объяснить наличием активной, мобильной нитратной гр. и остатка амида никотиновой кислоты, которые определяют два механизма спазмолитического эффекта на основании объединения свойств органических нитратов и модуляторов калиевых каналов. Первый механизм обусловлен активацией аденилатциклазы, что приводит к внутриклеточному накоплению гуанидилмонофосфата и, как следствие - к увеличению продукции эндотелий-зависимого фактора релаксации; второй связан с открытием калиевых каналов, усилением проводимости ионов калия, что приводит к гиперполяризации мембран и, соответственно, к расслаблению гладких мышц сосудов. Следствием этого являются периферическая вазодилатация, коронарорасширяющее действие и снижение АД [59,60].
Дистантное прекондиционирование миокарда. Феномен ИПРК описан с помощью суррогатных моделей ишемического/реперфузионного повреждения в случаях предынфарктной стенокардии, феномена разогрева ("warm-up"; повышение ишемического порога при последовательных ФН, если интервал времени между ними короткий - 20-60 мин), а также при выполнении чрескожной КАП. Применение ИПРК с помощью пережатия аорты во время выполнения КШ приводит к уменьшению выраженности повреждения миокарда. Однако такой метод ввиду его инвазивного характера и трудности практической реализации не может широко применяться. Поэтому более приемлемым считается менее инвазивный метод дистантного (отдаленного) ишемического прекондиционирования: при этом осуществление коротких эпизодов ишемии в одной ткани или органе приводят к защите другого органа или ткани, удаленных от места искусственно вызванной ишемии, от повреждающего действия длительной ишемии (рисунок 1) [5]. В экспериментальной модели ишемическо-реперфузионного повреждения у собак были получены данные о том, что за счет коротких эпизодов окклюзии огибающей КА, можно добиться уменьшения размера ОИМ, который развивался в результате острой окклюзии передней нисходящей КА [61]. Появились данные, что короткие эпизоды ишемии миокарда в органах, удаленных от сердца, почках, кишечнике и скелетных мышцах, могут предотвратить развитие ОИМ, что объясняли действием гормональных медиаторов или вовлечением нервных путей регуляции [62]. Были получены данные о том, что применение дистантного прекондиционирования приводит к уменьшению выраженности повреждения миокарда, связанного с выполнением КШ [63-65]. Данных о дистантном ишемическом посткондиционировании миокарда пока не появлялось, а весьма перспективным подходом для клинической практики считается дистантное (отдаленное) кондиционирование и локальное посткондиционирование миокарда [6]. Надежность их применения для обширных гр. пациентов должна быть показана в крупных клинических испытаниях.
Посткондиционирование миокарда. В 2003г Zhao Z. с соавт. [66] продемонстрировали кардио-протективную эффективность нескольких коротких эпизодов ишемии-реперфузии (3-6 коротких эпизодов продолжительностью 10-60 с прерывания реперфузии, во время которых вызывается ишемия миокарда), выполненных в период восстановления коронарного кровотока после состоявшейся длительной ишемии. Предотвращение пережатием КА присущих периоду реперфузии аритмий было показано в исследовании на крысах. Полученный феномен, получивший название упоминавшегося уже ишемического посткондиционирования (рисунок 1), может быть объяснен как простым прерыванием негативных процессов реперфузии короткими эпизодами ишемии, так и включением вышеописанных механизмов ИПРК, объединяемых реперфузией с механизмами ИПСК [8,14,49].
Практически прервать реперфузию после уже состоявшейся длительной ишемии короткими ишемическими эпизодами гораздо проще, чем непосредственно предварить ими возможную, но всегда неожиданную ишемию. В связи с этим возможность применения ИПСК в клинике представляется более реальной и осуществимой, чем использование ИПРК. Первый путь предполагает механическое прерывание раннего реперфузионного периода несколькими эпизодами ишемии и может использоваться в кардиохирургии или при проведении баллонной КАП. Второй путь в перспективе предполагает применение фармакологических агентов, ослабляющих выраженность реперфузионного повреждения так же эффективно, как и ИПРК, и в будущем может стать эффективным дополнением к существующим методам защиты сердца от повреждения [12,50]. Различные молекулярные "события", индуцированные ИПСК, в конечном итоге ослабляют реперфузионное повреждение путем ликвидации опасных последствий реперфузии - образования высоких концентраций активных форм кислорода, внутриклеточного отека и перегрузки клетки кальцием. Кратковременные периоды ишемии и реперфузии способны защищать миокард от необратимых повреждений, вызванных длительным ишемическим и реперфузионным стрессом. ИПСК ограничивает размеры ИМ, улучшает восстановление функции сердца после ишемии, уменьшает возникновение аритмий и сосудистую дисфункцию при реперфузии.
Основные механизмы защиты миокарда с помощью этого феномена связаны с регуляцией скоростей метаболических реакций, использующих АТФ, и поддержкой ионного гомеостаза в ишемизированных КМЦ. Они запускаются с помощью специфических триггеров на рецепторы КМЦ или медиаторы ИПСК, которые активизируют проведение внутриклеточного сигнала [12,67].
Заключение
Таким образом, ИПРК, ИК и ИПСК это благоприятные изменения в миокарде, вызываемые быстрыми адаптивными процессами в нем во время кратковременных эпизодов тяжелой ишемии/реперфузии миокарда, которые уменьшают ишемические изменения последующего, текущего или предыдущего, соответственно, периода тяжелой ишемии/реперфузии. Короткие повторные эпизоды региональной ишемии/реперфузии предстают как защитные ("протективные ишемии"), адаптирующие миокард к тяжелой ишемии/реперфузии, и рассматриваются как кардио-протективный механизм в отношении развития фатальной ишемии/реперфузии, включая развитие постишемической сократительной дисфункции, гибели миокардиальных клеток, реперфузионных аритмий, а также нарушений МЦ. Имеются многочисленные подтверждения карди-озащитных эффектов ИПРК, ИК и ИПСК, которые используются в клинических исследованиях: улучшение функции сердца после ишемии, уменьшение возникновения аритмий и сосудистой дисфункции при реперфузии и других состояниях [68-75]. Дистантное (отдаленное) кондиционирование и локальное посткондиционирование миокарда представляются высокими медицинскими технологиями будущего.
Литература - Murry CE, Jenning RD, Reimer KA. Preconditioning with ischemia: a delay of lethal cell injury in ischemic myocardium. Circulation 1986; 74 (5): 1122-36.
- Kloner RA, Jennings RB. Consequences of brief ischemia: stunning, preconditioning, and their clinical implications: Part 1. Circulation 2001; 104 (24): 2981-9.
- Kloner RA, Jennings RB. Consequences of brief ischemia: stunning, preconditioning, and their clinical implications: Part 2. Circulation 2001;104 (25): 3158-67.
- Kloner RA, Yellon D. Does ischemic preconditioning occur in patients? JACC 1994; 24 (4): 1333-42.
- Turer AT, Hill JA. Pathogenesis of myocardial ischemia-reperfusion injury and rationale for therapy. Am J Cardiol 2010; 106: 360-8.
- Kharbanda RK. Cardiac conditioning: a review of evolving strategies to reduce ischemia-reperfusion injury. Heart 2010; 96: 1179-86.
- Hausenloy DJ, Yellon DM. Preconditioningand postconditioning: underlying and clinical application. Atherosclerosis 2009; 204 (2): 334-41.
- Шляхто Е.В., Галагудзе М.М., Нифонтов Е.М., Щербак Н.С. Острое ишемическое повреждение и защита миокарда. В кн." Руководство по атеросклерозу и ишемической болезни сердца (под ред. акад. Е.И. Чазова и др.,) Москва "Медиа Медика" 2007; 552-73.
- Opie LH. Preconditioning and metabolic antiishemic agents. Eur Heart J 2003; 24: 1854-6.
- Петрищев Н.Н., Шляхто Е.В., Цырлин В.А. и др. Роль свободных радикалов кислорода в механизмах локального и дистантного ишемического прекондиционирования миокарда. Вест РАМН 2006; 8: 10-5.
- Hausenloy DJ, Ong SB, Yellon DM. The mitochondrial permeability transition pore as a target for preconditioning and postconditioning. Basic Res Cardiol 2009; 104 (2): 189-202.
- Писаренко О.И. Ишемическое прекондиционирование: от теории к практике. Кардиология 2005; 9: 62-72.
- Бойцов С.А. Патогенез хронической формы ишемической болезни сердца. В кн. "Руководство по атеросклерозу и ишемической болезни сердца'' (под ред. акад. Е.И. Чазова и др,) Москва "Медиа Медика" 2007; 330-48.
- Hausenloy DJ, Yellon DM. Preconditioning and postconditioning: united at reperfusion. Pharmacol. Ther 2007; 116 (2): 173-91.
- Granfeld A, Lefer DJ, Vinten-Johansen J. Protective ischemia in patients: preconditioning and postconditioning. Cadiovasc Res 2009; 83 (2): 234-46.
- Van Vunren D, Lochner A. Ischemic preconditioning: from bench to bedside... Cardiovasc J Afr 2008; 19 (6): 311-20.
- Ferdinandy P, Schulz R, Baxter GF. Interaction of cardiovascular risk factors with myocardial ischemia/reperfusion injury, preconditioning, and postconditioning. Pharmacol Rev 2007; 59 (4): 418-58.
- Hausenloy DJ, Yellon DM. Preconditioning and postconditioning: new strategies for cardioprotection. Diabetes Obes Metab 2008; 10 (6): 451-9.
- Сидоренко Г.И., Гурин А.В. Феномен прерывистой ишемии у человека и его роль в клинических проявлениях ишемической болезни сердца. Кардиология 1997; 10: 4-16.
- Jaffe MD, Quinn NK. Warm-up phenomenon in angina pectoris. Lancet 1980; 2: 934-6.
- Joy M, Cairns AW, Sprigings D. Observations on the warm up phenomenon in angina pectoris. Br Heart J 1987; 58: 116-21.
- Tuomainen P, Vanninen E, Halonen P, et al. Characterization of the warm up phenomenon in patients with coronary artery disease. Am Heart J 2002; 144: 870-6.
- Marber MS, Joy MD, Yellon DM. Is warm-up in angina preconditioning? Br Heart J 1994; 72: 213-5.
- Li JJ, Huang CX, Jiang H, et al. Ischemic preconditioning detected by treadmill exercise tests in patients with stable angina Angiology 2003; 54(1): 45-50.
- Kay IP, Kittelson J, Stewart RA. Collateral recruitment and ''warm-up'' after first exercise in ischemic heart disease. Am Heart J 2000; 140: 121-5.
- Аронов Д.М., Лупанов В.П. Функциональные пробы в кардиологии. М: Медпресс-Информ 2007; 212-3.
- Reimer KA, Murry CE, Jenning RB. Cardiac adaptation to is^emia. Ischemic preconditioning increases myocardial tolerance to subsequent ischemic episodes. Circulation 1990; 82 (6): 2266-8.
- Jenkins DJ, Baxter GF, Yellon DM. The pathophysiology of ischemic preconditioning. Pharmacol Res 1995; 31: 1-6.
- Тодосийчук В.В,. Кузнецов В.А. Влияние дипиридамола на феномен ишемического прекондиционирования у больных ишемической болезнью сердца при проведении парных велоэргометрий. Кардиология 2005; 9: 23-5.
- Crea F, Pupita G, Galassi AR, et al. Role of adenosine in pathogenesis of anginal pain. Circulation 1990; 81: 164-72.
- Mullane K. Myocardial preconditioning. Part of the adenosine revival. Circulation 1992; 85: 845-7.
- Baxter GF. Role of adenosine in delayed preconditioning of myocardium. Cardiovasc Res 2002; 55 (3): 483-94.
- Кузнецов В.А. Тодосийчук В.В. Действие нитроглицерина на феномен ишемической предпосылки у больных ишемической болезнью сердца при проведении парных нагрузочных тестов. Кардиология 2001; 4: 27-9.
- Иванов А.П., Горностаева Т.С., Эльгардт И.А. Роль предшествующей инфаркту миокарда стенокардии и феномена ишемического прекондиционирования в сохранности коронарного резерва в раннем постинфарктном периоде. Кардиоваск тер профил 2006; 5(1): 71-5.
- Коган-Пономарев М.Я., Самко А.Н., Ходеева Г.В. Влияет ли предшествующая инфаркту миокарда стенокардия на его размер, лечение и прогноз? Клинические аспекты феномена адаптации к ишемии. Кардиология 1998; 9: 60-4.
- Хаткевич А.Н., Дворянцев С.Н., Капелько В.И., Руугу К.Э. Защитный эффект ишемической предпосылки (прекондиционирования): влияние длительности ишемии. Кардиология 1998; 5: 4-8.
- Downey JM, Cohen MV. Reducing infarct size in the setting of acute myocardial infarction. Prog Cardiovasc Dis 2006; 48: 363.
- Кузнецов В.А., Тодосийчук В.В. Оценка феномена адаптации к ишемии методом суточного мониторирования ЭКГ. Кардиология 1998; 9: 4-6.
- Сидоренко Г.И., Комисарова С.М., Островский Ю.П. Вопросы адаптации в клинической кардиологии (количественная оценка резервов адаптации по данным прекондиционирования). Кардиология 2006; 3: 19-24.
- Napoli C, Liquuori A, Cacciatore F, et al. Warm-up phenomenon detected be electrocardiographic ambulatory monitoring in adult and older patients. J Am Geriat Soc 1999; 47 (9): 1114-7.
- Ottani F, Galvani M, Ferrini D, et al. Prodromal angina limits infarcts size. A role for ischemic preconditioning. Circulation 1995; 91: 291-7.
- Evrengul H, Seleci D, Tanriverdi H, Kaftan A. The antiarrhythmic effect and clinical consequences of ischemic preconditioning. Coron Artery Dis 2006; 17(3): 283-8.
- Шевченко О.П., Мишнев О.Д. и др. Ишемическая болезнь сердца, Москва 2005, Изд-во Реафарм; 416 с.
- Maybaum S, Ilan M, Mogilevsky J, Tzivoni D. Improvement in ischemic parameters during repeated exercise testing; a possible model for myocardial precondidioning. Am J Cardiol 1996; 78: 1087-91.
- Okishige K, Yamashita K, Yoshinaga H, et al. Electrophysiologic effects of ischemic prconditioning on QT dispersion during coronary angioplasty. JACC 1996; 28(1): 70-3.
- Deutsch E, Berger M, Kussmaul WG, et al. Adaptation to ischemia during percutaneous transluminal coronary angioplasty. Circulation 1990; 82: 2044-51.
- Hausenloy DJ, Yellon DM. The second window of preconditioning (SWOP) where are we now? Cardiovasc Drugs Ther 2010; 24 (3): 235-54.
- Bolli R, Dawm B, Tang XL, et al. The nitric oxide hypothesis of late preconditioning. Basis Res Cardiol 1998; 93(5): 325-38.
- Kloner RA, Rezkalla SH. Preconditioning, postconditioning and their application to clinical cardiology. Cardiovasc Res 2006; 70 (2): 297-307.
- Bolli R. The late phase of preconditioning. Circ Res 2000; 87: 972.
- Yellon DM, Alkhulaifi AM, Pugsley WB. Preconditioning the human myocardium. Lancet 1993; 342: 276-7.
- Alkhulaifi AM, Yellon DM, Pugsley WB. Preconditioning the humaf heart d ring aortocoronary bypass surgery. Eur J Cardiol Thorac Surg 1994; 8: 270-6.
- Leerar MA, Stoddard M, Ahmed M. Preconditioning of human -yocardium with adenosine during angioplasty. Cibculation 1997; 95: 2500-7.
- Heidland UE, Heintzen MP, Michel CJ, Strauer BE. Effect of adjunctive intracoronary adenosine on myocardial ischemia, hemodynanic function and left ventricular performance during percutaneous transluminal coronary angioplasty: clinical access to ischemic preconditioning? Coron Artery Dis 2000; 11(5): 4218.
- Dana A, Yellon DM. ATP dependent K+ channel: a novel therapeutic target in unstable angina. Eur Heart J 1999; 20: 2-5.
- The IONA Study Group. Effect of nicorandil on coronary evefts in p'tients with stable angina: the Impact Of Nicorandil in Angina (IONA) randomised trial. Lancet 2002; 351: 1269-75.
- Horinaka S, Yabe A, Yagi H, et al. Effects of nicorandil on cardiovascular events in patients with coronary artery disease in the Japanese Coronary Artery Disease (JCAD) study. Circ J 2010; 74(3): 503-9.
- Сизова ЖМ., Ших Е.В., Захарова В.Л., Байчоров И.Х. Возможности применения препарата Коронель у больных ишемической болезнью сердца. РМЖ 2009; 17(18): 1194-7.
- Roland E. Safety profile of anti-anginal agent with potassium channel opening activity: an overview. Eur Heart J 1993; 14 (suppl.B): 40-7.
- Taira N. Nicorandil as a hybrid between nitrates and potassium channel activators. Am J Cardiology 1989; 63 (21): 18J-24.
- Przyklenk KP, Bauer B, Olhze M, et al. Regional ischemic ''preconditioning' protects remote virgin myocardium from subseguent susdained coronary occlusion. Circulation 1993; 87(3): 893-9.
- Lym S.Y., Yellon D., Hausenloy D.J. The leural! nd humoral pathways in remote limb ischemic preconditioning. Basic Res Cardiol 2010; 105: 651-4.
- Hausenloy DJ, Mwamure PK, Venugopal V, et al. Effect of remote ischaemic preconditioning on myocardial injury in patients undergoing coronary artery bypass graft surgery: a randomized controlled trial. Lancet 2007; 370: 575-9.
- Venugopal V, Hausenloy DJ, Ludman A, et al. Remote ischaemic preconditioning reduces myocardial injury in patients undergoing cardiac surgery with cold-blood cardioplegia: a randomized controlled trial. Heart 2009; 95: 1567-71.
- Thielmann M, Kottenberg E, Boengler K, et al. Remote ischemic preconditioning reduces myocardial injury after coronary artery bypass surgery with crystalloid cardioplegic arrest. Basic Res Cardiol 2010; 105: 657-64.
- Zhao ZQ, Corvera JS, Halkos ME, et al. Inhibition ofmyocardial injury by ischemic postconditioning during reperfusion: comparison with ischemic preconditioning. Am J Physiol Heart Circ Physiol 2003; 2: H579-88.
- Лишманов Ю.Б., Маслов Л.Н. Ишемическое посткондиционирование сердца. Рецепторные механизмы и возможности клинического применения. Кардиология 2010; 6: 68-74.
- Метелица В.И. Справочник по клинической фармакологии сердечно-сосудистых лекарственных средств. Москва "ООО Мед информ агент" 2005; 1528 с.
- Milli M, Marchi F. The phenomenon of ischemic preconditioning. G Ital Cardiol 1994; 24 (4): 445-50.
- Schwarz ER, Reffelmann T, Kloner RA. Clinical effects of ischemic preconditioning. Curr Opin Cardiol 1999; 14(4): 3408.
- Rezkalla SH, Kloner RA. Preconditioning in humans. Heart Fail Rev 2007; 12(3-4): 201-6.
- Niccoli G, Altamura L, Farbetti A, et al. Ethanol abolishes ischemic preconditioning in humans. JACC 2008; 51(3): 271-5.
- Шляхто Е.В., Галагудза М.М., Сыренский А.В., Нифонтов Е.М. Кардиопротективные эффекты феномена ишемического посткондиционирования миокарда. Кардиология 2005; 7: 44-8.
- Науменко С.Е., Латышева Т.В.. Гилинский М.А. Ишемическое прекондиционирование и метаболизм норадреналина миокарда. Кардиология 2010; 6: 48-52.
- Dvir D, Battler A. Conventional and novel drug therapeutics to relief myocardial ischemia. Cardiovasc Drugs Ther 2010: 24(4): 319-23.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)