Инфузионная терапия у больных желчнокаменной болезнью, осложненной механической желтухой
Статьи
Опубликовано в журнале:
«ХИРУРГИЯ» 2010, №12, с. 82-86
Д.м.н. А.Ю. ЯКОВЛЕВ1, В.Б. СЕМЕНОВ2, к.м.н. Р.М. ЗАЙЦЕВ3, Н.Г. СМИРНОВА4, к.м.н. Н.В. ЕМЕЛЬЯНОВ5, А.Г. ЗАХАРОВ6, к.м.н. С.В. АКУЛЕНКО7, к.м.н. Н.В. ЗАРЕЧНОВА8
Infusion therapy in patients with cholelithiasis complicated by obstructive jaundice
А.Yu. YAKOVLEV, V.B. SEMENOV, R.М. ZAITSEV, N.G. SMIRNOVA, N.V. EMELYANOV, А.G. ZAKHAROV, S.V. AKULENKO, N.V. ZARECHNOVA
Нижегородская областная клиническая больница им. Н.А. Семашко, 4отдел клинических исследований ООО «НТФФ «ПОЛИСАН»
Ключевые слова: метаболические нарушения, механическая желтуха, гепатопротекция, ремаксол. Key words: obstucive joundice, choletithiasis.
Введение
Желчнокаменной болезнью (ЖКБ) страдает около 10—15% населения развитых стран, и за последние десятилетия численность заболевших удваивается каждое десятилетие [2, 4]. ЖКБ подразумевает не только наличие конкрементов в желчном пузыре и желчевыводящих путях, но и развитие ряда всевозможных осложнений в системе желчевыделения и в органах желудочно-кишечного тракта, анатомически и функционально связанных между собой.
Одним из осложнений ЖКБ является обструктивная механическая желтуха (МЖ), встречающаяся в дооперационном периоде, по данным разных авторов, у 28—40% больных с холедохолитиазом [2, 13] вследствие механической закупорки желчных протоков конкрементами.
Цифры гипербилирубинемии у этих пациентов могут широко колебаться в зависимости от степени обтурации желчевыводящих путей и развития вторичного внутрипеченочного холестаза на фоне длительно существующей или интермиттирующей желтухи. В биохимическом анализе крови повышается уровень конъюгированного билирубина и экскреторных ферментов — щелочной фосфатазы, γ-глютамилтранспептидазы.
При неразрешенном холестазе, когда в процесс вторично вовлекается паренхима печени, повышается уровень неконъюгированного билирубина вследствие нарушения его захвата и связывания гепатоцитами. Также повышается уровень индикаторных ферментов — аспартатаминотрансферазы, аланинаминотрансферазы, возможно повышение уровня амилазы ввиду вовлечения в патологический процесс поджелудочной железы [2, 4, 10, 13].
На фоне нарушенного печеночного энергообмена достаточно быстро присоединяются системные метаболические нарушения, которые в совокупности с прогрессированием эндогенной интоксикации приводят к развитию острой послеоперационной печеночной недостаточности, определяющей исход заболевания. В этих условиях особую актуальность приобретают препараты, оказывающие комплексное детоксицирующее и антигипоксическое действие, к числу которых относят новый инфузионный гепатопротектор ремаксол.
Ремаксол содержит активные метаболические компоненты — янтарную кислоту, рибоксин, никотинамид, метионин, а также электролиты — натрия хлорид, магния хлорид, калия хлорид, сольстабилизирующий агент N-метилглюкамин и является сбалансированным полиионным раствором.
Препарат способствует снижению уровня билирубина и его фракций, улучшает экскрецию прямого билирубина в желчь, снижает активность экскреторных ферментов — щелочной фосфатазы и γ-глютамилтранспептидазы, способствует окислению холестерина в желчные кислоты [8, 9].
Показанием к назначению ремаксола являются нарушения функции печени вследствие острого или хронического ее повреждения (токсические, алкогольные, лекарственные гепатиты).
Цель исследования — изучение эффективности периоперационного применения инфузионного гепатопротектора ремаксола у больных желчнокаменной болезнью, осложненной обтурационной механической желтухой.
Материал и методы
Клиническое проспективное рандомизированное исследование содержит анализ течения периоперационного периода у 60 пациентов с ЖКБ, осложненной МЖ. В зависимости от используемой инфузионной тактики больные были разделены на 2 группы.
В 1-й, основной, группе 26 пациентам в состав инфузионной терапии был включен ремаксол в дозе 800 мл/сут в течение 5 сут до операции и 8 сут послеоперационного периода.
2-ю, контрольную, группу составили 34 пациента, которым проводилась периоперационная инфузионная терапия растворами Рингера и 10% глюкозы в соотношении 1:1. Общий объем инфузий в группах был одинаковым и не превышал 1500 мл/ сут, за исключением дня операции.
Больные были рандомизированы методом «конвертов».
Критериями включения пациентов в исследование были ЖКБ, осложненная МЖ с уровнем билирубинемии при поступлении в интервале от 130 до 300 мкмоль/л.
Критериями исключения являлись перитонит, онкологические и эндокринные заболевания, а также сопутствующие сердечно-сосудистые и бронхолегочные заболевания в стадии декомпенсации на момент включения в исследование.
Всем больным были выполнены однотипные операции по поводу основного заболевания, включающие холецистэктомию, холедохолитотомию, а в 5 наблюдениях — пластику общего желчного протока.
Определение билирубина, лактата, пирувата, церулоплазмина и активности ферментов крови (АСТ, АЛТ, ГГТП, ЩФ и амилаза) проводили с помощью унифицированных методик на биохимическом анализаторе KONE 565 («KONE», Финляндия). Оценку эндотоксикоза осуществляли по методике С.В. Оболенского [7] с расчетом индекса синдрома эндогенной интоксикации (ИСЭИ) как отношения произведения концентрации веществ низкой и средней молекулярной массы (ВНиСММ) плазмы и эритроцитов к ВНиСММ мочи [11]. Интенсивность перекисного окисления липидов (ПОЛ) в сыворотке крови определяли на биохемилюминометре БХЛ-06 (НИЦ «Биоавтоматика», Нижний Новгород) методом индуцированной хемилюминесценции [6]. Первичные молекулярные продукты липопероксидации — диеновые конъюгаты (ДК) определяли УФ-спектрофотометрическим способом на длине волны 232 нм, вторичный продукт ПОЛ — малоновый диальдегид (МДА) — по реакции с тиобарбитуровой кислотой и результатам последующей фотометрии на КФК-3.
Статистическую обработку результатов исследования осуществляли с помощью пакета прикладных программ Microsoft Exсel 2007 и StatSoft Statistica 6.0. Все данные были проверены на нормальность распределения с помощью теста Шапиро—Уилкса. В работе приведены средние значения и их стандартные отклонения. Также в статистическом анализе использовали непараметрические методы сравнения Манна—Уитни, Уилкоксона и Sign-тест.
Результаты и обсуждение
При поступлении у всех пациентов регистрировали выраженные метаболические нарушения: гиперлактатемию, гиперпируватемию, высокие значения индекса лактат/пируват, активность ПОЛ при должных величинах церулоплазмина как одного из основных белков антиоксидантной системы крови (табл. 1). Полученные результаты подтверждают данные литературы о нарушениях метаболизма у больных механической желтухой и служат одним из обоснований дооперационного назначения препаратов-антигипоксантов [12]. Известно, что более половины образующегося в организме лактата метаболизируется в печени, поэтому динамика лактатемии может также рассматриваться как один из важных критериев эффективности применяемой гепатотропной терапии [15, 16, 18, 19]. Отрицательная динамика этого показателя и индекса лактат/пируват связана с неэффективностью проводимого лечения и ассоциируется с повышением риска летального исхода [17].
Таблица 1. Динамика метаболических показателей венозной крови (М±m)
| Группа больных |
Этап исследования |
| при поступлении |
перед операцией |
после операции |
1-е сутки после операции |
3-и сутки после операции |
5-е сутки после операции |
8-е сутки после операции |
| Лактат, ммоль/л |
| 1-я |
3,17±0,06 |
2,48±0,05*# |
2,54±0,05*# |
2,33±0,05*# |
2,08±0,04*# |
1,72±0,03*# |
1,61±0,04*# |
| 2-я |
3,03±0,06 |
2,88±0,05 |
3,16±0,07 |
2,98±0,08 |
2,52±0,07* |
2,14±0,07* |
1,76±0,04* |
| Пируват, мкмоль/л |
| 1-я |
0,173±0,003 |
0,195±0,003*# |
0,188±0,002*# |
0,201±0,003*# |
0,205±0,004*# |
0,184±0,003*# |
0,176±0,003 |
| 2-я |
0,176±0,003 |
0,175±0,003 |
0,178±0,003 |
0,183±0,002 |
0,179±0,003 |
0,172±0,002 |
0,169±0,003 |
| Лактат/пируват, усл.ед. |
| 1-я |
18,31±0,27 |
12,71±0,18*# |
13,52±0,19*# |
11,59±0,15*# |
10,16±0,10*# |
9,36±0,16*# |
9,14±0,12*# |
| 2-я |
17,69±0,29 |
16,42±0,22* |
17,73±0,12 |
16,28±0,23* |
14,09±0,13* |
12,44±0,14* |
10,66±0,19* |
| ДК, ед. опт.пл./ол |
| 1-я |
0,441±0,006 |
0,427±0,006 |
0,458±0,006# |
0,453±0,005# |
0,446±0,006# |
0,425±0,006# |
0,419±0,006*# |
| 2-я |
0,435±0,006 |
0,443±0,006 |
0,507±0,009* |
0,548±0,012* |
0,530±0,009* |
0,503±0,010* |
0,470±0,009* |
| МДА, мкмоль/л |
| 1-я |
5,21±0,09 |
4,91±0,07# |
5,16±0,08# |
5,24±0,09# |
5,09±0,08# |
4,92±0,07# |
4,76±0,06*# |
| 2-я |
5,09±0,07 |
5,16±0,07 |
5,59±0,10* |
6,24±0,12* |
6,33±0,12* |
6,06±0,11* |
5,69±0,09* |
| Церулоплазмин, мг/л |
| 1-я |
271,1±9,8 |
280,2±7,7 |
274,4±10,8# |
267,6±11,0# |
258,5±7,8# |
260,2±7,6# |
261,4±5,9# |
| 2-я |
280,6±7,3 |
273,0±6,6 |
231,4±6,9* |
216,8±5,9* |
203,4±4,9* |
203,7±4,6* |
218,3±4,3* |
Примечание. * — достоверность относительно исходного уровня, р≤0,05; # - достоверность относительно значений во 2-й группе на одинаковых этапах исследования, р≤0,05; ДК — диеновые конъюгаты, МДА — малоновый диальдегид.
Дооперационное введение ремаксола способствовало на этом этапе лечения снижению гиперлактатемии с ростом пируватемии и снижением соотношения лактат/пируват, что явилось подтверждением фармакологической коррекции дисбаланса аэробных/анаэробных процессов энергообразования. Рост пируватемии на фоне снижения уровня лактата венозной крови свидетельствовал о переводе конечных продуктов анаэробного гликолиза в цикл трикарбоновых кислот.
Дооперационное применение ремаксола обеспечило послеоперационную стабилизацию показателей метаболизма и ПОЛ у больных 1-й группы, в то время как у пациентов, не получавших инфузионные антигипоксанты, сразу после операции отмечалась гиперактивация процессов ПОЛ с образованием не только первичных, но и вторичных продуктов липопероксидации и истощением церулоплазминовой антиоксидантной системы крови.
Продолжающаяся после операции антигипоксическая гепатотропная инфузионная терапия обеспечила снижение исходных метаболических нарушений до уровня компенсации у всех пациентов 1-й группы, что дополнительно подчеркивает не только превентивную, но и корригирующую результативность экзогенного введения антигипоксантов в составе проводимой инфузионной терапии.
У всех пациентов при поступлении в стационар, кроме гипербилирубинемии, отмечался подъем уровня индикаторных ферментов —АЛТ, АСТ в 2—3 раза выше нормальных значений, что свидетельствует о паренхиматозном поражении печени.
Исследования билирубинемии и ферментемии не выявили значимых дооперационных преимуществ их коррекции при дополнительном включении в терапию ремаксола (табл. 2). Однако в раннем после операционном периоде определились явные преимущества дооперационного применения инфузионного антигипоксанта. У больных 2-й группы значительно возрастала активность сывороточных ферментов, свидетельствующих о цитолитических процессах в гепатобилиарной зоне, что является значимым риском развития острой послеоперационной печеночной недостаточности. Прогрессирование амилаземии после операции связано с анатомической общностью зоны оперативного вмешательства и поджелудочной железы и было значительно менее выраженным в случае дооперационного применения ремаксола, что можно расценивать как профилактику развития послеоперационного панкреатита, считающегося ординарным осложнением после подобных операций. Высокие темпы купирования ферментемии при послеоперационном продолжении инфузии ремаксола у больных 1-й группы подчеркивают гепатотропность и цитопротекторное действие экзогенно вводимых антигипоксантов, что повлияло на скорость снижения билирубинемии [1, 3, 14]. Регресс лабораторных маркеров холестаза (билирубин, ЩФ, ГГТП) можно связать с ускоренной коррекцией желчной гипертензии на уровне желчных протоков за счет снижения отека гепатоцитов [5].
Таблица 2. Динамика общего билирубина и ферментов венозной крови (М±m)
| Группа больных |
Этап исследования |
| при поступлении |
перед операцией |
после операции |
1-е сутки после операции |
3-и сутки после операции |
5-е сутки после операции |
8-е сутки после операции |
| Билирубин общий, мкмоль/л (N=4—21 мкмоль/л) |
| 1-я |
221,6±10,2 |
153,2±5,0* |
144,8±5,9* |
126,5±6,43* |
98,5±5,6*# |
66,5±3,9*# |
45,9±2,2*# |
| 2-я |
209,9±7,5 |
159,6±4,1* |
157,2±4,7* |
144,5±5,5* |
127,5±5,9* |
102,9±5,8* |
84,3±4,8* |
| АСТ, ед/л (N=0—40 ед/л) |
| 1-я |
133,1±16,2 |
100,5±9,6 |
120,1±8,84# |
109,4±8,9# |
86,8±6,2*# |
70,0±4,4*# |
59,8±3,3*# |
| 2-я |
128,7±8,0 |
101,8±7,9 |
173,7±15,3* |
161,2±11,9* |
153,3±13,8 |
124,9±10,5 |
96,2±7,0* |
| АЛТ, ед/л (N=0—38 ед/л) |
| 1-я |
129,4±9,2 |
112,7±7,5 |
122,5±12,5# |
121,6±10,9# |
108,6±8,7# |
87,2±7,1*# |
66,9±3,7*# |
| 2-я |
116,3±9,9 |
111,3±8,5 |
175,6±14,3* |
174,1±11,7* |
162,2±9,7* |
137,2±9,5 |
110,8±8,2 |
| ЩФ, ед/л (N=60—275 ед/л) |
| 1-я |
402,4±16,1 |
321,1±13,2* |
334,1±11,1*# |
320,3±11,0*# |
284,5±9,32*# |
275,8±8,3*# |
263,2±7,4*# |
| 2-я |
387,1±19,4 |
356,6±13,7 |
426,7±15,0 |
426,1±20,3 |
404,6±19,5 |
343,0±13,1 |
324,8±12,1* |
| ГГТП, ед/л (N=10—50 ед/л) |
| 1-я |
182,2±12,7 |
126,2±7,4* |
138,8±9,0*# |
130,8±7,8*# |
106,9±5,6*# |
87,6±5,3*# |
71,3±2,9*# |
| 2-я |
161,0±7,4 |
135,1±6,1* |
194,6±15,1 |
186,8±11,4 |
177,1±10,7 |
142,6±9,2 |
117,9±6,6* |
| Амилаза, ед/л (N=0—100 ед/л) |
| 1-я |
101,3±9,0 |
77,1±3,4 |
102,4±6,8# |
102,1±7,0# |
86,6±9,8# |
78,3±4,5# |
72,1±3,7*# |
| 2-я |
92,9±5,1 |
79,9±4,2 |
154,8±14,4* |
160,6±12,3* |
164,1±15,0* |
152,1±11,5* |
109,3±7,3 |
Примечание. * — достоверность относительно исходного уровня, р&
#8804;0,05;
# — достоверность относительно значений во 2-й группе на одинаковых этапах исследования, р&
#8804;0,05; АСТ — аспартатаминотрансфераза, АЛТ — аланинаминотрансфераза, ЩФ — щелочная фосфатаза, ГГТП — &
#947;-глютамилтранспептидаза.
При поступлении у больных с МЖ определялась субкомпенсированная степень эндотоксикоза с высоким уровнем ВНиСММ (веществ низкой и средней молекулярной массы) плазмы и эритроцитов и низкой почечной экскрецией эндотоксинов. Особенно высокими были значения ВНиСММ236—256нм, относящиеся к крупномолекулярному катаболическому пулу и отражающие детоксицирующую функцию печени и почек, ответственных за перевод крупных гидрофобных молекул в водорастворимые с последующей их элиминацией почками.
Снижение ИСЭИ до операции и в послеоперационном периоде у больных, получавших ремаксол, позволяет считать применение гепатопротекторных инфузионных препаратов-антигипоксантов перспективным методом интракорпоральной детоксикации не только у больных с МЖ, но и при других критических состояниях, сопровождающихся выраженным эндотоксикозом (см. рисунок). Компенсация эндотоксикоза у данной категории больных снижает риск развития острой послеоперационной печеночной недостаточности и полиорганной дисфункции.
Динамика ИСЭИ у больных исследуемых групп.
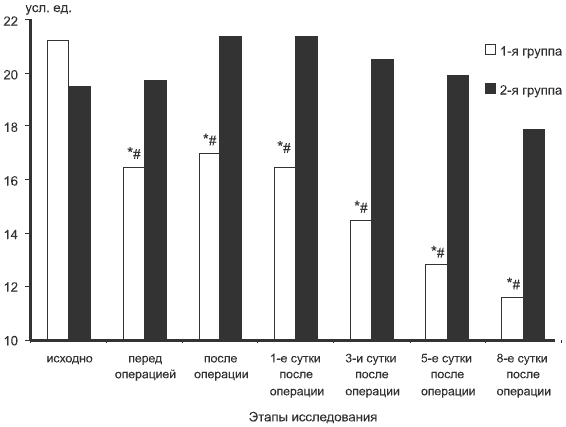
* — достоверность относительно исходного уровня, р≤0,05; # — достоверность относительно значений во 2-й группе на одинаковых этапах исследования, р≤0,05; ИСЭИ — индекс синдрома эндогенной интоксикации.
Таким образом, у больных с желчнокаменной болезнью, осложненной обтурационной механической желтухой, в раннем послеоперационном периоде отмечается декомпенсация исходных метаболических нарушений, эндотоксикоза и прогрессирование цитолитического синдрома печеночной недостаточности.
Введение инфузионного гепатопротектора ремаксола способствует более быстрому купированию метаболических нарушений, гипербилирубинемии, гиперферментенемии и коррекции проявлений эндотоксикоза у больных с обтурационной механической желтухой.
Для предупреждения декомпенсации нарушений гомеостаза и сокращения срока их купирования у больных с механической желтухой в комплекс инфузионной терапии в до- и послеоперационном периоде целесообразно включать инфузионный гепатопротектор ремаксол в дозе 800 мл/сут в течение 5 сут до и 8 сут после операции.
ЛИТЕРАТУРА
1. Афанасьев В.В., Лукьянова И.Ю. Особенности применения цитофлавина в современной клинической практике. Ст-Петербург 2010; 80.
2. Борисов А.Е. Руководство по хирургии печени и желчевыводящих путей. Ст-Петербург: Скифия 2003; 2.
3. Дунаев В.В., Тишкин В.С., Евдокимов Е.И. К механизму действия инозина. Фармакология и токсикология 1989; 52: 56—58.
4. Иванченкова Р.А. Хронические заболевания желчевыводящих путей. М: Атмосфера 2006.
5. Клиническая интерпретация лабораторных исследований. Под ред. проф. А.Б. Белевитина, проф. С.Г. Щербака. Ст-Петербург: ЭЛБИ-СПб 2006; 145.
6. Кузьмина Е.И., Нелюбин А.С., Щенникова М.К. Применение индуцированной хемилюминесценции для оценки свободнорадикальных реакций в биологических субстратах, Межвузовский сборник биохимии и биофизики микроорганизмов. Горький 1983; 179—183.
7. Оболенский С.В., Малахова М.Я., Ершов А.Л. Диагностика стадий эндогенной интоксикации и дифференцированное применение методов эфферентной терапии. Вестн хир 1991; 3: 95—100.
8. Сологуб Т.В., Горячева Л.Г. Гепатопротективная активность ремаксола при хронических поражениях печени. Клин мед 2010; 1: 62—66.
9. Суханов Д.С., Саватеева Т.Н. Антиоксидантная активность ремаксола на модели лекарственного поражения печени. Вестник Санкт-Петербургской государственной академии им. И.И. Мечникова 2008; 4: 127—131.
10. Шерлок Ш., Дули Дж. Заболевания печени и желчевыводящих путей. М: ГЭОТАР 1999.
11. Шукевич Л.Е., Шукевич Д.Л., Григорьев Е.В. Новый подход к диагностике синдрома эндогенной интоксикации при абдоминальном сепсисе. Материалы 4-й междунар. конф. «Актуальные аспекты экстракорпорального очищения крови в интенсивной терапии». М 2004; 94—95.
12. Яковлев А.Ю., Бояринов Г.А., Фошина С.Б. и др. Периоперационная коррекция гомеостаза у больных с механической желтухой. Общая реаниматология 2008; 4—2: 58—61.
13. 50 лекций по хирургии. Под ред. В.С. Савельева. М: Медиа Медика 2003.
14. Alberti K.G.M.M. Biochemical consequenses of hypoxia. J Clin Path 1977; 3: 11.
15. Buchalter S.E., Crain M.R., Kreisberg R. Regulation of lactate metabolism in vivo. Diabetes Metab Rev 1989; 5: 379—391.
16. Cohen R.D., Simpson R., Phil D. Lactate metabolism. Anesthesiology 1975; 43: 661—673.
17. De Jonghe B., Cheval C., Misset B. еt al. Relationship between blood lactate and early hepatic dysfunction in acute circulatory failure. J Crit Care 1999; 14: 7—11.
18. Johnson V., Bielanski E., Eiseman B. Lactate metabolism during marginal liver perfusion. Arch Surg 1969; 99: 75—79.
19. Kreisberg R.A. Pathogenesis and management of lactic acidosis. Ann Rev Med 1984; 35: 181—193.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 www.polysan.ru
www.polysan.ru

