Стандартизация тактики интенсивной терапии при острой печеночной недостаточности у пациентов с циррозом печени после портосистемного шунтирования
Статьи
Р.А. Ибадов1, А.Х. Бабаджанов1, С.Х. Ирматов1*, Н.Р. Гизатулина1, С.Х. Ибрагимов1, С.А. Рузибоев2
1Республиканский специализированный научно-практический медицинский центр хирургии им. акад. В.В. Вахидова, Ташкент, Узбекистан; 2Самаркандский государственный медицинский институт, Самарканд, Узбекистан
Цель исследования — анализ эффективности алгоритма интенсивной терапии острой печеночной недостаточности у пациентов с циррозом печени после портосистемного шунтирования, разработанного в Республиканском специализированном научно-практическом медицинском центре хирургии им. акад. В.В. Вахидова на основании собственного опыта и с учетом рекомендаций ведущих мировых гепатологических школ.
Материал и методы. Проанализированы результаты портосистемного шунтирования у 556 пациентов с циррозом печени и острой печеночной недостаточностью. Эффективность лечения оценена по наличию и выраженности послеоперационных осложнений, таких как печеночная недостаточность и печеночная энцефалопатия.
Результаты. Исходная декомпенсация цирроза печени по отечно-асцитическому синдрому достоверно повышает риск развития постоперационных осложнений портосистемного шунтирования — печеночной недостаточности (13,5% против 6,9% у пациентов без асцита; р≥0,05) и печеночной энцефалопатии (64,9% против 51,7%; р≥0,05). Летальность составила 3,8% (10 больных) в группе пациентов с предоперационным асцитическим синдромом и 2,3% (6) в группе без признаков асцита. Основной причиной ранней послеоперационной летальности стало развитие тромбоза анастомоза с рецидивом кровотечения из варикозно-расширенных вен пищевода и желудка. Для снижения рисков развития постоперационных осложнений и летальности разработан лечебно-тактический алгоритм, эффективный при сочетанном применении комплекса консервативных и биофизических методов лечения и направленный на устранение «разрешающих факторов» их развития. Одной из важных составляющих данного алгоритма является фармакотерапия с гепатопротективными препаратами у пациентов с циррозом печени для поддержания функционального состояния печени в постоперационный период.
Заключение. Антигипоксические, детоксицирующие и антиоксидантные свойства активных компонентов ремаксола и положительный опыт применения его у пациентов (снижение уровня билирубина, увеличение альбуминовой фракции общего белка крови и снижение активности АлАТ и АсАТ в 2 раза) позволяют рекомендовать препарат к включению в стандарт постоперационной патогенетической терапии у этой категории пациентов.
Ключевые слова: печеночная недостаточность, цирроз печени, портальная гипертензия, асцит, ремаксол.
Standardization of intensive therapy tactics for acute hepatic insufficiency in patients with liver cirrhosis after portosystem shunting
R.A. Ibadov, A.KH. Babadzhanov, S.KH. Irmatov, N.R. Gizatulina, S.KN. Ibragimov, S.A. Ruziboev
Repulican specialized scientific and practical medical center of surgery named after academician V. Vakhidov 700115, Tashkent, ul. Farhad 10, Uzbekistan; Samarkand State Medical Institute, Samarkand, ul. Amir Temur, 18, Uzbekistan
Aim. Here we analyze efficiency of the algorithm for intensive therapy of acute hepatic insufficiency in patients with cirrhosis after portosystemic shunting, based on the experience of the Republican Specialized Scientific and Practical Medical Center of Surgery named after academician V.V. Vakhidov and considering recommendations of the world's leading hepatology schools.
Materials and methods. Algorithm efficiency was analyzed based on the results of portosystemic shunting of 556 patients with cirrhosis and acute liver insufficiency. Treatment effectiveness was assessed by presence and severity of postoperative complications, such as hepatic insufficiency and hepatic encephalopathy.
Initial decompensation of liver cirrhosis significantly increases the risk of postoperative complications of portosystemic shunting due to edematous ascites syndrome — liver insufficiency (13.5% vs 6.9% in patients without ascites p≥0.05) and hepatic encephalopathy (64.9% vs. 51,7%, respectively, p≥0.05). In group of patients with preoperative ascites syndrome mortality rate was 3.8% (10 patients) and in the group without ascites — 2.3% (6 patients). The main cause of early postoperative lethality was anastomotic thrombosis development with recurrence of bleeding from esophagus and stomach varicose veins. To reduce the risk of postoperative complications and lethality, a therapeutic-tactical algorithm was developed which was effective in combination with a complex of conservative and biophysical methods of treatment and aimed at eliminating the «resolving factors» of their development
Results. One of the most important components of this algorithm is pharmacotherapy with hepatoprotective drugs use in patients with liver cirrhosis in the postoperative period to maintain liver functional state. Considering the antihypoxic, detoxifying and antioxidant properties of active components of remaxol and revealed positive effect of its use in patients (decrease in bilirubin level, increase in albumin fraction of total blood protein and decrease in activity of ALAT and ASAT in 2 times), this drug can be recommended for inclusion in the postoperative pathogenetic standard therapy in this category of patients.
Keywords: hepatic insufficiency, cirrhosis, portal hypertension, ascites, remaxol.
Введение
Постоянное пополнение информации об этиологии и патогенезе заболеваний печени требует систематизации и выработки общих подходов к их диагностике и лечению, что находит отражение в работе всемирных форумов, рабочих групп и согласительных комиссий. Наметившийся прогресс в диагностике и лечении заболеваний печени связан с развитием молекулярно-биологических методов диагностики, позволивших расшифровать структуру и уточнить варианты новых и давно известных гепатотропных вирусов, с использованием фармакологических препаратов, тормозящих развитие фиброза в печени, а также со значительными успехами в области хирургии портальной гипертензии, что стало возможным благодаря активному использованию различных вариантов портосистемного шунтирования (ПСШ) и TIPS, эндоваскулярной и эндоскопической хирургии при варикозно-расширенных венах пищевода и желудка (ВРВПЖ) и особенно при пересадке печени [1—5].
В то же время серьезным препятствием для широкого внедрения хирургического лечения больных циррозом печени (ЦП) являются высокая вероятность развития острой печеночной недостаточности (ОПН), прогрессирование активности цирротического процесса, гепатогенная и постшунтовая энцефалопатия, исходная гипоксия гепатоцитов, что нередко связано с недооценкой дооперационной активности цирротического процесса и его усугубление в раннем послеоперационном периоде [6—9].
По данным ряда авторов [10], развитие осложнений в послеоперационном периоде и их тяжесть во многом зависят от активности систем адаптогенеза пациента к операционно-анестезиологическому стрессу. Расстройства этих систем могут быть следствием воздействия различных эндогенных и экзогенных факторов, а также ответных биологических реакций организма [11]. Однако в ряде случаев эти взаимоотношения изучаются вне их патогенетической связи и взаимообусловленности, что зачастую и предопределяет неудовлетворительные результаты у этой группы больных.
В связи с этим в данной статье приведен анализ эффективности алгоритма интенсивной терапии ОПН у пациентов с ЦП после ПСШ, разработанного в Республиканском специализированном научно-практическом медицинском центре хирургии им. акад. В.В. Вахидова на основании собственного опыта и с учетом рекомендаций ведущих мировых гепатологических школ.
Материал и методы
Проанализированы результаты комплексной терапии 556 пациентов с ЦП и ОПН, лечившихся в Республиканском специализированном научно-практическом медицинском центре хирургии им. акад. В.В. Вахидова в 2000—2015 гг. ПСШ у 238 (42,8%) пациентов было произведено центральным (различные варианты), а у 318 (57,2%) — селективным (ДСРА) методом. По наличию/отсутствию асцитического синдрома в предоперационном периоде пациенты были разделены на две группы: в 1-ю (без признаков асцита) вошли 290 (52,1%) пациентов, во 2-ю (с асцитом) — 266 (47,9%), из них у 217 (39%) диагностирован умеренно-выраженный, а у 49 (8,9%) — выраженный асцит.
Эффективность лечения оценивали по наличию и выраженности постоперационных осложнений, таких как печеночная недостаточность (ПН) и печеночная энцефалопатия (ПЭ). Состояние пациентов в динамике оценивали по классификации Child— Pugh (A. Pugh, 1973), шкале Глазго, шоковый индекс — по методу Альговера, шкале APACHE-II (Acute Physiology and Chronic Health Evaluation II), степень активности кровотечения классифицировали по эндоскопическим признакам (Forrest, 1974). Для диагностики латентной формы ПЭ использовали аппарат HEPAtonormTM — Analyze («MERZ», Германия). Критерием оценки тяжести ПЭ на этапах ПСШ служила критическая частота мерцания, определенная с помощью этого аппарата. Отдельно регистрировали клиническую форму ПЭ.
Статистическую оценку значимости различий проводили непараметрическими методами: между независимыми группами с помощью U-критерия Манна—Уитни, между зависимыми (до и после лечения внутри одной группы) — с помощью критерия Вилкоксона. Статистические гипотезы проверяли при критическом уровне значимости p=0,05, т.е. различие считалось статистически значимым при p<0,05.
Результаты и обсуждение
Развитие в постоперационном периоде ПН было отмечено у 56 (10,1%) пациентов: из них 20 (6,9%) больных относились к 1-й группе (без признаков асцита), 36 (13,5%) — ко 2-й группе (с предоперационным асцитом) (табл. 1).
Таблица 1.
Частота и выраженность постоперационной печеночной недостаточности у пациентов после портосистемного шунтирования
|
Группа
|
Печеночная недостаточность (n=56) умеренная (n=37) тяжелая (n=19)
|
Критерий х2 по выраженности асцита (df=2)
|
|
1-я (n=290)
|
14 (4,8%)
|
6 (2,1%)
|
6,945, р<0,05
|
|
2-я (n=266) умеренный асцит (n=217)
выраженный асцит (n=49)
|
17 (7,8%)
6 (12,2%)
|
10 (4,6%)
3 (6,1%)
|
2,444, р>0,05
4,085, р>0,05
|
Выявлено, что чаще осложнения развиваются при более тяжелом предоперационном асците: у 27 (12,4%) пациентов с умеренным асцитом против 9 (18,4%) пациентов с выраженным асцитом (р>0,05) (табл. 2).
Таблица 2.
Частота развития постоперационной печеночной энцефалопатии у пациентов после портосистемного шунтирования
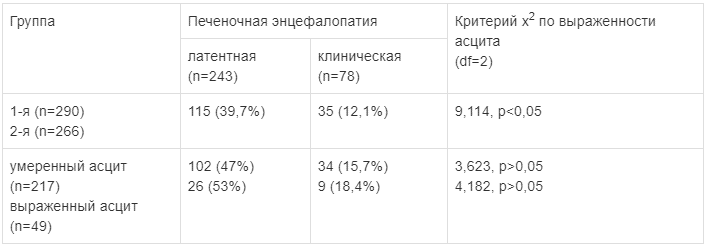
Признаки постоперационной ПЭ были зарегистрированы у 321 (57,7%) пациента, в том числе у 150 (51,7%) пациентов 1-й группы и у 171 (64,3%) — 2-й. Отмечена связь межу выраженностью асцита в предоперационном периоде и развитием ПЭ в постоперационном периоде: осложнения развились у 136 (62,6%) пациентов с умеренно выраженным и у 35 (71,4%) больных с выраженным асцитом. Латентная форма выявлена у 243 (75,7%) больных.
Анализ зависимости развития послеоперационных осложнений ПСШ у пациентов с ЦП и ОПН от наличия и выраженности предоперационного асцита выявил, что ПН регистрировалась у 18,3% пациентов с выраженным предоперационным асцитом, в то время как ПЭ — у 71,4% больных. В то же время у пациентов без признаков асцита в предоперационном периоде эти показатели составили 6,9 и 51,7% соответственно (р≤0,05).
В группе пациентов с предоперационным асцитическим синдромом умерли 10 (3,8%) пациентов, в группе без признаков асцита — 6 (2,3%) больных. Основной причиной ранней послеоперационной летальности стало развитие тромбоза анастомоза с рецидивом кровотечения из ВРВПЖ.
Таким образом, необходимость разработки алгоритма интенсивной терапии после ПСШ у пациентов с ЦП продиктована вероятностью развития осложнений и зависимостью их тяжести от наличия отягощенного предоперационного фона (асцита различной степени выраженности).
Применение лечебно-тактического алгоритма (рис. 1), разработанного авторами, позволяет уменьшить/решить ряд проблем.
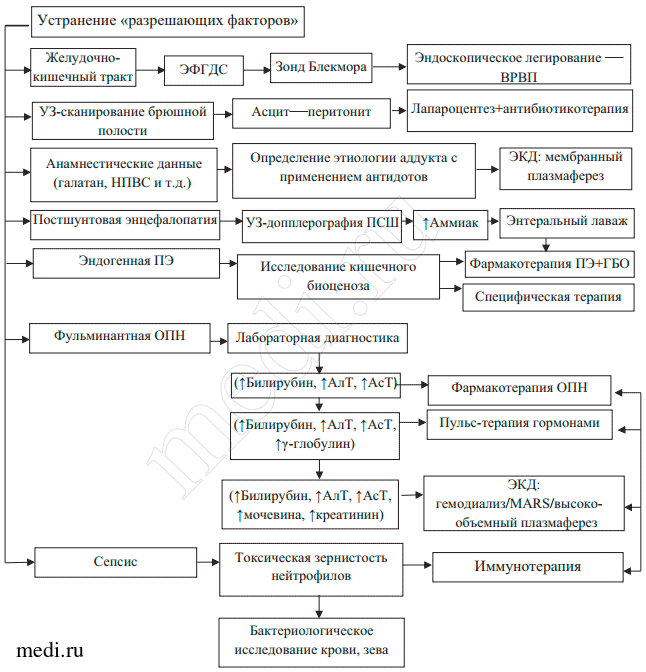 Рис. 1. Лечебно-тактический алгоритм при печеночной недостаточности.
Рис. 1. Лечебно-тактический алгоритм при печеночной недостаточности.
ЭФГДС — эзофагогастродуоденоскопия; ВРВП — варикозное расширение вен пищевода; ЭКД — экстракорпоральная детоксикация; ПСШ — портосистемное шунтирование; ПЭ — печеночная энцефалопатия; ГБО — гипербарическая оксигенация.
1. Лечение синдромов холестаза и цитолиза. Мы разделяем точку зрения большинства клиницистов, согласно которой традиционная фармакотерапия не является эффективной и должна быть дополнена одним из методов эфферентной терапии. Тем не менее рациональная фармакотерапия ПН зачастую может быть основным и единственным способом лечения, особенно в отсутствие оборудования для проведения высокоэффективной эфферентной терапии. По нашим наблюдениям, пульс-терапия стероидными гормонами эффективна только при выраженном аутоиммунном компоненте.
2. Коррекция гипогликемического синдрома (при поступлении больного обязательно определяют концентрацию глюкозы в крови). При снижении концентрации глюкозы в крови до 3,5 ммоль/л (60 мг%) и менее вводят 100 мл 50% раствора глюкозы. Постоянно вводят 5 или 10% раствор декстрозы; объем вводимой жидкости следует тщательно рассчитывать. Концентрацию глюкозы в крови определяют каждый час, при рецидиве гипогликемии дополнительно вводят 50% раствор глюкозы.
3. Коррекция водно-электролитных нарушений. Для восполнения объема крови (при потере до 20% объема крови или в случае, когда среднее давление в артериях составляет 80 мм рт.ст.) у больных ЦП используют растворы, содержащие макромолекулы (4% модифицированный желатиноль), или физиологический раствор. Следует избегать некоторых видов коллоидов, потому что установлено, что повторное введение гидроэтиламидона может усугубить портальную гипертензию и ПН [17]. Раствор Рингера противопоказан в случае ПН; считается также, что декстраны могут продлить продолжительность кровотечения и образовывать тромбы [10]. Если у больного отмечается инфицирование жидкости при асците, ассоциированном с кишечным кровотечением, предпочитают использовать 20% альбумин — так значительно снижается риск печеночно-почечного синдрома и повышается выживаемость [18]. Минимальными обязательными критериями контроля инфузионной терапии после обширной резекции печени являются следующие показатели (ежечасно): температура тела, пульс, частота и характер дыхания, диурез. При проведении инфузионной терапии необходим мониторинг показателей центрального венозного давления (ЦВД) и контроль диуреза (не менее 40 мл/ч). Уровень ЦВД ниже 6—12 см вод.ст. свидетельствует о гиповолемии.
4. Гепатопротективная коррекция. Очень важно, особенно у больных ЦП, грамотно подобрать гепатопротективную терапию. Ремаксол (ООО «НТФФ «ПОЛИСАН», Санкт-Петербург, Россия) — универсальный гепатопротекторный препарат, обладающий антигипоксическим, детоксицирующим и непрямым антиоксидантным свойствами. Янтарная кислота оказывает дезинтоксикационное (за счет сохранения пула коэнзима Q и митохондриального восстановленного глутадиона) и антиоксидантное (за счет активации ферментативного звена антиоксидантной системы) действие. Детоксицирующее действие сукцината дополняется увеличением пула коэнзима Q, восстановленного глутадиона, участвующего в функционировании детоксицирующей функции гепатоцитов и объемозависимым дезинтоксикационным эффектом препарата.
Нами проведен сравнительный анализ эффективности терапии 36 пациентов в возрасте от 32 до 64 лет с ЦП после ПСШ. Пациенты 1-й группы (n=20) в составе комплексной постоперационной терапии в течение 10 дней получали ремаксол внутривенно капельно по 400 мл. Пациенты 2-й (группа сравнения, n=16) — адеметионин в дозе 400 мг/сут. Всех пациентов обследовали в динамике — до и после лечения. Помимо общеклинических, определяли показатели печеночной активности (уровни трансаминаз и общего билирубина) и уровень альбумина в крови.
Анализ полученных данных выявил выраженное снижение уровня билирубина (с 72±1,25 до 37±2,5 мкмоль/л), тенденцию к улучшению синтетической функции печени (увеличение альбуминовой фракции общего белка крови с 31,0± 1,2 до 38,0±1,1 г/л), снижение активностей АлАТ и АсАТ в 2 раза по сравнению с таковыми в группе сравнения (рис. 2). Полученные результаты свидетельствовали о положительном влиянии ремаксола на функциональное состояние печени и показатели лабораторных исследований периферической крови у пациентов с ЦП. На фоне проведения терапии нежелательных явлений на введение препарата не выявлено, все пациенты получили лечение в полном объеме.
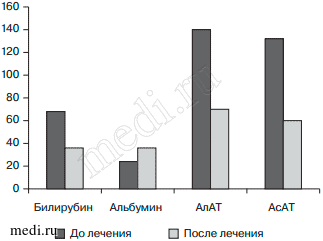 Рис. 2. Динамика показателей билирубина, альбумина, АлАТ и АсАТ у больных циррозом печени на фоне комплексной терапии с включением инфузии ремаксола, билирубин - мкмоль/л, альбумин - г/л, АлАТ - ед/л, АсАТ - ед/л.
Рис. 2. Динамика показателей билирубина, альбумина, АлАТ и АсАТ у больных циррозом печени на фоне комплексной терапии с включением инфузии ремаксола, билирубин - мкмоль/л, альбумин - г/л, АлАТ - ед/л, АсАТ - ед/л.
Таким образом, на основании сказанного и по результатам наших исследований наиболее эффективной является следующая схема заместительной фармакотерапии в комплексном лечении печеночной недостаточности:
— адаптированная аминокислота 10% (аминоплазмаль гепа 10%; акумин гепа 10—500 мл/сут);
— адаптированный раствор янтарной кислоты (ремаксол) до 800 мл/сут;
— альбумин 10% (20) — суточная потребность определяется показателем альбуминовой фракцией общего белка крови и поддерживается на уровне 38—40 г/л;
— урсодезоксихолевая кислота до 1500 мг/сут.
5. Профилактика и лечение витальных осложнений со стороны других органов и систем. Профилактика и лечение дыхательной недостаточности и бронхолегочных осложнений (состояние дыхательной системы достаточно оценить посредством пульсоксиметрии) — обязательно осуществляют ингаляции кислорода через маску. Для профилактики аспирационных осложнений у коматозного больного производят эндотрахеальную интубацию. В случае дыхательной недостаточности, проявляющейся подъемом рСО2 (более 6,5 кПа) или снижением рО2 (менее 10 кПа) в артериальной крови, прибегают к искусственной вентиляции легких).
Профилактика и лечение отека головного мозга. Локальная холодовая гипотермия. Магнезий-лидокаиновая смесь внутривенно на постоянной перфузии + препараты, воздействующие на активность ингибиторных нейротрансмиттеров в ЦНС или на их соотношение.
Профилактика и лечение гепаторенального синдрома. Одним из условий ведения больных после обширных резекций печени в реанимационном отделении является измерение почасового диуреза, который не только отражает уровень тканевой перфузии или степень наполнения сосудистого русла, но и служит индикатором развития у больного гепаторенального синдрома. В норме за 1 ч выделяется 0,5—1 мл/кг мочи. Снижение диуреза менее 0,5 мл/ кг/ч свидетельствует о высоком риске развития гепаторенального синдрома.
Наиболее часто используемая схема фармакотерапии отечно-асцитического синдрома включает в себя по возможности воздействие на все звенья патогенеза асцита у больных ЦП с учетом риска детонации ПЭ даже на минимальное изменение водноэлектролитного состава организма. В связи с этим назначают: 1) петлевые диуретики с учетом не более 40 мг/сут; 2) антагонисты альдестерона до 200 мг/ сут; 3) альбумин 20% 200 мл; 4) сердечные гликозиды (до 2 мл/сут под контролем ЧСС).
По данным ведущих гепатологических центров мира, при развитии гепаторенального синдрома прогноз крайне неблагоприятный даже при использовании методов экстракорпоральной детоксикации (ЭКД). В настоящее время нет оптимальной терапии, однако ряд вмешательств, используемых в реанимации (вазоактивные вещества, механическая вентиляция), влияют на кровоснабжение внутренних органов (согласно данным Reanimation hepatosplanchnique) [19]. Даже если польза от вмешательств, направленных на кровоснабжение печени и других внутренних органов, остается недоказанной, представляется логичным ограничить вмешательства, которые могут еще больше изменить кровоснабжение печени и внутренних органов.
Особенности лечения печеночной (смешанной) энцефалопатии
1. Устранение «разрешающих факторов».
Следует подчеркнуть, что у больных ЦП детонатором развития ПН и ПЭ может послужить даже незначительное изменение гомеостаза организма (бактериальные инфекции, водно-электролитные нарушения на фоне приема диуретиков, экзогенная или эндогенная интоксикация и т.д.). Так, например, в отличие от кровотечений любой другой этиологии, где ведущим определяющим прогноз моментом, бесспорно, является степень тяжести кровопотери, у больных ЦП кровотечение из ВРВПЖ тесно связано и конкурирует по значимости с функциональным состоянием печени. При этом анализ функционального состояния печени больных ЦП, поступивших в различные сроки от начала кровотечения, показал, что в более поздние сроки уменьшается число больных с функциональным классом А и увеличивается число больных с функциональными классами В и С по Child—Pugh. Существенные структурные изменения функциональных групп больных ЦП происходят в течение первых суток с начала кровотечения, и именно этот срок следует признать оптимальным для решения о целесообразности оперативного лечения. «Золотым стандартом» лечебно-диагностической тактики при развитии ОПН на фоне кровотечения из ВРВПЖ являются установка зонда Блекмора, экстренная эндоскопическая склеротерапия, медикаментозные средства гемостаза, заместительная терапия, энтеральный лаваж.
Наиболее сложно решается проблема с бактериальными инфекциями, которые коррелируют со степенью гепатоцеллюлярной недостаточности и часто вызываются энтеробактериями. Ишемия пищеварительного тракта при кровотечениях может способствовать распространению бактерий. Чаще всего выявляют инфекции в асцитической жидкости (50%), при поражении мочевыводящих (25%) и дыхательных (25%) путей. Метаанализ, охвативший 500 больных, показал, что профилактика антибиотиками уменьшает частоту инфекций на 32%, смертность на 9,1%, а также риск рецидива ранних кровотечений [12]. Профилактику антибиотиками следует проводить больным после определения инфекционного агента, предпочтение отдается флюроквинолонам из-за простоты их введения и низкой стоимости. В настоящее время рекомендуется следующая схема: 400 мг норфлоксацина 2 раза в день в течение 7 дней [12, 13]. Показатель «стоимость/ эффективность» парентерального способа введения идентичен таковому при пероральном введении [14]. Мы придерживаемся тактики широкоспекторной эмпирической антибиотикотерапии с последующим переводом пациента на специфический антибиотик в соответствии с высеваемой микрофлорой. На первом этапе предпочтение отдается пиперациллину/тазобактаму в 3-кратном использовании для внутривенного вливания до 17,5 г/сут с последующим подключением группы цефалоспоринов (цефапиразон/сульбактам до 4 г/сут) как наиболее оптимальной для перекрестного взаимодействия.
Таким образом, опыт применения лечебно-тактического алгоритма терапии острой печеночной недостаточности у пациентов с ЦП после ПСШ показал свою эффективность и может быть рекомендован к дальнейшему использованию.
Заключение
Исходная декомпенсация цирроза печени по отечно-асцитическому синдрому достоверно повышает риск развития постоперационных осложнений портосистемного шунтирования — печеночной недостаточности (13,5% против 6,9% у пациентов без асцита; р≥0,05) и печеночной энцефалопатии (64,9% против 51,7%; р≥0,05). В группе пациентов с предоперационным асцитическим синдромом летальность составила 3,8% (10 больных), в группе без признаков асцита — 2,3% (6 больных). Основной причиной ранней послеоперационной летальности стало развитие тромбоза анастомоза с рецидивом кровотечения из варикозно-расширенных вен пищевода и желудка.
Для снижения рисков развития постоперационных осложнений и летальности был разработан лечебно-тактический алгоритм, эффективный при сочетанном применении комплекса консервативных и биофизических методов лечения и направленный на устранение «разрешающих факторов» их развития.
Одной из важных составляющих данного алгоритма является фармакотерапия с применением гепатопротективных препаратов для поддержания функционального состояния печени у пациентов с циррозом печени в постоперационный период. Антигипоксические, детоксицирующие и антиоксидантные свойства активных компонентов ремаксола и выявленный положительный эффект применения его у пациентов (снижение уровня билирубина, увеличение альбуминовой фракции общего белка крови и снижение активностей АлАТ и АсАТ в 2 раза) позволяют рекомендовать препарат для включения в стандарт постоперационной патогенетической терапии у этой категории пациентов.
ЛИТЕРАТУРА/REFERENCES
1. Готье С.В., Константинов Б.А., Цирульникова О.М. Трансплантация печени. Руководство для врачей. М.: Медицинское информационное агентство; 2008. [Got’e SV, Konstantinov BA, Cirul’nikova OM. Liver transplantation: a guide for doctors. M.: Medicinskoe informacionnoe agentstvo; 2008. (In Russ.)].
2. Каримов Ш.И., Боровский С.П., Бралов А.З. Малоинвазивные рентгенохирургические вмешательства в лечении цирроза печени и портальной гипертензии. Анналы хирургической гепатологии. 2005;10(2):79а-79. [Karimov ShI, Borovskij SP, Bralov AZ. Minimally invasive x-ray surgery in the treatment of cirrhosis and portal hypertension. Annaly khirurgicheskoy gepatologii. 2005;10(2):79а-79. (In Russ.)].
3. Назыров Ф.Г., Ибадов Р.А. Стандартизация лечебной тактики печeночной энцефалопатии у пациентов с циррозом печени после хирургического вмешательства. Carrahiyya. Baku. 2011;3(27):41-43. [Nazyrov FG, Ibadov RA. Standardization of therapeutic tactics of hepatic encephalopathy in patients with cirrhosis after surgical intervention. Carrahiyya. Baku. 2011;3(27):41-43].
4. Назыров Ф.Г., Соколова А.С., Девятов А.В., Саяпин С.Н. Анализ состояния и перспективы развития трансформируемых зондов для остановки кровотечений из варикозно-расширенных вен пищевода. Хирургия. 2010;12:58-64. [Nazyrov FG, Sokolova AS, Deviatov AV, Saiapin SN. Treatment of esophageal varices bleeding with the use of transformable probes. Khirurgiia. 2010;12:58-64. (In Russ.)].
5. Orloff MJ, Vaida F, Haynes KS, Hye RJ, Isenberg JI, Jinich-Brook H. Randomized controlled trial of emergency transjugular intrahepatic portosystemic shunt versus emergency portacaval shunt treatment of acute bleeding esophageal varices in cirrhosis. Gastrointest Surg. 2012;16(11):2094-2111.
6. Акилов Х.А., Назиров Ф.Г., Хорошаев В.А. Патогенетическое обоснование хирургического лечения резистентного асцита у больных циррозом печени. Медицинский журнал Узбекистана. 1991;11:11-14. [Akilov HA, Nazirov FG, Horoshaev VA. Pathogenetic substantiation of surgical treatment of resistant ascites in patients with cirrhosis of the liver. Med Zh Uzb. 1991;11:11-14. (In Russ.)].
7. Шерлок Ш., Дули Дж. Заболевания печени и желчных путей. М.: ГЭОТАР-Мед; 2002. [Sherlok Sh, Duli Dzh. Diseases of the liver and biliary tract. M.: GEHOTAR-Med. 2002. (In Russ.)].
8. Orloff MJ. Prophylactic portasystemic shunt in non-cirrhotic portal fibrosis: is it worthwhile? Nobody knows. Indian J Gastroenterol. 2005;24(6):239-242.
9. Wolff M, Hirner A. Surgical treatment of portal hypertension. Zentralbl Chir. 2005;130(3):238-245.
10. Samana CM, Marchetti F. Substituts du plasma et de hemostase. Sang Thromb Vaiss. 1992;4:415-421.
11. Назыров Ф.Г., Девятов А.В., Ибадов Р.А. Портосистемное шунтирование — как один из основных путей профилактики кровотечений из варикозно-расширенных вен пищевода у больных циррозом печени. Анналы хирургической гепатологии. 2005;10(2):83. [Nazyrov FG, Devyatov AV, Ibadov RA. Portosystemic shunting is one of the main ways to prevent bleeding from varicose veins of the esophagus in patients with cirrhosis of the liver. Annaly hirurgicheskoj gepatologii. 2005;10(2):83. (In Russ.)].
12. Christidis C, Mai F, Ramos J, Senejoux A, Callard P, Navaroo R, et al. Worsening of hepatic dysfunction as a consequence of repeated hydroxyethylstarch infusions. J Hepatol. 2001;35:726-732.
13. Sort P, Navasa M, Arroyo V, Aldeguer X, Planas R, Ruiz-Del-Arbol L, et al. Effect of intravenous albumin on renal impairment and mortality in patients with cirrhosis and spontaneous bacterial peritonitis. N Engl J Med. 1999;341:403-409.
14. De Backer, Creteur J. Reanimation hepatosplanchnique. Elsevier; 2010.
15. Hou MC, Lin HC, Liu TT, Kuo B, Lee FY, Chang FY et al. Antibiotic prophylaxis after endoscopic therapy prevents rebleeding in acute variceal hemorrhage : a randomised trial. Hepatology. 2004;39:746-753.
16. Soriano G, Guarner C, Tomas A, Villanueva C, Torras X, Gonzales D, et al. Norfloxacin prevents bacterial infection in cirrhotics with gastrointestinal hemorrhage. Gastroenterology. 1992;03:1267-1272.
17. Sabat M, Kolle L, Soriano G, Ortiz J, Pamplona J, Novella MT, et al. Parenteral antibiotic prophylaxis of bacterial infections does not improve cost-efficacy of oral norfloxacin in cirrhotic patients with gastrointestinal bleeding. Am J Gastroenterol. 1998;93:2457-2462.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 www.polysan.ru
www.polysan.ru www.polysan.ru
www.polysan.ru