Оптимизация процесса репарации тканей при использовании Ремаксола
Статьи
"ХИРУРГИЯ" 4, 2017
Д.м.н., проф. А.П. ВЛАСОВ1*, к.м.н. П.П. 3AЙЦEB1, к.м.н. П.А. ВЛАСОВ1, к.м.н. Г.А. ШЕВАЛАЕВ1, д.м.н. Т.И. ВЛАСОВА1, д.м.н., проф. Э.И. ПОЛОЗОВА1, асп. СВ. КОНОНЕНКО, А.Л. КОВАЛЕНКО2
1ФГБОУ ВО «Национальный исследовательский Мордовский государственный университет им. Н.П. Огарева», Саранск, Россия;
2ФГБУН «Институт токсикологии Федерального медико-биологического агентства», Санкт-Петербург, Россия
Цель исследования — изучение влияния Ремаксола на репаративныи процесс тканевых структур лапаротомной раны. Материал и методы. Обследованы 90 больных с острым аппендицитом (ОА), осложненным местным перитонитом, в раннем послеоперационном периоде. Традиционную терапию получали 50 пациентов, остальные 40 — Ремаксол (ежедневное в течение 5 сут по 400 мл внутривенное введение). Результаты и заключение. Установлена способность Ремаксола оптимизировать течение репаративного процесса лапаротомной раны, что подтверждено данными ранотензиометрии и цитологическим исследованием раневого экссудата. В основе индукторной регенераторной эффективности Ремаксола лежит его способность улучшать микроциркуляцию, противоотечное действие, а также способность уменьшать избыточную интенсивность перекисного окисления мембранных липидов, фосфолипазную активность и явления гипоксии.
Ключевые слова: хирургическая рана, регенерация, Ремаксол, гипоксия, перекисное окисление.
В настоящее время, несмотря на большие успехи хирургии, фармакологии, физиотерапии, осложнения со стороны хирургических ран различных органов и тканей продолжают оставаться довольно частым явлением [1—3]. В ряде случаев они могут стать причиной послеоперационной летальности [4—7]. Данная проблема особенно актуальна у больных с сопутствующими соматическими заболеваниями. В связи с этим продолжается поиск путей оптимизации регенеративных процессов в послеоперационном периоде [8—11].
Известно, что одним из факторов, усугубляющих течение репарации, являются процессы перекисного окисления липидов и гипоксия [12—14]. Эти патологические процессы негативно влияют на репаративный потенциал тканей, поскольку приводят к деструкции биологических мембран, от которых напрямую зависит способность клетки к восстановлению. Следовательно, для более быстрого восстановления функционального состояния клеток (а вместе с ним и репаративной способности тканей) необходима терапия, обладающая способностью влиять на мембранодестабилизирующие агенты. С этой точки зрения наш интерес вызвал отечественный лекарственный препарат Ремаксол, обладающий по заявлению производителя (ООО «НТФФ «ПОЛИСАН», Санкт-Петербург) антигипоксантным и антиоксидантным действиями [15, 16].
Цель исследования — изучение влияния Ремаксола на репаративный процесс тканевых структур лапаротомной раны.
Таблица 1. Динамика количества клеточных элементов раневого экссудата лапаротомной раны при применении Ремаксола (М±т)
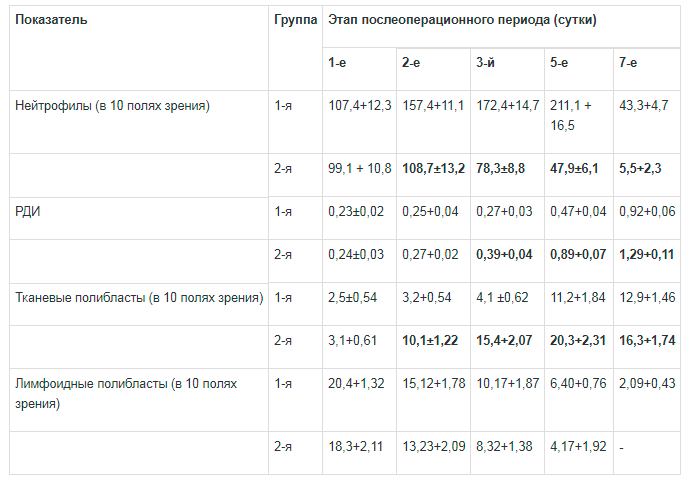
Примечание. Здесь и в табл. 2, 3: полужирным шрифтом выделена достоверность отличия по отношению к контролю при p<0.05; 1-я — контрольная группа, 2-я — основная.
Материал и методы
Клинический раздел работы представлен наблюдениями за 90 больными острым аппендицитом (ОА), осложненным местным серозно-гнойным перитонитом, которым производилась аппендэктомия. 1-я (контрольная) группа состояла из 50, 2-я (исследуемая) — из 40 больных. Подбор пациентов осуществлялся по нозологии, объему хирургического вмешательства, возрасту. В 1-й группе острый флегмонозный аппендицит диагностирован у 16 (32,0%) больных, острый гангренозный — у 28 (56,0%), острый гангренозно-перфоративный — у 6 (12%), во 2-й группе - у 14 (35,0%), 19 (47,5%) и 7 (17,5%) больных соответственно. Контрольными сроками наблюдения были 1,2,3,5,7-е сутки после операции.
В раннем послеоперационном периоде больным контрольной группы назначалась традиционная терапия; исследуемой группы — комбинированная, включающая традиционную и инфузии Ремаксола (ежедневные в течение 5 сут внутривенные капельные введения по 400 мл). В исследуемой группе количество традиционных инфузионных средств сокращали на 400 мл.
Характер и темп регенерации раны оценивали поданным ранотензиометрии (РТМ) и цитологического исследования раневого экссудата (РЭ). В тканях регистрировали показатели трофики (окислительно-восстановительный (редокс) потенциал, коэффициент диффузии кислорода). В плазме крови определяли активность фосфолипазы А2, суперок-сиддисмутазы, содержание ТБК-реагирующих продуктов (малонового диальдегида), диеновых конъю-гатов, молочной и пировиноградной кислот.
Полученные цифровые данные обрабатывали методом вариационной статистики с использованием t-критерия Стьюдента.
Результаты и заключение
Самыми доступными из малоинвазивных тестов, по которым возможно объективно оценить течение репаративного процесса тканевых структур кожной раны, являются РТМ и цитологическое исследование РЭ. Поскольку темп заживления зависит от трофики и биоэнергетики тканей, производилась оценка диффузионной способности для кислорода и окислительно-восстановительного (редокс) потенциала. Безусловно, как указано выше, течение репаративного процесса во многом определено интенсивностью перекисного окисления мембранных липидов и гипоксией, что и послужило поводом для их изучения. Отметим, что в тканевых структурах раны из-за необходимости биопсии исследования такого рода затруднены. Поэтому эти показатели исследовали в крови.
Изучение в динамике РЭ у больных ОА, осложненным перитонитом, группы сравнения показало, что через сутки после операции количество нейтро-филов составило 107,4+12,3 в 10 полях зрения (табл. 1). Через 2 сут их количество увеличивалось еще на 46,7% (/КО,05). У большинства этих форменных элементов крови наблюдается гомогенизация ядер, их набухание, фрагментация, пикноз и полное разрушение с образованием зернистости. Реже в нейтрофилах РЭ была зафиксирована нормальная структура ядер.
Через 3 сут после операции количество нейтро-филов увеличивалось на 60,7 (р<0,05). Отмечено, что ядра многих из них увеличены в размерах, в некоторых они разрыхлены. Микроскопически регистрированы явления дегенерации нейтрофилов, проявляющейся во фрагментации и пикнозе ядер. К концу периода наблюдения содержание нейтро-фильных лейкоцитов снижалось до 43,3±4,7. Отмечалось прогрессирующее снижение их дегенеративных форм и преобладание клеток, сохранивших нормальную структуру. Указанное являлось фактом завершения к этому сроку фазы воспаления. Об этом свидетельствовал регенеративно-дегенеративный индекс (РДИ) (соотношение сохранивших свою форму и дегенеративных форм нейтрофилов) [4]. Так, через сутки после операции РДИ составил 0,23±0,02, через 5 - 0,47±0,04 (р<0,05) и только к 7-м суткам его значение приближалось к единице (0,92+0,06).
Таблииа 2. Некоторые показатели агрегаиионного состояния регенерирующих структур лапаротомной раны при применении Ремаксола (М±т)
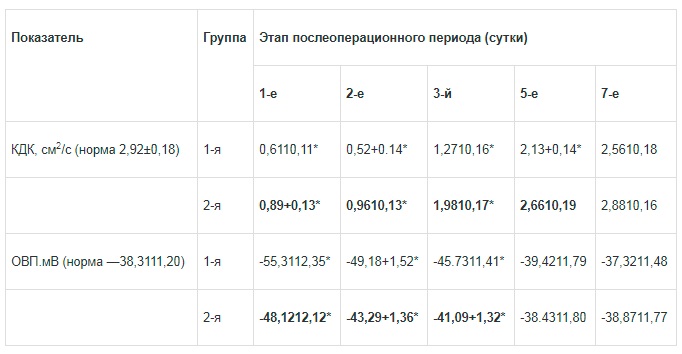
Примечание. Здесь и далее: * — достоверность отличия по отношению к норме при p<0,05.
Определенное значение для оценки темпа и характера заживления тканей имеет определение в РЭ лимфоидных и тканевых полибластов. Первые в начальные 5 сут после операции варьировали от 6,4 до 20,4 в 10 полях зрения, вторые — как признаки развития молодой соединительной ткани — в первые 5 сут были в незначительном количестве (от 2,5 до 11,2 в 10 полях зрения).
Течение репаративного процесса кожной раны на фоне применения Ремаксола, судя по цитограммам РЭ, было значительно интенсивней. Так же, как и в контроле, максимальное количество нейтрофилов в РЭ наблюдалось в самые ранние сроки послеоперационного периода (3 сут), когда их количество достигало 108,7±13,2. Затем их содержание прогрессивно снижалось. К 5-м суткам после операции зарегистрировано уменьшение их дегенеративных форм. У больных этой группы отмечено повышение РДИ, который к этому сроку составил 0,89±0,07, что было больше соответствующего показателя контрольной группы на 89,4% (p<0,05), являясь фактом стихания воспаления в регенеративном типе клеточной реакции уже в эти сроки.
Об улучшении процесса заживления тканей свидетельствовало и быстрое повышение в РЭ тканевых полибластов. Так, в срок 3 сут после операции их количество в исследуемой группе было больше контрольного более чем в 3,7 раза (p<0,05). Через 5 сут этих форменных элементов в ране стало еще больше и оказалось выше контрольного уровня на 81,3% p<0,05).
К сроку 7 сут количество соединительнотканных элементов уменьшалось до 15,8+1,74 (/КО,05), что свидетельствовало о завершении этого периода раневого процесса с переходом в фазу реорганизации рубца.
Таким образом, качественный и количественный анализы раневого отделяемого показали, что при терапии Ремаксолом в тканевых структурах раны процесс воспаления проходит все характерные стадии, однако отмечается более быстрая их смена. Важнейшим результатом такого рода терапии является ранняя выраженная реакция соединительнотканных клеточных элементов. Как известно, их быстрое накопление в составе РЭ указывает на активное протекание процессов экссудации и миграции клеточных элементов из кровеносного русла.
Другой показатель хода репаративного процесса — данные РТМ, также свидетельствовал о сравнительно лучших его характеристиках при применении в раннем послеоперационном периоде. При оценке прочности сращения тканей в области раневых поверхностей сила биологической консолидации заметно отличалась от таковой контрольной группы. Уже через 3 сут после операции она была выше контрольного значения на 26,7% (p<0,01), через 5 - на 47,8% (p<0,05), через 7 - на 32,2% (p<0,05).
Таким образом, нами выявлен достаточно высокий репаративный эффект Ремаксола. Следующей задачей клинико-лабораторного исследования явилось изучение механизмов индукторного эффекта препарата. С этой целью нами изучены биоэнергетика и диффузионная способность тканей по линии швов.
Оказалось, что процесс репарации в начальные сроки после операции сопровождает достаточно выраженные нарушения биоэнергетики регенерирующих структур. Так, редокс-потенциал тканей по линии швов лапаротомной раны в первые 3-е суток был снижен на 44,4, 28,4 и 19,4% (p<0,05) соответственно. Отмечено, что одним из факторов угнетения окислительно-восстановительных процессов явилось ухудшение диффузионной способности тканей для кислорода, проявлением чего было снижение коэффициента диффузии кислорода в первые 3 срока наблюдения на 79,1,82,2 и 56,5% (p<0,05) соответственно (табл. 2).
Применение Ремаксола в раннем послеоперационном периоде приводило к улучшению агрегатного состояния тканей, что сопровождалось сравнительно лучшими характеристиками их диффузионной способности для кислорода и, как следствие, улучшением биоэнергетики. В начальные сроки послеоперационного периода (в первые 3 сут) отмечено снижение (на 32,2—69,5%) коэффициента диффузии кислорода. Однако по сравнению с контролем уже после первого введения препарата он повышался на 45,9%, после второго — на 84,6%, после третьего — на 55,9%, после пятого введения — на 24,9% (p<0,05).
Таблица 3. Показатели перекисного окисления липилов, активности фосфолипазы А2, гипоксии в плазме крови при применении Ремаксола (М±т, n=48)
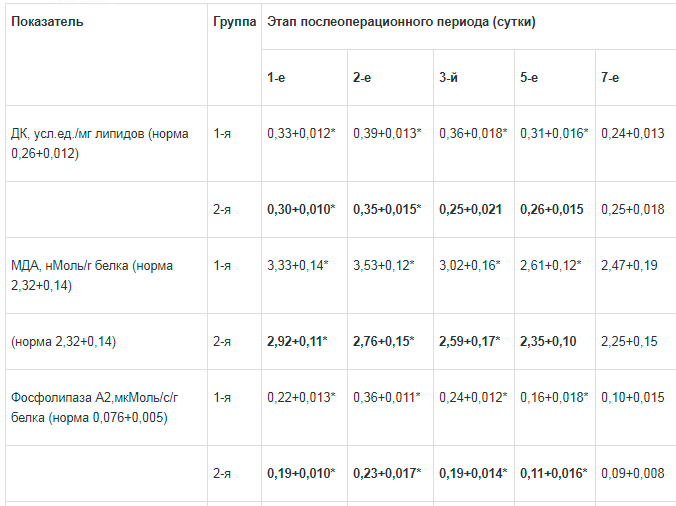
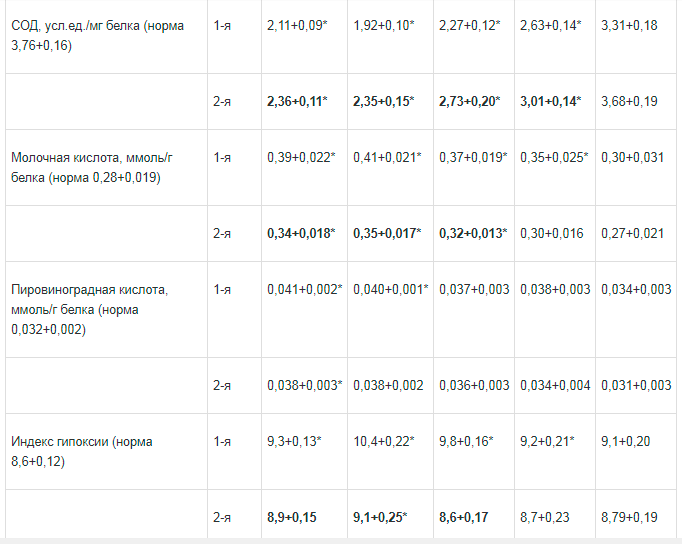
Как указано нами выше, одними из факторов, которые вызывают мембранодестабилизирующие явления, вносящие определенный негативный вклад вухудшение трофики и развитие гипоксии в регенерирующих тканях, являются перекисное окисление мембранных липидов и активность фосфолипазньгх систем. Нам не удалось исследовать указанные процессы в самих тканях, так как это сопряжено с биопсией. Поэтому их оценка произведена по соответствующим показателям в крови.
Биохимические исследования показали, что в раннем послеоперационном периоде в плазме крови содержание первичных и вторичных молекулярных продуктов липопероксидации повышалось. Так, уровень диеновых конъюгатов возрастал в первые 4 этапа периода наблюдения на 26,9, 50,9, 38,5 и 19,2% (p<0,05) соответственно, ТБК-реагирующих продуктов — на 43,5, 52,2, 30,2 и 12,5% (p<0,05) соответственно. При этом ферментный антиоксидантный потенциал падал, о чем свидетельствовало уменьшение активности супероксиддисмутазы на 43,8, 48,8, 39,5 и 30,1 % (p<0,05) соответственно срокам наблюдения. Отметим, что в раннем послеоперационном периоде в плазме крови больных ОА, осложненном перитонитом, существенно (на 189,5, 373,7, 215,8 и 110,5% соответственно этапам наблюдения) повышалась активность фосфолипазы А2. Определенный научный интерес вызывает и факт повышения в плазме крови уровня недоокисленных продуктов — молочной и пировиноградной кислот, что свидетельствовало о развитии общей гипоксии. Индекс гипоксии достоверно повышался на 8,1, 20,9 и 14,0% соответственно на 1-е, 3-й и 5-е сутки.
Несомненно, указанные расстройства гомеостаза на организменном уровне создавали в достаточной степени неблагоприятный фон для функционирования всех систем и не могли не отразиться на репаративном потенциале тканей лапаротомной раны.
В исследуемой группе применение Ремаксола приводило к быстрой коррекции указанных расстройств. В раннем послеоперационном периоде существенное снижение (диеновых конъюгатов на 9,1%, МДА — на 12,3%) уровня продуктов перекисное окисление липидов (ПОЛ) в плазме крови по сравнению с контролем наблюдалось уже после первого введения препарата и регистрировалось в последующие этапы периода наблюдения: через 2 сут - на 10,3 и 21,8%, через 3 - на 30,6 и 14,2%, через 5 сут — на 16,1 и 10,0% (p<0,05). Указанный процесс сопровождался повышением антиоксидантного потенциала, что проявлялось в повышении активности супероксиддисмутазы (СОД) на 12,1, 22,6, 20,7 и 14,6% (p<0,05) соответственно (табл. 3).
Подчеркнем, что Ремаксол приводит к заметному снижению активности фосфолипазы А2, которая уже после первого введения препарата по сравнению с контролем уменьшалась на 13,6%. Такого рода динамика отмечена и в последующие этапы периода наблюдения (снижение активности на 36,1, 20,8 и31,3%(/К0,05)).
Ремаксол также приводил к коррекции общей гипоксии. Отмечена положительная динамика содержания молочной и пировиноградной кислот: их уровень по сравнению с контролем уменьшался на 12,8 и 7,3% (p<0
,05) соответственно с первых суток терапии.
Таким образом, анализируя результаты клини-ко-лабораторно-инструментального исследования, можно сделать заключение о способности Ремаксола оптимизировать течение репаративного процесса. Безусловно, в основе индукторной регенераторной эффективности лежит его способность улучшать (быстро восстанавливать) состояние биоэнергетических систем за счет улучшения микроциркуляции, противоотечного действия, что быстро нормализует агрегатное состояние экстравазальных пространств регенерирующих тканей и их свойства как диффузионной среды для кислорода. В осуществлении репаративного действия препарата лежит его способность эффективно корригировать избыточную интенсивность перекисного окисления мембранных липидов, фосфолипазную активность и явления гипоксии.
Вывод
Применение Ремаксола в раннем послеоперационном периоде у больных ОА, осложненным местным перитонитом, приводит к укорочению продолжительности заживления раны за счет сокращения фазы воспаления, что подтверждается уменьшением содержания в РЭ нейтрофилов, в том числе их разрушенных форм, и сравнительно высоким РДИ на протяжении первых 3—5 суток после операции.
Оптимизация процесса заживления лапаротомной раны на фоне ремаксолотерапии происходит за счет повышения диффузионной способности тканей для кислорода и их биоэнергетики.
В повышении Ремаксолом репаративного потенциала тканей немаловажное значение имеет его способность уменьшать избыточную интенсивность перекисного окисления мембранных липидов, фосфолипазную активность и явления гипоксии.
ЛИТЕРАТУРА
1. Блатун Л.А. Местное медикаментозное лечение ран. Хирургия. 2011;4:51-59.
2. Murphy GR, Gardiner MD, Glass GE. Meta-analysis of antibiotics for simple hand injuries requiring surgery. Br J Surg. 2016; 103(5):487-492.
3. Pawar AY, Biswas SK. Postoperative Spine Infections. Asian Spine J. 2016;10(1):176-183.
4. Доброквашин C.B., Измайлов А.Г., Волков Д.Е. Новые технологии влечении гнойных ран и полостей. Вестник экспериментальной и клинической хирургии. 2011;4(4):822-823.
5. Никольский В.И., Калмин О.В.. Федорова М.Г., Янгуразо-ва Е.В., Титова Е.В., Венедиктов А.А. Особенности процесса регенерации соединительной ткани передней брюшной стенки после имплантации ксеноперикардиальной пластины. Инновационные имплантаты в хирургии. Сборник трудов. Часть третья. M.: НЦССХим. АН. Бакулева РАМН; 2014.
6. Сажин В.П., Бодрова Н.Г., Климов Д.Е. Антибиотикотерапия при гнойных хирургических заболеваниях органов брюшной полости и мягких тканей. Хирургия. 2010;(6):4-9.
7. Hawn MT, Vick СС, Richman J, Holman W, Deierhoi RJ, Graham LA. Henderson WG, Itani KM. Surgical site infection prevention: time to move beyond the surgical care improvement program. Ann Surg. 2011;254(3):494-501.doi: 10.1097/SLA.0b013e31822c6929
8. Давыдов Ю.А., Абрамов А.Ю., Ларичев А.Б. Регуляция раневого процесса у больных пожилого и старческого возраста методом вакуум-терапии. Хирургия. 1994;7:7-10.
9. Maier S, Korner Р, Diedrich S, Kramer A, Heidecke CD. Definitio and management of wound infections. Chirurg. 2011;82(3):235-241 doi: 10.1007/s00104-010-2012-5
10. Mantovani A, Biswas SK, Galdiero MR et al. Macrophage plasticity and polarization in tissue repair and remodeling. / Pathol. 2013;229(2): 176-185.
11. Whiteside LA. Prophylactic perioperative local antibiotic irrigation. Bone Joint J. 2016;98(l):23-26.
12. Винник Ю.С.. Салмина А.Б., Дробушевская А.И. Особенности патогенеза длительно незаживающих ран. Новости хирургии. 2011; 19<3): 101-110.
13. Куликов Л.К., Казанков С.С. Привалов Ю.А., Соботович В.Ф., Смирнов А.А., Гармашов В.И. Динамика биохимических показателей грануляционной ткани экспериментальных инфицированных ран при лечении биологически активными препаратами. Новости хирургии. 2014;22(4):395-402.
14. Мнихович М.В., Еремин Н.Р. Экспериментально-морфологический анализ гистогенеза кожной раны под влиянием низкоинтенсивного лазерного излучения. Вестник новых медицинских технологий. 2013;20(2):113-120.
15. Виноградова Т.И., Суханов Д.С., Заболотных Н.В. Сравнительная оценка влияния ремаксола и адеметионина на репаративно-регенераторные процессы печени в условиях хирургического вмешательства в эксперименте. Экспериментальная и юшниче-ская фармакология. 2011 ;74(2):34-38.
16. Доровских В.А., Ли ОН., Симонова Н.В. Ремаксол в коррекции процессов перекисного окисления липидов биомембран, индуцированных Холодовым воздействием. Якутский медицинский журнал. 2015;4(52):21-24.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 www.polysan.ru
www.polysan.ru www.polysan.ru
www.polysan.ru