Коррекция энергодефицитных состояний как возможность адаптации больных злокачественными новообразованиями гепатопанкреатодуоденальной зоны в периоперационный период
Статьи
Опубликовано в журнале Анестезиология и реаниматология. 2016; 61 (3): DOI: 10.18821/0201-7563-2016-3
Кит О.И., Туманян С.В., Орос О.В., Иванова Л.Г., Нетывченко Н.В., Сугак Е.Ю.
ФГБУ Ростовский научно-исследовательский онкологический институт Минздрава РФ, 344037, Ростов-на-Дону, Россия
Проведено проспективное слепое контролируемое рандомизированное исследование у 48 больных (от 39 до 77 лет) по поводу злокачественных новообразований органов гепатопанкреатодуоденальной зоны. Все больные оперированы в условиях общей анестезии. Непосредственно перед операцией случайным образом больные были разделены на основную (26) и контрольную (22) группы. В основной группе больных с целью компенсации энергодефицитных состояний и органной гипоксии в поджелудочной железе и печени в интра- и послеоперационном периоде в состав инфузионной терапии включали Ремаксол, введение которого начинали до начала анестезии; в контрольной антигипоксанты не использовались. Нозологическая структура основной патологии и объем выполненных оперативных вмешательств (панкреатодуоденальная резекция, дистальная и проксимальная резекция поджелудочной железы, резекция печени) были однотипными во всех группах. Интегральная оценка прогноза и тяжести состояния оценивались по шкалам SAPS II и АРАСНЕ III. Состояние энергообмена и типа энергодефицита оценивали по транспорту кислорода, концентрации лактата. С целью определения уровня стрессорного воздействия и формирования адаптационных реакций исследовали количественный и качественный состав периферической крови. Исследование проведено до операции, на 2-е и 5-е сутки периоперационного периода. Статистический анализ проводили с помощью пакета программ Statistica 6.0. Анализ полученных результатов позволил установить, что преморбидный фон больных со злокачественными новообразованиями органов гепатопанкреатодуоденальной зоны характеризуется различными видами энергетической недостаточности, срывом адаптивных реакций физиологического типа, преобладанием стрессорного ответа организма. Дифференцированный подход к выбору патогенетически обоснованной метаболической программы в периоперационном периоде у этих больных способствует редукции различных видов гипоэргоза, эффективной доставке и потреблению кислорода, адекватной тканевой оксигенации, восстановлению адаптивных реакций физиологического типа.
Ключевые слова: злокачественные новообразования органов гепатопанкреатодуоденальной зоны; энергетическая недостаточность; адаптационные реакции; гипоксия; ремаксол.
Для цитирования: Кит О.И., Туманян С.В., Орос О.В., Иванова Л.Г, Нетывченко Н.В., Сугак Е.Ю. Коррекция энергодефицитных состояний как возможность адаптации больных злокачественными новообразованиями гепатопанкреатодуоденальной зоны в периоперационный период. Анестезиология и реаниматология. 2016.
Для корреспонденции:
Туманян Сергей Вартанович, д-р мед. наук, проф., рук. отд. анестезиологии-реаниматологии ФГБУ РНИОИ.
Correction energy deficient states as possible perioperative adaptation of cancer hepatopancreatoduodenal zone patients
Kit O.I., Tumanyan S.V., Oros O.V., Ivanova L.G., Netyvchenko N.V., Sugak E.Y.
Rostov research oncological Institute, 344037, Rostov-on-Don, Russian Federation
The aim of this study was to determine the role remaxol in complex intensive therapy of various forms gipoergosis during the perioperative period in patients with hepatopancreatoduodenal zone malignancies. The treatment of 48 patients was analyzed. Immediately prior to surgery, at random, patients were divided into primary (n = 26) and control group (n = 22). In the study group for compensation the energy deficient states and organ hypoxia in the pancreas and the liver during the intra- and postoperative periods remaxol was included in the infusion therapy, the introduction of which had been began before the start of anesthesia. In the control group antihypoxants weren t used. Integral assessment of prognosis and severity on a scale SAPS II and APACHE II. Status of energy and the type of energy deficit was estimated by the transport of oxygen and the concentration of lactate. In order to determine the level of stress exposure and the formation of adaptive reactions examined quantitative and qualitative composition of the peripheral blood. The study was conducted prior to surgery, on the 2nd and 5th day perioperative period. Inclusion in the scheme of metabolic remaxol program in the perioperative period in patients with malignant diseases of hepatopancreatoduodenal zone promotes the reduction of different types of gipoergosis, efficient delivery and oxygen consumption, the adequacy of tissue oxygenation and restoration of adaptive physiological reactions such as.
Keywords: Malignant neoplasms of hepatopancreatoduodenal area; energy failure; adaptive response; hypoxia, remaxol.
For citation: Kit O.I., Tumanyan S.V., Oros O.V., Ivanova L.G., Netyvchenko N.V., Sugak E.Y. Correction energy deficient states as possible perioperative adaptation of cancer hepatopancreatoduodenal zone patients. Anaesthesiology and reanimatology (Russian journal of Anаеsthesiology and Reanimatology) 2016.
For correspondence:
Sergey V. Tumanyan, MD, professor, head of anesthesiology and intensive care department of Rostov research oncological Institute, 344037? Rostov-on-Don, Russian Federation.
Введение. Особенности обширных хирургических вмешательств на органах гепатопанкреатодуоденальной зоны связаны в первую очередь с выраженностью эндотоксикоза, значительной травматичностью операций, длительностью анестезиологического обеспечения, риском развития послеоперационных осложнений.
Кроме того, в большинстве случаев хирургические приемы сами по себе ухудшают местное кровоснабжение тканей в ходе операции [1-4]. При вмешательствах на жизненно важных органах угроза нарушения доставки кислорода тканям принимает характер еще более серьезный и угрожающий для жизнедеятельности всего организма в целом [5-8]. В этих условиях модуляция хирургического стресс-ответа, обусловленного трансформированием метаболизма и развитием совокупности патофизиологических изменений в организме, является наиболее существенным индуктором эндогенной интоксикации, гипоксии, мобилизации субстратов энергии. Эти изменения, обозначаемые термином «гипоэргоз» или энергетическая недостаточность, введенным впервые в клиническую практику С.Н. Ефуни и В.А. Шпектором [9], характеризуют несоответствие между потребностью организма или органа-мишени в энергии и тем количеством АТФ, которое может в данный момент использоваться для поддержания структурной целостности и функциональной активности ткани или органа.
Измерить потребность организма больного в энергии невозможно, поэтому об адекватности ее доставки судят по изменениям, отражающим характер и степень кислородного бюджета. Интегральной системой оценки его интенсивности является кислородный транспорт, а трактовка его параметров обеспечивает диагностику разновидностей гипоэргоза - энергетической недостаточности организма. Значительная роль гипоксии и инверсии метаболизма в формировании нарушений гомеостаза у хирургических больных диктует необходимость широкого использования антигипоксантов [10, 11]. Появление новых препаратов, содержащих субстратные антигипоксанты, позволяет расширить возможности патогенетически обоснованной интенсивной терапии. Перечисленные задачи заставляют искать пути оптимизации периоперационной защиты больных от хирургической агрессии, оперированных на гепатопанкреатодуоденальной зоне, обусловливая актуальность проблемы.
Цель исследования - определить роль ремаксола в комплексе интенсивной терапии различных форм гипоэргоза в периоперационном периоде у больных со злокачественными образованиями гепатопанкреатодуоденальной зоны.
Материалы и метод. Проведено проспективное слепое контролируемое рандомизированное исследование у 48 больных в возрасте от 39 до 77 лет по поводу злокачественных новообразований органов гепатопанкреатодуоденальной зоны. Все больные оперированы в условиях общей анестезии. Премедикация на операционном столе: мидозалам 0,07-0,1 мг @.-кг и фентанил 0,9—1,3 мкг @. кг; индукция: пропофол 1,5-2,0 мг @. кг; базисная анестезия: севофлуран 1,3—1,6 МАК воздушно-кислородной смесью (low flow anesthesia) (FiO2 0,3), введением фентанила (0,9—1,2 мкг @. кг перед кожным разрезом и поддерживающей дозой 1,5—1,8 мкг @. кг @. ч). Миоплегия - эсмероном в принятых дозах. Объем операционной кровопотери составил 8,8±1,3 мл @. кг. На операционном столе у всех больных в качестве базисной терапии использовали инфузионное обеспечение сбалансированными кристаллоидными растворами и гелофузином, при проявлении нарушений в системе коагуляции - свежезамороженной плазмой. Трансфузию эритроцитной взвеси проводили по строгим показаниям при уровне Hb < 80 г/л. Непосредственно перед операцией случайным образом больные были разделены на основную (26) и контрольную (22) группы. В основной группе больных с целью компенсации энергодефицитных состояний и органной гипоксии в поджелудочной железе и печени в интра- и послеоперационном периоде в состав инфузионной терапии включался ремаксол, введение которого начинали до начала анестезии. Ремаксол - раствор со сбалансированным комплексом физиологически активных компонентов, которые, усиливая действия друг друга, улучшают энергетическое обеспечение клеток, ускоряют при гипоксических состояниях переход анаэробных процессов в аэробные, дают антиоксидантный и цитопротекторный эффект. Основные механизмы действия этих веществ широко известны и проверены в клинической практике. Объем инфузии ремаксола составлял 800 мл/ сут, согласно рекомендациям производителя, продолжительность 5 сут. В контрольной антигипоксанты не использовались. Нозологическая структура основной патологии и объем выполненных оперативных вмешательств (панкреатодуоденальная резекция, дистальная и проксимальная резекция поджелудочной железы, резекция печени) были однотипными во всех группах. Группы рандомизированы по полу, возрасту, антропометрическим данным и продолжительности операции, физическому статусу по классификации ASA. Для оценки исходного фона обследована группа из 16 здоровых лиц. Интегральная оценка прогноза и тяжести состояния оценивались по шкалам SAPS II и АРАСНЕ III. Из исследования были исключены больные, которые отказались от участия или больные с тяжелыми сопутствующими заболеваниями в стадии декомпенсации. Все больные обследованы. Состояние энергообмена и типа энергодефицита оценивали по газовому составу крови на анализаторе Cobas b 221 Roche (Швейцария), концентрации лактата. Определяли сродство гемоглобина к кислороду и смещение кривой диссоциации гемоглобина (КДО) по уровню Р50, кислородную емкость артериальной (CaO2) и венозной (CyO2) крови, доставку (DO2), потребление (VO2) и экстракцию кислорода (ЕО2) на основании общепринятых формул [12]. Изучали центральную гемодинамику методом тетраполярной интегральной реографии комплексом Диамант Р (Россия). С целью определения уровня стрессорного воздействия и формирования адаптационных реакций исследовали лейкоцитарную формулу крови. Количественный и качественный состав периферической крови изучали на гематологическом анализаторе LH-500 (Beckman Coulter, США) с использованием VCS-технологии. Изучали структуру популяций лейкоцитов (нейтрофилов, лимфоцитов, моноцитов, эозинофилов), эритроцитов и тромбоцитов по объему - V (Volume) составляющих их клеток, электрической проводимости - C (Conductivity) и величине лазериндуцированного светорассеяния - S (Scatter). По всем индивидуальным пробам крови для определения степени вариабельности всех изменений в каждой популяции лейкоцитов для каждого исследуемого параметра (V, C и S) на основе выдаваемых прибором гистограмм учитывали стандартное отклонение - SD (Standared Deviation) - параметр, количественно характеризующий форму распределения клеток. Исследование проведено до операции, на 2-е и 5-е сутки периоперационного периода. Статистический анализ проводили с помощью пакета программ Statistica 6.0 (Statsoft, США). Результаты обработаны методом вариационной статистики и корреляционного анализа. Для оценки межгрупповых различий использовали критерий Стьюдента, результаты считались статистически значимыми при p < 0,05.
Результаты. До хирургического лечения у 23,1% пациентов основной группы и 22,75% контрольной группы не отмечено значительных нарушений кислородтранспортной системы и энергодефицита. Доставка кислорода тканям существенно не страдала, составляя 518,2±26,2 и 516,4±20,1 мл/мин/м2. При этом потребление кислорода находилось в рамках типовых значений (157±21,2 и 160,8±22,3 мл/мин/м2), а экстракция кислорода тканями не превышала 26,4±1,4 и 26,7±1,2% в обеих группах, что, видимо, связано с достаточно оптимальными значениями ударного индекса (УИ) и гемоглобина (Hb). Для 57,8% больных основной группы и 54,6% контрольной группы была характерна картина гиперметаболического гипоэргоза. Резко возросшая потребность клеток в энергии у этой категории больных характеризовалась повышенными значениями D02 (538,5±23,1, 541,2±22,4 мл/мин/м2), существенным увеличением V02 (183,4±18,7, 181,8±21,3 мл/мин/м2; p < 0,05) и Е02 (30,7±1,3, 31,2±1,3%; p < 0,05), выраженность которых зависела от сохраненных резервов кровообращения и концентрации Hb. На этом фоне КДО стремилась к смещению вправо, что связано с быстрейшей отдачей кислорода тканям. Также у этой категории больных выявлена тенденция к увеличению уровня глюкозы, характерная при активизации глюконеогенеза, что сопоставимо как с увеличенной доставкой кислорода, так и повышенными значениями его экстракции.
Указанные изменения свидетельствовали об угнетении энергетического метаболизма и коррелировали с напряжением стрессреализующих систем. Прежде всего отмечено, что у больных с гиперметаболическим гипоэргозом в обеих группах доля антистрессорных реакций составила всего 29,6%, из них 18,5% приходилось на реакции спокойной и повышенной активации.
Частота выявления реакции тренировки была наименьшей и составляла четвертую часть физиологических реакций. 0 признаках неполноценности и напряженности физиологических реакций свидетельствовало отсутствие реакции переактивации, когда состояние было пограничным и близким к стрессу. Количество стрессовых реакций составляло значительную долю (70,4%) отклика организма больных на злокачественный процесс. При этом коэффициент соотношения антистрессорных реакций и стресса (КАС/С) снижался до 0,42 (рис. 1). У 19,1% больных основной группы и у 22,7% контрольной зарегистрировано состояние гипоксического энергодефицита. У этой категории больных до операции отмечены низкие значения DO2 (412,5±22,4, 415,7±23,1 мл/мин/м2; p < 0,05), кислородной емкости венозной крови, высокая степень экстракции кислорода тканями (34,5±1,3, 35,7±1,1%; p < 0,05) с выраженным повышением концентрации лактата до 2,8±0,2 и 3,1±0,1 ммоль/л; p < 0,05, смещением КДО влево, ухудшая отдачу кислорода оксигемоглобином. На этом фоне регистрировалось уменьшение соотношения глюкоза/лактат на 37,4% больных (p < 0,05), указывая на модифицирование углеводного обмена в его аэ- и анаэробной фазе, трансформирование характера окислительных процессов.
Рис. 1. Динамика Р50, лактата и КАС/С у больных контрольной группы с гиперметаболическим гипоэргозом на этапах исследования 2-е и 5-е сутки - после операции; здесь и на рис. 2-4.
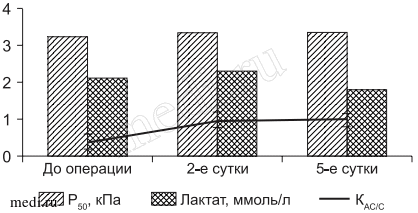
Доля антистрессорных реакций у этой категории больных составила 28,6%. Численность реакций стресса у этой категории больных по сравнению с предыдущей группой не увеличивалась, составляя 71,4%. Однако, идентифицируя реакции стресса в этой группе больных, выявлено присутствие как острой, так и хронической их форм. Причем хронический стресс в 1,7 раза превышал острый, составляя 40,5% от доли стрессовых реакций, указывая на истощение стресс-реализующих систем, что являлось наименее благоприятными условиями для мобилизации защитных систем. Это подтверждалось и уменьшением КАС/С (рис. 2). Результаты исследований, проведенных в послеоперационном периоде, показали, что у 22,8% больных контрольной группы, у которых до операции не отмечено нарушений кислородтранспортной функции и энергодефицита на этапах исследования существенных изменений энергетического статуса не происходило. Из 56,4% больных контрольной группы в послеоперационном периоде состояние гиперметаболического гипоэргоза сохранялось лишь у 36,4% больных на втором этапе исследования. Оно поддерживалось как за счет повышения доставки (547,6±21,3 мл/мин/м2), так и усиления Е02 (31,2±1,2, 31,4±1,1%;p < 0,05). В этой же группе больных, как и следовало ожидать, увеличивались показатели VO2 (186,4±23,1, 187,3±22,4 мл/мин/м2; p < 0,05). Количество антистрессовых реакций и стресса распределялось почти равномерно, на что указывал КАС/С (см. рис. 1).
Рис. 2. Динамика Р50, лактата и КАС/С у больных контрольной группы с гипоксическим гипоэргозом на этапах исследования.
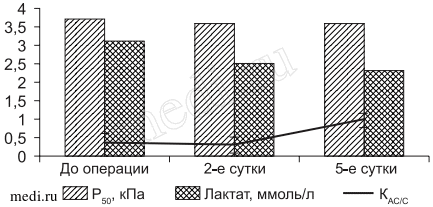
У 18,2% больных этой же группы на 2-е сутки послеоперационного периода состояние гиперметаболического гипоэргоза сменялось отсутствием энергодефицита или наличием тенденции к гиперметаболическому энергодефициту, что свидетельствовало об умеренной активации стресс-реализующих механизмов организма больных. Зарегистрировано, что доля антистрессорных реакций у этой категории больных возрастала и составила 74,7%, из которых 50,1% приходилась на долю спокойной и повышенной активации. Количество стрессовых реакций уменьшалось, что отражалось на увеличении КАС/С. На этом же этапе исследования у 22,7% больных с исходным гипоксическим энергодефицитом состояние кислородного обеспечения также не изменялось. УИ не превышал 35,2 мл/м2. Можно заметить, что у этой категории больных как до операции, так и в послеоперационном периоде реализовавшаяся недостаточная сократительная способность миокарда выражалась в низких цифрах СИ. Причем, чем ниже был УИ, тем меньше доставлялось кислорода тканям. На это указывало снижение D02 на 11% (368,5±20,1 мл/мин/м2; p < 0,05) и VO2 на 14% (133,7±20,1 мл/ мин/м2; p < 0,05). Обращало на себя внимание и то обстоятельство, что у этой группы больных поддержание VO2 происходило в основном за счет высокой экстракции кислорода (35,2±1,1;p < 0,05) на фоне сохраняющейся анемии - НЬ 82,7±2,3 г/л. Идентификация реакции стресса выявила присутствие как острой, так и хронической формы Количество стрессорных реакций составляло большую часть ответа организма больных на хирургическую агрессию, а именно 81,3%, причем хронический стресс в 2,1 раза превышал острый. Превалирование стрессорных реакций на 2-е сутки подтверждалось не только подсчетом индивидуальных, но и средних значений. Так, уровень лимфоцитов был намного меньше верхней границы стресса, отражая выраженный иммунодефицит и снижение неспецифической резистентности. Уменьшение числа лимфоцитов, доходящее в отдельных случаях до 7-10% при одновременном моноцитозе до 15% и аэозинофилии, указывало, что формирование стресса происходит на низких уровнях реактивности, которые являются наименее благоприятными для мобилизации защитных систем. К 5-м суткам послеоперационного периода под влиянием проводимой интенсивной терапии состояние больных в контрольной группе улучшалось: нарушение энергодефицита зарегистрировано у 22,8% больных (13,7% с гиперметаболическим видом гипоэргоза и 9,1% с гипоксическим). На этом фоне количество стрессорных реакций у этой категории больных достоверно уменьшалось, что создавало более благоприятные условия для мобилизации компенсаторно-приспособительных реакций (см. рис. 1, 2).
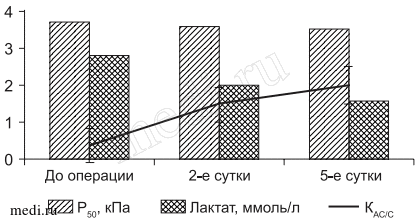
В основной группе у 23,1% больных, у которых до операции не было отмечено значительных нарушений кислородтранспортной системы и энергетического статуса, в послеоперационном периоде особых изменений не происходило. Из 57,8% больных основной группы в послеоперационном периоде состояние гиперметаболического гипоэргоза сохранялось лишь у 15,4% больных на втором этапе исследования. Оно поддерживалось высокой DО2 (535,6±20,4 мл/мин/м2), увеличением ЕО2 (31,7±1,3%; p < 0,052 и VO2 (184,7±21,3 мл/мин/м2; p < 0,05). Количество физиологических реакций и реакций стресса распределилось в соотношении 2 к 1 (рис. 3). У 42,4% больных этой же группы на 2-е сутки послеоперационного периода состояние гиперметаболического гипоэргоза сменялось его отсутствием или тенденцией к гиперметаболическому энергодефициту, свидетельствуя о достаточной активации стресс-лимитирующих систем у этих больных. На этом фоне количество стрессорных реакций у этой категории больных не зарегистрировано, что создавало достаточно благоприятные условия для мобилизации компенсаторно-приспособительных реакций. На этом же этапе исследования у 19,1% больных с исходно зарегистрированным гипоксическим энергодефицитом состояние кислородного обеспечения у 14,9% из них сменялась тенденцией к гиперметаболическому энергодефициту или его отсутствию, способствуя восстановлению адаптивных реакций физиологического типа (рис. 4). Следует также отметить, что на 2-е сутки в основной группе с гипоксическим гипоэргозом концентрация лактата снижались на 28,8% (p < 0,05), а на 5-е сутки стремились к норме, способствуя преобразованию глюкозы в другие соединения, такие как гликоген, аминокислоты и пр. Регресс лактатемии на фоне снижения уровня глюкозы подтверждал доминирование субстратного окисления в цикле Кребса. Это сказывалось на динамике индекса глюкоза/лактат, который повышался в основной группе соответственно на 26,9% (p < 0,05) на 2-е и на 38,5% (p < 0,05) на 5-е сутки периоперационного периода, свидетельствуя о нормализации процессов утилизации глюкозы тканями и нивелирование процессов тканевой гипоксии. Только у 4,2% больных отмечалось состояние гипоксического гипоэргоза - низкая DО2 (388,7±24,2 мл/мин/м2; p < 0,05) и VO2 на фоне высокой ЕО2 (35,8±1,4; p < 0,05) и сохраняющейся анемии (НЬ 84,3±2,1 г/л).
Рис. 3. Динамика Р50, лактата и КАС/С у больных основной группы с гиперметаболическим гипоэргозом на этапах исследования.
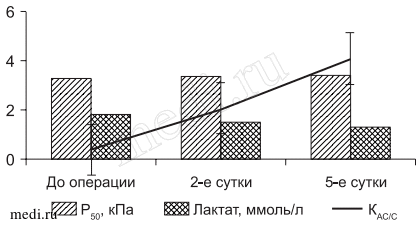
Рис. 4. Динамика Р50, лактата и КАС/С у больных основной группы с гипоксическим гипоэргозом на этапах исследования.
Обсуждение результатов. Подводя следующие итоги, можно отметить, что у обследуемых больных в обеих группах регистрируются различные виды энергодефицитных состояний. Также необходимо заметить, что предпочтение у больных раком гепатопанкреатодуоденальной зоны следует отдать гиперметаболическому варианту гипоэргоза, имевшему место в 56,2% случаев. Гипоксический вариант энергообмена фиксировали в 20,96% случаев соответственно. Учитывая формулу DO2, следует отметить, что для больных с гипоксическим видом гипоэргоза характерен сочетанный вид гипоксии: малого сердечного выброса, сочетающегося с гемической и тканевой, подтверждающийся высоким содержанием лактата (3,1±0,2 ммоль/л; р < 0,05). Таким образом, результаты проведенных исследований констатировали четкую взаимосвязь между характером изменений транспорта и потребления кислорода, что в конечном итоге позволило выявить механизмы, характеризующие формирование различных видов энергодефицита, в периоперационном периоде у больных со злокачественными заболеваниями органов гепатопанкреатодуоденальной зоны.
Учитывая всю сложность проблемы развития гипоэргоза у данной категории больных, поднимается вопрос об оценке их состояния на уровне организма как целого, с позиций общих неспецифических адаптационных реакций. Известно, что неспецифической основой различных патологических состояний является стресс. Эта реакция, впервые описанная Г Селье (1936, 1972, 1979) [13], характеризуется включением гипоталамо-гипофизарно-надпочечникового механизма, увеличивающего глюкокортикоидную функцию и каскадом инволютивных изменений лимфоидной ткани, щитовидной железы, половых желез. Таким образом, при стрессе ценой высоких энергозатрат и наличием элементов повреждения организм защищается от воздействия сильного раздражителя. Однако стресс не является единственной стандартной формой ответа организма как целого. В 70-е годы прошлого столетия стали известны еще 3 архетипа адаптационных реакций с характерными для них симптомокомплексами. Это антистрессорные реакции физиологического типа соответственно тренировка, спокойная и повышенная активация [13], различающиеся между собой и стрессом, и близкие к различным вариантам нормы (открытие № 158, 1975 г.) [13]. Это открытие, описывающее закономерности развития различных реакций в зависимости от силы раздражителя, легло в основу теории адаптационной деятельности организма. Идентификация адаптационных реакций у больных со злокачественными заболеваниями органов гепатопанкреатодуоденальной зоны позволила составить представление об их общей структуре в рамках выборки и на последующих этапах исследования. Таким образом, представленные выше данные свидетельствуют, что преморбидный фон у больных со злокачественными заболеваниями гепатопанкреатодуоденальной зоны характеризуется развитием различных видов энергообмена и сниженными возможностями защитных механизмов компенсаторно-приспособительных систем. Следовательно, злокачественный процесс способствовал ряду выявленных изменений энергодефицитных состояний, содействовал срыву адаптивных реакций физиологического типа и преобладанию реакций стресс-ответа организма у данной категории больных. В этих условиях резкое напряжение адаптивных механизмов проявляется на всех уровнях иерархической организации - от субклеточного до организменного. Это связано с существованием единых принципов структурного обеспечения реакций адаптации и согласованностью ритмов экзо- и эндогенных процессов [14]. Указанные изменения заставляют пересмотреть взгляд на тактику использования метаболических средств, содействующих восстановлению защитных механизмов адаптации и направленных на коррекцию различных вариантов нарушенного энергообмена, которые у этой категории больных представляют особую опасность. Как показали результаты наших исследований, метаболическую программу следует начинать непосредственно перед началом оперативного вмешательства и обеспечить позитивный антигипоксантный эффект до начала анестезии. Этот этап следует считать наиболее физиологически оправданным, так как в дальнейшем увеличивается возможность усугубления нарушений энергообмена в периоперационном периоде. Поэтому такую тактику метаболического обеспечения у больных со злокачественными новообразованиями гепатопанкреатодуоденальной зоны можно рассматривать как один из перспективных путей, снижающих последствия различных видов гипоэргоза и восстановления механизмов компенсаторно-адаптивных процессов. Это получило подтверждение при исследовании структуры антистрессорных реакций в ходе проведения метаболической программы. На этом фоне происходило уменьшение стрессорных реакций. При анализе результатов их исследования выявлено, что на 2-е и 5-е сутки периоперационного периода в основной группе больных средние значения антистрессорных реакций превалировали над суммарной реакцией стресса достоверно увеличиваясь от исходных. По-видимому, следует полагать, что полученные результаты и связаны, и реализуются через многокомпонентный состав ремаксола: сукцината, метионина, никотинамида и рибоксина, стабилизирующих метаболические процессы не только в мембранах гепатоцитов, но и мембранах клеток в целом. Следовательно, его важной особенностью является активное воздействие на DO2 и VO2. Как видно из представленных результатов, значения показателей кислородного транспорта в основной группе выглядят предпочтительнее, чем в контрольной, и свидетельствуют о нивелировании смешанных форм гипоксии при явлениях гипоксического гипоэргоза. В динамике повышалось содержание кислорода в артериальной крови, улучшалась артериовенозная разница, указывая на нормализацию функций дыхательной цепи в клетках. Наступало более выраженное и быстрое снижение метаболических изменений, нарушения энергообмена минимизировались и носили достоверный характер. По всей вероятности, это обусловлено мощной системой энергопродукции, которая образуется в организме больных в результате преобразования сукцината, а также других метаболических средств, входящих в состав ремаксола, необходимых для обеспечения жизнедеятельности в целом. В условиях возрастания нагрузки на органы и системы, участвующие в транспорте кислорода, и обеспечения их работы энергоснабжение поддерживается преимущественно за счет окисления янтарной кислоты. Мощность энергопродукции при этом в значительной степени превосходит все прочие системы энергообразования в организме, вырабатывая широкий диапазон неспецифического лечебного воздействия ремаксола. Таким образом, в результате проведенных исследований установлено, что у больных предложенный вариант метаболической программы позволил качественно и достоверно улучшить их состояние, благоприятствовал эффективной коррекции различных видов энергетической недостаточности, нивелированию смешанных форм гипоксии, обеспечивая восстановление адаптивных реакций физиологического типа в периоперационный период.
Выводы
1. Преморбидный фон больных со злокачественными заболеваниями органов гепатопанкреатодуоденальной зоны характеризуется различными видами энергетической недостаточности, срывом адаптивных реакций физиологического типа и преобладанием стрессорного ответа организма.
2. Дифференцированный подход к выбору патогенетически обоснованной метаболической программы в периоперационном периоде у больных со злокачественными заболеваниями органов гепатопанкреатодуоденальной зоны способствует редукции различных видов гипоэргоза, эффективной доставке и потреблению кислорода, адекватности тканевой оксигенации, восстановлению адаптивных реакций физиологического типа.
Финансирование. Исследование не имело спонсорской поддержки.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Литература
1. Патютко Ю.И. Хирургия рака органов билиопанкреатодуоденальной зоны. М.: Медицина; 2007.
2. Кошель А.П., Клоков С.С., Миронова Е.Б. Диагностика и лечение рака поджелудочной железы. Вопросы реконструктивной и пластической хирургии. 2012; (4): 60-5.
3. Кудашкин Н.Е., Агафонова М.Г., Котельников А.Г. и др. Стратегия радикального лечения опухолей периампуллярной локализации, осложненных механической желтухой. Фарматека. 2012; (8): 77-81.
4. Расулов Р.И., Хаматов Р.К., Сонголов Г.И. и др. Комплексное лечение больных местнораспространенным раком головки поджелудочной железы. Анналы хирургической гепатологии. 2013; (2): 75-89.
5. Лукьянова Л.Д. Гипоксия при патологиях. Молекулярные механизмыипринципыкоррекции.В кн.: Перфторорганические соединения в биологии и медицине. Пущино; 2001: 56-69.
6. Яковлев А.Ю., Чичканова А.С., Улитин Д.Н., Мокров К.В., Акуленко С.В. Коррекция печеночной дисфункции при подготовке к системной лекарственной терапии больных со злокачественными новообразованиями желчевыводящих путей. Вопросы онкологии. 2012; 58 (4): 3-6.
7. Гринев М.В., Гринев К.М. Цитокин-ассоциированные нарушения микроциркуляции (ишемически-реперфузионный синдром) в генезе критических состояний. Хирургия. 2010; (1)2: 70-6.
8. Трофимов В.А., Аксенова О.Н., Дудко А.А. и др. Перекисное окисление липидов в ядрах клеток печени мышей в норме и после частичной гепатэктомии. Бюл. экспер. биол. 2013; (4): 427-30.
9. Ефуни С.Н., Шпектор В.А. Гипоксические состояния и их классификация. Анестезиол. и реаниматол. 1986; (2): 3-12.
10. Костюченко А.Л., Семиголовский Н.Ю. Современные реальности клинического применения антигипоксантов. ФАРМиндекс: ПРАКТИК. 2002; 3: 102-22.
11. Мороз В.В. Стратегия и тактика применения антигипоксантов при критических состояниях. В кн.: Фундаментальные проблемы реаниматологии (Избранные лекции и обзоры): Труды института общей реаниматологии РАМН. М.; 2005; т. 4: 210-20.
12. Заболотских И. Б., Зыбин К. Д., Курзанов А. Н., Мусаева Т. С. Сверхмедленные биопотенциалы как способ экспресс-диагностики типа энергодефицита у реанимационных больных. Кубанский научный медицинский вестник. 2009; (1): 37-42.
13. Гаркави Л.Х., Квакина Е.Б., Кузьменко Т.С. Антистрессорные реакции активации. Активационная терапия. Реакция активации как путь к здоровью через процессы саморегуляции. М.: ИМЕДИС; 1998.
14. Саркисов Д.С. Общие закономерности и структурное обеспечение адаптации и компенсации нарушенных функций. Структурные основы адаптации и компенсации нарушенных функций. М.: Медицина; 1987: 9-83.
Conflict of interest. The authors declare no conflict of interest.
Funding. Нет информации!
References
1. Patyutko Yu.I. Cancer Surgery of Biliopankreatoduodenalnoy Zone. Moscow: Meditsina; 2007. (in Russian).
2. Koshel’ A.P., Klokov S.S., Mironova E.B. Diagnosis and treatment of pancreatic cancer. Voprosy rekonstruktivnoy i plasticheskoy khirurgii. 2012; (4): 60-5. (in Russian)
3. Kudashkin N.E., Agafonova M.G., Kotel’nikov A.G. et al. The strategy of radical treatment of tumors periampullyarnoy localization, complicated by obstructive jaundice. Farmateka. 2012; (8): 77-81. (in Russian)
4. Rasulov R.I., Khamatov R.K., Songolov G.I. et al. Complex treatment of patients with locally advanced pancreatic head. Annaly khirurgicheskoy gepatologii. 2013; (2): 75-89. (in Russian)
5. Luk’yanova L.D. Hypoxia pathologies. Molecular mechanisms and principles of correction. In: Perfluororganic Compounds in Biology and Medicine. Pushchino; 2001: 56-69. (in Russian)
6. Yakovlev A.Yu., Chichkanova A.S., Ulitin D.N., Mokrov K.V., Akulenko S.V. Correction of hepatic dysfunction in preparation for systemic drug therapy of patients with malignant tumors of the biliary tract. Voprosy onkologii. 2012; 58 (4): 3-6. (in Russian)
7. Grinev M.V., Grinev K.M. Cytokine-associated disorders of microcirculation (ischemia-reperfusion syndrome) in the genesis of critical states. Khirurgiya. 2010; (12): 70-6. (in Russian)
8. Trofimov V.A., Aksenova O.N., Dudko A.A. et al. Lipid peroxidation in the mouse liver cell nuclei in normal conditions and after a partial hepatectomy. Byul. eksper biol. 2013; (4): 427-30. (in Russian)
9. Efuni S.N., Shpektor V.A. Hypoxic conditions and their classification. Anesteziol. i reanimatol. 1986; (2): 3-12. (in Russian)
10. Kostyuchenko A.L., Semigolovskiy N.Yu. The Modern Reality of Clinical Application Antihypoxants. FARMindeks: PRAKTIK; 2002; 3: 102-22. (in Russian)
11. Moroz V. V. Strategy and tactics antihypoxants in critical conditions. In: Fundamental Problems of Resuscitation (Selected Lectures and Reviews): Proceedings of the Institute of General Medical Sciences Resuscitation. Moscow: 2005; Vol. 4: 210-20 (in Russian)
12. Zabolotskikh I.B., Zybin K.D., Kurzanov A.N., Musaeva T.S. Infraslow biopotentials as a way to express the type of energy deficiency diagnosis in critically ill patients. Kubanskiy nauchnyy meditsinskiy vestnik. 2009; (1): 37-42. (in Russian)
13. Garkavi L.Kh., Kvakina E.B., Kuz’menko T.S. Antistress Activation Reaction. Activation Therapy. The Reaction of Activation as a Way to Health Through Processes of Self-regulation. Moscow: IMEDIS; 1998. (in Russian)
14. Sarkisov D.S. General Regularities and Structural Maintenance of Adaptation and Compensation of Impaired Functions. Structural Basis of Adaptation and Compensation of Impaired Functions. Moscow: Meditsina; 1987: 9-83. (in Russian)
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 www.polysan.ru
www.polysan.ru www.polysan.ru
www.polysan.ru