Комплексная оценка эффективности Ремаксола у больных стеатогепатитом с гипераммониемией
Статьи
Опубликовано в журнале:
Экспериментальная и клиническая фармакология. 2020 Том 83 № 5 С. 24-28
DOI: 10.30906/0869-2092-2020-83-5-24-28
С. А. Алексеенко1, А. С. Колтунов1, Е. А. Агеева2, А. Ю. Сергеева2
1 ФГБОУ ВО ДВГМУ Минздрава РФ, Россия, 680000, Хабаровск, ул. Муравьева-Амурского, 35.
1 КГ БУЗ “Городская клиническая поликлиника № 3”, Россия, 680000, Хабаровск, ул. Дикопольцева, 34.
Изучена эффективность ремаксола у пациентов со стеатогепатитом различного генеза и гипераммониемией. Проанализированы результаты лечения 30 пациентов, получавших ремаксол внутривенно капельно со скоростью 40-60 кап/мин 400 мл 1 раз в сутки, курс 10 дней. Оценивали динамику (до начала лечения, через 5, 11 и 30 дней) общего самочувствия, когнитивных функций (“Тест связи чисел”), уровня билирубина, трансаминаз, гамма-глутамилтранспептидазы и аммиака крови. Применение ремаксола сопровождалось улучшением клинико-лабораторных данных: уменьшалась выраженность астении и когнитивных нарушений по тесту связи чисел в 1,2 раза к 11 дню наблюдения до (50,77±13,93) баллов. Выявлено улучшение функциональных печеночных показателей: снижение к 11 дню наблюдения средних значений уровня трансаминаз в 2,5 раза, гамма-глутамилтранспептидазы – в 1,9 раза, общего билирубина – в 1,7 раза, аммиака – в 1,8 раза, которое сохранялось до 30 дней от начала терапии (р ≤0,05). Корреляционный анализ выявил статистически значимую прямую корреляцию между уровнем аммиака, аспартатаминотрансферазы, общего билирубина, щелочной фосфатазы в крови и показателями теста связи чисел до начала терапии (ro1 = 0,64; ro2 = 0,39; ro3 = 0,72; ro4 = 0,49 при р <0,05). При этом общее самочувствие пациентов находилось в статистически значимой обратной зависимости от показателей теста, уровней аммиака, аспартатаминотрасферазы, щелочной фосфатазы, гамма-глутамилтранспептидазы и общего билирубина в крови (ro1 = -0,56; ro2 = – 0,46; ro3= -0,58; ro4 = -0,56; ro5 = -0,6; ro6 = -0,38 при р <0,05). Полученные результаты свидетельствуют об эффективности ремаксола у пациентов со стеатогепатитом различной этиологии с гипераммониемией, что, наряду с хорошей переносимостью препарата, позволяет рекомендовать его включение в схемы лечения.
Ключевые слова: стеатогепатит; гипераммониемия; ремаксол; янтарная кислота; астения; когнитивные нарушения.
Введение
Повышение уровня аммиака в крови (гипераммониемия) является одним из ведущих признаков метаболических нарушений и может развиваться у пациентов на доцирротической стадии [1,6]. Имеются экспериментальные данные о стимулирующем влиянии гипераммониемии на звездчатые клетки печени человека, что способствует прогрессированию портальной гипертензии и формированию фиброза печени. Также установлено, что гипераммониемия стимулирует эндо-ретикулярный и окислительный стресс и нарушает внутрипеченочную гемодинамику за счет развития нитрозативного стресса, что сопровождается нарастанием портального давления [13, 14]. Выявлено, что при неалкогольной жировой болезни печени (НАЖБП) на стадии стеатоза и при циррозе печени (ЦП) снижается активность ферментов цикла синтеза мочевины и синтеза глутамина в гепатобиоптатах на 20 и 50%, соответственно, в сравнении со здоровыми лицами [5, 12]. В механизмах развития стеатогепатита у больных с НАЖБП существенное значение имеет тканевая гипоксия, нарушение функций митохондрий, уменьшение запасов АТФ в гепатоцитах, в результате чего образуются свободные радикалы и активизируется перекисное окисление липидов, при этом повреждаются клеточные мембраны [15].
Аммиак легко проникает через гематоэнцефалический барьер, стимулирует транспорт ароматических аминокислот в головной мозг и тем самым усиливает синтез ложных нейромедиаторов, а также серотонина [3], что клинически у большинства пациентов проявляется развитием печеночной энцефалопатии (ПЭ) – комплекса потенциально обратимых нервно-психических нарушений, возникающих в результате острой или хронической печеночной недостаточности и/или порто-системного шунтирования крови. Однако есть данные о том, что у 10-15% пациентов с хроническими заболеваниями печени возможно развитие гипераммониемии без признаков ПЭ [9]. Диагноз ПЭ устанавливается на основании комплекса признаков, включающих клинические симптомы и клинико-лабораторные данные [8-10, 16].
Универсальным подходом при проведении патогенетической терапии у пациентов с поражениями печени является применение средств, способствующих восстановлению энергетического потенциала гепатоцитов, таких как ремаксол (ООО “НТФФ “ПОЛИ-САН”, г. Санкт-Петербург), состоящий из янтарной кислоты, меглюмина, инозина, метионина и никотинамида. Наиболее активным компонентом является янтарная кислота, анион которой – сукцинат, часто используют как синоним янтарной кислоты. Мощность системы энергопродукции, использующей сукцинат, в сотни раз превосходит мощность всех других систем энергообразования организма. Преимущества сукцината наиболее выражены в условиях гипоксии, когда НАД-зависимое клеточное дыхание угнетено. Инозин – производное пурина и структурный предшественник АТФ. Благодаря инозину увеличивается содержание общего пула пуриновых нуклеотидов, необходимых для ресинтеза не только макроэргов (АТФ и ГТФ), но также вторичных мессенджеров (цАМФ и цГМФ) и нуклеиновых кислот. Никотинамид активирует НАД-зависимые ферментные системы. Метионин, являясь незаменимой аминокислотой, регулирует жировой и белковый обмен, препятствует накоплению молекул нейтральных липидов в печени и служит кофактором реакций трансметилирования, необходимых для осуществления синтетических процессов в гепатоцитах. Ремаксол обладает клинической эффективностью при состояниях, сопровождающихся нарушениями функции печени из-за острого или хронического её повреждения алкогольного или токсического генеза, а также в терапии инфекционных и лекарственных гепатитов [4]. При этом в литературе результаты исследований, посвящённых комплексной оценке эффективности ремаксола в лечении больных стеатогепатитом, сопровождающимся гипераммониемией, отсутствуют.
В связи с этим проведено изучение эффективности ремаксола в составе комбинированной терапии пациентов со стеатогепатитом различного генеза и гипераммониемией.
Методы исследования
Проведен анализ результатов лечения 30 пациентов (13 женщин, 17 мужчин, от 29-59 лет, средний возраст – (46,5±7,7) лет) со стеатогепатитом неалкогольного (n = 21) и смешанного (n = 9) генеза и гипераммониемией в Бюджетном учреждении здравоохранения “Городская клиническая поликлиника № 3” г. Хабаровска.
Дизайн исследования был согласован на совещании кафедры госпитальной терапии лечебного факультета Дальневосточного государственного медицинского университета (ФГБОУ ВО ДВГМУ) Минздрава России (Протокол № 149 от 03.09.2018). Все пациенты подписали информированное согласие на включение в исследование.
Критериями исключения служили: цирроз печени, ВИЧ-инфекция, сифилис, вирусные гепатиты В и С, туберкулез, беременность и период грудного вскармливания, тяжелые системные заболевания, аутоиммунные заболевания в стадии декомпенсации, сахарный диабет, заболевания щитовидной железы, хроническая сердечная, легочная, почечная недостаточность, последствия острого нарушения мозгового кровообращения (ОНМК) и острого инфаркта миокарда (ОИМ), одна почка у пациента, наркотическая зависимость.
Обследование пациентов включало инструментальные: ультразвуковое исследование печени с оценкой косого вертикального размера (КВР) печени до лечения и на 30 день после начала терапии и эластографию (FibroScan, Франция), и лабораторные методы исследования: общий клинический анализ крови, уровень аммиака в крови (метод микродиффузии на аппарате PocketChem ВА РА-4140 (ARKRAY, Япония) [1], уровень аланианаминотрансферазы (АЛТ), аспартатаминотрансферазы (ACT), щелочной фосфатазы (ЩФ), гамма-глутамилтранспептидазы (ГГТП), общего билирубина и холестерина, глюкозы в крови стандартными методами.
Для выявления нарушений в когнитивной сфере и диагностики печеночной энцефалопатии использовали тест связи чисел [1]. Субъективную оценку общего самочувствия оценивали по выраженности астении (усталость, слабость, недомогание): 1 – невыносимые симптомы, 2 – очень выраженные симптомы, 3 – выраженные симптомы, 4 – слабо выраженные симптомы, 5 – симптомы отсутствуют. Оценка проводилась как самим пациентом, так и лечащим врачом в динамике наблюдения: перед началом лечения, на 5, 11 и 30 дни исследования.
В схему лечения всех пациентов был включен ремаксол внутривенно капельно со скоростью 40-60 кап./мин 400 мл 1 раз в сутки курсом в 10 дней.
Статистическая обработка и анализ полученных результатов были выполнены с помощью программного пакета StatSoft Statistica 6.1.478. Проверку нормальности распределения значений в выборках осуществляли по методу Шапиро-Уилка. Для определения корреляционной зависимости использовали коэффициент ранговой корреляции Спирмена (ro) при уровне вероятности р <0,05. Статистическую значимость динамики биохимических показателей, результатов теста связи чисел и общего самочувствия рассчитывали при помощи критерия Фридмана.
Результаты и их обсуждение
У всех пациентов на протяжении наблюдения отмечали признаки астении, оценка их выраженности проводилась как самим пациентом, так и врачом по совокупности клинико-лабораторных признаков. На фоне проведенного лечения отмечена статистически значимая положительная динамика общего самочувствия пациентов (рис. 1).
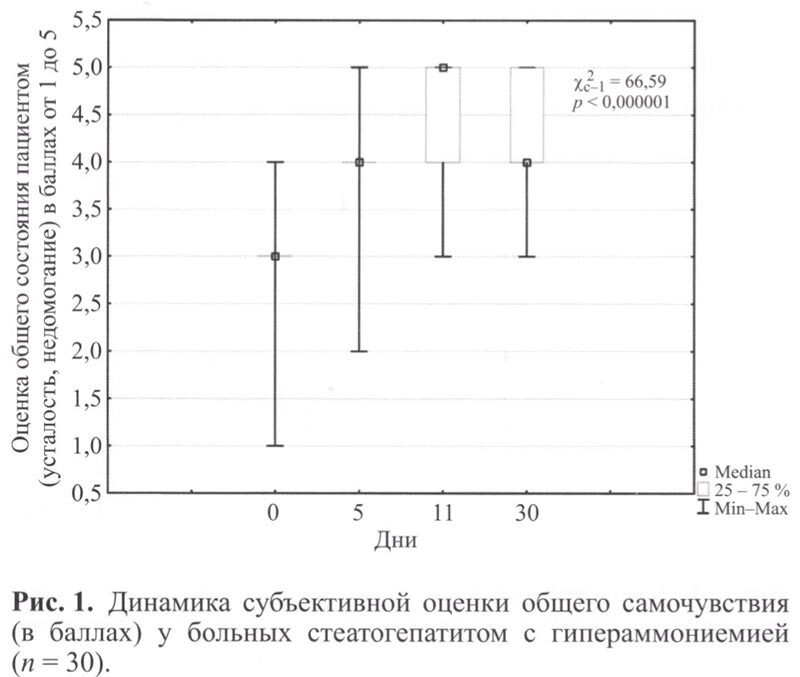
Кроме того, отмечены (таблица) совпадение оценки состояния пациентом и врачом, её положительная динамика на фоне проводимой терапии к 11 сут терапии и сохранение положительной динамики на 30 сут наблюдения (р ≥0,05).
Анализ биохимических показателей до начала лечения выявил повышение уровня трансаминаз (АЛТ 31-89 Ед/л, ACT 35-95 Ед/л), свидетельствующее о низкой степени активности воспалительного процесса, у 12 больных (40%). Умеренная степень активности (АЛТ 90-145 Ед/л, ACT 96-264 Ед/л) зарегистрирована у 17 пациентов (56,7%). Высокая степень активности (АЛТ 1498 Ед/л, ACT 549 Ед/л) зарегистрирована у 1 больного (3,3%). У 11 пациентов (36,7%) выявлена гипербилирубинемия в пределах 31,5-386,5 мкмоль/л. Умеренное повышение ГГТП (62-240 Ед/л) выявлено у 17 больных (56,7%). Выраженное повышение ГГТП (573-1559 Ед/л) выявлено у 3 пациентов (10%). Повышение уровня ЩФ в пределах 180-573 Ед/л выявлено у 10 больных (3,3%).
В динамике у 20 пациентов (66,7%) отмечена нормализация уровня трансаминаз к 10 дню лечения, на 30 день исследования – у 21 (70%) пациента (рис. 2, 3).
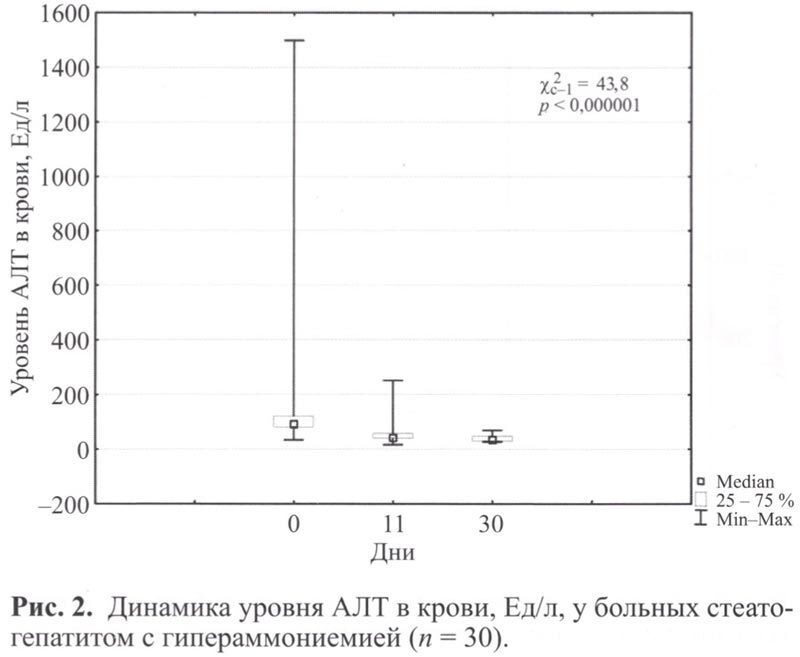
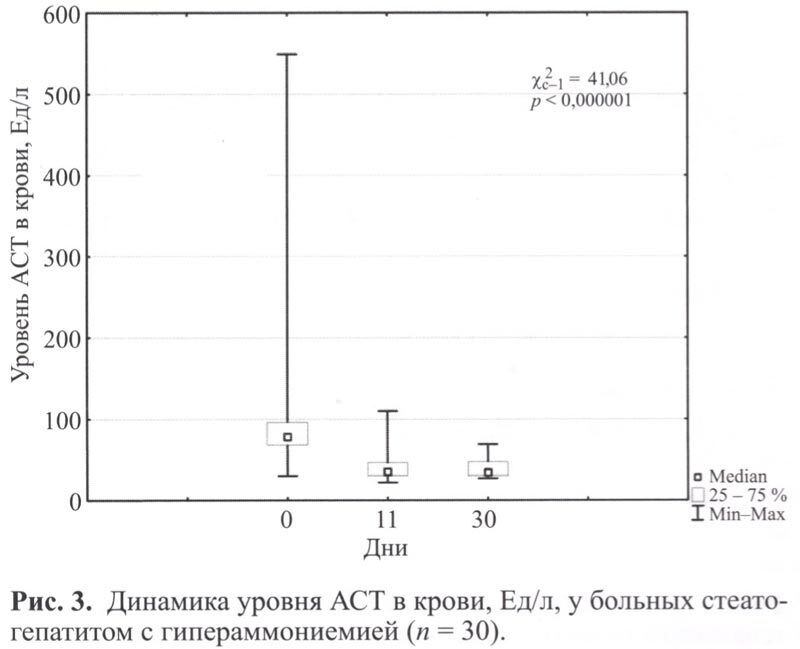
К 30 дню наблюдения у 7 пациентов (63,6%) с исходной гипербилирубинемией выявлена нормализация уровня общего билирубина (рис 4).
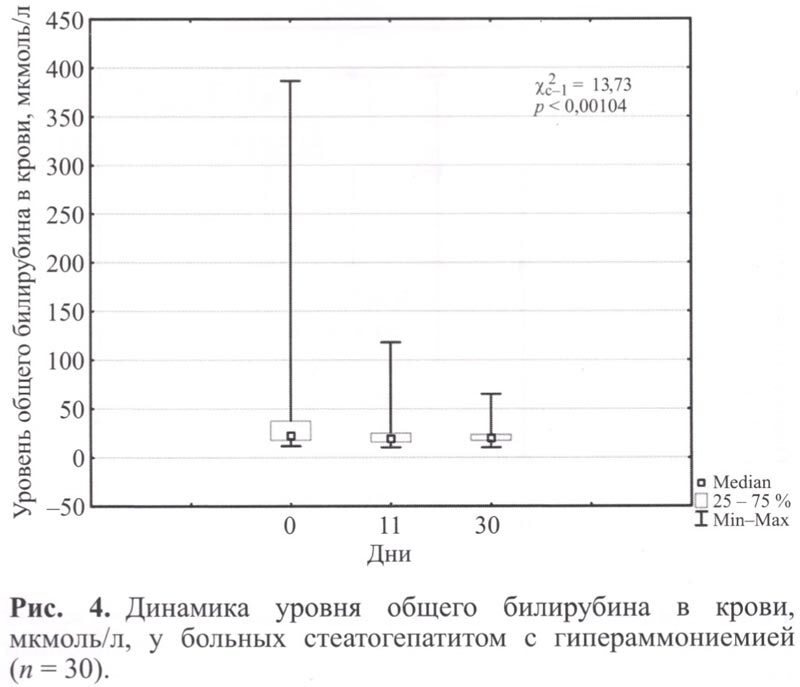
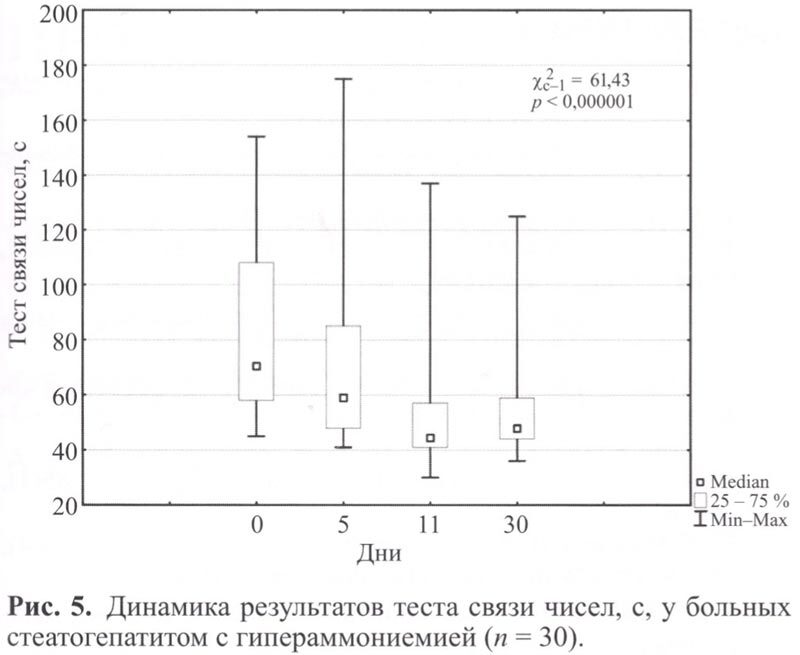
Тест связи чисел имел статистически значимую положительную динамику у всех пациентов по окончании курса лечения. Тем не менее к концу наблюдения нормализация показателей достигнута только 23,3% пациентов (рис. 5).
Динамика оценки самочувствия пациентами и врачами (М±т)
| Оценка состояния пациента, баллы | Срок наблюдения от начала лечения |
| до начала лечения | через 5 дней | через 11 дней | через 30 дней |
| Пациентом | 2,93±0,69 | 3,93±0,69 | 4,7±0,59 | 4,4±0,61 |
| Врачом | 3,3±0,47 | 4,1±0,72 | 4,7±0,53 | 4,5±0,57 |
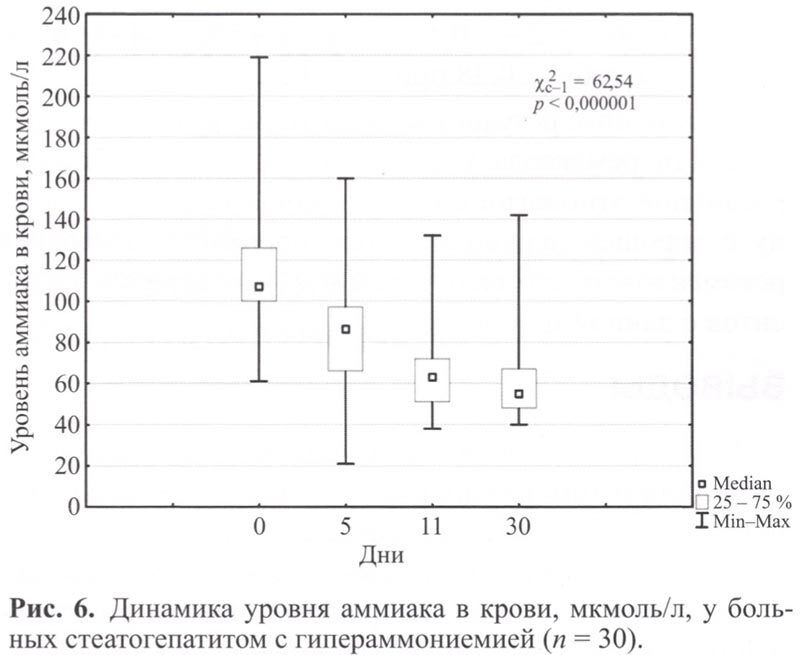
Отчетливое снижение уровня аммиака в крови наблюдали у всех пациентов на 10 день терапии, которое сохранялось на данном уровне к 30 дню исследования (рис 6).
Корреляционный анализ данных выявил, что у пациентов до лечения была статистически значимая прямая корреляция между уровнем аммиака и уровнями общего билирубина, ACT, ЩФ в крови, а также показателями теста связи чисел (ro1 = 0,64; ro2 = 0,39; ro3 = 0,72; ro4 = 0,49 при р <0,05). Общее самочувствие пациентов находилось в статистически значимой обратной зависимости от показателей теста связи чисел, уровней аммиака, ACT, ЩФ, ГГТП и общего билирубина в крови (ro1 = -0,56; го2=-0,46; ro3 = -0,58; ro4 = -0,56; ro5= -0,6; ro6 = -0,38 при р <0,05).
Нежелательных реакций, связанных с применением препарата, не выявлено.
Как известно, аммиак является одним из конечных продуктов обмена азотсодержащих веществ, постоянно образующихся в тканях организма. Аммиак является токсичным соединением, у здорового человека присутствует в крови в относительно небольших концентрациях (25-40 мкмоль/л) и быстро метаболизируется в печени до мочевины [2,3]. В связи с этим наиболее распространенными причинами формирования гипераммониемии являются нарушения деятельности печени различной этиологии.
Гипераммониемия признана одним из ведущих факторов развития и прогрессирования печеночной энцефалопатии и существенной причиной прогрессирования портальной гипертензии и фиброза печени [1, 11, 16]. У наблюдаемых пациентов до начала терапии были выявлены биохимические и инструментальные признаки фиброза печени: повышение более чем в 2,5 раза уровня общего билирубина, трансаминаз, ГГТП в крови, умеренные диффузные изменения паренхимы и повышение эхогенности печени, КВР печени соответствовал F3-F4 (по METAVIR), и гипераммониемия, среднее значение которой составило (117,73±34,05) мкмоль/л. Тест на наличие когнитивных нарушений выявил наличие признаков ПЭ I степени (среднее значение теста связи чисел (ТСЧ) до начала лечения – (62,15±24,75) баллов.
Ремаксол – препарат с гепатотропным, антигипоксическим, детоксицирующим, анаболическим и непрямым антиоксидантным свойствами, подтвержденными рядом экспериментальных и клинических исследованиях при патологии печени различного генеза, лекарственной гепатотоксичности, а также у пациентов в периоперационном периоде. Мета-анализ данных 5 рандомизированных клинических исследований подтвердил высокий терапевтический потенциал и хорошую переносимость препарата при медикаментозной коррекции поражений печени различной этиологии [7].
После курса ремаксола отмечено улучшение клинико-лабораторных данных: уменьшение выраженности астении и когнитивных нарушений (по ТСЧ в 1,2 раза к 11 дню наблюдения – до (50,77±13,93) баллов). Выявлено улучшение функциональных печеночных показателей: снижение к 11 дню наблюдения средних значений уровня трансаминаз в 2,5 раза, ГГТП – в 1,9 раза, общего билирубина – в 1,7 раза, аммиака – в 1,8 раза, которое сохранялось до 30 дня от начала терапии (р ≤0,05). При инструментальном обследовании через 30 дней от начала терапии признаки фиброза сохранялись, хотя выраженность процесса уменьшилась и соответствовала F2-F3 (р ≥0,05). Проведенный корреляционный анализ выявил статистически значимую прямую корреляцию между уровнем аммиака, ACT, общего билирубина, ЩФ в крови и показателями ТСЧ до начала терапии (ro1 =0,64; ro2 = 0,39; ro3 = 0,72; ro4 = 0,49 при р <0,05). При этом общее самочувствие пациентов находилось в статистически значимой обратной зависимости от показателей ТСЧ, уровней аммиака, ACT, ЩФ, ГГТП и общего билирубина в крови (ro1 = -0,56; ro2 = -0,46; ro3 = -0,58; ro4 = -0,56; ro5 = -0,6; ro6 = -0,38 при p <0,05).
Полученные результаты свидетельствуют об эффективности ремаксола у пациентов со стеатогепатитом различной этиологии с гипераммониемией, что, наряду с хорошей переносимостью препарата, позволяет рекомендовать его включение в схемы терапии пациентов с данной патологией.
Выводы
- На фоне лечения ремаксолом у пациентов со стеатогепатитом различной этиологии и гипераммониемией получена статистически значимая положительная динамика клинических данных (уменьшение выраженности астении) на фоне улучшения показателей печеночной активности (снижение уровня трансаминаз, общего билирубина и ГГТП), сохранявшаяся до 30 дня наблюдения.
- Применение ремаксола сопровождалось статистически значимой положительной динамикой восстановления уровня аммиака в крови на фоне уменьшения когнитивных нарушений (по результатам ТСЧ), также сохранявшейся до 30 дня наблюдения.
- Полученные данные, наряду с хорошей переносимостью ремаксола и длительностью эффекта (до 30 дней наблюдения), позволяют рекомендовать включение препарата в схемы терапии пациентов со стеатогепатитом и гипераммониемией для уменьшения риска прогрессирования заболевания и развития ряда возможных осложнений.
Литература
- С. А. Алексеенко, Е. А. Агеева, О. П. Полковникова, РМЖ. Мед. обозрение, 1(7), 19-23 (2018).
- Т. Т. Березов, Б. Ф. Коровкин, Биологическая химия, Медицина, Москва (2008).
- Е. В. Голованова, Терапия, 20(2), 49-55 (2018).
- В. А. Заплутанов, М. Г. Романцов, Д. С. Суханов, Ремаксол, Санкт-Петербург (2012).
- Т. Д. Звягинцева, А. И. Чернобай, Практикуючий лiкар, № 1,46-52 (2015).
- Л. Ю. Ильченко, И. Г. Никитин, Архив внутренней мед., 8(3), 186-193 (2018); doi: 10.20514/2226-6704-2018-8-3-186-193.
- Н. К. Мазина, П. В. Мазин, Д. С. Суханов, Тер. архив, 85(1), 56-61 (2013).
- Е. Л. Никонов, В. А. Аксенов, Доказат. гастроэнтерол., 6(4), 25-31 (2017); doi: 10.17116/dokgastro20176425-31.
- Ч. С. Павлов, И. В. Дамулин, В. Т. Ивашкин, Рос. ж. гастроэнтерол., гепатол., колопроктол., 26(1), 44-53 (2016).
- Я. С. Циммерман, Гастроэнтерол, Санкт-Петербурга, № 2, 68-75 (2017).
- V. Felipo, A. Urios, Е. Montesinos, et al., Metab. Brain Dis., 27(1), 51-58 (2012); doi: 10.1007/sll011-011-9269-3. Epub 2011 Nov. 10.
- I. Grgurevic, K. Podrug, I. Mikolasevic, et al.. Can. J. Gastroenterol. Hepatol., 2020; 9181368 (2020); doi: 10.1155/2020/9181368.
- R. Jalan, F. De Chiara, V. Balasubramaniyan, et al., J. Hepatol., 4(4), 823-833 (2016); doi: 10.1016/j.jhep._2015.11.019.
- Schiff’s Diseases of the Liver, E. R. Schiff, W. C. Maddrey, K. R. Reddy (eds.), Wiley Blackwell (2018).
- K. L. Thomsen, F. De Chiara, K. Rombouts, et al., Med. Hypotheses., 113, 91-97 (2018); doi: 10.1016/j.mehy.2018.02.010.
- H. Vilstrup, P. Amodio, J. Bajaj, et al., Hepatology, 60(2), 715-735 (2014); doi: 10.1002/hep._27210.
Comprehensive assessment of the effectiveness of Remaxol in the treatment of steatohepatitis patients with hyperammonemia
S. A. Alekseenko1, A. S. Koltunov1, E. A. Ageeva2, and A. Yu. Sergeeva2
1 Far Eastern State Medical University, ul. Murav'eva-Amurskogo 35, Khabarovsk, 680000 Russia
2 Municipal Clinical Hospital No. 3, ul. Dikopoltseva 4, Khabarovsk, 680000 Russia
The efficacy of remaxol in patients with steatohepatitis of various origins complicated by hyperammonemia has been studied. Results of treatment of a group of 30 patients receiving remaxol intravenously via dripper at a rate of 40-60 drop/min in a dose of 400 mL once a day over 10-days course were analyzed. The dynamics (before treatment, 5, 11, and 30 days after treatment) were assessed in terms of general well-being, cognitive functions (number-link test) and level of bilirubin, transaminases, gamma-glutamyl transpeptidase, and blood ammonia. The administration of remaxol led to improvement in clinical and laboratory indices including decreased severity of asthenia and cognitive impairment (number-link test index decreased 1.2 times to 50.77±13.93 points) and improved liver function indices (average transaminase level decreased 2.5 times, gamma-glutamyl transpeptidase 1.9 times, total bilirubin 1.7 times, and ammonia 1.8 times) by the 11th day of observation and remained on these levels up to 30 days from the start of therapy (p ≤0.05). Correlation analysis revealed a statistically significant direct correlation between the levels of ammonia, aspartate aminotransferase, total bilirubin, and alkaline phosphatase in the blood and indicators of the number-link test before the start of therapy (ro1 = 0.64; ro2 = 0.39; ro3 = 0.72; ro4 = 0, 49 at p <0.05). The general well-being of the patients was in a statistically significant inverse dependence on the test parameters, levels of ammonia, aspartate aminotransferase, alkaline phosphatase, gamma-glutamyl transpeptidase and total bilirubin in the blood (ro1 = -0.56; ro2 = -0.46; ro3 = -0,58; ro4 = -0.56; ro5 = -0.6; and ro 6 = -0.38 at p <0.05). The obtained results indicate the effectiveness of remaxol administration in patients with steatohepatitis of various etiologies complicated with hyperammonemia and, in view of good tolerability of the drug, allow remaxol inclusion in the treatment regimen of patients with this pathology.
Keywords: steatohepatitis; hyperammonemia; remaxol; succinic acid; asthenia; cognitive impairment.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 www.polysan.ru
www.polysan.ru www.polysan.ru
www.polysan.ru