Анестезиологическое обеспечение и интенсивная терапия при проведении гипертермической интраоперационной внутрибрюшной химиотерапии у больных раком желудка Обзор литературы и собственный клинический опыт
Статьи
Опубликовано в журнале:
«Анестезиология и реаниматология», 2015, ТОМ №60, № 1, с. 50-54
Хороненко В.Э., Шеметова М.М., Дрожжина О.В., Хомяков В.М., Соболев Д.Д.
ФГБУ Московский научно-исследовательский онкологический институт им П.А. Герцена Министерства здравоохранения РФ, 125284, г.Москва
Несмотря на неуклонное снижение заболеваемости в последнее 10-летие, рак желудка остается одной из самых частых причин смерти от злокачественных новообразований в мире. К моменту постановки диагноза почти у 70% больных опухолевый процесс носит местно-распространенный или генерализованный характер, что снижает возможность радикального хирургического лечения. Одной из основных причин неэффективности лечения становится перитонеальный канцероматоз. Между тем такой категории больных показано комплексное лечение в виде циторедуктивных операций с гипертермической интраоперационной внутрибрюшной химиотерапией (ГИВХ) для улучшения качества и увеличения продолжительности жизни. На сегодняшний день в нашей стране хирургические вмешательства с использованием методики ГИВХ выполняются в очень ограниченном числе онкологических стационаров, поэтому единого подхода к периоперационному ведению этого контингента больных пока нет. В нашем институте с ноября 2010 г. ведется проспективное клиническое исследование, посвященное применению гипертермической интраоперационной внутрибрюшной химиотерапии у больных с местно-распространенным и диссеминированным раком желудка. Материал и методы. В исследование вошли 30 пациентов (18 мужчин и 12 женщин), которым выполняли оперативные вмешательства в объеме чрезбрюшинной гастрэктомии с расширенной лимфаденэктомией D2, дополненные принципиальной холецистэктомией и овариоэктомией (у женщин). Средний возраст пациентов составил 48,5 ± 5,3 года. Методика анестезии включала использование регионарного компонента и ингаляционного анестетика севофлурана. С целью улучшения результатов лечения, руководствуясь современными тенденциями, направленными на раннее восстановление по методике fast track, проводили предоперационную подготовку: энтералъное питание (из расчета 25-30 ккал/кг/сут), гепатопротекция (внутривенная инфузия раствораремаксол 500мл/сут, за 3 сут до оперативного вмешательства), антисекреторная и антиферментная терапия (омепразол 40 мг/сут, октреотид 100 мкг за 2 ч до операции, апротинина сульфат 30000 АТрЕ после вводной анестезии), антиоксидантная и иммуномодулирующая терапия (галавит, цитофлавин, церулоплазмин, витамин С), антикоагулянтная профилактика (эноксапарин натрия 40 мг вечером накануне оперативного вмешательства). Результаты. Анализ мирового и собственного клинического опыта применения ГИВХ в комплексном плане лечения больных раком желудка показал, что безопасность этой агрессивной, но высокоэффективной методики требует не только тщательного отбора пациентов согласно критериям, но и использования специальных методов защиты пациента на всех этапах хирургического лечения. Применение патогенетически обоснованных способов защиты от термической травмы, своевременный контроль и коррекция нарушений гомеостаза, вызванных токсическим воздействием химиопрепаратов и ожогом брюшины, раннее начало энтералъного питания и использование органопротекторной терапии позволяет снизить риск развития осложнений и добиться улучшения результатов лечения онкологических больных.
Ключевые слова: гипертермическая интраоперационная внутрибрюшная химиотерапия; предоперационная подготовка; перитонеальный канцероматоз; лечение диссеменированного рака желудка, анестезия. Для цитирования: Анестезиология и реаниматология. 2015; 60 (1).
Anaesthesia And Intensive Care During Intraoperative Intraperitoneal Hyperthermic Chemotherapy In Patients With Gastric Cancer (Literature Reviewand Own Clinical Experience)
Khoronenko V.E., Shemetova M.M., Drozhzhina O.V., Khomyakov V.M., Sobolev D.D.
Gertsen Scientific Research Oncological Institute, Dept of Anaesthesiology & Intensive Care, Moscow, Russian Federation
Despite a steady decline in the incidence in recent decades, gastric cancer remains one of the most frequent causes of death from cancer in the world. By the time of diagnosis the tumor process is locally advanced or generalized in nearly 70% of patients that reduces the possibility of radical surgical treatment. Peritoneal carcinomatosis is a one of the main causes of treatment failure. This patients need complex treatment with cytoreductive surgery and intraoperative hyperthermic intraperitoneal chemotherapy (IHIC) to improve the quality and duration of life. Today in Russia, surgeries with IHIC are performed in a very limited number of oncology hospitals, thus there is no unified approach to the perioperative management of these patients. Design: Since November 2010 in our institution we started a prospective clinical study of the use of intraoperative hyperthermic intraperitoneal chemotherapy in patients with locally advanced or metastatic gastric cancer. Materials and Methods: The study included 30 patients (18 men and 12 women) who underwent transabdominal gastrectomy with extended lymphadenectomy D2, supplemented principled cholecystectomy and oophorectomy (in women). Mean age was 48.5 ± 5.3 years. Technique involved the use of regional anesthesia component and inhalation anesthetic sevoflurane. Preoperative preparation included enteral nutrition (based on 25-30 kcal / kg / day), liver protection (intravenous remaxol infusion of 500 ml / day for 3 days prior to surgery), antisecretory and antifermental therapy (omeprazole 40 mg / day, 100 mg octreotide for 2 h before surgery, aprotinin sulfate 30000 after induction of anesthesia), antioxidant and immunomodulatory therapy (galavit, cytoflavin, ceruloplasmin vitamin C), anticoagulant prophylaxis (enoxaparin sodium 40 mg on the evening before surgery). Results: Analysis of the world and our own clinical experience with intraoperative hyperthermic intraperitoneal chemotherapy in a comprehensive plan of treatment of patients with gastric cancer showed that the this aggressive, but highly effective technique can be requires not only careful patient selection according to the criteria, but also the use of special methods to protective therapy at all stages of the surgical treatment. Application of pathogenetic ways of protection from thermal injury, timely control and correction of homeostasis caused by the toxic effects of chemotherapy and burn peritoneum, early enteral nutrition and the use of organ-therapy reduce the risk of complications and achieve better results of treatment in cancer patients.
Keywords: hyperthermic intraoperative intraperitoneal chemotherapy, preoperative preparation, peritoneal carcinomatosis, treatment of gastric cancer, anaesthesia
Несмотря на неуклонное снижение заболеваемости в последнее десятилетие, рак желудка остается одной из самых частых причин смерти от злокачественных новообразований в мире. В России в 2010 г. было диагностировано 36,7 тыс. новых случаев рака желудка [1]. Из общего числа пациентов I—II стадии болезни установлена лишь у 26,3% больных, III стадия диагностирована у 27,2% , IV - у 42,3% пациентов. Таким образом, к моменту постановки диагноза почти у 70% больных в нашей стране опухолевый процесс носит местно-распространенный или генерализованный характер [1, 2, 15,24, 31].
Основным методом лечения, который дает надежды на стойкое выздоровление больных раком желудка, является выполнение радикального оперативного вмешательства. Однако при распространенности опухолевого процесса в течение 1-го года после операции у 60-70% пациентов наблюдается рецидив заболевания, 5-летний рубеж переживают менее 30% больных. Одной из основных причин неэффективности хирургического лечения при первично-резектабельном раке становится перитонеальный канцероматоз - ПК [10,11,16,18,20,23,28, 37]. Более 20% больных с диссеминацией по брюшине, находящихся на лечении в общехирургических стационарах, получают лишь симптоматическую помощь по неотложным показаниям, хотя из них около 75% не имеют отдаленных метастазов. Они многократно поступают в больницы с напряженным асцитом и значительную часть жизни проводят в этих лечебных учреждениях, где им выполняют лишь повторные лапароцентезы для эвакуации жидкости из брюшной полости. Между тем такой категории больных показано комплексное лечение в виде циторедуктивных операций с гипертермической интраоперационной внутрибрюшинной химиотерапией (ГИВХ) для улучшения качества и увеличения продолжительности жизни [4,13,19,21,27,28].
Условия процедуры ГИВХ позволяют химиопрепарату воздействовать непосредственно на пораженные ткани, избегая гематоперитонеального плазматического барьера, который ограничивает резорбцию цитостатиков из брюшной полости в кровь. Тем самым можно существенно увеличивать дозу, а, следовательно, эффективность препаратов в сравнении с системной химиотерапией и снизить их токсическое системное действие. Возможность регионарного введения лекарственного препарата при высокой температуре увеличивает как его цитотоксическую активность, так и его проникновение в неопластические клеточные слои. Известно, что по сравнению с нормальными клетками опухолевые наиболее чувствительны к нагреванию в температурном диапазоне от 42 до 44°С, в нормальных тканях температурный режим для возникновения процессов необратимой клеточной деструкции составляет в среднем 45,7°С. Патогенетический эффект локальной гипертермии основан на способности температурного фактора (42°С и более) вызывать стойкую денатурацию белковых структур опухолевых клеток, инактивировать клеточные ферментные системы и синтез ДНК, изменять реологические свойства крови с нарушением микроциркуляторного кровотока в зоне опухоли, а также увеличивать проницаемость цитоплазматической мембраны за счет активизации перекисного окисления липидов, что приводит к пенетрации и депонированию цитотоксического агента внутри самой раковой клетки и ведет к ее гибели [5,14,16,22, 33].
В 1980-х годах Р.Н. Sugarbaker [29] на основе ряда исследований подтвердил эффективность циторедуктивной операции с применением ГИВХ у пациентов с ПК и оптимизировал данную методику, что послужило основанием для ее дальнейшего развития и широкого распространения по всему миру [3,7, 9,12,25, 32, 40]. В связи с этим в последние 15 лет интерес к изучению эффективности внутрибрюшинного введения противоопухолевых препаратов при раке желудка как способа профилактики и лечения ПК существенно возрос.
Большинство исследователей оценивают ГИВХ как достаточно безопасный метод, обладающий значительно меньшей гематологической токсичностью по сравнению с системной химиотерапией. Так, по данным Г. Schwarz и соавт. [41], гематологическая токсичность 3—4-й степени на фоне проведения ГИВХ, включающей митомицин, цисплатин, 5-фторурацил, проявляется анемией у 6,6% больных, лейкопенией у 13,2 %, тромбоцитопениейу 15,3% [34, 35,41].
Тем не менее, являясь одним из наиболее перспективных методов в лечении канцероматоза брюшины, циторедуктивная хирургия с применением ГИВХ имеет множество осложнений, связанных с использованием гипертермии при проведении процедуры и последствиями ожога брюшины, а также токсическим действием химиопрепаратов. В послеоперационном периоде они развиваются в 27% случаев, из них 1,5% приводят к летальным исходам [6, 8, 17]. К наиболее значимым осложнениям следует отнести острую почечную, сердечную недостаточность и пневмонию.
Применение препаратов платины наиболее часто приводит к развитию острой почечной недостаточности (3%) и тяжелой послеоперационной тошноте и рвоте, что связано с выраженной нефротоксичностью [13, 19, 25, 36]. Те или иные токсические эффекты имеют место почти у половины больных (40-50%), что вносит существенные коррективы в тактику периоперационного ведения таких пациентов. Для предупреждения развития осложнений проводится гипергидратация, достигаемая введением больших объемов инфузионных сред, что в свою очередь увеличивает нагрузку на сердечно-сосудистую систему, приводит к усугублению анемии и негативно сказывается на процессах свертывания крови вследствие гемодилюции.
Значимым последствием гипертермической перфузии является массивная потеря белка в результате ожога брюшины и образования транссудата, что приводит к выраженной гипопротеинемии с возможными гемодинамическими нарушениями в послеоперационном периоде [5,16]. Профилактика подобных осложнений заключается в своевременном контроле температуры перфузионного раствора, температуры тела пациента, уровня общего белка, альбумина и коррекции гипопротеинемии.
С повышением температуры во время проведения процедуры ГИВХ у больных происходит постоянное нарастание нагрузки на кровеносную систему вследствие развития гипердинамического состояния. Отмечается увеличение частоты сердечных сокращений, снижение сердечного выброса и системного сосудистого сопротивления. Первоначальным ответом на тепловой стресс является расширение периферической сосудистой сети, возникает несоответствие объема циркулирующей крови сосудистому руслу. Гиповолемия приводит к еще большему росту числа сердечных сокращений, формируя порочный круг [13,30]. Высокая температура тела повышает скорость метаболизма, увеличивая системную потребность в кислороде. Нивелировать отрицательное воздействие гипертермии на кровообращение можно, только препятствуя резкому повышению температуры, что достигается подогревом инфузионных сред и самого пациента. Постепенное изменение температуры позволяет организму включить механизмы адаптации и частично скомпенсировать повреждающее воздействие [18].
При заполнении полости перфузатом происходит увеличение внутрибрюшного давления и смещение диафрагмы, что приводит к снижению функциональной остаточной емкости легких и увеличению давления в дыхательных путях. Эти изменения ведут к снижению оксигенации легочной ткани и резкому рефлекторному повышению центрального венозного давления, которое, помимо неблагоприятно влияния на сердечный выброс, может способствовать развитию пневмонии в послеоперационном периоде [22].
Специфичным для пациентов, перенесших ГИВХ, является выраженный плохо купируемый послеоперационный болевой синдром, обусловленный, по мнению большинства исследователей, ожогом брюшины. Абдоминальная боль имеет место у 50 % пациентов [24].
По данным многих авторов, ГИВХ не приводит к повышению частоты хирургических осложнений (абсцессов, спаечной кишечной непроходимости), а также несостоятельности швов межкишечных анастомозов. Последнее подтверждено экспериментальными данными, полученными в исследованиях на животных [12, 40]. Высокий риск развития инфекционных осложнений определяется скомпрометированным общим соматическим статусом онкологических больных, длительной продолжительностью и высокой травматичностью оперативных вмешательств принятых в онкологии, сниженной по сравнению с другими категориями пациентов физической активностью в раннем послеоперационном периоде. Среди инфекционных осложнений наиболее часто встречается пневмония 3,5-6% [18, 38], что обусловлено, как показано выше, и особенностями выполнения процедуры ГИВХ.
Применение методики ГИВХ делает хирургическое вмешательство более агрессивным. Существенно увеличивается продолжительность операции и анестезии (в среднем на 1,5-2 ч), происходит усиление ноцицептивной импульсации. Термическое и токсическое воздействие часто приводит к интраоперационным нарушениям гемодинамики, связанным с нарушением водно-электролитного и кислотно-щелочного равновесия, анемией и гипопротеинемией [13, 39]. Все перечисленное выше требует разработки критериев отбора, алгоритма предоперационной подготовки пациентов к подобным вмешательствам, а также тактики анестезии и послеоперационной интенсивной терапии.
На сегодняшний день в нашей стране хирургические вмешательства с использованием методики ГИВХ выполняются в очень ограниченном числе онкологических стационаров, поэтому единого подхода к периоперационному ведению этого контингента больных пока нет. В нашем институте с ноября 2010 г. ведется проспективное клиническое исследование, посвященное применению ГИВХ у больных с местно-распространенным и диссеминированным раком желудка. Продолжается набор клинического материала, отработка протоколов предоперационной подготовки, анестезиологического обеспечения и послеоперационной интенсивной терапии, направленных на оптимизацию лечения и снижение количества осложнений.
Собственный клинический опыт. Критериями включения для проведения ГИВХ является гистологически подтвержденный местно-распространенный и диссеминированный рак желудка с одним или несколькими из нижеперечисленных факторов: 1) массивный выход на серозную оболочку; 2) тотальное/ субтотальное поражение с инвазией до субсерозной оболочки (скирр); 3) наличие специфического экссудата либо свободных раковых клеток в смывах при срочном интраоперационном цитологическом исследовании или по результатам дооперационного обследования (пункции); 4) наличие ограниченной диссеминации (Р1/Р2) при условии выполнения полной циторедукции (CC-0/CC-l); 5) наличие метастазов в яичниках.
Критерии исключения: 1) возраст старше 70 лет; 2) тяжелая сопутствующая патология в стадии обострения или субкомпенсации; 3) ожирение (ИМТ более 40); 4) анемия 9/л, тромбоцитопения 9/л; 5) распространение опухоли на пищевод, требующее выполнения операции из комбинированного доступа (торакотомии); 6) вовлечение поджелудочной железы, требующее ее резекции; 7) массивная (РЗ) диссеминация по брюшине либо ограниченная диссеминация при невозможности полной циторедукции; 8) отдаленные метастазы (гематогенные и экстраабдоминальные лимфогенные); 9) выраженный спаечный процесс вследствие ранее перенесенных вмешательств на органах брюшной полости; 10) кахексия; 11) беременность или кормление грудью; 12) любые иные клинические состояния, которые, по мнению исследователя, могут препятствовать безопасному выполнению протокола; 12) отказ больного о проведения лечения.
Материал и методы. В исследование вошли 30 пациентов, среди них 18 мужчин и 12 женщин, которым выполняли оперативные вмешательства в объеме чрезбрюшинной гастрэктомии с расширенной лимфаденэктомией D2, дополненные принципиальной холецистэктомией и овариоэктомией (у женщин). Средний возраст пациентов составил 48,5 ± 5,3 года. По сопутствующей соматической патологии распределение пациентов было следующее: дыхательная недостаточность 1-2-й степени на фоне ХОБЛ 2 пациента; ПИКС - 1 больной; ИБС - 3 пациента; артериальная гипертензия - 7 пациентов. По категориям физического статуса ASA больные относились ко II классу. Среднее время операции составило 7,28 ± 0,3 ч.
Па предоперационном этапе, помимо рутинных исследований (ЭКГ, лабораторные тесты), всем больным были выполнены ультразвуковое ангиосканирование вен нижних конечностей, эхокардиография, суточное мониторирование ЭКГ по Холтеру, исследование функции почек (нефросцинтиграфия), исследование функции внешнего дыхания.
Перед операцией пациентам назначали стандартную 3-ступенчатую премедикацию: диазепам (0,15 ± 0,03 мг/кг) накануне операции в 22 ч. В день операции в 7 ч 30 мин 0,15 ± 0,03 мг/кг диазепама. За 40 мин до начала оперативного вмешательства 0,15 ± 0,03 мг/кг диазепама, 0,01 мг/кг атропина, 0,3 мг/кг супрастина, 1,4 мг/кг трамадола. В качестве компонента превентивной анальгезии непосредственно перед началом вводной анестезии пациентам внутривенно капельно вводили раствор парацетамола в дозе 1000 мг.
Методика анестезии включала использование регионарного компонента и ингаляционного анестетика севофлурана, что позволяло адекватно провести анестезиологическую защиту пациента от операционного стресса на всех этапах операции.
Вводная анестезия (диазепам 0,15±0,03 мг/кг, пропофол 0,85 ± 0,31 мг/ кг, фентанил 0,003±0,0005 мг/кг, кетамин 0,65±0,2 мг/кг) была одинаковой и проводилась по принятой в институте методике.
Катетеризация эпидурального пространства осуществлялась по стандартной методике на уровне ThVI-ThVIII позвонков, с проведением катетера краниально на 4—5 см. После введения тест-дозы 2% лидокаина 2% (2 мл) и исключения возможных осложнений начиналась инфузия 0,35% раствора ропивакаина в эпидуральное пространство с насыщающей скоростью 8-10 мл/ч и последующим снижением до 4—6 мл/ч. Поддержание анестезии осуществлялось ингаляцией севофлурана 0,8-1,0 МАК в кислородно-воздушной смеси (Fi02 0,3-0,6), введением фентанила (0,00137 ± 0,00061 мг/ кг x ч), кетамина (0,19 ± 0,03 мг/кг x ч), миорелаксация обеспечивалась рокурония бромидом (1,43 ± 0,12 мг/кг).
По окончании оперативного вмешательства осуществляли пробуждение пациентов на операционном столе и перевод на самостоятельное дыхание, при отсутствии адекватного восстановления мышечного тонуса выполняли реверсию нервно-мышечного блока - суггамадекс 3,5 ± 0,73 мг/кг.
В послеоперационном периоде обезболивание пациентов осуществляли постоянной инфузией 0,2% ропивакаина в эпидуральное пространство со скоростью 6-8 мл/ч под контролем гемодинамических показателей и оценки уровня боли по визуально аналоговой шкале. При необходимости по мере нарастания болевого синдрома пациентам назначали тримепередин (0,85 ± 0,006 мг/кг/сут). Дополнительное обезболивание - препараты НПВС и парацетамол не использовали ввиду негативного их влияния на функцию печени и мочевыделительной системы.
Во время анестезии мониторинг ЧСС, АД неинвазивное и АД инвазивное (лучевая артерия), Sp02, EtC02, ЭКГ, термометрию осуществляли в непрерывном режиме (монитор CarescapeB850, GE Medical systems, США). Адекватность анестезии оценивали путем определения уровня глюкозы, лактата крови; уровень седации - с использованием метода энтропии (встроенный модуль монитора Carescape B850, GE Medical systems, США). Экспресс-методом оценивали показатели газообмена, кислотно-основного состояния (КОС), Hb, Ht, уровни глюкозы и электролитов плазмы крови. Регистрировали общий объем кровопотери, инфузионно-трансфузионной терапии, темп мочеотделения. Для предотвращения нежелательных стрессовых реакций, связанных с перепадом температур во время ГИВХ и нарушениями терморегуляции для подогрева и охлаждения инфузионных сред и пациента использовали специальные приборы для подогрева инфузионных сред (STIHLER, Германия) и стабилизирующие термоодеяла с системой обогрева пациента (Bair Hugger, Германия) (см. таблицу).
Показатели гемодинамики пациентов на этапах анестезии и операции
| Параметр |
Этап анестезии и операции |
после
премедикации |
начало ГИВХ |
температурный максимум |
окончание ГИВХ |
| АДс, ммрт. ст. |
132 ± 13 |
105 ± 10 |
90 ± 13 |
110 ± 14 |
| АДд, ммрт. ст. |
71 ± 15 |
54 ± 9 |
39 ± 4 |
41 ± 11 |
| АДср, мм рт. ст. |
100 ± 12 |
77 ± 8 |
95 ± 13 |
100 ± 12 |
| ЧСС, (мин-1) |
75 ± 5 |
78 ± 4 |
105 ± 3 |
97 ± 4 |
В послеоперационном периоде в условиях отделения реанимации и интенсивной терапии проводили контроль основных витальных функций (неинвазивное АД, ЧСС, SpO2, ЭКГ, термометрия), контроль показателей общего, биохимического анализов крови, коагулограммы, тромбоэластограммы, кислотно-основного состояния. При необходимости выполняли обзорную рентгенографию органов грудной клетки и санационную фибробронхоскопию, ультразвуковое дуплексное ангио-сканирование нижних конечностей. Проводили сравнительный анализ динамики печеночных ферментов, сроков вертикализации и послеоперационной реабилитации, характера и сроков возникновения послеоперационных осложнений.
Сеанс ВГХТ проводили после завершения хирургического этапа при помощи интраперитонеальной гипертермической химиотерапевтической системы SunCHIP (GamidaTech, Франция) по открытой методике. Лаваж осуществляли физиологическим раствором (2 л/м2) с добавлением цисплатина в дозе 75 мг/м2 и митомицина С в дозе 20 мг/м2. Температура перфузата на входе в брюшную полость составляла 44—45°С, на выходе - 42-43°С. Длительность процедуры -1ч. Адъювантная системная химиотерапия после операции не проводилась.
В начале исследования специальная предоперационная подготовка пациентов не проводилась. Пациенты были объединены для анализа в 1-ю группу (n = 21). В дальнейшем с целью улучшения результатов лечения руководствуясь современными тенденциями, направленными на раннее восстановление по методике fast track, мы приступили к поиску оптимальных методов предоперационной подготовки. Была сформирована 2-я группа, которая в настоящее время насчитывает 9 больных. Пациентам 2-й группы на этапе подготовки к операции осуществляли: энтеральное питание (из расчета 25-30 ккал/кг/сут), гепатопротекцию (внутривенная инфузия раствора ремаксола 500 мл/сут за 3 сут до оперативного вмешательства), антисекреторную и антиферментную терапию (омепразол 40 мг/сут, октреотид 100 мкг за 2 ч до операции, апротинина сульфат 30 000 АТрЕ после вводной анестезии), антиоксидантную и иммуномодулирующую терапию (галавит, цитофлавин, церулоплазмин, витамин С), антикоагулянтную профилактику (эноксапарин натрия 40 мг вечером накануне оперативного вмешательства).
При выявлении на догоспитальном этапе сопутствующей патологии в стадии субкомпенсации пациенты направлялись к профильным специалистам (кардиологу, пульмонологу, нефрологу) с целью подбора адекватной терапии или ее коррекции при необходимости с повторной госпитализацией в стационар.
Результаты исследования и их обсуждение. В группах пациенты были сопоставимы по полу, возрасту, характеру основного и сопутствующих заболеваний и их терапии. Всем пациентам успешно выполнены оперативные вмешательства запланированного объема и проведена процедура ГИВХ. Интраоперационная кровопотеря составила в среднем 600 ± 57,3 мл, внутривенная инфузия - 6396 ± 211,3 мл, диурез - 261,2 ± 15,6 мл/ч.
При анализе полученных данных течение анестезии у всех пациентов было стабильным, гемодинамических отклонений не выявлено, достоверных отличий по уровню среднего АД и ЧСС на разных этапах операции между группами не получено. На момент выполнения процедуры ГИВХ у всех больных отмечалась аналогичная динамика показателей кровообращения в виде снижения АД и повышения ЧСС, которая коррелировала с постепенным нарастанием температуры в брюшной полости и пищеводе, что можно расценивать как компенсаторную реакцию. Во всех случаях ЧСС не превышала субмаксимальную величину показателя, не более 110 в 1 мин. Процедура ГИВХ не сопровождалась тяжелыми интраоперационными осложнениями.
Динамика температурных показателей на этапах ГИВХ была следующей: к моменту начала сеанса 36,2 ± 2,1 °С, на этапе проведения - 38,3 ± 1,7 °С, при окончании - 38,5 ± 1,4 °С. Для предотвращения резкого перепада температур во время ГИВХ с момента индукции анестезии осуществляли обогрев растворов и пациента при помощи термоодеяла. Температура подаваемого в одеяло воздуха составляла 38 °С, при этом температуру пациента поддерживали на уровне 36,7-37,0 °С, достигая максимальных значений к моменту начала проведения сеанса ГИВХ - 37,5 °С. В дальнейшем при подъеме температуры пациента выше 38,5 °С и необходимости охлаждения также использовали термоодеяло, но температуру подаваемого в него воздуха снижали до 30 °С. Кроме того, понижали температуру воздуха в операционной и охлаждали переливаемые растворы.
Интраоперационные изменения в показателях кислотно-основного состояния крови у двух групп пациентов были однотипны и носили следующий характер: увеличение температуры тела вызывало снижение рO2 капиллярной крови до 46 ± 7,4 мм рт. ст., некоторое увеличение рСO2 до 47 ± 5,3 мм рт. ст., повышение газообмена в тканях и сдвиг рН крови в сторону ацидоза, однако не превышающего значения компенсации.
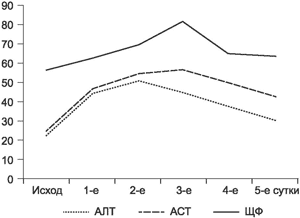
В послеоперационном периоде оценивали динамику показателей крови по общему и биохимическому анализам, данным гемостазиограммы и тромбоэластограммы (рис. 1,2). Отличий в показателях клеточного состава, состояния гемостаза, коагуляции и уровнях продуктов азотистого обмена между пациентами 1-й и 2-й групп не найдено. Однако установлены выраженные отличия в динамике ферментов печени. Так, к концу 1-х суток послеоперационного периода у пациентов 1-й группы отмечается резкий рост уровней АЛТ, ACT и щелочной фосфатазы, которые увеличиваются почти в 3 раза по сравнению с исходными значениями, достигая максимума к 3-м суткам. У больных 2-й группы подобной динамики не наблюдалось. Колебания уровней АЛТ, ACT и щелочной фосфатазы находились в пределах от 10 до 20 ед. Подобные отличия могут быть связаны с применением у больных 2-й группы мощной гепатопротекторной и антиоксидантной терапии.
Рис. 1. Динамика уровня печеночных ферментов у пациентов 1-й группы.
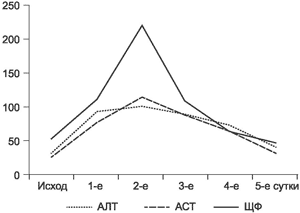
Рис. 2. Динамика уровня печеночных ферментов у пациентов 2-й группы.
Послеоперационная тактика ведения пациентов 2-й группы направлена на раннюю реабилитацию. Энтеральное питание препаратами гистамина и полуэлементными питательными смесями начинали в первые 3 ч после окончания оперативного вмешательства через зонд, заведенный за межкишечный анастомоз. В 1-е сутки после операции проводили вертикализацию пациентов, осуществляли дыхательную гимнастику с целью предупреждения респираторных осложнений. Стремились к максимально более раннему удалению дренажей и катетеров. Ранняя активизация больных позволила существенно сократить сроки их пребывания в ОРИТ, а также сроки госпитализации в целом (рис. 3).
Рис. 3. Сроки послеоперационной реабилитации пациентов.
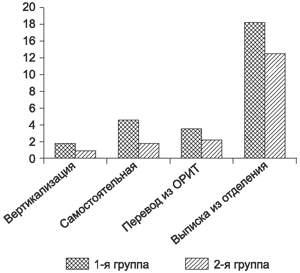
Среднее время пребывания пациентов в ОРИТ для 1-й группы составило 4 ± 1,5 дня, для пациентов 2-й группы - 2,5 ±1,2 дня.
У 17 из 21 больных 1-й группы послеоперационный период протекал благоприятно. Осложнения диагностированы у 4 пациентов: двусторонняя пневмония у 1, ОРДС у 1, у 2 больных на 5-е сутки послеоперационного периода диагностирована острая почечная недостаточность, потребовавшая выполнения сеансов гемодиализа. Хирургических осложнений не было. У пациентов 2-й группы осложнения не выявлены.
Заключение
Анализ мирового и собственного клинического опыта применения гипертермической интраоперационной внутрибрюшной химиотерапии в комплексном плане лечения больных раком желудка показал, что безопасность этой агрессивной, но высокоэффективной методики требует не только тщательного отбора пациентов согласно критериям, но и использования специальных методов защиты пациента на всех этапах хирургического лечения. Применение патогенетически обоснованных способов защиты от термической травмы, своевременный контроль и коррекция нарушений гомеостаза, вызванных токсическим воздействием химиопрепаратов и ожогом брюшины, раннее начало энтерального питания и использование органопротекторной терапии позволяют снизить риск развития осложнений и добиться улучшения результатов лечения онкологических больных.
На момент написания статьи клиническое исследование продолжается и в скором времени мы надеемся получить достоверные результаты для разработки алгоритма периоперационного ведения этой категории больных и возможности его широкого применения на практике.
REFERENCES
*ЛИТЕРАТУРА
1. Jemal A., Siegel R., Xu J., Ward E. Cancer statistics. CA Cancer J. Clin. 2010; 60 (5): 277-300.
2. Alonso O., Sugarbaker RH. Adult respiratory distress syndrome occurring in two patients undergoing cytoreductive surgery plus perioperative intraperitoneal chemotherapy: case reports and a review of the literature. Am. Surg. 2000; 66: 1032-6.
3. BickelA, ArzomanovT., Ivry S. et al. Reversal of adverse hemodynamic effects of pneumoperitoneum by pressure equilibration. Arch. Surg. 2004; 139: 1320-5.
4. Capone A., Valle M., Proietti R, Federici O., Garofalo A, Petrosillo N. Postoperative infections in cytoreductive surgery with hypermermicintraperi-toneal intraoperative chemotherapy for peritoneal carcinomatosis. J. Surg. Oncol. 2007; 96 (6): 507-13
5. Ceelen W.P, Hesse U., De Hemptinne B. et al. Hyperthermicintraperito-nealchemoperfusion in the treatment of locally advanced intra-abdominal cancer. Br. J. Surg. 2000; 87: 1006-15.
6. Chen Y., Liu B.L, Shang В., Chen A.S., Liu S.Q, Sun W. et al. Nutrition support in surgical patients with colorectal cancer. World J. Gastroenterol. 2011; 12: 1779-86.
7. Di Fiore F, Lecleire S., Pop D., Rigal O., Hamidou H., Paillot B. et al. Baseline nutritional status is predictive of response to treatment and survival in patients treated by definitive chemoradiotherapy for a locally advanced esophageal cancer. Am. J. Gastroenterol. 2007; 12: 2557-63.
8. Eltabbakh G.H., A>vtrey C.S., Walker P. Adult respiratory distress syndrome after extensive cytoreductive surgery. A case report. J. Reprod. Med. 2000; 45: 5 \-A.
9. Esquivel J., Angulo F, Bland R.K., Stephens A.D., Sugarbaker PH. Hemodynamic and cardiac function parameters during heated intraoperative intraperitoneal chemotherapy using the open "coliseum technique". Ann. Surg. Oncol. 2000; 7 (4): 296-300.
10. Esquivel J., Vidal-Jove J., Steves M. A., Sugarbaker PH. Morbidity and mortality of cytoreductive surgery and intraperitoneal chemotherapy. Surgery. 1993; 113 (6): 631-6.
11. Glehen O., Osinsky D., Cotte E. et al. Intraperitonealchemohypermermia using a closed abdominal procedure and cytoreductive surgery for the treatment of peritoneal carcinomatosis: morbidity and mortality analysis of 216 consecutive procedures. Ann. Surg. Oncol. 2003; 10 (8): 863-9.
12. Gupta D., Lammersfeld CA, Burrows J.L., Dahlk S.L., Vashi P.G., Grutsch J.F et al. Bioelectrical impedance phase angle in clinical practice: implications for prognosis in advanced colorectal cancer. Am. J. Clin. Nutr. 2004; 12: 1634-8.
13. Gupta D., Lammersfeld C.A., Vashi P.G., Burrows J., Lis C.G., Grutsch J.F. Prognostic significance of Subjective Global Assessment (SGA) in advanced colorectal cancer. Eur. J. Clin. Nutr. 2005; 12: 35-40.
14. Gupta D., Lis C.G., Granick J., Grutsch J.F, Vashi P.G., Lammersfeld CA. Malnutrition was associated with poor quality of life in colorectal cancer: a retrospective analysis. J. Clin. Epidemiol. 2006; 12: 704-9.
15. Jacquet P., Sugarbaker PH. Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis. Cancer Treat. Res. 1996;82:359-74.
16. Kanakoudis F, Petrou A., Michaloudis D. et al. Anaesthesia for intra-peritoneal perfusion of hyperthermic chemotherapy. Haemodynamic changes, oxygen consumption and delivery. Anaesthesia. 1996; 51: 1033-6.
17. Kashtan J., Green J.F, Parsons E.Q. et al. Hemodynamic effect of increased abdominal pressure. J. Surg. Res. 1981; 30: 249-55.
18. Macri A, Saladino E., Trimarchi G., Bartolo V, Rossitto M., Cannao A. et al. Cytoreductive surgery plus hypermermicintraperitoneal chemotherapy in elderly patients. In Vivo. 2011; 25 (4): 687-90.
19. McPartland S.J., Goodman M.D. The effect of elevated body mass index on outcomes following cytoreductive surgery with hyperthermic intraperitoneal chemotherapy. Ann. Surg. Oncol. 2013; Oct 1.
20. Owusu-Agyemang P., Soliz J., Hayes-Jordan A., Harun N., Gottumukkala V Safety of epidural analgesia in the perioperative care of patients undergoing cytoreductive surgery with hyperthermic intraperitoneal chemotherapy. Ann. Surg. Oncol. 2013; Aug 28.
21. SautnerT., HofbauerF, DepischD., Schiessel R, Jakesz R Adjuvant intraperito-nealcisplatin chemotherapy does not improve long term survival after surgery for advanced gastric cancer. J. Clin. Oncol. 1994; 12 (5): 970^1.
22. Schmidt C, Creutzenberg M., Piso P. et al. Peri-operative anaesthetic management of cytoreductive surgery with hyperthermic intraperitoneal chemotherapy. Anaesthesia. 2008; 63: 389-95.
23. Schnake K.J., Sugarbaker PH., Yoo D. Neutropenia following perioperative intraperitoneal chemotherapy. Tumori. 1999; 85 (1): 41-6.
24. Schwarz L., Bridoux V, Veber В., Oksenhendler E., Royon V, Michot F, Tuech J. Hemophagocytic syndrome: an unusual and underestimated complication of cytoreduction surgery with heated intraperitoneal oxaliplatin. Ann. Surg. Oncol. 2013; 20 (12): 3919-26.
25. Spratt J.S., Adcock R.A, Sherrill W. et al. Hyperthermic peritoneal perfusion system in canines. Cancer Res. 1980; 40: 253-5.
26. Spratt J.S., Adcock R.A., Muskovin M. et al. Clinical delivery system for intraperitoneal hyperthermic chemotherapy. Cancer Res. 1980; 40: 256-60.
27. Stephens AD., Alderman R, Chang D., Edwards G.D., Esquivel J., Sebbag G et al. Morbidity and mortality analysis of 200 treatments with cytoreductive surgery and hyperthermic intraoperative intraperitoneal chemotherapy using the coliseum technique. Ann. Surg. Oncol. 1999; 6 (8): 790-6.
28. Stuart O.A, Stephens A.D., Welch L., Sugarbaker PH. Safety monitoring of the coliseum technique for heated intraoperative intraperitoneal chemotherapy with mitomycin С Ann. Surg. Oncol. 2002; 9: 186-91.
29. Sugarbaker PH. Peritoneal carcinomatosis: natural history and rational therapeutic interventions using intraperitoneal chemotherapy. Cancer Treat. Res. 1996; 81: 149-68.
30. Sugarbaker PH. Surgical management of peritoneal carcinosis: diagnosis, and treatment. Langenbecks Arch. Chir. 1988; 373: 189-96.
31. Sugarbaker PH., Kern K., Lack E. Malignant pseudomyxomapentonei of colonic origin: natural history and presentation of a curative approach to treatment. Dis. Colon Rect. 1987; 30: 772-9.
32. Sugarbaker PH. Clinical research methodologies in diagnosis and staging of patients with peritoneal carcinomatosis. Cancer Treat. Res. 1996; 82: 359-74.
33. Sugarbaker PH. Technical Handbook for the Integration of Cytoreductive Surgery and Perioperative Intraperitoneal Chemotherapy into the Surgical Management of Gastrointestinal and Gynecologic Malignancy. 4th ed. Michigan: Ludann Company; 2005.
34. Tabrizian P., Jibara G., Shrager В., Franssen В., Yang M.J., Sarpel U. et al. Outcomes for cytoreductive surgery and hypermermicintraperitoneal chemotherapy in the elderly. Surg. Oncol. 2013; 22 (3): 184-9.
35. Vashi PG, Gupta D, Lammersfeld CA, Braun D.P, Popiel B, Misra S, Brown K.C. The relationship between baseline nutritional status with subsequent parenteral nutrition and clinical outcomes in cancer patients undergoing hyperthermic intraperitoneal chemotherapy. Nutr. J. 2013; 12: 118.
36. Votanopoulos K.I., Newman N.A., Russell G., Ihemelandu C, Shen P., Stewart J.H., Levine E.A. Outcomes of Cytoreductive Surgery (CRS) with hyperthermicintraperitoneal chemotherapy (ШРЕС) in patients older than 70 years; survival benefit at considerable morbidity and mortality. Ann. Surg. Oncol. 2013; 20 (11): 3497-503.
37. Wakahara Т., Shiraki M., Murase K., Fukushima H., Matsuura K., Fukao A. et al. Nutritional screening with Subjective Global Assessment predicts hospital stay in patients with digestive diseases. Nutrition. 2007; 12: 634-9.
38. Yan T.D., Zappa L., Edwards G., Alderman R, Marquardt C.E., Sugarbaker PH. Perioperative outcomes of cytoreductive surgery and perioperative intraperitoneal chemotherapy for non-Appendiceal peritoneal carcinomatosis from a prospective database. J. Surg. Oncol. 2007; 96 (2): 102-12.
39. Petrov V.P., Kitaev AV, Zuev V.K., Lazarev G.V, Khaburzaniya A.K., Leonov S.V Gipertermicheskaya khimioterapiya pri radikal'nykh i tsitoreduktivnykh operatsiyakh v lechenii rasprostranennogo kolorektal'nogo i ovarial'vogo raka. In: [Problemygno urgii iproktologii: Materialy IIIKongressa assotsiatsii khirurgov im. N.I. Pirogova]. M.; 2002. (in Russian)
40. Petrov VP, Lazarev G.V, Rozhkov AG, Kitaev AV, Voronin N.I., Tsarev M.I., Leonov S.V. Lechebnaya taktika pri rasprostranennom rake tolstoy kishki. Rossiyskiy onkologicheskiy zhurnal. 2003; 4: 25-2. (in Russian)
41. Schwarz L., Yoo V, Bridoux V, Veber В., Oksenhendler E., Royon V, Michot F, Tuech J.J. Hemophagocytic syndrome: an unusual and underestimated complication of cytoreduction surgery with heated intraperitoneal oxaliplatin. Ann. Surg. Oncol. 2013; Nov.
*39. Петров В.П., Китаев А.В., Зуев В.К., Лазарев Г.В., Хабурзания А.К., Леонов СВ. Гипертермическая химиотерапия при радикальных и циторедуктивных операциях в лечении распространенного колоректального и овариального рака. В кн.: Проблемы гнойной хирургии и проктологии: Материалы III Конгресса ассоциации хирургов им Н.И. Пирогова. М.; 2002.
*40. Петров В.П., Лазарев Г.В., Рожков АГ., Китаев АВ., Воронин Н.И., Царев М.И., Леонов СВ. Лечебная тактика при распространенном раке толстой кишки. Российский онкологический журнал. 2003; 4: 25-2.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 www.polysan.ru
www.polysan.ru



