Эффективность ремаксола у пациентов с алкогольной болезнью печени
Статьи
В. В. Стельмах1, И. Г. Бакулин1, А. Л. Коваленко2, В. К. Козлов2 - 4
1 ФГБОУ ВО Северо-Западный государственный медицинский университет имени И. И. Мечникова Минздрава России, 191015, Санкт-Петербург, ул. Кирочная, д. 41.
2 ФГБУ НКЦТ им. С. Н. Голикова ФМБА России, Россия, 192019, Санкт-Петербург, ул. Бехтерева, д. 1.
3 ФГБУ ВПО Новгородский государственный университет имени Ярослава Мудрого, Россия, 173003, Великий Новгород, ул. Большая Санкт-Петербургская, д. 41.
4 ФГБОУ ВПО Санкт-Петербургский государственный университет, Россия, 199034, Санкт-Петербург, Университетская наб., д. 7 - 9.
Цитирование: Эффективность ремаксола у пациентов с алкогольной болезнью печени / В. В. Стельмах, И. Г. Бакулин, А. Л. Коваленко, В. К. Козлов // Экспериментальная и клиническая фармакология. – 2022. – Т. 85, № 6. – С. 25-31. – DOI 10.30906/0869-2092-2022-85-6-25-31. – EDN STCBKH.
Обследовано 85 пациентов с алкогольной болезнью печени (АБП) в возрасте от 24 до 70 лет. Пациенты основной группы (n = 50) в составе комплексной терапии получали ремаксол: ежедневно (10- 12 дней) внутривенно капельно по 400 мл 1 раз в сутки; пациентам группы сравнения (n = 35) вводили адеметионин (800 мг, внутривенно) 1 раз в сутки в течение 10-12 дней. Включение ремаксола в комплексное лечение пациентов с АБП на цирротической стадии способствовало улучшению компенсаторных возможностей печени и краткосрочного жизненного прогноза: в 2,3 раза уменьшилось количество больных со значением расчетного индекса MELD > 11 в основной группе, по сравнению с 1,4 раза в группе сравнения; установлено статистически значимое различие в динамике показателей синдрома цитолиза у пациентов основной группы (снижение активности аланинаминотрансферазы с 108,2 ± 25,0 до 56,8 ± 15,1 ЕД/л, р < 0,05, аспартатаминотрансферазы с 115,1 ± 12,6 до 59,7 ± 16,3 ЕД/л,р < 0,05), по сравнению с аналогичными показателями группы сравнения (снижение аланинаминотрансферазы с 90,9 ± 21,3 до 81,0 ± 11,3 ЕД/л,р > 0,05, аспартатаминотрансферазы с 128,6 ± 10,3 до 82,9 ± 10,6 ЕД/л, р < 0,05). Отмечен выраженный антихолестатический эффект ремаксола у больных алкогольным стеатогепатитом: снижение активности гамма-глутамилтранспептидазы с 611,4 ± 68,1 до 330,9 ± 42,1 ЕД/л, (р < 0,05) у пациентов основной группы, по сравнению со снижением активности этого фермента с 437,0 ± 54,2 до 290,1 ± 46,1 ЕД/л, (р <0,05) в группе сравнения, при этом кратность снижения составила 1,9 в основной группе и 1,5 раза в группе сравнения, соответственно. В основной группе больных наблюдали улучшение белково-синтетической функции печени (по увеличению синтеза альбумина гепатоцитами с 31,9 ± 0,5 до 36,3 ± 0,8 г/л в основной группе, р < 0,05, по сравнению с таковыми показателями в группе сравнения с 29,4 ± 1,1 до 30,6 ± 1,3 г/л, р > 0,05). После завершения применения лекарственных средств у 74 % пациентов с АБП основной группы выявлено повышение уровня тромбоцитов: с (99,7 ± 12,9) · 109/л до (137,6 ± 19,1) · 109/л (р < 0,05) и лишь у 50 % больных группы сравнения: с (123,3 ± 11,2) · 109/л до (163,1 ± 18,5) · 109/л (р < 0,05)). Ремаксол положительно влияет на клиническое течение АБП, в том числе, на цирротической стадии, способствует улучшению краткосрочного жизненного прогноза (по индексу MELD), существенно уменьшает выраженность основных клинических синдромов (астено-вегетативного, диспепсического, холестатического), способствует развитию дезинтоксикационного, мембраностабилизирующего, цитопротекторного, а также выраженного антихолестатического эффектов.
Ключевые слова: алкогольная болезнь печени; индекс MELD; ремаксол; гепатотропная терапия; токсический гепатит; гепатотропный эффект; антихолестатический эффект.
Efficiency of remaxol in alcoholic liver disease patients
V. V. Stel’makh1, I. G. Bakulin1 A. L. Kovalenko2, and V. K. Kozlov2-4
1 I.I. Mechnikov North-Western State Medical University, ul. Kirochnaya 41, St. Petersburg, 191015 Russia
2 S. N. Golikov Scientific Clinical Center of Toxicology, Federal Biomedical Agency of the Russian Federation, ul. Bekhtereva 1, St Petersburg, 192019 Russia
3 Yaroslav the Wise Novgorod State University, ul. Bolshaya 41, Veliky Novgorod, 173003 Russia
4 St. Petersburg State University, Universitetskaya nab. 7-9, St. Petersburg, 199034 Russia
A group of 85 patients with alcoholic liver disease (ALD) aged 24 to 70 years were examined. Patients of the main group (n = 50) received Remaxol as part of complex therapy: daily intravenous drip of 400.0 mL once per day for 10 - 12 days. Patients of the comparison group (n = 35) received Ademethionine in parenteral form 800 mg once per day for 10 - 12 days. The inclusion of Remaxol in the complex treatment of patients with ALD at the cirrhotic stage increased compensatory abilities of the liver and improved short-term life prognosis: the number of patients with calculated MELD index >11 in the main group decreased 2.3 times against 1.4 times in the comparison group; statistically significant difference was found in the dynamics of cytolysis syndrome in patients of the main group (decrease in ALT from 108.2 ± 25.0 to 56.8 ± 15.1 U/L(p < 0.05) and AST from 115.1 ± 12.6 to 59.7 ± 16.3 U/L (p < 0.05)) against the comparison group (decrease in ALT from 90.9 ± 21.3 to 81.0 ± 11.3 U/L (p > 0.05) and AST from 128.6 ± 10.3 to 82.9 ± 10.6 U/L(p < 0.05)). Apronounced anticholestatic effect of Remaxol was observed in patients with alcoholic steatohepatitis: as manifested by decrease in GGTP from 611.4 ± 68.1 to 330.9 ± 42.1 U/L, p < 0.05) in patients of the main group compared with a decrease in GGTP from 437.0 ± 54.2 to 290.1 ± 46.1 U/L (p < 0.05) in the comparison group, while at the same time, the multiplicity of decrease in the level of the GGTP enzyme was 1.9 in the main group against 1.5 in the comparison group. In the main group of patients, there was improvement in the protein-synthetic liver function (increase in the synthesis of albumin by hepatocytes from 31.9 ± 0.5 to 36.3 ± 0.8 g/L in the main group (p < 0.05) and from 29.4 ± 1.1 to 30.6 ± 1.3 g/L in the comparison group (p > 0.05)). Upon completion of the infusion therapy, 74% of patients with ALD in the main group showed increase in platelet level from 99.7 ± 12.9 · 109/L to 137.6 ± 19.1 · 109/L (p < 0.05) against only 50% of patients in the comparison group(from 123.3 ± 11.2 · 109/Lto 163.1 ± 18.5 · 109/L(p < 0.05)).The infusion therapy with Remaxol has a positive effect on the clinical course of ALD (including the cirrhotic stage), improves the short-term life prognosis (according to the MELD index), significantly reduces severity of the main clinical syndromes (asthenovegetative, dyspeptic, cholestatic), promotes the development of detoxification, membrane-stabilizing, cytoprotective, as well as pronounced anticholestatic effects.
Keywords: alcoholic liver disease; MELD index; remaxol; infusion therapy; hepatotropic therapy; toxic hepatitis; hepatotropic effect, antichoestatic effect.
Введение
Алкогольная болезнь печени (АБП) занимает второе место после вирусных гепатитов среди глобальных проблем гепатологии. С избыточным потреблением спиртных напитков связывают 3,8 % летальных исходов в мире [24].
Многообразные нарушения, развивающиеся в результате алкогольной интоксикации и затрагивающие практически все виды обмена веществ, определяются как прямыми мембранотропными, так и метаболическими эффектами этанола [23]. К наиболее важным повреждающим эффектам, формирующимся на этапах катаболизма этилового спирта, относятся: образование и действие его токсического метаболита — ацетальдегида [27], интенсификация процессов свободнорадикального окисления липидов мембран [26], активация некрозовоспалительных и фибротических процессов в ткани печени [19]. Смещение соотношения пиридин-нуклеотидов в сторону восстановленных форм подавляет аэробное дыхание и синтез макроэргов, переводит метаболизм на анаэробные пути с развитием метаболического ацидоза, митохондриальной дисфункции, ухудшением процессов энергообеспечения организма [21].
Учитывая широкое распространение АБП, тяжелый прогноз и клинико-социальное значение, необходим поиск оптимальных методов лечения, воздействующих на комплекс нарушений, имеющихся у данной категории пациентов. В этой связи метаболическую композицию «Ремаксол раствор для инфузий», обладающую гепатотропным антиоксидантным/антигипоксантным действием можно рассматривать как перспективное лекарственное средство (ЛС) для терапии АБП [15].
Важными компонентами этого ЛС являются соединения — регуляторы энергетического обмена гепатоцитов: янтарная кислота, улучшающая метаболизм цикла Кребса, инозин, способствующий синтезу нуклеиновых кислот и улучшению метаболизма печеночных клеток (за счет активации гликолиза и β-окисления жирных кислот), никотинамид, стимулирующий процессы тканевого дыхания и метионин. Механизм гепатотропного действия ремаксола обусловлен комплексом биохимических процессов, затрагивающих цикл трикарбоновых кислот и сукцинатоксидазное окисление с последующим активным синтезом АТФ, индукцию эндогенного S-аденозилметионина (SAM) с активацией процессов трансметилирования и транссульфатирования, способствуя нивелированию токсического повреждения гепатоцитов при АБП. Важную роль в фармакологической активности ремаксола играет нормализация энергетики клетки и коррекция тканевой гипоксии, что позволяет отнести его к группе метионин- и сукцинатсодержащих гепатотропных ЛС [14].
Экспериментальные данные показали, что входящий в состав ремаксола метионин, под влиянием метионинаденозилтрансферазы (MAT) превращается в SAM, в дальнейшем участвует в реакциях трансметилирования, транссульфурирования и в синтезе полиаминов [13]. Синтез полиаминов — ключевое звено в формировании рибосом, необходимых для пролиферации гепатоцитов и регенерации печеночной ткани.
Помимо субстратного антигипоксического действия, сукцинат является лигандом G-белок-сопряженных рецепторов SUCNR1 (GPR91) цитоплазматических мембран клеток и выполняет функцию первичного мессенджера [25]. Эти рецепторы локализуются во многих тканях — в печени, селезенке, почках (эпителий проксимальных канальцев), сосудах, головном мозге (клетки глии) [28]. Активация этих рецепторов сукцинатом, присутствующим в плазме крови и межтканевой жидкости, регулирует адаптацию клеток к недостатку или нарушению утилизации кислорода [6]. В условиях гипоксии происходит более эффективный сукцинатзависимый синтез энергии в митохондриях; сукцинатзависимая стабилизация фактора HIF-1α и последующая инициация его транскрипционной активности; сукцинатзависимое формирование резистентности организма к кислородной недостаточности [8]. Стимуляция печеночной регенерации отчасти связана и с янтарной кислотой, входящей в состав ремаксола, оказывающей рецепторно-опосредованное воздействие на GPR91 (SUCNR1) купферовских клеток печени, обеспечивающих метаболизм и регенерацию клеток печеночной паренхимы [17].
На основании проведенных клинических исследований установлено наличие у ремаксола выраженной специфической фармакологической активности, направленной на коррекцию изменений метаболизма и нарушений энергетического обмена клеток при острых и хронических заболеваниях печени различного генеза (вирусного, токсического, лекарственного, алкогольного) [2, 4, 6]. По данным ряда авторов, применение этого ЛС приводит к стимуляции процессов энергообразования в митохондриях, активации обмена веществ в гепатоцитах, способствуя нормализации белок-синтетической и пигментообразующей функции печени, снижению выраженности белковой, жировой и углеводной дистрофии гепатоцитов, уменьшению зон некроза гепатоцитов, интенсификации процессов регенерации поврежденных гепатоцитов [12].
Применение ремаксола (ООО “НТФФ “ПОЛИСАН”, Россия) патогенетически оправдано в условиях гипоксии, деэнергизации (дефицит выработки и утилизации АТФ) гепатоцитов, повреждения клеточных мембран (цитоплазматических и митохондриальных), активации свободно-радикального окисления и угнетения антиоксидантной защиты, которые сопутствуют большинству хронических диффузных заболеваний печени, в том числе и АБП [1, 11].
Цель данного исследования — оценка эффективности включения ремаксола в комплексную инфузионную терапию пациентов с АБП. Оценивали клиническое течение заболевания с учетом основных симптомов и синдромов, динамики показателей, характеризующих функциональное состояние печени, рассчитывали прогностический индекс MELD (Model for End-stage Liver Disease).
Методы исследования
В открытое контрольно-сравнительное исследование было включено 85 пациентов (74 мужчин и 11 женщин), страдающих АБП как на доцирротических стадиях, так и с циррозом печени (ЦП) в исходе АБП, находящихся на обследовании и лечении в период с 2012 - 2016 гг. в клинике внутренних болезней и нефрологии СЗГМУ имени И. И. Мечникова (г. Санкт-Петербург) и в отделении гепатологии ГБУЗ Московском клиническом научно-практическом центре Департамента здравоохранения г. Москвы.
Средний возраст исследуемых больных составил 48,5 ± 10,6 лет (от 24 до 70 лет). В соответствии с МКБ-10 диагнозы пациентов: К70.0: Алкогольная жировая дистрофия печени; К 70.1. Алкогольный гепатит; К 70.2 Алкогольный фиброз и склероз печени; К 70.3. Алкогольный цирроз печени К 71.0. Токсическое поражение печени с холестазом; К 71.3. Токсическое поражение печени, протекающее по типу хронического персистирующего гепатита; К 71.5. Токсическое поражение печени, протекающее по типу хронического активного гепатита; К 71.7. Токсическое поражение печени с фиброзом и циррозом печени в форме алкогольного стеатогепатита.
Критериями включения являлись: злоупотребление алкоголем в течение последних 3 и более лет, заполнение опросника AUDIT не менее, чем на 8 баллов: уровень аланинаминотрансферазы (АЛТ) и/или аспартатаминотрансферазы (АСТ) с превышением показателей верхней границы нормы (ВГН) в 1,5 - 10 раз. В исследование не включали пациентов с хроническими диффузными заболеваниями печени любой другой этиологии, лиц с цирротической стадией алкогольной болезни печени (MELD >17); пациентов с заболеваниями сердечно-легочной системы, крови и кроветворных органов, костно-мышечной системы, мочевыделительной системы и других внутренних органов в состоянии декомпенсации; больных со злокачественными новообразованиями печени и других органов. Исследуемые пациенты были рандомизированы на 2 группы. Процедуру рандомизации осуществляли по мере поступления больных в стационар (методом конвертов и таблиц случайных чисел).
Пациентам основной группы (группа 1) вводили ремаксол: ежедневно внутривенно капельно в объеме 400 мл в день со скоростью 60 капель в минуту (10 - 12 дней). Пациенты группы сравнения (группа 2) получали адеметионин (Гептрал), внутривенно в дозе 800 мг в сутки (10 - 12 дней). Сопутствующая терапия была строго унифицирована для всех больных (растворы кристаллоидов, полиферментные, антисекреторные ЛС).
С целью исключения прямого воздействия на исследуемые параметры и возможного влияния на исходы лечения на период проведения инфузионной терапии не применяли ЛС из группы гепатопротекторов, кроме использованных в исследовании ремаксола и адеметионина. Исследование имело гуманистический, неинтервенционный характер, проводилось в соответствии с этическими принципами Хельсинкской декларации Всемирной медицинской ассоциации.
Всем больным проводили комплексное обследование, включающее общий осмотр с оценкой антропометрических показателей (определение массы тела, роста, индекса массы тела), клинических признаков заболевания, интерпретацией лабораторных показателей (клинический анализ крови, биохимический анализ крови (с определением уровней билирубина, АЛТ, АСТ, гамма-глутамилтранспептидазы (ГГТП), щелочной фосфатазы (ЩФ), глюкозы, креатинина, альбумина, общего холестерина, коагулограммы), серологических методов исследования (HBsAg и суммарные антитела к вирусу гепатита С методом иммуноферментного анализа) и инструментальных методов исследования (ультразвуковое исследование органов брюшной полости, электрокардиограмма, эзофагогастродуоденоскопия). Диагноз устанавливался на основании совокупности клинико-лабораторных данных в соответствии с классификацией МКБ-10.
В исследовании выделены 2 базовые точки: исходные данные до начала исследования и 13-14 день (после окончания применения ЛС). Всем больным проводили оценку некро-воспалительной активности печени и степени фиброзирования по результатам Фибро-Акти-Теста, рассчитывали прогностический индекс MELD. Как известно, при количестве баллов по шкале MELD менее 20 3-месячная летальность составляет 27 %, а при более 20 - 76 % [22]. При значении расчетного индекса MELD, менее или равном 11, диагностируют компенсированную стадию ЦП, а при показателе более 11 устанавливают декомпенсированный цирроз [7]. Неблагоприятный жизненный прогноз пациентов с ЦП ассоциирован со значением МELD> 18 [20].
Для обработки полученных данных были использованы пакеты программ Office Std. 2010 (Excel 2010) и Statistica 7.0. Оценку значимости различия проводили непараметрическими методами: между независимыми группами (Контроль-Ремаксол) при помощи U-критерия Манна — Уитни, между связанными выборками (до и после, на 6-ой день) — при помощи теста Вилкоксона и Sign-теста. Для сравнения качественных признаков использовались χ 2 критерий — для оценки частоты появления признака, который работает при n > 5, в противном случае использовали точный критерий Фишера. Проверку статистических гипотез проводили при критическом уровне значимости р = 0,05, т.е. различие считали статистически значимым, если p <0,05.
Результаты и их обсуждение
Исходно у подавляющего большинства исследуемых больных наблюдались жалобы астеновегетативного и диспепсического характера. Около половины (52 %) пациентов беспокоил кожный зуд различной степени интенсивности, у 25 % больных наблюдалась желтуха.
ЦП в исходе хронического гепатита алкогольной этиологии был выявлен у 29 (58 %) пациентов 1 группы и у 17 (48 %) пациентов 2 группы, при этом у 22 % больных установлен Child Pugh A, Child Pugh В — у 20 % больных, Child Pugh С — у 7 % больных.
Исследуемым больным была проведена оценка степени тяжести алкогольного гепатита и жизненного прогноза по шкале MELD. У 55 % больных (16 человек из 29) 1 группы на цирротической стадии АБП и 59 % больных 2 группы (10 человек из 17) индекс MELD составил более 11 (13,2 ± 1,5 и 15,5 ± 4,2 соответственно, p > 0,05), что рассматривается как пороговое значение между компенсированной и декомпенсированной стадией ЦП, указывающим на прогноз выживаемости в течение 3-12 мес 74 - 59 % соответственно [7, 18]. Все пациенты демонстрировали значение индекса Меддрея < 32.
Распределение исследуемых больных в зависимости от стадии поражения печени по данным Фибро-Акти-Теста представлено на рис. 1.
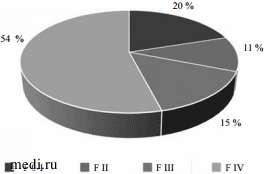 Рис. 1.
Рис. 1. Распределение исследуемых пациентов (n = 85) в зависимости от стадии фиброза печени.
Применение исследуемых ЛС способствовало снижению жалоб и частоты патологических симптомов у исследуемых пациентов, при этом в группе больных, получавших ремаксол, наблюдалось более существенное уменьшение проявлений астенического, диспепсического и болевого абдоминального синдромов, по сравнению с группой сравнения (р < 0,05) (рис. 2).
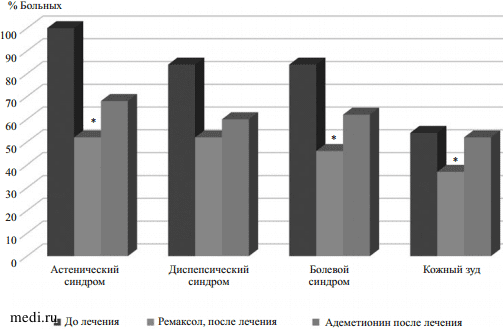 Рис. 2.
Рис. 2. Динамика частоты основных клинических синдромов в исследуемых группах в зависимости от проводимой терапии.
У пациентов исследуемых групп исходно регистрировали различные проявления синдрома цитолиза и холестаза (таблица). У 25 % исследуемых пациентов обеих групп с F IV по данным Фибро-Акти-Теста исходно выявлено нарушение белково-синтетической функции печени.
В ходе настоящего исследования выявлены значимые отличия в динамике показателей синдрома цитолиза и холестаза у пациентов с АБП, получавших ремаксол, по сравнению с пациентами группы сравнения (таблица).
Динамика показателей синдрома цитолиза, холестаза у исследуемых пациентов в зависимости от проводимой терапии (М ± m)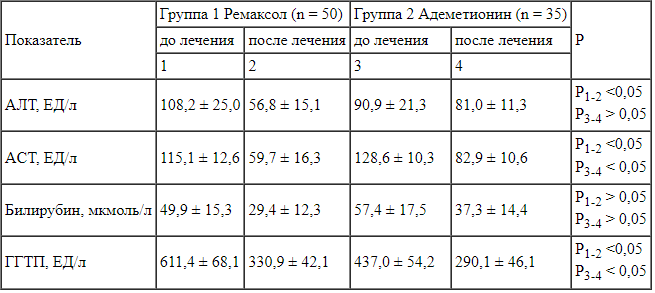 Отмечен выраженный антихолестатический эффект ремаксола у больных алкогольным стеатогепатитом по статистически значимому различию в динамике показателей холестаза между группами (по изменению величины ГГТП, р = 0,02). После окончания 12-дневного курса лечения в основной 1 группе больных было зарегистрировано более существенное уменьшение средних значений ГГТП. Кратность снижения уровня фермента ГГТП составила 1,9 в основной группе и 1,5 раза в группе сравнения соответственно, что указывает на большую эффективность ремаксола по сравнению с адеметионином в отношении внутрипеченочного холестаза при АБП.
Отмечен выраженный антихолестатический эффект ремаксола у больных алкогольным стеатогепатитом по статистически значимому различию в динамике показателей холестаза между группами (по изменению величины ГГТП, р = 0,02). После окончания 12-дневного курса лечения в основной 1 группе больных было зарегистрировано более существенное уменьшение средних значений ГГТП. Кратность снижения уровня фермента ГГТП составила 1,9 в основной группе и 1,5 раза в группе сравнения соответственно, что указывает на большую эффективность ремаксола по сравнению с адеметионином в отношении внутрипеченочного холестаза при АБП.
Было показано, что применение ремаксола способствует уменьшению выраженности клинических проявлений и улучшению прогноза при острых отравлениях этанолом не только благодаря его гепатотропному действию, но и участию в коррекции метаболических нарушений: уменьшении гипоксических проявлений, восстановлении системы антиоксидантной защиты и снижении активности процессов перекисного окисления липидов [3, 16]. Полученные результаты настоящего исследования свидетельствуют о положительном влиянии этого ЛС на функциональное состояние печени у пациентов с АБП как на доцирротических стадиях, так и при развитии цирроза печени в исходе алкогольного стеатогепатита, что, в конечном счете, отражается в улучшении краткосрочного жизненного прогноза. Ремаксол способствовал улучшению функционального состояния печени: в 2,3 раза уменьшилось количество пациентов с АБП с показателями индекса MELD >11, являющимся пороговым значением декомпенсированной стадии цирроза печени, влияющим на прогноз выживаемости в течение 3-12 мес. Так, до лечения значения расчетного индекса MELD 13,2 ± 1,5 наблюдались у 16 из 29 (55 %) пациентов с циррозом печени в 1 группе, а в конце лечения — лишь у 7 из 29 (24 %) и составили 12,6 ± 1,2. В группе сравнения, у больных на цирротической стадии заболевания, исходно у 10 из 17 (59 %) пациентов прогностически неблагоприятные значения расчетного индекса MELD составили 15,5 ± 2,5, а в конце лечения сохранялись высокими у 7 из 17 (41 %) пациентов. Таким образом, снижение частоты декомпенсации печени на фоне применения ЛС достигалось в 2,3 раза чаще в основной группе и в 1,4 раза — в группе сравнения (рис. 3).
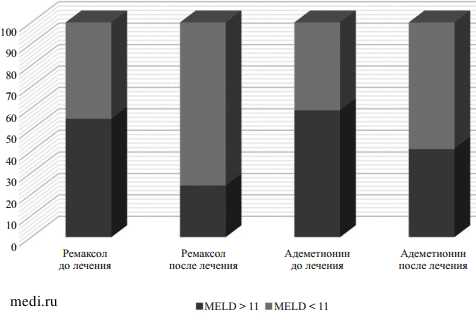 Рис. 3.
Рис. 3. Доля пациентов (%) на цирротической стадии алкогольной болезни печени и прогностически неблагоприятными значениями расчетного индекса MELD > 11 в зависимости от проводимой терапии.
Печеночно-клеточная недостаточность осложняет течение цирротической стадии заболеваний печени вне зависимости от этиологии. Наиболее значимым параметром гепатопротекторной эффективности ремаксол а следует считать улучшение белково-синтетической функции печени, определяемой по содержанию альбумина в крови [4]. У пациентов основной группы с ЦП и печеночно-клеточной недостаточностью на фоне терапии регистрировалось улучшение показателей белково-синтетической функции печени (по увеличению синтеза альбумина гепатоцитами с 31,9 ± 0,5 до 36,3 ± 0,8 г/л в основной группе (на 14 %, р < 0,05) и с 29,4 ± 1,1 до 30,6 ± 1,3 г/л в группе сравнения (на 4 %, р > 0,05)).
Исследование эффективности ремаксола в комплексной терапии пациентов с АБП выявило наличие цитопротективного (в отношении тромбоцитов периферической крови) эффекта. Необходимо отметить, что исходно в обеих группах цитопенический синдром наблюдался у 53 % больных, при этом у 32 % пациентов была выявлена тромбоцитопения; двухростковая цитопения — у 17 % исследуемых больных; панцитопения — у 4 % пациентов. Тромбоцитопения исходно обнаружена у 57 % больных в основной группе и у 69 % больных группы сравнения. После завершения применения ЛС у 74 % пациентов с АБП основной группы наблюдалось повышение уровня тромбоцитов с (99,7 ± 12,9) · 109/л до (137,6 ± 19,1) · 109/л (р < 0,05). У 50 % лиц с АБП группы сравнения наблюдали повышение уровня тромбоцитов в периферической крови с (123,3 ± 11,2) · 109/л до (163,1 ± 18,5) · 109/л (р < 0,05). Повышение уровня тромбоцитов периферической крови на фоне применения ремаксола, по-видимому, было связано с уменьшением проявлений гиперспленизма и улучшением функционального состояния печени, что, в свою очередь, сочеталось с уменьшением числа пациентов с показателями индекса MELD >11. Сходный эффект ремаксола был выявлен в ряде исследований, проведенных ранее [2, 10].
В ходе исследования отмечена хорошая переносимость ЛС “Ремаксол для инфузий”: при соблюдении скорости введения 40 - 60 капель в минуту у исследуемых больных не наблюдалось нежелательных явлений. При превышении скорости введения в ряде случаев отмечалось чувство “першения в горле” (5 %), сухой кашель (3 %), покраснение кожи лица (4 %), что не требовало прекращения введения препарата при замедлении скорости внутривенного введения. У пациентов группы сравнения среди нежелательных явлений отмечались головные боли (9 %), головокружения (3 %), не требующие отмены ЛС.
Результаты проведенного исследования убедительно показали, что включение ремаксола в комплексную терапию пациентов с АБП положительно влияет на клиническое течение заболевания и его прогноз; способствует регрессу гепатоцеллюлярного повреждения и внутрипеченочного холестаза; улучшает белок-синтетическую функцию печени; оказывает цитопротекторный эффект; ремаксол имеет хороший профиль безопасности, что позволяет рекомендовать его применение при АБП в том числе и на цирротической стадии, а также планировать более широкомасштабные исследования в этом направлении.
Выводы
1. Включение ремаксола в комплексное лечение пациентов с АБП на цирротической стадии способствовало улучшению компенсаторных возможностей печени и краткосрочного жизненного прогноза: в 2,3 раза уменьшилось количество больных со значением расчетного индекса MELD > 11 в основной группе, по сравнению с 1,4 раза в группе сравнения; установлено статистически значимое различие в динамике показателей синдромов цитолиза у пациентов основной группы (снижение АЛТ с 108,2 ± 25,0 до 56,8 ± 15,1 ЕД/л, р <0,05, АСТ с 115,1 ± 12,6 до 59,7 ± 16,3 ЕД/л, р < 0,05) по сравнению с таковыми показателями группы сравнения (снижение АЛТ с 90,9 ± 21,3 до 81,0 ± 11,3 ЕД/л, р >0,05, АСТ с 128,6 ± 10,3 до 82,9 ± 10,6 ЕД/л, р <0,05).
2. Отмечен выраженный антихолестатический эффект ремаксола у больных алкогольным стеатогепатитом: снижение ГГТП с 611,4 ± 68,1 до 330,9 ± 42,1 ЕД/л (р < 0,05) у пациентов основной группы, по сравнению со снижением ГГТП с 437,0 ± 54,2 до 290,1 ± 46,1 ЕД/л (р < 0,05) в группе сравнения, при этом кратность снижения уровня активности фермента ГГТП составила 1,9 в основной группе и 1,5 раза в группе сравнения, соответственно.
3. В основной группе больных наблюдалось улучшение белково-синтетической функции печени (увеличение синтеза альбумина гепатоцитами с 31,9 ± 0,5 до 36,3 ± 0,8 г/л в основной группе,р < 0,05, по сравнению с таковыми показателями в группе сравнения с 29,4 ± 1,1 до 30,6 ± 1,3 г/л, р > 0,05). По завершению инфузионной терапии у 74 % пациентов с АБП основной группы наблюдалось повышение уровня тромбоцитов с (99,7 ± 12,9) · 109/л до (137,6 ± 19,1) · 109/л (р < 0,05) и лишь у 50 % больных группы сравнения (с (123,3 ± 11,2) · 109/л до (163,1 ± 18,5) · 109/л (р < 0,05)).
Литература
1. И. Е. Гридчик, А. В. Курдяков, А. И. Матвеев, Эксперим. и клин. фармакол., 78(12), 11 - 14 (2015).
2. К. К. Ильяшенко, М. В. Белова, А. Ю. Симонова и др., Эксперим. и клин. фармакол., 80(12), 26 - 30 (2017).
3. Г. А. Ливанов, А. Н. Лодягин, С. В. Лубсанова и др., Ж. неврол. и психиатр. им. C. C. Корсакова, 115(4 - 2), 64 - 68 (2015).
4. Г. А. Ливанов, И. А. Шикалова, Эксперим. и клин. гастро-энтерол., № 5, 45 - 50 (2016).
5. Н. К. Мазина, П. В. Мазин, Д. С. Суханов, Терапевт. архив, № 1, 56-61 (2013).
6. С. В. Оковитый, С. В. Радько, Е. Б. Шустов, Хим.-фарм. журн., №9, 24-28 (2015).
7. С. В. Падучева, И. А. Булатова, А. П. Щёкотова и др., Пермский мед. журн., 34(6), 40 - 44 (2017).
8. В. А. Приходько, Н. О. Селизарова, С. В. Оковитый, Архив патологии, 83(2), 52-61 (2021).
9. Т. В. Сологуб, Л. Г. Горячевая, Клин. мед., №1, 62-66 (2010).
10. В. В. Стельмах, В. К. Козлов, Эксперим. и клин. гастроэнтерол., № 4(128), 72 - 79 (2016).
11. В. В. Стельмах, В. К. Козлов, И. А. Самусенко, Медицинский алфавит. Практическая гастроэнтерология, 40(4), 62-68 (2017).
12. Д. С. Суханов, Т. И. Виноградова, Н. В. Заболотных и др., Антибиотики и химиотер., 56(1 -2), 13 - 17 (2011).
13. Д. С. Суханов, А. Ю. Петров, А. Л. Коваленко и др., Эксперим. и клин. фармакол., № 10, 34 - 38 (2011).
14. Д. С. Суханов, А. Ю. Петров, А. Л. Коваленко и др., Вестник Российской академии медицинских наук, 67(3), 86 - 90 (2012).
15. О. Н. Топчеева, Е. В. Винницкая, И. Г. Бакулин, Гастроэнтерология, № 2 (103), Часть II, 27 (2015).
16. В. В. Шилов, И. А. Шикалова, С. А. Васильев и др., Клин. мед., №2, 45 -48 (2013).
17. P. R. Correa, E. A. Kruglov, M. Thompson, et al., J. Hepatol., 47(2), 262 - 269 (2007).
18. W. Dunn, L. H. Jamil, L. S. Brown, et al., Hepatology, 41(2), 353-358 (2005).
19. A. M. Elsharkawy, F. Oakley, D. A. Mann, Apoptosis, 10(5), 927 - 939 (2005).
20. A. Floden, Transplant. Proc., 39, 385 - 386 (2007).
21. J. B. Hoek, A. Cahill, J. G. Pastorino, Gastroenterol., 122(7), 2049 - 2063 (2002).
22. P. S. Kamath, R. H. Wiesner, M. A. Malinchoc, Hepatology, 33(2), 464-470 (2001).
23. C. S. Lieber, J. Med., 67(1), 84 - 94 (2000).
24. J. Rehm, C. Mathers, S. Popova, et al., Lancet, 373, 2223 - 2233 (2009).
25. J. H. Robben, R. A. Fenton, S. L. Vargas, et al., Kidney Int., 76(12), 1258- 1267 (2009).
26. M. J. Sanchez Perez, E. Gonzales-Reimers, F. Santolaria-Fernandez, et al., Alcohol., 41(6), 593 - 597 (2006).
27. N. Signorini-Allibe, B. Gonthier, F. Lamarche, et al., Alcohol., 40(3), 163- 171 (2005).
28. S. Tonack, C. Tang, S. Offermanns, Amer. J. Physiol., 304(4), 501 -513 (2012).
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 www.polysan.ru
www.polysan.ru
 Рис. 1. Распределение исследуемых пациентов (n = 85) в зависимости от стадии фиброза печени.
Рис. 1. Распределение исследуемых пациентов (n = 85) в зависимости от стадии фиброза печени.  Рис. 2. Динамика частоты основных клинических синдромов в исследуемых группах в зависимости от проводимой терапии.
Рис. 2. Динамика частоты основных клинических синдромов в исследуемых группах в зависимости от проводимой терапии.  Отмечен выраженный антихолестатический эффект ремаксола у больных алкогольным стеатогепатитом по статистически значимому различию в динамике показателей холестаза между группами (по изменению величины ГГТП, р = 0,02). После окончания 12-дневного курса лечения в основной 1 группе больных было зарегистрировано более существенное уменьшение средних значений ГГТП. Кратность снижения уровня фермента ГГТП составила 1,9 в основной группе и 1,5 раза в группе сравнения соответственно, что указывает на большую эффективность ремаксола по сравнению с адеметионином в отношении внутрипеченочного холестаза при АБП.
Отмечен выраженный антихолестатический эффект ремаксола у больных алкогольным стеатогепатитом по статистически значимому различию в динамике показателей холестаза между группами (по изменению величины ГГТП, р = 0,02). После окончания 12-дневного курса лечения в основной 1 группе больных было зарегистрировано более существенное уменьшение средних значений ГГТП. Кратность снижения уровня фермента ГГТП составила 1,9 в основной группе и 1,5 раза в группе сравнения соответственно, что указывает на большую эффективность ремаксола по сравнению с адеметионином в отношении внутрипеченочного холестаза при АБП.  Рис. 3. Доля пациентов (%) на цирротической стадии алкогольной болезни печени и прогностически неблагоприятными значениями расчетного индекса MELD > 11 в зависимости от проводимой терапии.
Рис. 3. Доля пациентов (%) на цирротической стадии алкогольной болезни печени и прогностически неблагоприятными значениями расчетного индекса MELD > 11 в зависимости от проводимой терапии. 