Многокомпонентные инфузионные гепатопротекторы при лекарственном поражении печени
Статьи
Опубликовано в журнале:
Медицинский совет. 2019; 3: 84-88. DOI: doi.org/10.21518/2079-701X-2019-3-84-88
Е.И. Сас1,2, В.Б. Гриневич1
1 Федеральное государственное бюджетное военное образовательное учреждение высшего образования «Военно-медицинская академия имени С.М. Кирова» Министерства обороны Российской Федерации: 194044, Россия, г. Санкт-Петербург, ул. Академика Лебедева, д. 6
2 Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный педиатрический медицинский университет» Министерства здравоохранения Российской Федерации: 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2
Резюме
Лекарственные поражения печени (ЛПП) остаются сегодня одной из наиболее актуальных проблем не только гастроэнтерологии, но и всей терапии. До 10% случаев изменение лабораторных показателей можно связать с приемом лекарств. В последние годы значение ЛПП существенно возросло, что объясняется повышением количества лекарственных средств на фармацевтическом рынке, отпускаемых без рецепта, а также несоблюдением способов и режимов приема препаратов. В патогенезе ЛПП имеются общие звенья, включающие гипоксию, деэнергизацию (дефицит выработки АТФ), повреждение мембран гепатоцитов и угнетение антиоксидантной защиты. Исходя из этого, патогенетическая фармакотерапия и профилактика поражений печени опираются на препараты с механизмом действия, направленным на устранение одного или нескольких звеньев патогенеза. Одним из таких препаратов является Ремаксол, в состав которого входят антиоксиданты-антигипоксанты метаболитного типа: естественные метаболиты, субстраты и кофакторы, участвующие в энергетическом обмене. Ремаксол назначался 30 больным язвенной болезнью двенадцатиперстной кишки (ЯБДК) в фазе обострения в дополнение к основной эрадикационной терапии при возникновении цитолитического синдрома к концу первой недели терапии внутривенно капельно со скоростью 40-60 кап/мин в суточной дозе 400 мл в течение 10 дней ежедневно. На фоне применения Ремаксола у пациентов с ЛПП отмечалась стабилизация основных биохимических показателей: уровня АСТ, АЛТ, прямого билирубина, ГГТП и щелочной фосфатазы. Данные изменения сопровождались положительной динамикой общего состояния. Использование Ремаксола у пациентов с ЛПП позволит добиваться клинической и биохимической ремиссии, предупреждая развитие тяжелых поражений печени, и способствует сохранению рекомендуемой длительности терапии основного заболевания.
Ключевые слова: лекарственное поражение печени, побочный эффект, янтарная кислота, Ремаксол
Для цитирования: Сас Е.И., Гриневич В.Б. Многокомпонентные инфузионные гепатопротекторы при лекарственном поражении печени. Медицинский совет. 2019; 3: 84-88. DOI: doi.org/10.21518/2079-701X-2019-3-84-88.
Конфликт интересов: авторы заявляют об отсутствии конфликта интересов.
Информация об авторах:
Сас Евгений Иванович – д.м.н., профессор 2-й кафедры терапии (усовершенствования врачей) Федерального государственного бюджетного военного образовательного учреждения высшего образования «Военно-медицинская академия имени С.М. Кирова» Министерства обороны Российской Федерации
Гриневич Владимир Борисович – д.м.н., профессор, полковник медицинской службы, заведующий 2-й кафедрой терапии (усовершенствования врачей) Федерального государственного бюджетного военного образовательного учреждения высшего образования «Военномедицинская академия имени С.М. Кирова» Министерства обороны Российской Федерации; вице-президент Научного общества гастроэнтерологов России (НОГР) – президент Панкреатического клуба
Multi-component infusion hepatoprotectors for liver damage
Evgeny I. Sas1,2, Vladimir B. Grinevich1
1 Federal State Budgetary Military Educational Institution of Higher Education «Military Medical Academy named after S.M. Kirov» of the Ministry of Defense of the Russian Federation: 194044, Russia, Saint-Petersburg, 6, Akademika Lebedev Street
2 Federal State Budgetary Educational Institution of Higher Education «St. Petersburg State Pediatric Medical University» of the Ministry of Health of the Russian Federation: 194100, Saint-Petersburg, 2, Litovskaya St.
Abstract
Drug-induced liver injuries (DILI) remain today one of the most pressing problems not only in gastroenterology, but also in all therapy. Up to 10% of the changes in laboratory parameters can be attributed to the use of drugs. The importance of DILI has increased significantly in recent years, due to the increase in the number of over-the-counter medicines on the pharmaceutical market, as well as non-compliance with the methods and modes of administration. There are common links in the pathogenesis of DILI, including hypoxia, de-energization (deficit of ATP production), damage to hepatocyte membranes and suppression of antioxidant protection. Therefore, pathogenetic pharmacotherapy and prevention of liver damage are based on drugs with an action mechanism aimed at eliminating one or more links in the pathogenesis. One of these drugs is Remaxol, which includes antihypoxant-antioxidants of metabolic type: natural metabolites, substrates and cofactors involved in energy metabolism. Remaxol was administered to 30 patients with duodenal ulcer (DU) in the acute phase in addition to the main eradication therapy in the case of cytolytic syndrome by the end of the first week of therapy intravenously dripping at a rate of 40-60 drops/min in a daily dose of 400 ml for 10 days a day. Against the background of Remaxol application, the patients with DILI had stabilization of the main biochemical parameters: the level of AST, ALT, direct bilirubin, GGT and alkaline phosphatase.
These changes were accompanied by a positive dynamics of the general state of health. The use of Remaxol in patients with DILI will allow to achieve clinical and biochemical remission, preventing the development of severe liver damage, and contributes to the preservation of the recommended duration of treatment of the underlying disease.
Keywords: drug-induced liver injury, side effect, amber acid, Remaxol
For citing: Sas E.I., Grinevich V.B. Multi-component infusion hepatoprotectors for liver damage. Meditsinsky Sovet. 2019; 3: 84-88. DOI: doi.org/10.21518/2079-701X-2019-3-84-88.
Conflict of interest: The authors declare no conflict of interest.
Author credentials:
Sas Evgeny Ivanovich – Dr. of Sci. (Med), Professor of the 2nd Department (Therapy of Advanced Medical Education) of the Federal State Budgetary Military Educational Institution of Higher Education «Military Medical Academy named after S.M. Kirov» of the Ministry of Defense of the Russian Federation
Grinevich Vladimir Borisovich – Dr. of Sci. (Med), Professor, Head of the 2nd Department (Therapy of Advanced Medical Education) of the Federal State Budgetary Military Educational Institution of Higher Education «Military Medical Academy named after S.M. Kirov» of the Ministry of Defense of the Russian Federation; VicePresident of the Scientific Society of Gastroenterologists of Russia (SSGR) – President of the Pancreatic Club
Лекарственные поражения печени (ЛПП) – клинические и морфологические изменения печени, вызванные прямым или опосредованным повреждающим воздействием лекарственных препаратов или их метаболитов. Возникают они, как правило, у лиц, обладающих повышенной чувствительностью к данным препаратам, что обусловлено индивидуальными генетическими особенностями человека, либо могут быть связаны с фоновыми и сопутствующими заболеваниями, определяющими эту патологическую реакцию [1]. По различным данным, около 5% случаев клинически выявляемой желтухи связано с приемом лекарственных препаратов. Однако при обследовании больных с хроническим гепатитом неясной этиологии в 10% случаев изменение лабораторных показателей можно связать с приемом лекарств. Факторы риска развития ЛПП могут быть подразделены на эндогенные и экзогенные [2]. К экзогенным относятся: прием алкоголя, одновременный прием нескольких препаратов, доза, длительность и способ введения препарата, а также особенности его фармакокинетики и иммуногенность. К эндогенным факторам риска можно отнести: женский пол, возраст старше 40 лет, беременность, ожирение, дефицит массы тела, сопутствующие хронические заболевания печени, почек, сердца, реакции на препарат в анамнезе (либо на препарат данной фармакологической группы) [3]. Однако необходимо отметить, что гепатотоксический эффект лекарственных препаратов подразделяется на дозозависимый, который усиливается при увеличении дозы того или иного препарата, и дозонезависимый, связанный с идиосинкразией.
В последние годы значение ЛПП существенно возросло, что объясняется повышением количества лекарственных средств на фармацевтическом рынке, отпускаемых без рецепта, несоблюдением способов и режимов приема препаратов, а также высоким распространением среди населения хронических диффузных заболеваний печени. Так как ЛПП могут имитировать симптомы различных острых и хронических заболеваний печени, верификация диагноза может вызывать серьезные затруднения. Установление точного и своевременного диагноза в данном случае играет ведущую роль в тактике ведения пациента [4].
Последствия таких поражений, как правило, могут носить необратимый характер и ведут к снижению качества жизни, а порой могут стать причиной цирроза и рака печени [2, 4-6].
Острое повреждение может возникать в паренхиме органа за счет как цитотоксического действия на гепатоциты (цитолитические поражения), так и поражения элементов внутрипеченочной желчевыводящей системы (холестатические поражения) либо носит сочетанный характер. В патогенезе ЛПП разного происхождения имеются общие звенья, включающие гипоксию, деэнергизацию (дефицит выработки и утилизации АТФ), повреждение мембран гепатоцитов (цитоплазматических и митохондриальных), активизацию свободнорадикального окисления и угнетение антиоксидантной защиты [1, 2, 5, 6]. Исходя из этого, патогенетическая фармакотерапия и профилактика поражений печени опираются на препараты с механизмом действия, направленным на устранение одного или нескольких звеньев патогенеза [7, 8-12].
Однако, несмотря на видимую простоту, ЛПП имеют широкий ассортимент патогенетических точек приложения. При этом основные звенья патогенеза ЛПП могут быть как связаны между собой, так и сильно различаться, что создает определенные сложности при выборе терапии. Так, активация перекисного окисления липидов (ПОЛ) приводит к избыточному образованию свободных радикалов. Следующий шаг в этой патогенетической цепочке – нарушение функций митохондрий (за счет повреждения митохондриальной мембраны) и истощение запасов АТФ. Однако избыточное образование свободных радикалов может приводить и к денатурации белков (т.е. потере функциональной активности основных ферментативных систем), и к разрушению цитоскелета клетки (с весьма многочисленными исходами, в том числе, как вариант, нарушение гомеостаза Са). Также существуют и другие патогенетические механизмы развития ЛПП: образование гаптенов с последующим развитием аутоиммунной реакции на органеллы, с которыми произошло связывание гаптена; блокада транспортной РНК с нарушением процессов репарации клетки; связывание с ядерными и цитоплазматическими молекулами, изменение их функциональной активности, нарушение основных саногенетических механизмов функционирования клетки (как частный вариант, связывание с мембранными рецепторами). Все эти механизмы могут как развиваться по отдельности, так и сочетаться при развитии ЛПП даже на прием одного лекарственного препарата.
В свою очередь, это создает определенные сложности при выборе гепатопротективного препарата с целью лечения ЛПП: препарат должен быть полифункциональным, иметь несколько точек приложения, и максимально корригировать возникающие нарушения. Каждый из известных гепатопротекторов имеет свои «сильные стороны», основные точки приложения, однако неспособен максимально «перекрывать» все известные патогенетические механизмы токсического воздействия лекарственных препаратов на печень, что практически всегда ставит врача перед выбором либо требует в некоторых ситуациях комбинировать препараты. Одним из логических выводов из вышесказанного является создание современных высокоэффективных комбинированных лекарственных средств, оказывающих гепатопротекторное действие, обладающих взаимопотенцирующим механизмом действия. Одним из таких препаратов является Ремаксол, в состав которого входят антиоксиданты-антигипоксанты метаболитного типа: естественные метаболиты, субстраты и кофакторы, участвующие в энергетическом обмене [8-11, 13-14].
Фармакодинамика Ремаксола, позиционируемого как многокомпонентный инфузионный гепатопротектор, включает антиоксидантные, антигипоксантные и мембраностабилизирующие свойства [15], которые обеспечиваются его составом. В состав Ремаксола входят естественные метаболиты, оказывающие гепатотропный эффект (янтарная кислота, рибоксин, никотинамид, метионин), и компоненты (Na+, K+, Mg2+, CL- и N-метилглюкамин), необходимые для обеспечения определенной осмолярности и буферной емкости инфузионного препарата [16, 17].
Согласно опубликованным данным, клинические проявления благоприятного действия Ремаксола при гепатопатиях весьма разнообразны и превосходят эффекты традиционной фармакотерапии: сопровождаются повышением качества жизни пациентов (исчезновение астеновегетативного синдрома, признаков интоксикации, диспепсии), нормализацией углеводного, липидного и пигментного обмена, восстановлением синтетической функции печени, исчезновением признаков цитолиза и холестаза [15, 16].
Янтарная кислота, представленная в Ремаксоле как один из основных действующих компонентов, является универсальным промежуточным метаболитом, образующимся при взаимопревращении углеводов, белков и жиров в растительных и животных клетках. В физиологических условиях янтарная кислота диссоциирована, поэтому название ее аниона – «сукцинат» часто применяют как синоним термина «янтарная кислота». Она является продуктом пятой и субстратом шестой реакции в цикле Кребса. Уникальность лечебного воздействия янтарной кислоты в организме связано с продукцией энергии, необходимой для обеспечения жизнедеятельности непосредственно при прохождении реакции (так называемое субстратное фосфолирирование). Это в корне отличается от других реакций в цикле Кребса, в которых для синтеза АТФ требуется вовлечение всего каскада дыхательной цепи, который тоже повреждается при ЛПП. Таким образом, при возрастании нагрузки на энергетическую систему клетки поддержание ее работы обеспечивается преимущественно за счет окисления янтарной кислоты (т.е. янтарная кислота в условиях оксидативного стресса и гипоксии дает клетке возможность еще одного «дополнительного вздоха» с целью адаптации к возникшим патогенетическим процессам).
Именно это и обеспечивает широкий диапазон неспецифического лечебного действия янтарной кислоты и ее солей. Кроме того, янтарная кислота обладает и такими эффектами, как актопротекторный и противовирусный.
В экспериментальных исследованиях биологическая активность экзогенного сукцината зависела от дозы, режима введения препарата, его химической формы (кислота, соль, сложный эфир), а также от функционального состояния организма.
При применении физиологических доз янтарной кислоты выявлены две ведущие группы эффектов:
- прямое действие янтарной кислоты на клеточный метаболизм;
- влияние янтарной кислоты на транспорт свободного кислорода в ткани.
В экспериментах in vitro было показано, что применение сукцината приводило к приросту потребления кислорода тканями за счет окисления добавленных субстратов до конечных продуктов: углекислоты, воды и тепла. Одна молекула добавленной к ткани дикарбоновой кислоты обеспечивает окисление многих эндогенных субстратов. Иными словами, окисление сукцината является необходимым условием каталитического действия любой другой из карбоновых кислот для усвоения тканью кислорода (цикл три- и дикарбоновых кислот).
Потеря интермедиатов цикла возрастает при острых и хронических отравлениях аммиаком. Пополнение пула кислот цикла Кребса нарушается при алкоголизме, гиповитаминозе В6 и при отравлениях ингибиторами пиридоксальфосфат-зависимых ферментов. Поэтому пополнение пула интермедиатов цикла Кребса, в том числе из пищевых источников, является необходимым.
Никотинамид активирует NAD-зависимые ферменты клеток, защищающие мембраны клеток от разрушения свободными радикалами.
Синтез макроэргических молекул усиливается под воздействием инозина – производного пурина – предшественника аденозинтрифосфата. Антиоксидантное действие инозина реализуется за счет:
- активации синтеза NAD в митохондриях из никотинамида, где инозин выступает в роли донора рибозы;
- стимуляции анаэробного гликолиза с образованием лактата и NAD+;
- ингибирования фермента ксантиноксидазы и подавления радикальных процессов.
Липотропный эффект метионина способствует синтезу холина, недостаточное образование которого приводит к нарушению синтеза фосфолипидов из жиров и отложению нейтрального жира в печени. Путем метилирования и транссульфирования метионин обезвреживает токсичные продукты.
Целью исследования явилось изучение клинической и биохимической эффективности Ремаксола при ЛПП с минимальной и умеренной активностью.
Ремаксол назначался 30 больным язвенной болезнью двенадцатиперстной кишки (ЯБДК) в фазе обострения в дополнение к основной эрадикационной терапии при возникновении цитолитического синдрома к концу первой недели терапии внутривенно капельно со скоростью 40-60 кап/мин в суточной дозе 400 мл в течение 10 дней ежедневно. Средний возраст больных составил 37,7±7,3 года. Соотношение мужчин и женщин среди больных ЯБДК, получавших терапию Ремаксолом, составило 80 и 20% (24 и 6 человек соответственно).
У всех больных в динамике проводилось исследование следующих показателей:
- общеклинических;
- биохимических (АСТ, АЛТ, билирубин, ЩФ, ГГТП, глюкоза, калий);
- холестерина и липопротеидов сыворотки крови (общий холестерин, холестерин ЛПНП, холестерин ЛПВП, коэффициент атерогенности (КА));
- ФГДС;
- ЭКГ;
- УЗИ органов брюшной полости.
- Оценка выраженности клинических проявлений болевого абдоминального и диспептического синдромов проводилась путем самонаблюдения с использованием балльного шкалирования (визуально-аналоговая шкала) при значениях: 0 – отсутствие симптома, 5 – максимальная его выраженность.
- Оценка психологического статуса.
- Проведена оценка качества жизни по опроснику SF-36 (в баллах рассматривались следующие шкалы: PF – физического функционирования, RP – физического ролевого функционирования, BP – боли, GH – общего здоровья, VT – жизнеспособности, SF – социального функционирования, RE – ролевого эмоционального функционирования, MH – ментального (психологического) здоровья).
На фоне применения Ремаксола у пациентов с ЛПП отмечалась стабилизация основных биохимических показателей: уровня АСТ, АЛТ, прямого билирубина, ГГТП и щелочной фосфатазы (рис. 1).
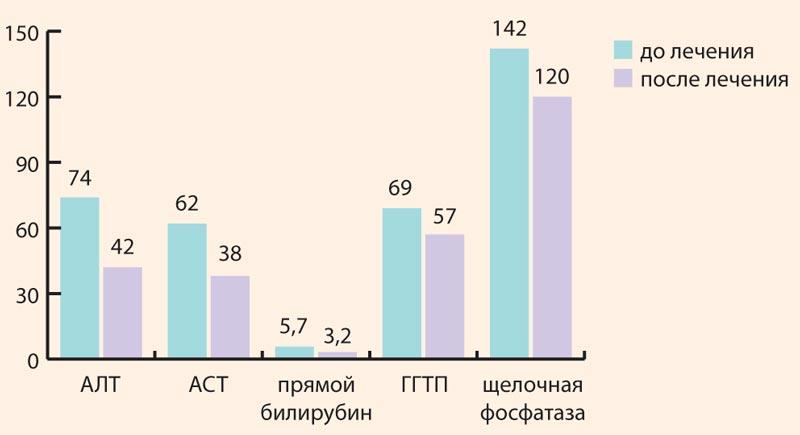 Рисунок 1. Динамика основных биохимических показателей у пациентов с ЛПП на фоне использования Ремаксола
Рисунок 1. Динамика основных биохимических показателей у пациентов с ЛПП на фоне использования Ремаксола
Figure 1. Dynamics of basic biochemical parameters in patients with DILI against the background of Remaxol use
Данные изменения сопровождались положительной динамикой общего состояния (табл.). Так, препарат Ремаксол эффективно купировал ведущие клинические синдромы болезни – астеновегетативный, диспепсический синдромы (по показателям выраженности общей слабости, утомляемости, сухости во рту и металлического привкуса во рту).
Таблица. Динамика регрессии клинических проявлений диспепсического и абдоминального синдромов у больных ЯБДК при использовании Ремаксола
Table. Dynamics of regression of clinical manifestations of dyspeptic and abdominal syndromes in DU patients using Remaxol
| Клинические симптомы | Основная группа
|
| До лечения | После лечения
|
| Общая слабость, баллы | 2,9±0,3 | 1,6±0,4* |
| Утомляемость, баллы | 2,7±0,3 | 1,6±0,3 * |
| Сухость во рту, баллы | 3,2±1,2 | 1,3±0,3 |
| Металлический привкус во рту, баллы | 2,5±0,2 | 1,7±0,1* |
* Различия с группой сравнения статистически значимы (р <0,05).
Данные изменения сопровождались положительной динамикой качества жизни: по данным общего опросника SF-36 наибольшее приращение показателей качества жизни пациентов было отмечено по шкалам ролевого физического и физического функционирования, а также шкале боли (рис. 2). Безусловно, в реализации данных положительный изменений значительный вклад был внесен эрадикационной терапией, однако ее безопасность и продолжительность была обеспечена гепатопротективным эффектом Ремаксола.
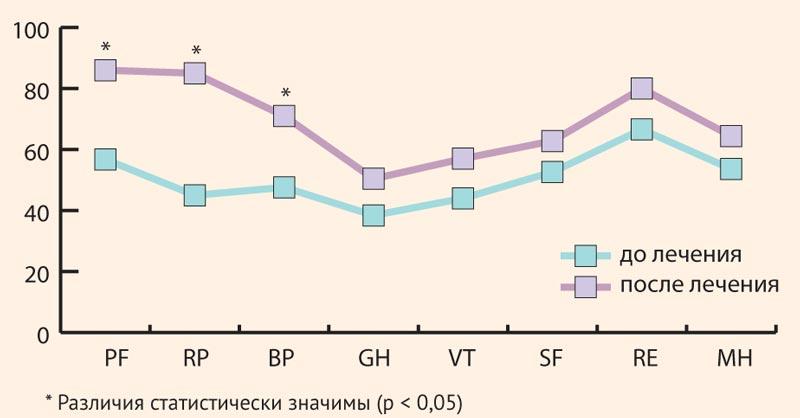 Рисунок 2. Динамика качества жизни у пациентов с ЛПП на фоне использования Ремаксола
Рисунок 2. Динамика качества жизни у пациентов с ЛПП на фоне использования Ремаксола
Figure 2. Dynamics of quality of life in patients with DILI with Remaxol
Таким образом, использование Ремаксола у пациентов с лекарственными поражениями печени позволяет добиваться клинической и биохимической ремиссии, предупреждая развитие тяжелых поражений печени, и способствует сохранению рекомендуемой длительности терапии основного заболевания.
Литература/References
- Abboud G., Kaplowitz N. Drug-induced Liver injury. Drug Saf. 2007;30(4):277-294.
- Andrade RJ., Robles M., Fernandez-Castaner A., Lopez-Ortega S., Lopez-Vega M.C., Lucena M.I. Assessment of drug-induced hepatotoxicity in clinical practice: a challenge for gastroenterologists. World J Gastroenterol. 2007;13(3):329-340.
- Mindikoglu A.L., Magder L.S., Regev A. Outcome of liver transplantation for drug-induced acute liver failure in the United States: analysis of the united network for organ sharing database. Liver Transpl. 2009;15:719-29.
- Полунина Т.Е. Лекарственные гепатиты. Тер. архив. 1999;71(12):46-49. [Polunina T.E. Medicinal hepatitis. Ther. archive. [Ter. arhiv.]. 1999;71(12):46-49.] (In Russ).
- Полунина Т.Е., Маев И.В. Лекарственный гепатит. Consilium medicum. Приложение к журналу Consilium medicum. Гастроэнтерология. 2008;1:3-10. [Polunina T.E., Maev I.V Medicinal hepatitis. Consilium medicum. Appendix to the journal Consilium medicum. Gastroenterology [Consilium medicum. Prilozhenie k zhurnalu Consilium medicum. Gastrojenterologija]. 2008;1:3-10.] (In Russ).
- Ковтун А.В., Яковенко А.Н., Яковенко Э.П. и др. Лекарственно-индуцированные поражения печени. Диагностика и лечение. Лечащий врач. 2009;2:8-14. [Kovtun A.V., Yakovenko A.N., Yakovenko E.P. et al. Drug-induced liver injury. Diagnostics and treatment. Doctor in charge [Lechashhij vrach]. 2009;2:8-14.] (In Russ).
- Gunawan B., Kaplowitz N. Chapter 119 Drug-induced liver disease. Advanced therapy in gastroenterology and liver disease. 2005:689693.] (In Russ).
- Суханов Д.С., Артюшкова Е.Б., Дудка В.Т., Оковитый С.В. Эффективность ремаксола и адеметионина при сочетанном экспериментальном поражении печени противотуберкулезными препаратами резервного ряда и алкоголем. Туберкулез и болезни легких. 2014;92(4):59-62. [Suhanov D.S., Artyushkova E.B., Dudka V.T.,Okovityj S.V. Efficacy of remaxol and ademetionine in experimental drug-induced liver injury with combination of backup anti-tuberculosis drugs and alcohol. Tuberculosis and lung diseases. [Tuberkulez i bolezni legkih.] 2014;92(4):59-62.] (In Russ.)
- Bode C. Dangerous Liaisons. The Scientist. 2010;5:320-343.
- Шерлок Ш., Дули Дж. Заболевание печени и желчевыводящих путей: Практич. рук.: Пер. с англ. Под ред. З.Г. Апросиной, Н.А. Мухина. М.: Гэотар Медицина, 1999; 864 с. [Sherlock S., Dooley J. Liver and biliary tract disease: Practical hands: Per. from English. Under editorship of Z.G. Aprosina, N.A. Mukhin. M.: Gaotar Medicine, 1999; 864 p..] (In Russ).
- Clark J.M., Brancati F.L., Diehl A.M. The prevalence and etiology of elevated aminotransferase levels in the United States. Am J Gastroenterol. 2003;98: 960-7.
- Jalan R., Hayes PC. Review article: quantitative tests of liver function. Aliment Pharmacol Ther. 1995;9:263.
- Lee W.M. Drug-induced hepatotoxicity. N. Engl. J. Med. 2003;349:474-485.
- Poordad F.F. Laboratory evaluation and liver biopsy assessment in liver disease Chapter105. Advanced therapy in gastroenterology and liver disease. 2005:604-611.
- Павелкина В.Ф., Амплеева Н.П. Сравнительная эффективность гепатотропной активности ремаксола и эссенциале Н при хронических вирусных гепатитах. Экспер. и клин. фармакол. 2014;12:17-21. [Pavelkina V.F., Ampleeva N.P. Comparative efficiency of hepatotropic activity of Remaxol and Essentiale N in chronic viral hepatitis. Exper. and clin. pharmacol. [Jeksper. i klin.farmakol.]. 2014;12:17-21.] (In Russ).
- Сологуб Т.В., Горячева Л.Г, Суханов Д.С. и др. Гепатопротективная активность ремаксола при хронических поражениях печени (материалы многоцентрового рандомизированного плацебо-контролируемого исследования). Клин. мед. 2010;1:62-66. [Sologub T.V, Goryacheva L.G., Sukhanov D.S., et aL Hepatoprotective activity of Remaxol in chronic liver damage (materials of multicenter randomized placebo-controlled study). Clin. med. [Klin. Med.]. 2010;1:62-66.] (In Russ).
- Суханов Д.С., Романцов М.Г. Эффекты гепатопротектора при поражении печени у больных туберкулезом органов дыхания. Успехи современного естествознания. 2008;10:40-50. Sukhanov D.S., Romantsov M.G. Effects of hepatoprotector in liver damage in patients with respiratory tract tuberculosis. Successes of modern science [Uspehi sovremennogo estestvoznanija]. 2008;10:40-50.] (In Russ).
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 www.polysan.ru
www.polysan.ru
 Рисунок 1. Динамика основных биохимических показателей у пациентов с ЛПП на фоне использования Ремаксола
Рисунок 1. Динамика основных биохимических показателей у пациентов с ЛПП на фоне использования Ремаксола  Рисунок 2. Динамика качества жизни у пациентов с ЛПП на фоне использования Ремаксола
Рисунок 2. Динамика качества жизни у пациентов с ЛПП на фоне использования Ремаксола 