Патогенетические связи повреждения печени, ожирения и COVID-19
Статьи
И. Г. Бакулин, д. м. н., проф. кафедры пропедевтики внутренних болезней, гастроэнтерологии и диетологии им. С. М. Рысса
Н. В. Бакулина, д.м.н., проф. кафедры внутренних болезней, клинической фармакологии и нефрологии
С. В. Тихонов, к.м.н., доцент кафедры внутренних болезней, клинической фармакологии и нефрологии
C. А. Винчук, к.м.н., доцент кафедры патологической анатомии
В. Д. Декканова, ст. лаборант кафедры внутренних болезней, клинической фармакологии и нефрологии
H. А. Прокофьева, зав. терапевтическим отделением № 2 клиники им. Петра Великого
ФГБОУ ВО «Северо-Западный государственный медицинский университет имени И. И. Мечникова» Минздрава России, Санкт-Петербург
Медицинский алфавит № 30 / 2020. Практическая гастроэнтерология (3)
Pathogenetic links of liver damage, obesity and COVID-19
I. G. Bakulin, N. V. Bakulina, S. V. Tikhonov, S. A. Vinchuk, V. D. Dekkanova, N. A. Prokofiev
North-Western State Medical University n.a. I.I. Mechnikov, Saint Petersburg, Russia
Резюме
Для изучения потенциальной взаимосвязи ожирения, поражения печени и характера течения COVID-19 был проведен ретроспективный анализ 73 историй болезни пациентов, проходивших лечение коронавирусной пневмонии на базе клиники СЗГМУ им. И. И. Мечникова. Средний ИМТ у участников исследования равнялся 30,8 ± 5,8 кг/м2, окружность талии - 103,5 ± 13,5 см, абдоминальным ожирением страдали 77 % пациентов, цитолитический синдром диагностировался у 71 %. В проведенном исследовании не удалось установить связь между наличием ожирения и цитолитическим синдромом. Степень повышения уровня трансаминаз зависела от тяжести течения COVID-19 (уровень ферритина, СРБ и сатурация крови кислородом), но не от величины ИМТ, окружности талии, наличия СД второго типа.
Ключевые слова: COVID-19, SARS-CoV-2, ожирение, абдоминальное ожирение, аланинаминотрасфераза, аспартатаминотрансфераза, гепатит, неалкогольная жировая болезнь печени, ферритин, С-реактивный белок.
Summary
A retrospective analysis of 73 case histories of COVID-19 patients were made to study the potential relationship between obesity, liver damage and COVID-19. The average BMI of the study participants was 30.8 ± 5.8 kg/m2, waist circumference 103.5 ± 13.5 cm, 77 % of patients had abdominal obesity, 71 % of patients had cytolytic syndrome. There was not link between the presence of obesity and the level of transaminases. The degree of transaminases increase depended on the severity of COVID-19 (level of ferritin, CRP, and oxygen saturation of the blood) and wasn't connected with BMI, waist circumference, and the presence of type 2 diabetes.
Key words: COVID-19, SARS-CoV-2, obesity, abdominal obesity, alanine aminotransferase, aspartate aminotransferase, hepatitis, non-alcoholic fatty liver disease, ferritin, C-reactive protein.
Введение
В 2019 году в г. Ухани (КНР) впервые зафиксирована вспышка тяжелой пневмонии неясного генеза с высокой контагиозностью и летальностью. 30 января 2020 года ВОЗ объявила эту вспышку чрезвычайно опасной ситуацией для общественного здоровья, имеющей международное значение. 11 февраля 2020 года новое заболевание получило официальное название «инфекция, вызванная новым коронавирусом COVID-19» (COrona Virus Disease 2019). Международный комитет по таксономии вирусов присвоил возбудителю инфекции официальное название SARS-CoV-2 [1-3].
11 марта 2020 года была объявлена пандемия новой коронавирусной инфекции COVID-19 [2]. В Российской Федерации, по данным Росстата, опубликованным 7 августа, за период с апреля по июнь непосредственно от COVID-19 умерло 16388 человек, смерть 3 443 пациентов наступила от других заболеваний, декомпенсированных на фоне данной инфекции [4].
В популяции круглогодично присутствуют четыре сезонных коронавируса -HCoV-229E, -OC 43, -NL63 и -HKU 1, вызывающих поражение верхних дыхательных путей легкой и средней степени тяжести. Два типа коронавируса являются высокопатогенными, приводящими к летальным исходам - это новый SARS-CoV-2 и MERS-CoV - вирус ближневосточного респираторного синдрома (MERS) [5].
Впервые коронавирус стал причиной развития эпидемии в 2002 году. Почти по всем странам мира прокатилась волна атипичной пневмонии, вызванная коронавирусом SARS-CoV Эпидемия длилась в течение 2 лет, с 2002 по 2004 год. В 2012 году на Аравийском полуострове произошла еще одна вспышка инфекции, причиной которой являлся MERS-CoV. В отличие от SARS-CоV, MERS-CoV продолжает циркулировать в популяции и вызывать новые случаи заболевания [5].
Основной путь взаимодействия SARS-CoV и SARS-CoV-2 с клетками человека опосредуется рецепторами к ангиотензин превращающему ферменту 2 (АСЕ2), что было подтверждено исследованиями китайских ученых во время эпидемии атипичной пневмонии и в недавних работах по изучению COVID-19 [6]. MERS-CoV для входа в клетки хозяина использует дипеп-тидилпептидазу-4 [7].
Факторами, ухудшающими течение коронавирусной инфекции, являются ожирение, артериальная гипертензия, сахарный диабет [8-10]. Таким образом, именно ожирение и ассоциированные с ним заболевания, входящие в структуру метаболического синдрома, определяют характер течения данной инфекции. Пациенты с ожирением и НАЖБП имеют шестикратное повышение риска тяжелого и очень тяжелого течения COVID-19 [10].
Ожирение является крупнейшей неинфекционной пандемией XXI века. Согласно эпидемиологическим данным, частота встречаемости ожирения в мире с 1975 года увеличилась в три раза. На сегодняшний день от осложнений, связанных с ожирением, погибает больше людей, чем от аномально низкой массы тела. По прогнозу Всемирной организации здравоохранения, при сохранении тенденции распространения заболевания, через 10 лет 60 % населения мира, то есть 3,3 миллиарда человек, будут иметь избыточный вес, а 1,1 миллиард -страдать ожирением. В Российской Федерации на 2016 год ожирение диагностировалось у 26,2 %, избыточная масса тела - у 62,0 % населения [12].
Ожирение - хроническое заболевание обмена веществ, развивающееся в результате дисбаланса потребления и расхода энергии и проявляющееся избыточным развитием жировой ткани, прогрессирующее при естественном течении, имеющее определенный круг осложнений, повышающее риск развития различных заболеваний, с высокой вероятностью рецидива после окончания лечения. Морбидное ожирение диагностируется при индексе массы тела (ИМТ) > 40 кг/м2, вне зависимости от осложнений, или ИМТ > 35 кг/м2 при наличии серьезных осложнений, ассоциированных с ожирением [13].
Исходное состояние печения может играть ключевую роль в развитии новой коронавирусной инфекции и определять тяжесть ее течения.
Во время предыдущей эпидемии атипичной пневмонии у 60 % пациентов наблюдались поражения печени различной степени тяжести. В условиях нынешней пандемии нарушение функции печени наблюдается у 14-53 % пациентов с COVID-19, особенно у больных с тяжелым течением заболевания [14].
Для всех трех типов коронавируса печень может являться органом-мишенью. Фермент дипептидилпептидаза-4 (DPP-4), являвшийся ключевым для проникновения в клетку MERS-CoV, в большом количестве экспрессируется в тканях печени. В литературе присутствует неоднозначная информация о репликации РНК коронавирусов в гепатоцитах. При изучении аутопсийного материала специалисты из Саудовской Аравии обнаружили соответствующие гистологические изменения ткани печени у пациентов с подтвержденным MERS-COV, но сами вирусные частицы обнаружены не были [15].
Высокая экспрессия рецепторов ACE 2, ключевых рецепторов для проникновения в клетки SARS-CoV-2, отмечается на альвеолярных клетках легких второго типа (более 80 %), в эндотелии сосудов малых и крупных артерий и вен, а также в базальном слое плоского эпителия, слизистой оболочки носа, полости рта и носоглотки [14, 16]. Также экспрессия ACE 2 высока в желудочно-кишечном тракте - в гладких мышцах слизистой оболочки желудка, энтероцитах двенадцатиперстной, тощей и подвздошной кишок [17, 18].
X. Chai et al. выявили своеобразное распределение рецепторов к ангиотензин превращающему ферменту 2 в гепатобилиарной системе. Рецепторы в большей степени экспрессируются на эндотелии мелких кровеносных сосудов и минимально - на синусоидальном эндотелии. Наиболее активная экспрессия рецептора отмечается на холангиоцитах (59,7 %), что сопоставимо с уровнем экспрессии в альвеолярных клетках легких второго типа, тогда как в гепатоцитах данный показатель равен 2,6 % [19]. Иммуногистохимическое окрашивание не выявило рецепторов к ACE 2 на клетках Купфера, Т- и В-лимфоцитах. [15, 19, 20]. G. Jinyang et al. обнаружили в тканях печени вирусные нуклеиновые кислоты SARS, а в цитоплазме гепатоцитов - типичные для коронавирусов шиповидные структуры [10]. Высокий уровень экспрессии рецептора ACE 2 на холангиоцитах и обнаружение нуклеиновых кислот вируса непосредственно в гепатоцитах указывают на то, что печень является потенциальной мишенью для SARS-CoV-2, при этом проникновение вируса может осуществляться через холангиоциты внутрипеченочных желчных протоков.
С целью изучения потенциальной взаимосвязи ожирения, поражения печени и характера течения COVID-19 ретроспективно были проанализированы истории болезни пациентов, проходивших лечение коронавирусной пневмонии на базе клиники СЗГМУ им. И. И. Мечникова в мае-июне 2020 года.
Материалы и методы
В исследовании приняли участие 73 пациента: 37 (51,4 %) женщин и 36 (48,6 %) мужчин с подтвержденной при проведении компьютерной томографии (КТ) пневмонией, вызванной SARS-CoV-2.
Всем пациентам выполнялся стандартный набор физикальных, инструментальных и лабораторных исследований на момент поступления в стационар: физикальное обследование, включая антропометрию и пульсоксиметрию; КТ для определения процента поражения легочной ткани; электрокардиография; лабораторное обследование - клинический, биохимический анализы крови, анализ мочи, коагулограмма; ПЦР на SARS-CoV-2.
Исследование имело ретроспективный дизайн. Статистическая обработка данных осуществлялась в программе Statistica 10.
Результаты
Антропометрические данные участников исследования представлены в таблице 1.
Таблица 1
Антропометрические параметры пациентов с COVID-19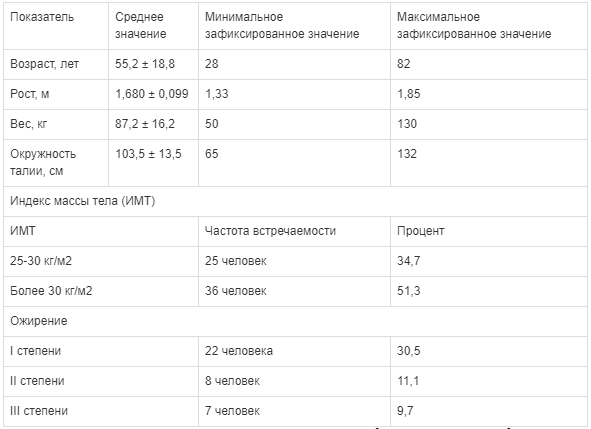
Средний ИМТ у участников исследования равнялся 30,8 ± 5,8 кг/м2 (от 21,70 до 48,06 кг/м2), окружность талии составляла 103,5 ± 13,5 см. Абдоминальным ожирением страдали 77 % пациентов.
Наиболее частыми хроническими заболеваниями у пациентов являлись гипертоническая болезнь у 65 (90,0 %), ишемическая болезнь сердца у 37 (51,0 %), СД 2 типа у 14 (19,4 %) пациентов.
На момент поступления в стационар, по данным КТ грудной клетки, пациенты ранжировались следующим образом:
- КТ 1 (вовлечение до 25 % паренхимы легких) диагностировалось у 11 (15,2 %) пациентов;
- КТ 2 (вовлечение 25-50 % паренхимы легких) диагностировалось у 33 (45,8 %) пациентов;
- КТ 3 (вовлечение 50-75 % паренхимы легких) диагностировалось у 20 (27,7 %) пациентов;
- КТ 4 (вовлечение паренхимы легкого от 75 %) диагностировалось у 6 (8,3 %) пациентов.
Сатурация крови кислородом (SpO2) находилась на уровне от 85 до 98 % и в среднем составляла 93,0 ± 3,2 %.
Данные стандартного лабораторного обследования участников исследования представлены в таблице 2.
Таблица 2
Результаты лабораторных исследований у пациентов с COVID-19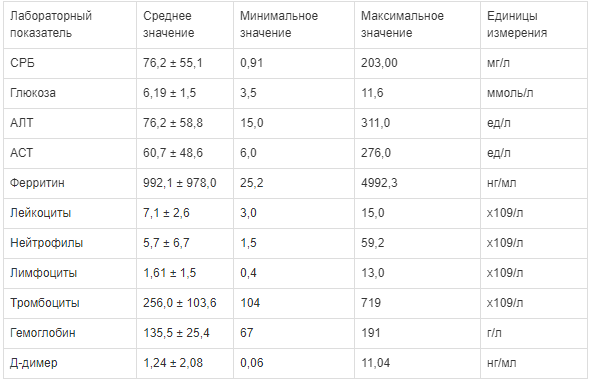
Цитолитический синдром диагностировался у 54 (71 %) пациентов на момент поступления в клинику.
При сравнении групп пациентов с цитолизом и без цитолиза при помощи критерия Манна-Уитни было выявлено, что больные с явлениями цитолиза моложе: средний возраст пациентов с цитолизом - 56,3 ± 13,2 года, пациентов без цитолиза - 64,2 ± 17,2 года (р = 0,003), у пациентов с цитолизом отмечаются достоверно более высокие уровни СРБ (р = 0,030). По другим показателям, включая антропометрические данные и распространенность инфильтрации в легких группы между собой не отличались.
Участники исследования, страдающие и не страдающие ожирением, не отличались по оцениваемым в исследовании лабораторным и инструментальным данным. Абдоминальное ожирение закономерно чаще выявлялось у мужчин, у пациентов с гипертонической болезнью, а также у пациентов с повышенным гематокритом. Значения АЛТ и АСТ у пациентов с нормальной, избыточной массой тела и ожирением представлены в таблице 3.
Таблица 3
Значения АЛТ и АСТ у пациентов нормальной, избыточной массой тела и ожирением
ИМТ, кг/м2 | АЛТ, ммоль/л | АСТ, ммоль/л |
Менее 24,9 | 84,1 ± 41,4 | 73,5 ± 45,6 |
25,0-29,9 | 85,20 ± 69,05 | 60,20 ± 53,08 |
30,0-34,9 | 64,3 ± 42,3 | 54,3 ± 33,8 |
35,0-39,9 | 78,5 ± 66,3 | 61,9 ± 42,8 |
Выше 40,0 | 61,7 ± 21,2 | 65,2 ± 17,9 |
При оценке коэффициента ранговой корреляции Спирмена уровень аминотрансфераз имел отрицательную корреляцию связь с возрастом пациента (коэффициент ранговой корреляции для АЛТ = -0,3; АСТ = -0,26) и наличием СД 2 типа (коэффициент ранговой корреляции для АЛТ = -0,28; АСТ = -0,25). Таким образом, более выраженное повышение трансаминаз было характерно для пациентов младших возрастных групп и пациентов, не страдающих сахарным диабетом.
Положительная корреляция наблюдалась между уровнем ферритина и концентрацией АЛТ (0,34) и АСТ (0,36). Уровень АСТ имел отрицательную корреляционную связь с SPO2 (-0,37). Низкие значения SрО2 были ассоциированы с повышением плазменной концентрации АСТ. Концентрация АЛТ у мужчин была достоверно выше, чем у женщин, что может объясняться более частым присутствием абдоминального ожирения.
СРБ имел достоверную положительную корреляционную связь со степенью изменений в легких (0,37), по данным КТ, уровнем лейкоцитов (0,32), уровнем нейтрофилов (0,49), Д-димером (0,29) и глюкозой плазмы крови (0,27), а также отрицательную корреляционную связь с SрО2 (-0,25) и концентрацией лимфоцитов (-0,28).
Степень ожирения отрицательно коррелировала с концентрацией лейкоцитов (-0,23) и нейтрофилов (-0,29).
Обсуждение результатов
Летальность от коронавирусной инфекции, составляющая 2-6 %, выше у пациентов с ожирением и ассоциированными метаболическими заболеваниями, в частности НАЖБП [14].
При НАЖБП происходит жировая дистрофия гепатоцитов с накоплением в них капель жира, нередко развиваются воспалительная инфильтрация, фокальный некроз печеночных клеток с последующим замещением их соединительной тканью. Жировая дистрофия тесно коррелирует с инсулинорезистентностью, сопровождается снижением способности инсулина подавлять продукцию глюкозы и липопротеинов очень низкой плотности гепатоцитами [21], что вызывает гипергликемию и гипертриглицеридемию. Прогрессирование болезни коррелирует с выраженностью метаболических отклонений, которые, в свою очередь, обусловливают развитие функциональных и структурных сосудистых нарушений - эндотелиальной дисфункции, увеличения толщины комплекса интима-медиа, кальцификации и атеросклеротических бляшек. В большинстве исследований показано, что биохимические маркеры атеросклероза, системного воспаления, гиперкоагуляции выше у пациентов с НАЖБП независимо от ИМТ [22].
Основная гипотеза, послужившая причиной проведения данного ретроспективного анализа, заключалась в том, что ключевую роль в тяжелом течение COVID-19 у пациентов с ожирением играет печень, в частности наличие и выраженность НАЖБП. Кроме того, у пациентов с НАЖБП потенциально чаще развивается острое повреждение печени SARS-CoV-2, учитывая имеющуюся дефектность данного органа.
В исследовании китайских коллег, в котором сравнивались пациенты с COVID-19, имеющие и не имеющие ожирение, было продемонстрирован-но, что пациенты с ожирением имеют более высокие уровни аминотрансфераз, глюкозы, ЛПНП, более низкое количество лимфоцитов и тяжелее переносят заболевание [10]. У пациентов с ожирением и НАЖБП повышен синтез провоспалительных факторов в печени и висцеральном жире, в частности увеличены плазменные концентрации интерлейкина 6 (ИЛ-6), основного участника цитокинового шторма. Таким образом, НАЖБП можно рассматривать как фактор риска более тяжелого течения COVID-19 [10].
В процессе исследования аутопсийного материала пациентов, скончавшихся от коронавирусной пневмонии тяжелого течения, патоморфологами СЗГМУ им. И. И. Мечникова определялись выраженное жировое перерождение и полнокровие печени.
На рисунках 1 и 2 представлена гистологическая картина мускатной печени пациента 72 лет, скончавшегося от респираторного дис-тресс-синдрома и полиорганной недостаточности на фоне тотальной вирусной пневмонии (КТ III-IV степени). Сопутствующими заболеваниями пациента являлись абдоминальное ожирение, гипертоническая болезнь, ишемическая болезнь сердца, атеросклероз коронарных артерий, цереброваскулярная болезнь, церебральный атеросклероз. На представленных снимках ткань печени однородная, светло-коричневая, полнокровная, с сохраненной архитектоникой и очагами дискомплексации печеночных балок. Часть портальных трактов незначительно расширена за счет отека, местами со слабой лимфоплазмоцитарной инфильтрацией и фиброзом. В большей части гепатоцитов - крупнокапельная и мелкокапельная жировая дистрофия и баллонная дистрофия. Отмечается неравномерное полнокровие синусов.
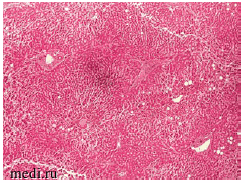 Рисунок 1. «Мускатная печень» пациента 70 лет, скончавшегося на фоне крайне тяжелого течения COVID-19. Ув. 10х.
Рисунок 1. «Мускатная печень» пациента 70 лет, скончавшегося на фоне крайне тяжелого течения COVID-19. Ув. 10х.
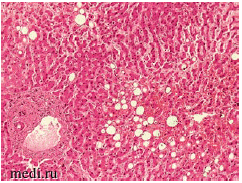 Рисунок 2. «Мускатная печень» пациента 70 лет, скончавшегося на фоне крайне тяжелого течения COVID-19 c заметным полнокровием синусов, крупно- и мелкокапельной жировой дистрофией. Ув. 20х.
Рисунок 2. «Мускатная печень» пациента 70 лет, скончавшегося на фоне крайне тяжелого течения COVID-19 c заметным полнокровием синусов, крупно- и мелкокапельной жировой дистрофией. Ув. 20х.
На рисунках 3 и 4 представлена гистологическая картина печени пациента 34 лет, скончавшегося от острой дыхательной недостаточности, на фоне тяжелой двусторонней полисегментарной пневмонии (КТ4), вызванной SARS-CoV-2. Основным фоновым заболеванием пациента являлось морбидное ожирение (ИМТ выше 40 кг/м2).
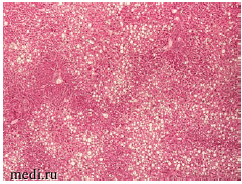 Рисунок 3. Стеатоз (мелко- и крупнокапельная жировая дистрофия гепатоцитов) на фоне венозного полнокровия ткани печени пациента 32 лет с морбидным ожирением, скончавшегося на фоне крайне тяжелого течения COVID-19. Ув. 10х.
Рисунок 3. Стеатоз (мелко- и крупнокапельная жировая дистрофия гепатоцитов) на фоне венозного полнокровия ткани печени пациента 32 лет с морбидным ожирением, скончавшегося на фоне крайне тяжелого течения COVID-19. Ув. 10х.
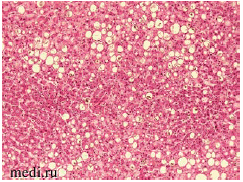 Рисунок 4. Жировая дистрофия печени с холестазом и кровоизлияния в синусоидальных капиллярах пациента 32 лет с морбидным ожирением, скончавшегося на фоне крайне тяжелого течения COVID-19. Ув. 20х.
Рисунок 4. Жировая дистрофия печени с холестазом и кровоизлияния в синусоидальных капиллярах пациента 32 лет с морбидным ожирением, скончавшегося на фоне крайне тяжелого течения COVID-19. Ув. 20х.
При морфологическом исследовании ткань печени выглядит пестрой из-за чередования мелких очагов красного, темно-бордового и желтого цвета, вены печени не расширены, полнокровны, желчные протоки расширены. Отмечается резкое нарушение архитектоники за счет выраженной крупно- и мелкокапельной жировой дистрофии гепатоцитов в сочетании с холестазом. Центральные вены и капилляризированные синусоиды полнокровны, отмечается расширение пространств Диссе.
По данным зарубежных патоморфологов, при анализе аутопсийного материала пациентов с COVID-19, как правило, обнаруживалась увеличенная в размерах печень с гладкой поверхностью, на разрезе - глинистого вида.
При гистологическом изучении выявлялись типичные для вирусного поражения печени признаки: увеличение количества митозов, апоптоз-ные тельца, баллонизации гепатоцитов, увеличение числа двухъядерных гепатоцитов и жировая дистрофия. В инфицированных гепатоцитах определялся выраженный отек митохондрий, расширение цистерн эндоплазматического ретикулума, уменьшение количества гранул гликогена, при иммуногистохимическом исследовании - небольшое количество CD 4+- и CD 8+-лимфоцитов [10, 23].
В проведенном нами исследовании было выявлено, что пациенты с COVID-19 и цитолитическим синдромом моложе и имеют более высокие уровни СРБ. При этом отличия по ИМТ и окружности талии от группы пациентов без цитолитического синдрома отсутствовали. Группы пациентов, страдающих и не страдающих ожирением, в частности его абдоминальной формой, не отличались между собой. Уровни АЛТ и АСТ имели отрицательную корреляционную связь с возрастом пациентов и наличием СД 2 типа. Таким образом, повышение трансаминаз у участников исследования не было ассоциировано с ожирением и чаще выявлялось у молодых пациентов без сахарного диабета. Данные факты явились неожиданными для нас, учитывая первоначальную гипотезу и результаты предшествующих исследований.
В исследовании была выявлена положительная корреляционная связь между уровнем трансаминаз и ферритином (острофазовый белок, являющийся маркером тяжелого течения COVID-19), более высокие плазменные концентрации АЛТ и АСТ отмечались у пациентов с низкими значениями SPO2.
Таким образом, в исследовании нам не удалось установить связь между наличием ожирения и цитолитическим синдромом. Степень повышения трансаминаз зависела от тяжести течения COVID-19, маркерами которой являются уровень ферритина, СРБ и сатурация крови кислородом.
Не исключается, что предполагаемую связь между ожирением и повреждением печени не удалось выявить по причине малого размера выборки и ее особенностей. Так, в исследование были включены пациенты, госпитализированные в стационар по поводу пневмонии средней степени тяжести, вызванной SARS-CoV-2. Большинство из этих пациентов имело ожирение и ассоциированные с ожирением заболевания, а также повышение трансаминаз. Включение в анализ пациентов, переносящих коронавирусную инфекцию легкого течения, а также пациентов с тяжелым и очень тяжелым течением, возможно, повлияло бы на конечные результаты исследования.
В международной научной литературе данные о влиянии сопутствующих патологий на развитие цитолитического синдрома у пациентов с COVID-19 неоднозначны [14, 24]. L. Pan et al. из китайской провинции Хубэй не увидели четкой связи между тяжестью течения COVID-19 и повышением уровня трансаминаз. Несмотря на то что у пациентов из группы тяже ло го течения COVID- 1 9 уровни трансаминаз были выше, они не выходили за пределы референсных значений [24].
При этом большинство авторов все же указывают на более выраженное повышение уровня трансаминаз у пациентов с более тяжелым течением COVID-19 [14, 25]. Пациенты в субклинической стадии заболевании не имели цитолитического синдрома в отличие от пациентов с выраженной клинической картиной, у которых диагноз ставился на более поздних стадиях [26].
Метаанализ 52 исследований, посвященных патологии гепатобилиарной системы при COVID-19, выявил четкую корреляцию между тяжестью течения инфекции и декомпенсацией функций печени. Распространенность цитолитического синдрома у пациентов с более тяжелым течением инфекции составила 38 % (повышение АЛТ), 48 % (повышение АСТ) против 30 % (повышение АЛТ) и 21 % (повышение АСТ) у пациентов с более легкой степенью тяжести. Различные гепатотоксические реакции определялись у каждого пятого пациента с COVID-19 [27].
Повышение активности трансаминаз является частой ситуацией у пациентов с COVID-19. Возможные причины повреждения печени и развития цитолитического синдрома у пациентов с новой коронавирусной инфекцией:
1. прямой повреждающий эффект вируса. Учитывая более высокую экспрессию рецепторов ACE 2 в холангиоцитах, печень является потенциальной мишенью для SARS-CoV-2;
2. повреждение печени лекарственными препаратами. Повышение активности печеночных ферментов отмечается у пациентов, получавших терапию лопинавиром или ритонавиром [28]. Нестероидные противовоспалительные препараты и парацетамол нередко вызывают лекарственные поражения печени. Антибактериальные препараты (макролиды, фторхинолоны) также относятся к потенциально гепатотоксическим препаратам. Стоит отметить, что при тяжелой бактериальной пневмонии пациенты нередко принимают большее количество жаропонижающих средств, однако подобный цитолитический синдром не развивается;
3. гипоксическое повреждение печени вследствие дыхательной недостаточности;
4. повреждение печени в рамках микрососудистого тромбоза, возникающего вследствие повышения прокоагулянтной активности плазмы;
5. повреждение печени в рамках генерализованной воспалительной реакции с повышением СРБ, провоспалительных цитокинов, цитокинового шторма;
6. лабораторная манифестация хронического заболевания печени (НАЖБП) на фоне воздействия вышеописанных факторов.
В настоящее время идет активный поиск фармакоагентов, которые могли бы оказать протективное действие на структурное и функциональное состояние печени, а также быть эффективными при поражениях печени у инфицированных новой коронавирусной инфекцией. Потенциально к таким лекарственным средствам можно отнести лекарственный препарат Ремаксол®.
В состав Ремаксола® входят янтарная кислота, метионин, инозин, никотинамид, N-метилглюкамин. Благодаря поликомпонентному составу Ремаксол® оказывает дезинтоксикационное, антиоксидантное, цитопротективное, энергокорригирующее действие, восстанавливает белково-синтетическую функцию печени [29]. В клинических исследованиях была доказана эффективность Ремаксола® при различных нарушениях функции печени вследствие ее острого или хронического повреждения (токсические, алкогольные, лекарственные гепатиты). Согласно инструкции препарат применяется внутривенно капельно в суточной дозе от 400 до 800 мл в течение 3-12 дней [30].
Полифункциональность Ремаксола ® обеспечивается сбалансированным полионным раствором, компоненты которого обладают взаимопотенцирующим влиянием. Ремаксол® можно считать препаратом выбора при повреждениях печени у пациентов с COVID-19, учитывая потенциальное воздействие сразу на несколько патогенетических механизмов развития данного патологического процесса.
Заключение
Ожирение является значимым фактором риска тяжелого течения и развития летального исхода при COVID-19. В проведенном нами исследовании избыточный вес имели 86 %, ожирение - более половины пациентов с коронавирусной пневмонией. Цитолитический синдром определялся у 71 % пациентов. При этом достоверной связи между ИМТ, окружностью талии и выраженностью цитолитического синдрома выявлено не было.
Механизмы развития и факторы риска цитолитического синдрома у пациентов с новой коронавирусной инфекцией, а также исходы данного патологического процесса остаются не до конца и не всегда понятными. Мнения о прогрессировании поражений печени COVID-19 до хронической патологии нередко носят противоречивый характер. В приведенном нами исследовании было выявлено, что повышение активности трансаминаз было ассоциировано с тяжестью течения COVID-19, что может служить как диагностическим, так и прогностическим инструментом.
Поражения печени при новой коронавирусной инфекции требуют дальнейшего исследования и анализа, так же, как и изучение эффективности и безопасности препаратов, обладающих гепатопротективным потенциалом.
Список литературы
1. Сайт Всемирной организации здравоохранения. Заявление по итогам второго совещания Комитета по чрезвычайной ситуации в соответствии с Международными медико-санитарными правилами в связи со вспышкой заболевания, вызванного новым коронавирусом 2019 г. (nCoV) от 30.01.2020. Обращение от 01.10.2020.
2. Сайт Всемирной организации здравоохранения. Вступительное слово генерального директора на пресс-брифинге по COVID-19 11 марта 2020 г. Обращение от 01.10.2020.
3. Начало эпидемии COVID-19. Багненко С. Ф., Беляков Н. А., Рассохин В. В. и др. СПб., Балтийский мед. образовательный центр, 2020. 360 с.
4. rosstat.gov.ru
5. minzdrav.gov.ru. Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 9 (26.10.2020). Обращение от 01.10.2020.
6. Li W., Moore M. J., Vasilieva N. et al. Angiotensin-converting enzyme 2 is a functional receptor for the SARS coronavirus. Nature. 2003. N426 (6965). Р. 450-454.
7. Boonacker E., Van Noorden C.J. The multifunctional or moonlighting protein CD26/DPPIV. Eur J Cell Biol. 2003. N82 (2). Р. 53-73.
8. Zheng K. I., Gao F., Wang X. B. et al. Letter to the Editor: Obesity as a risk factor for greater severity of COVID-19 in patients with metabolic associated fatty liver disease. Metabolism. 2020. N 108. Р. 54-64.
9. Jothimani D, Venugopal R, Abedin MF, Kaliamoor thy I, Rela M. COVID-19 and the liver. J Hepatol. 2020. N S 0168-8278 (20). Р. 30377-9.
10. Jinyang G., Bing H., Jian W. COVID-19: Gastrointestinal Manifestations and Potential Fecal-Oral Transmission. Gastroenterology. 2020. N 158. Р. 1518-1519.
11. Сайганов С. А., Мазуров В. И., Бакулин И. Г. и др. Клиническое течение, эффективность терапии и исходы новой коронавирусной инфекции: предварительный анализ. Вестник Северо-Западного государственного медицинского университета им. И. И. Мечникова.2020. № 2 (12). C. 27-48.
12. URL: https://www.who./global-guidelines/obesity. Обращение от 01.09.2020.
13. Дедов И. И. Морбидное ожирение. Москва., МИА, 2014. 608 с.
14. Zhang C., Shi L., Wang F. S. Liver injury in COVID-19: management and challenges. Lancet Gastroenterol Hepatol. 2020. N 5 (5). Р. 428-430.
15. Alsaad K. O., Hajeer A. H., Al Balwi M. Histopathology of Middle East respiratory syndrome coronavirus (MERS-CoV) infection - clinicopathological and ultrastructural study. Histopathology. 2018. N 72. Р. 516-524.
16. Zhao S., Lin Q., Ran J. et al. Preliminary estimation of the basic reproduction number of novel coronavirus (2019-nCoV) in China, from 2019 to 2020: a data-driven analysis in the early phase of the outbreak. Int J Infect Dis. 2020. N 92. Р. 214-217.
17. Hamming I., Timens W., Bulthuis M. L. et al.. Tissue distribution of ACE 2 protein, the functional receptor for SARS coronavirus. A first step in understanding SARS pathogenesis. J Pathol. 2004. N 203 (2). Р. 631-637.
18. Драпкина О. М., Маев И. В., Бакулин И. Г. и др. Временные методические рекомендации: «Болезни органов пищеварения в условиях пандемии новой коронавирусной инфекции (COVID-19)». Профилактическая медицина. 2020. № 32 (23). С. 120-152.
19. Chai X., Hu L., Zhang Y. et al. Specific ACE 2 expression in cholangiocytes may cause liver damage after 2019-nCoV infection. BioRxiv. 2020. N 1. Р. 101-10.
20. Zhou C. Evaluating new evidence in the early dynamics of the novel coronavirus COVID-19 outbreak in Wuhan, China with real time domestic traffic and potential asymptomatic transmissions. medRxiv. 2020. N 32. Р. 13-22.
21. Yki-Jarvinen H. Non-alcoholic fatty liver disease as a cause and a consequence of metabolic syndrome. Lancet Diabetes Endocrinol. 2014. N 2. Р. 901-910.
22. Targher G., Day C. P., Bonora E. Risk of cardiovascular disease in patients with nonalcoholic fatty liver disease. N Engl J Med. 2010. N 363. Р. 1341-1350.
23. Wang Y., Liu S., Liu H. et al. SARSCoV-2 infection of the liver directly contributes to hepatic impairment in patients with COVID-19. Journal of Hepatology. 2020. N 3. Р. 41-52.
24. Pan L, Mu M, Yang P, et al. Clinical Characteristics of COVID-19 Patients With Digestive Symptoms in Hubei. Am J Gastroenterol. 2020. N 115 (5). Р. 766-773.
25. Gurala D., Moussawi H., Philipose J. et al. Acute Liver Failure in a COVID-19 Patient Without any Preexisting Liver Disease. Cureus. 2020. N 12 (8). Р. 10045.
26. Shi H, Han X, Jiang N. Radiological findings from 81 patients with COVID-19 pneumonia in Wuhan, China: a descriptive study. Lancet Infect Dis. 2020. N 20 (4). Р. 425-434.
27. Mohammad Z. Liver Function in Novel Coronavirus Disease (COVID-19): A Systematic Review and Meta-Analysis. medRxiv. 2020.
28. Fan Z., Chen L., Li J. et al. Clinical features of COVID-19 related liver damage. medRxiv. 2020.
29. Мазина Н. А., Мазин П. В., Суханов Д. С. Клиническая эффективность сукцинатсодержащего инфузионного препарата при фармакотерапии поражений печени разного генеза: результаты метаанализа. Антибиотики и химиотерапия. 2015. № 60. С. 3-9.
30. www.rlsnet.ru. Официальная инструкция к препарату Ремаксол®. Обращение от 01.10.2020.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 www.polysan.ru
www.polysan.ru


 Рисунок 1. «Мускатная печень» пациента 70 лет, скончавшегося на фоне крайне тяжелого течения COVID-19. Ув. 10х.
Рисунок 1. «Мускатная печень» пациента 70 лет, скончавшегося на фоне крайне тяжелого течения COVID-19. Ув. 10х. Рисунок 2. «Мускатная печень» пациента 70 лет, скончавшегося на фоне крайне тяжелого течения COVID-19 c заметным полнокровием синусов, крупно- и мелкокапельной жировой дистрофией. Ув. 20х.
Рисунок 2. «Мускатная печень» пациента 70 лет, скончавшегося на фоне крайне тяжелого течения COVID-19 c заметным полнокровием синусов, крупно- и мелкокапельной жировой дистрофией. Ув. 20х. Рисунок 3. Стеатоз (мелко- и крупнокапельная жировая дистрофия гепатоцитов) на фоне венозного полнокровия ткани печени пациента 32 лет с морбидным ожирением, скончавшегося на фоне крайне тяжелого течения COVID-19. Ув. 10х.
Рисунок 3. Стеатоз (мелко- и крупнокапельная жировая дистрофия гепатоцитов) на фоне венозного полнокровия ткани печени пациента 32 лет с морбидным ожирением, скончавшегося на фоне крайне тяжелого течения COVID-19. Ув. 10х. Рисунок 4. Жировая дистрофия печени с холестазом и кровоизлияния в синусоидальных капиллярах пациента 32 лет с морбидным ожирением, скончавшегося на фоне крайне тяжелого течения COVID-19. Ув. 20х.
Рисунок 4. Жировая дистрофия печени с холестазом и кровоизлияния в синусоидальных капиллярах пациента 32 лет с морбидным ожирением, скончавшегося на фоне крайне тяжелого течения COVID-19. Ув. 20х.