Возможности коррекции гепатотоксических реакций на фоне терапии у больных с COVID-19 (описание клинического случая)
Статьи
Смок А. М.1,2, Малкова А. М.3, Кудлай Д. А.4,5, Старшинова А. А.6
1Федеральное государственное бюджетное образовательное учреждение высшего образования «Первый Санкт-Петербургский государственный медицинский университет имени академика И. П. Павлова» Министерства здравоохранения Российской Федерации, Санкт-Петербург, Россия
2Санкт-Петербургское государственное бюджетное учреждение здравоохранения «Городская Александровская больница», Санкт-Петербург, Россия
3Федеральное государственное бюджетное образовательное учреждение высшего образования «Санкт-Петербургский государственный университет», Санкт-Петербург, Россия
4Федеральное государственное бюджетное учреждение «Государственный научный центр "Институт иммунологии”» Федерального медико-биологического агентства, Москва, Россия
5Федеральное государственное автономное образовательное учреждение высшего образования Первый Московский государственный медицинский университет имени И. М. Сеченова Министерства здравоохранения Российской Федерации, Москва, Россия
6 Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр имени В. А. Алмазова» Министерства здравоохранения Российской Федерации, Санкт-Петербург, Россия
Трансляционная медицина. 2020; 7 (6): 65-72. DOI: 10.18705/2311-4495-2020-7-6-65-72
Контактная информация:
Старшинова Анна Андреевна, ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России, ул. Аккуратова, д. 2, Санкт-Петербург, Россия, 197341.
Резюме
В 2020 году началась пандемия новой коронавирусной инфекции (COVID-19). Лечение данной инфекции ограничено отсутствием эффективного этиологического лечения, что требует подбора эмпирической и симптоматической терапии. Полученная некоторая эффективность применения противомалярийных препаратов, противоретровирусных препаратов в комплексе с антибактериальной терапией позволила рекомендовать их к применению в схеме лечения больных с COVID-19. Однако данные препараты провоцируют развитие нежелательных реакций, которые требуют коррекции с целью возможности продолжения лечения. Учитывая необходимость применения комплексной терапии при лечении больных COVID-19 и непосредственное влияние вируса на клетки печени, вероятность развития гепатотоксических нежелательных реакций достаточна велика. Описанные случаи побочных реакций со стороны печени характеризуются нарушением функциональной активности, повышением уровня печеночных проб, развитием мелкокапельной жировой инфильтрации и слабо выраженной воспалительной реакции в дольках печени. Развитие данных явлений требует назначения гепатопротективных препаратов, которые повышают резистентность печени к повреждающему действию различных патогенов и способствуют восстановлению функциональной активности гепатоцитов. Согласно проведенным исследованиям, гепатотропный препарат инозин + меглюмин +метионин + никотинамид + янтарная кислота и реамберин способствуют нормализации липидного обмена, снижению уровня ферментных маркеров повреждения печени. В статье представлен клинический пример, в котором у больного COVID-19 с целью коррекции гепатотоксической реакции применялся препарат инозин + меглюмин + метионин + никотинамид + янтарная кислота на фоне комплексного лечения с применением лопинавира + ритонавира. Благодаря гепатопротективной терапии через неделю было достигнуто снижение аланинаминотрансферазы, альфа-амилазы, показателей крови до нормальных значений.
Ключевые слова: гепатопротекторы, гепатотоксичность, нежелательные явления, противовирусная терапия, COVID-19.
Possibilities for correcting hepatotoxic reactions during therapy in patients with covid-19 (case report)
Smok A. M.1,2, Malkova A. M.3, Kudlay D. A.4,5, Starshinova A. A.6
1Academician I. P. Pavlov First Saint Petersburg State Medical University, Saint Petersburg, Russia
2Alexandrovskaya hospital. Saint Petersburg, Russia
3Saint Petersburg State University, Saint Petersburg, Russia
4National Research Center — Institute of Immunology Federal Medical-Biological Agency of Russia, Moscow, Russia
5Sechenov First Moscow State Medical University, Moscow, Russia
6Almazov National Medical Research Centre, Saint Petersburg, Russia
Corresponding author:
Starshinova Anna A., Almazov National Medical Research Centre, Akkuratova str. 2, Saint Petersburg, Russia, 197341.
Abstract
In 2020, a pandemic of the new coronavirus infection (COVID-19) began. Treatment of this infection is limited by the lack of effective etiological treatment, which requires the selection of empirical and symptomatic therapy, lire obtained some effectiveness of the use of antimalarial drugs, antiretroviral drugs in combination with antibacterial therapy made it possible to recommend it for use in the treatment regimen for patients with COVID-19. However, these drugs provoke the development of undesirable side reactions that require correction to continue treatment. Considering the need to use complex therapy in the treatment of patients with COVID-19 and the direct effect of the virus on liver cells, the likelihood of developing hepatotoxicity is quite high. The described cases of liver damage are characterized by impaired functional activity, an increase in the level of liver function tests, the development of small-drop fatty infiltration and a mild inflammatory reaction in the liver lobules. The development of these complications requires the hepatoprotective drugs, which increase the liver's resistance to the damaging effects of various pathogens and help restore the functional activity of hepatocytes. According to the conducted studies, hepatotropic drug inosine+ + meglumine + methionine + nicotinamide + succinic acid and reamberin contribute to the normalization of lipid metabolism, a decrease in the level of enzyme markers of liver damage. The article presents the complex treatment with lopinavir + ritonavir. Thanks to hepatoprotective therapy, a week later, a decrease in ALT, alpha-amylase, blood counts to normal values was achieved.
Key words: adverse events, antiviral therapy, COVID-19. hepatoprotectors, hepatotoxicity.
Список сокращений: АЛТ — аланинаминотрансфераза, АПФ-2 — ангиотензинпревращающего фермента-2, АСТ — аспартатаминотрансфераза.
Введение
Распространение новой коронавирусной инфекции, вызванной вирусом SARS-CoV-2 (Severe acute respiratory syndrome-related coronavirus-2), по данным Всемирной организации здравоохранения (ВОЗ), к ноябрю 2020 года привело к заболеванию COVID-19 (Coronavirus Disease 2019) более чем у 60,0 млн и к смерти более 1,4 млн человек, что связано с тяжелыми проявлениями заболевания чаще всего у взрослых [1-3].
Коронавирус впервые был выделен от цыплят в 1931 году американскими ветеринарами A. F. Schalk и M. C. Hawn. В 1965 году в D. A. J. Tyrrell и M. L. Bynoe (Великобритания), используя органную культуру трахеи 14-22-недельного человеческого эмбриона, получили штамм первого коронавируса человека (HCoV — Human coronavirus) [4].
До 2002 года считалось, что коронавирусы являются больше ветеринарными патогенами, которые не опасны для человека, так как могут вызывать нетяжелые заболевания верхних дыхательных путей (с крайне редкими летальными исходами) [5]. Однако с ноября 2002 года по июль 2003 года в Китае был выделен вирус SARS-CoV (Severe acute respiratory syndrome-related coronavirus) (Betacoronavirus, Sarbecovirus), который явился причиной тяжелого острого респираторного синдрома с летальностью 9,2 % в 17 провинциях Китая [6].
В 2012 году в мире появился новый коронавирус MERS-CoV (Middle East respiratory syndrome-related coronavirus) — возбудитель ближневосточного респираторного синдрома (MERS), принадлежащего к роду Betacoronavirus, Merbecovirus [3], который был выделен из смывов носоглотки скончавшегося от внебольничной пневмонии 60-летнего мужчины в госпитале города Джидда (западная Саудовская Аравия) [4].
Появление SARS-CoV-1 и MERS-CoV может быть подтверждением межвидовой трансмиссии, которая и является причиной появления новых коронавирусов, более агрессивных по своим свойствам по сравнению с HCoV-OC43 [5].
В декабре 2019 года в провинции Хубэй в городе Ухань были зарегистрированы первые случаи вирусной пневмонии, вызванной вирусом SARS-CoV-2 [6]. Возникло предположение, что инфицирование людей данным вирусом могло быть связано с посещением городского рыбного рынка и контактом с дикими животными [4]. В начале января 2020 года был выделен возбудитель пневмонии, который был идентифицирован как представитель Coronaviridae и назван novel coronavirus 2019 (2019-nCoV), а заболевание получило название COVID-2019 (Coronavirus Disease 2019) [1].
В настоящее время уже известно, что коронавирусы, проникая через слизистую верхних дыхательных путей, реплицируются в клетках реснитчатого эпителия и вызывают ринит, глоссит, кашель с возможной системной интоксикацией, температурой, артралгией и потерей обоняния [7]. Преодолевая барьеры верхних дыхательных путей вирус попадает в легкие и связывается с ангиотензинпревращающим ферментом-2 (АПФ-2) с помощью рецепторсвязывающего домена (RBD) S1 субъединицы поверхностного S (spike) белка, инициируя эндоцитоз вирионов в клетку [8, 9]. Внутри эндосомы субъединица S1 отщепляется, благодаря чему белок слияния субъединицы S2 вставляется в мембрану эндосомы и происходит высвобождение вируса в цитоплазму клетки [10, 11].
Из легких вирус попадает в системный кровоток — фаза виремии, когда вирус атакует клетки, экспрессирующие ангиотензинпревращающий фермент-2: альвеоциты 2-го типа, клетки сердца, почек, гастроинтестинального тракта, макрофаги [12], а также эндотелий артериальных и венозных сосудов, гладкомышечные клетки артерий [13]. Во время острой фазы развития заболевания происходит прямое цитотоксическое действие вируса на клетки, что вызывает иммуноопосредованные и сосудистые осложнения [14].
Важно отметить, что острая фаза характеризуется развитием пневмонии, однако при адекватном лечении и нормальном функционировании иммунной системы возможно восстановление и выздоровление, по данным различных исследований, в 45-93 % случаев [15, 16]. В группах риска (пожилой возраст, наличие сопутствующих заболеваний) иммунная система не может эффективно контролировать течение заболевания, из-за чего развиваются серьезные осложнения, угрожающие жизни пациента [3].
В настоящее время нет эффективных этиологических методов лечения больных COVID-19. Проведенные исследования по изучению эффективности применения ремдесивира, фавипиравира и умифеновира не показали значимых различий в группах сравнения по числу выздоровевших и снижению летальных исходов [16-18]. Согласно представленным данным, можно говорить только о незначительной эффективности гидроксихлорохин сульфата в сочетании с азитромицином, а также о некоторой эффективности лопинавира + ритонавира [16, 19]. Необходимость получения даже незначительной клинической эффективности требует применения всех возможных средств, что позволило включить данные препараты в рекомендации по лечению больных COVID-19 [20]. Однако необходимо учитывать, что каждый из препаратов может вызывать свои нежелательные явления, которые будут требовать отмены терапии и назначения дополнительной корригирующей терапии.
Согласно проведенным исследованиям, причиной возникновения нежелательных явлений является не только непосредственное воздействие лекарственного препарата, но и ряд факторов, таких как возраст, пол, сопутствующие заболевания, индивидуальная чувствительность организма к лекарственному веществу и непосредственное воздействие самого инфекционного агента на гепатоциты [21].
В настоящее время отмечено, что функциональная активность печени может нарушаться под влиянием непосредственно вируса SARS-CoV-2 [22]. В литературе отмечается, что повышение уровня печеночных проб имеет место у половины больных COVID-19 [23]. Результаты гистологического исследования биоптатов печени на фоне новой коронавирусной инфекции выявило развитие мелкокапельной жировой инфильтрации и слабо выраженной воспалительной реакции в дольках печени [22].
Учитывая необходимость применения комплексной терапии при лечении больных COVID-19 и непосредственное влияние вируса на клетки печени, вероятность развития нежелательных явлений со стороны печени достаточна велика. Развитие данных явлений требует назначения гепатопротективных препаратов, которые повышают резистентность печени к повреждающему действию различных патогенов и способствуют восстановлению функциональной активности гепатоцитов [24, 25]. Назначение и выбор гепатопротективных препаратов зависит от изменения функциональных показателей печени и повышения уровня аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы и фракции билирубина) [26].
Согласно проведенным исследованиям, препарат инозин + меглюмин + метионин + никотинамид + янтарная кислота и реамберин оказывают положительное влияние на показатели липидного обмена: в 1,9-1,4 раза уменьшается уровень триглицеридов, а также ферментные маркеры повреждения печени, способствуя нормализации активности АлАТ и АсАТ [27, 28].
В представленном клиническом примере продемонстрирована возможность нормализации показателей печени у больного COVID-19 c применением сбалансированного гепатотропного раствора инозин + меглюмин + метионин + никотинамид + янтарная кислота.
Клинический пример
Пациент М., 61 год, поступил в отделение реанимации и интенсивной терапии с диагнозом «вирусная пневмония, вызванная вирусом SARS-CoV-2».
Из анамнеза известно, что заболел остро с появлением слабости, одышки, подъема температуры до 38 °C. К врачу на догоспитальном этапе не обращался. На третьи сутки от начала заболевания, на фоне самостоятельного приема симптоматической терапии, отмечалось ухудшение состояния, которое потребовало госпитализации в стационар. До настоящего времени болел редко, аллергический анамнез не отягощен. Сопутствующих патологий нет.
Клинический статус пациента
Состояние тяжелое. Тяжесть состояния обусловлена дыхательной недостаточностью 3 степени на фоне течения внебольничной двусторонней пневмонии, которая обусловлена развитием явлений эндогенной интоксикации. При оценке тяжести пациента по шкале NEWSZ (National Institute of Health Stroke Scale) — 10 баллов. Сознание ясное, по шкале Глазго — 15 баллов. Кожа и слизистые покровы обычной окраски и влажности без патологических высыпаний. Цианоза нет. Температура тела 38,3 °C. Периферические лимфоузлы не увеличены. Пастозность нижних конечностей голени с двух сторон, АД — 160/70 мм рт. ст.; частота сердечных сокращений — 155 ударов в минуту, частота дыхания — 33-35 в минуту. В акте дыхания участвует дополнительная дыхательная мускулатура. SpO2 88 % на фоне инсуффляции О2 6-8 л/мин через назальные канюли. Дыхание с двух сторон жесткое, крепитирующие хрипы в нижних отделах с двух сторон. Живот мягкий, безболезненный при пальпации. Физиологические отправления в норме.
После осмотра пациент по показаниям переведен в отделение реанимационной терапии. В течение 55 минут после госпитализации пациента в стационар отмечалось нарастание дыхательной недостаточности, десатурация до 53 %, нарушения уровня сознания (сопор), что потребовало перевода пациента на искусственную вентиляцию легких (ИО — 150).
Результаты обследования
С помощью молекулярно-генетического исследования методом ПЦР в мазке слизистой оболочки носоглотки и ротоглотки была выделена РНК вируса SARS-CoV-2.
По данным лабораторных исследований при поступлении в стационар в клиническом анализе крови отмечался незначительный лейкоцитоз (11,3 на 109/л), повышение нейтрофилов (абсолютных — 9,93 на 109/л и относительных — 78,9 %), лимфоцитопения 14 % и 1,77 на 109/л, моноцитоз (0,83 на 109/л), снижение уровня тромбоцитов (137 на 109/л).
Согласно результатам биохимического анализа крови отмечался рост общего билирубина до 31,4 мкмоль/л, С-реактивный белок — 295 мг/л, лактатдегидрогеназа — более 1055 Е/л, ферритин — более 2000 нг/мл, Д-димер — 8,02 мг/мл, прокальцитонин — 1,03 нг/мл, остальные биохимические показатели были в пределах нормы.
По данным лучевого обследования органов грудной клетки отмечались выраженные изменения в легких с явлениями вирусной пневмонии с поражением 3 степени. КТ-картина соответствовала двусторонней специфической вирусной пневмонии 3 степени. Площадь поражения легочной ткани ≈ 65-70 %. КТ-признаки двустороннего гидроторакса, легочно-венозного застоя (рис. 1).
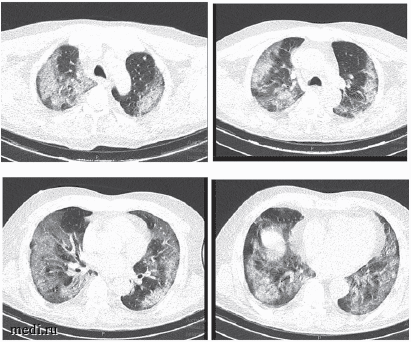 Рис. 1. МСКТ пациента М., 61 год, с двусторонней пневмонией, больного COVID-19
Рис. 1. МСКТ пациента М., 61 год, с двусторонней пневмонией, больного COVID-19
Согласно клинической картине, клиническим рекомендациям № 6 [20], а также результатам лабораторного и инструментального обследования пациента, была назначена этиотропная терапия (лопинавир + ритонавир 400 + 100 мг х 2 раза в сутки 14 дней) + интерферон β -1 в 8 млн (через сутки, 7 инъекций на курс). Применялась также патогенетическая терапия: дексаметазон (по схеме 8 мг х 4 раз в сутки с последующей деэскалацией дозировки), антипиретическая терапия (парацетамол при температуре больше 38,0 °C), дезинтоксикационная терапия (сбалансированные кристаллоидные растворы, обеспечивающие водно-электролитную нагрузку), антибиотикотерапия (защищенные аминопенициллины с дальнейшей сменой препарата по результатам бактериологических посевов), комплексная терапия бронхита (мукоактивные и бронхолитические средства), профилактика венозных тромбоэмболических осложнений (низкомолекулярный гепарин), респираторная терапия, медикаментозная седация (натриевая соль γ-оксимасляной кислоты), нейромышечная блокада (пипекурония бромид — 2 мг/час), витаминотерапия (аскорбиновая кислота и тиамин), гастропротекция (омепразол — 40 мг х 1 р/сут), энтеральное питание (нутрикомп стандарт 30 ккал/кг).
На фоне проведения патогенетической терапии с включением лопинавира + ритонавира через двое суток отмечалось значительное повышение функциональных показателей печени (АЛТ — 661 Е/л; АСТ — 841 Е/л; альфа-амилаза — 337 Е/л) при нормальных показателях общего билирубина — 20,3 мкмоль/л, щелочная фосфатаза в норме (93 Ед/л), что характеризует гепатоцеллюлярный тип поражения печени [21]. Показатели свертываемости крови без существенных изменений (активированное частичное тромбопластиновое время — 27,1 с; международное нормализованное отношение — 1,08; протромбин по Квику — 3,38 мг на 100 мл плазмы крови; протромбиновое время — 14,8), за исключением некоторого снижения протромбинового индекса — 86 %.
С целью возможного лекарственного поражения печени оценка по обновленной версии шкалы RUCAM [29] не проводилась, что связано с тяжестью состояния пациента.
Развитие нежелательных явлений со стороны печени и печеночной недостаточности послужило поводом для назначения препарата инозин + меглюмин + метионин + никотинамид + янтарная кислота по 400 мл один раз в день в течение 7 дней.
На фоне гепатопротективной терапии через два дня АЛТ снизилась до 453 Е/л и АСТ до 271 Е/л, альфа-амилаза — до 53 Е/л.
Одновременно отмечалось снижение показателей крови (лейкоциты —7,95 на 109/л; лимфоциты — 5,4%).
Через 7 дней применения препарата инозин + меглюмин + метионин + никотинамид + янтарная кислота в виде в/в инфузии печеночные показатели снизились до нормальных значений, что позволило продолжить лечение пациента в условиях отделения с назначением симптоматической терапии.
Обсуждение
Повреждение печени может быть вызвано прямым воздействием SARS-CoV-2, последствиями системных нарушений, таких как септический шок, полиорганная дисфункция, цитокиновый шторм, а также быть последствием токсичности, связанной с применением лекарственных препаратов [30].
На данный момент патогенез прямого поражения гепатоцитов вирусом изучается. Однако известно, что при инфекции, вызванной вирусом SARS-CoV и MERS-CoV, повреждение печени встречалось в 66 % случаев [31]. При гистологических исследованиях обнаруживались вирусные частицы в гепатоцитах, а также поражение ткани, характерное для вирусной инфекции: большое количество митотических клеток печени, баллонная дегенерация гепатоцитов, умеренная инфильтрация лимфоцитов, стеатоз и некроз центральных долей, сопровождающийся явным апоптозом [32]. Исследования in vitro показали, что SARS-CoV-специфический белок 7a может вызывать апоптоз клеток в различных органах (включая легкие, почки и печень) через каспаза-зависимый путь, дополнительно подтверждая возможность SARS-CoV непосредственно атаковать ткани печени и вызывать ее повреждение [33].
Гистологические исследования у пациентов с COVID-19 обнаружили умеренный микрососудистый стеатоз и умеренную лобулярную и портальную активность, указывающие на то, что повреждение печени может быть вызвано либо инфекцией SARS-CoV-2, либо повреждением печени, вызванным применением лекарственных препаратов [30].
Остается неясным механизм повреждения гепатоцитов. Считается, что экспрессия рецептора АПФ-2, необходимого для инвазии вируса, высоко выражена в холангиоцитах (59,7 % клеток), тогда как в гепатоцитах наблюдается низкая экспрессия (2,6 %) [33]. Следовательно, SARS-CoV-2 необязательно непосредственно инфицирует клетки печени, но может вызывать дисфункцию желчных протоков, связываясь с их клетками, которые играют важную роль в регенерации печени.
В настоящее время нет однозначных рекомендаций по применению каких-либо гепатопротективных препаратов для лечения или коррекции нежелательных явлений со стороны печении, что связно с отсутствием исследований. Однако Европейское общество по изучению печени (EASL — The European Association for the Study of the Liver) рекомендует учитывать возможность развития нежелательных явлений у пациентов, имеющих факторы риска развития гепатотоксических реакций [22]. Согласно последним рекомендациям Министерства здравоохранения Российской Федерации (клинические рекомендации, версия № 8 от 03.09.20), препарат лопинавир + ритонавир не рекомендован к применению для лечения больных COVID-19 [34], однако необходимо учитывать рекомендации EASL в отношении развития нежелательных явлений со стороны печени, которые могут развиваться на фоне применения тоцилизумаба, ремдесивира, метилпреднизолона ацепоната и т.д., в особенности у больных с гепатитами, циррозом печени или тяжелыми заболеваниями печени [22].
Заключение
В настоящее время исследования, направленные на изучение влияния вируса SARS-CoV-2, продолжаются. Одновременно ведутся многочисленные исследования по эффективности различных препаратов и схем терапии у больных СOVID-19. Очевидно, что необходимость применения комплексной терапии у больных с тяжелыми проявлениями COVID-19 требует системной оценки состояния пациента и предотвращения развития нежелательных явлений с учетом статуса больного и наличия сопутствующей патологии. Гепатотоксические реакции являются одними из наиболее распространенных, что требует назначения гепатопротективной терапии, которая будет способствовать снижению интоксикации смешанного генеза и предотвращать токсическое поражение печени. Необходимость проведения данных мероприятий будет способствовать получению хорошей эффективности лечения на фоне проводимой терапии и скорейшему выздоровлению пациента.
Конфликт интересов / Conflict of interest
Авторы заявили об отсутствии потенциального конфликта интересов. / The authors declare no conflict of interest.
Информация об авторах:
Смок Александр Михайлович, врач анестезиолог-реаниматолог отделения реанимации и интенсивной терапии № 2 клиники научно-клинического центра анестезиологии и реаниматологии ФГБОУ ВО ПСПбГМУ им. И. П. Павлова Минздрава России; отделение реанимации СПб ГБУЗ «Александровская больница»;
Малкова Анна Михайловна, младший научный сотрудник лаборатория мозаики аутоиммунитета, Санкт-Петербургский государственный университет;
Кудлай Дмитрий Анатольевич, д.м.н., профессор кафедры фармакологии Института фармации ФГАОУ ВО Первый МГМУ им. И. М. Сеченова Минздрава России; ведущий научный сотрудник лаборатории персонализированной медицины и молекулярной иммунологии № 71, ФГБУ «ГНЦ институт иммунологии» ФМБА России;
Старшинова Анна Андреевна, д.м.н., начальник управления научными исследованиями, ФГБУ «НМИЦ им. В. А. Алмазова» Минздрава России.
Author information:
Smok Aleksandr M., Anesthesiologist-Resuscitator, Resuscitation and Intensive Care Unit of the 2nd Clinic of the Scientific and Clinical Center of Anesthesiology and Resuscitation of the Academician I. P. Pavlov First Saint Petersburg State Medical University; Intensive Care Unit, Alexandrovskaya Hospital;
Malkova Anna M., Junior Researcher, Laboratory of Autoimmune Mosaics, Saint Petersburg State University;
Kudlay Dmitry A., Dr. Sci., Professor of the Department of Pharmacology, Institute of Pharmacy, Sechenov First Moscow State Medical University (Sechenov University); Leading Researcher, Laboratory of Personalized Medicine and Molecular Immunology No. 71, National Research Center — Institute of Immunology Federal Medical-Biological Agency of Russia;
Starshinova Anna A., Dr. Sci., Head of Research Department, Almazov National Medical Research Centre.
Список литературы / References
1. WHO. Coronavirus disease (COVID-19) Pandemic. Geneva: WHO; 2020.
2. CORONAVIRUS (COVID-19). https:// coronavirus-monitor.ru/ (01 August 2020).
3. Starshinova AA, Kushnareva EA, Malkova AM, et al. New coronaviral infection: features of clinical course, capabilities of diagnostics, treatment and prevention in adults and children. Voprosy sovremennoj pediatrii=Current Pediatrics. 2020; 19 (2): 123-131. In Russian [Старшинова А.А., Кушнарева Е.А., Малкова А.М. и др. Новая коронавирусная инфекция: особенности клинического течения, возможности диагностики, лечения и профилактики инфекции у взрослых и детей. Вопросы современной педиатрии. 2020; 19 (2): 123-131].
4. Shchelkanov MYu, Popova AYu, Dedkov VG, et al. History of investigation and current classification of coronaviruses (Nidovirales: Coronaviridae). Infekciya i immunitet=Infection and Immunity. 2020; 10 (2): 221-246. In Russian [Щелканов М.Ю., Попова А.Ю., Дедков В.Г. и др. История изучения и современная классификация коронавирусов (Nidovirales: Coronaviridae). Инфекция и иммунитет. 2020; 10 (2): 221-246].
5. Lau SKP, Lee P, Tsang aKl, et al. Molecular epidemiology of human coronavirus OC43 reveals evolution of different genotypes over time and recent emergence of a novel genotype due to natural recombination. J Virol. 2011; 85 (21): 11325-11337.
6. Rothe C, Schunk M, Sothmann P, at al. Transmission of 2019-nCoV infection from an asymptomatic contact in Germany. N Engl J Med. 2020; 382 (10): 970-971.
7. Wolfel R, Corman VM, Guggemos W, et al. Virological assessment of hospitalized cases of coronavirus disease 2019. 2020. MedRxiv. doi: 10.1101/2020.03.05.20030502.
8. Ong SWX, Tan YK, Chia PY, et al. Air, surface environmental, and personal protective equipment contamination by severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) from a symptomatic patient. JAMA. 2020; 323 (16): 1610-1612.
9. Wu F, Zhao S, Yu B, et al. A new coronavirus associated with human respiratory disease in China. Nature. 2020; 579 (7798): 265-269.
10. Letko M, Marzi A, Munster V. Functional assessment of cell entry and receptor usage for SARS-CoV-2 and other lineage B betacoronaviruses. Nat Microbiol. 2020; 5 (4): 562-569.
11. Giani M, Seminati D, Lucchini A, et al. Exuberant plasmocytosis in bronchoalveolar lavage specimen of the first patient requiring extracorporeal membrane oxygenation for SARS-CoV-2 in Europe. J Thorac Oncol. 2020; 15 (5): e65-e66.
12. Liu W, Li H. COVID-19: Attacks the 1-beta chain of hemoglobin and captures the porphyrin to inhibit human heme metabolism. 2020. ChemRxiv. doi: 10.26434/ chemrxiv.11938173.v5.
13. Geleris J, Sun Y, Platt J, et al. Observational study of hydroxychloroquine in hospitalized patients with COVID-19. N Engl J Med. 2020; 382 (25): 2411-2418.
14. Cavalli G, De Luca G, Campochiaro C, et al. Interleukin-1 blockade with high-dose anakinra in patients with COVID-19, acute respiratory distress syndrome, and hyperinflammation: a retrospective cohort study. Lancet Rheumatol. 2020; 2 (6): e325-e331.
15. Wu Z, McGoogan JM. Characteristics of and important lessons from the coronavirus disease 2019 (COVID-19) outbreak in China: summary of a report of 72 314 cases from the Chinese Center for Disease Control and Prevention. JAMA 2020; 323 (13): 1239-1242.
16. Li Y, Xie Z, Lin W, et al. Efficacy and safety of lopinavir/ritonavir or arbidol in adult patients with mild/ moderate COVID-19: an exploratory randomized controlled trial. 2020. Med (N Y).
17. Beigel JH, Tomashek KM, Dodd LE, et al. Remdesivir for the treatment of COVID-19 — Preliminary Report. N Engl J Med. 2020; 383 (10): 994.
18. Clinical study evaluating the efficacy of faviprevir in COVID-19 treatment.
19. Geleris J, Sun Y, Platt J, et al. Observational study of hydroxychloroquine in hospitalized patients with COVID-19. N Engl J Med. 2020; 382 (25): 2411-2418.
20. Temporary guidelines “Prevention, diagnosis and treatment of new coronavirus infection (COVID-19)” (version 6 of 04.24.2020). P 165. In Russian [Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» (версия 6 от 24.04.2020). c. 165].
21. Starshinova AA, Belyaeva EN, Panteleev AM, et al. Use of hepatoprotectors during tuberculosis chemotherapy: review of the Russian and international studies. Tuberkulez i bolezni legkih= Tuberculosis and lung diseases. 2018; 96 (10): 63-69. In Russian [Старшинова А.А., Беляева Е.Н., Пантелеев А.М. и др. Применение гепатопротекторов на фоне химиотерапии туберкулеза: обзор отечественных и зарубежных исследований. Туберкулез и болезни легких. 2018; 96 (10): 63-69].
22. Boettler T, Newsome PN, Mondelli MU, et al. Care of patients with liver disease during the COVID-19 pandemic: EASL-ESCMID position paper. JHEP Rep. 2020; 2 (3): 100113.
23. Fan Z, Chen L, Li J, et al. Clinical features of COVID-19-related liver damage. Clin Gastroenterol Hepatol. 2020; 18 (7): 1561-1566.
24. Shabanov PD, Ganapol’skij VP, Zhumasheva AB, et al. Trekrezan as a metabolic activator with the properties of a meteoadaptogen, psychoenergizer and immunomodulator. Vestnik Rossijskoj voenno-medicinskoj akademii= Bulletin of the Russian Military Medical Academy. 2006; 15 (1): 53-57. In Russian [Шабанов П.Д., Ганапольский В.П., Жумашева А.Б. и др. Трекрезан как метаболический активатор, обладающий свойствами метеоадаптогена, психоэнергизатора и иммуномодулятора. Вестник Российской военно-медицинской академии. 2006; 15 (1): 53-57].
25. Ivanova DA, Kudlay DA, Borisov SE, et al. Effect of silymarin for the prevention of drug-induced liver injury in tuberculosis patients. Tuberkulez i social’no znachimye zabolevaniya= Tuberculosis and socially significant diseases. 2017; 4: 28-33. In Russian [Иванова Д.А., Куд-лай Д.А., Борисов С.Е., et al. Эффективность Силимарина в профилактике лекарственного поражения печени у больных туберкулезом. Туберкулез и социально значимые заболевания. 2017; 4: 28-33].
26. Ilchenko LYu, Okovityi SV. Remaxol: mechanisms of action and application in real clinical practice. Part II. Arhiv vnutrennej mediciny=Archive of Internal Medicine. 2016; 6(3): 8-18. In Russian [Ильченко Л.Ю. Оковитый С.В. Ремаксол: механизмы действия и применение в клинической практике. Часть 2. Архив внутренней медицины. 2016; 6(3): 8-18].
27. Ilchenko LYu, Okovityi SV. Remaxol: mechanisms of action and application in real clinical practice. Part I. Arhiv vnutrennej mediciny=Archive of Internal Medicine. 2016; 6 (2): 16-22. In Russian [Ильченко Л.Ю., Оковитый С.В. Ремаксол: механизмы действия и применение в клинической практике. Часть 1. Архив внутренней медицины. 2016; 6 (2): 16-22].
28. Sologub Tv, Sukhanov DS, Petrov AYu, et al. The risk of poor outcomes in pharmacoeconomic analysis and the evaluation of the safety of remaxol in therapy for chronic viral hepatic lesions (according to the materials of multicenter randomized clinical studies). Epidemiologiya i infekcionnye bolezni=Epidemiology and infectious diseases. 2010; 1: 61-64. In Russian [Сологуб Т.В., Суханов Д.С., Петров А.Ю. и др. Риск неблагоприятных исходов при фармакоэкономическом анализе и оценка безопасности ремаксола в терапии хронических вирусных поражений печени (по материалам многоцентровых рандомизированных клинических исследований). Эпидемиология и инфекционные болезни. 2010; 1: 61-64].
29. Danan G, Teschke R. RUCAM in drug and herb induced liver injury: the update. Int J Mol Sci. 2015; 17 (1): 14.
30. Su T-H, Kao J-H. The clinical manifestations and management of COVID-19-related liver injury. J Formos Med Assoc. 2020; 119 (6): 1016-1018.
31. Chai X, Hu L, Zhang Y, et al. Specific ACE2 expression in cholangiocytes may cause liver damage after 2019-nCoV infection. 2020. bioRxiv.
32. Zhang H, Kang Z, Gong H, et al. The digestive system is a potential route of 2019-nCov infection: a bioinformatics analysis based on single-cell transcriptomes. 2020. bioRxiv.
33. Ji D, Qin E, Xu J, et al. Implication of non-alcoholic fatty liver diseases (NAFLD) in patients with COVID-19: a preliminary analysis. J Hepatol. 2020; 73 (2): 451-453.
34. Temporary guidelines “Prevention, diagnosis and treatment of new coronavirus infection (COVID-19)” (version 8 of 03.09.2020). P. 226. In Russian [Временные методические рекомендации «Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19)» (версия 8 от 03.09.2020). c. 226].
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 www.polysan.ru
www.polysan.ru
 Рис. 1.
Рис. 1. 