Применение гепатопротекторов на фоне химиотерапии туберкулеза: обзор отечественных и зарубежных исследований
Статьи
А. А. Старшинова1,2, Е. Н. Беляева1,3, А. М. Пантелеев3,4, М. В. Павлова1
1ФГБУ «Санкт-Петербургский научно-исследовательский институт фтизиопульмонологии» МЗ РФ, Санкт-Петербург, Россия
2ФГБОУ ВО «Санкт-Петербургский государственный университет», Санкт-Петербург, Россия
3ГБУЗ «Городская туберкулезная больница № 2», Санкт-Петербург, Россия
4ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова» МЗ РФ, Санкт-Петербург, Россия
Представлен обзор отечественных и зарубежных исследований, посвященных применению на фоне противотуберкулезной терапии гепатопротекторов, в том числе препаратов производных метионина и содержащих янтарную кислоту.
Ключевые слова: гепатопротекторы, полихимиотерапия, туберкулез, нежелательные явления, препараты янтарной кислоты, производные метионина
Для цитирования: Старшинова А. А., Беляева Е. Н., Пантелеев А. М., Павлова М. В. Применение гепатопротекторов на фоне химиотерапии туберкулеза: обзор отечественных и зарубежных исследований // Туберкулёз и болезни лёгких. - 2018. - Т. 96, № 10. - С.
DOI: 10.21292/2075-1230-2018-96-9-_-_
Use of hepatoprotectors during tuberculosis chemotherapy: review of the russian and international studies
А. А. Stаrshinovа1,2, E. N. Belyaevа1,3, А. M. Рanteleev3,4, M. V Pаvlovа1
1St. Petersburg Research Institute of Phthisiopulmonology, St. Petersburg, Russia
2St. Petersburg University, St. Petersburg, Russia
3Tuberculosis Hospital no. 2, St. Petersburg
4Pavlov First Saint Petersburg State Medical University, St. Petersburg, Russia
The article presents the review of the Russian and international studies devoted to the use of hepatoprotectors during anti-tuberculosis treatment, including methionine derivatives and agents containing succinic acid.
Key words: hepatoprotectors, polychemotherapy, tuberculosis, adverse events, drugs containing succinic acid, methionine derivatives
For citations: Starshinova А.А., Belyaeva E.N., Panteleev A.M., Pavlova M.V Use of hepatoprotectors during tuberculosis chemotherapy: review of the Russian and international studies. Tuberculosis and Lung Diseases, 2018, Vol. 96, no. 10, P_-_. (In Russ.) DOI: 10.21292/2075-1230-2018-96-10-
Основными причинами распространения туберкулеза с лекарственной устойчивостью возбудителя являются проблемы в организации лечения: прерывание лечения пациентами, невыполнение стандартных режимов химиотерапии. Этому способствует высокая частота возникновения нежелательных явлений на прием отдельных противотуберкулезных препаратов (ПТП) и их сочетаний [1, 20, 25].
При лечении туберкулеза, оказывая влияние на жизнедеятельность микобактерий туберкулеза, ПТП одновременно влияют на макроорганизм, вызывая функциональные нарушения многих систем организма пациента [1, 2, 14, 20, 25].
Систематизации нежелательных явлений на препараты уделяется значительное внимание с момента появления химиотерапии, что привело к созданию нескольких классификаций, одни разработаны на основе повреждения определенных органов и систем, другие - с учетом особенностей патогенеза нежелательных воздействий препаратов [3, 6].
Гепатотоксические реакции на фоне ПТП отмечаются, по данным разных авторов, в 44-60% случаев и связаны с образованием метаболитов, вызывающих в 60% случаев токсическое повреждение печени, что проявляется нарушением дезинтоксикационной, белковосинтетической и других функций. Лекарственные гепатиты могут сопровождаться синдромом цитолиза в 34,1%, явлениями холестаза - в 50% и их сочетанием - в 15,9% случаев [3, 5, 8, 28].
Согласно принятым в 1989-1990 гг. «Советом международных медицинских научных организаций» критериям диагностики повреждений печени лекарственной этиологии, определены разные типы поражения печени: гепатоцеллюлярные (цитолитические), при повышении уровня АЛТ в 5 раз и более от нормы; холестатические, при повышении уровня щелочной фосфатазы в 2 раза и выше от нормы; смешанные - повышение одновременно в 2 раза уровней АЛТ и щелочной фосфатазы, при соотношении их более 2, но менее 5 [17].
Механизмы гепатотоксичности бывают разными, что доказано в экспериментальных исследованиях [13] (рис.).
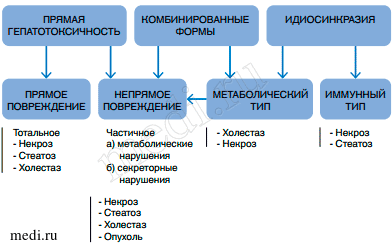 Рис.
Рис. Механизмы гепатотоксичности (фармакотерапия лекарственных поражений печени при туберкулезе [13])
Fig. Mechanisms of hepatotoxicity (pharmacotherapy of drug-induced liver damage in case of tuberculosis [13])
Основными виновниками развития гепатотоксических реакций являлись рифампицин (67% случаев), пиразинамид (30%) и изониазид (7%) [3, 4, 8, 23, 27]. По данным ряда авторов, гепатотоксические реакции вызывают протионамид, парааминосалициловая кислота, линезолид, бедаквилин и тиоуреидоиминометилпиридиния перхлорат. Как правило, наряду с ними, развиваются гиперурикемия, артралгия, поражение желудочно-кишечного тракта, центральной нервной системы, полинейропатия, кардио- и нефропатические реакции [10, 16].
Поражение печени при туберкулезе может быть обусловлено не только токсическим влиянием препаратов, но и интоксикационным воздействием самого инфекционного процесса, а также развитием системного воспалительного ответа. При этом факторами риска развития гепатотоксических реакций являются хронические заболевания печени и желчевыводящих путей [4, 11, 26].
В клинической практике встречаются от 1,7 до 90,0% случаев, когда нежелательные явления на фоне противотуберкулезной терапии носят как токсический, так и аллергический характер (токсико-аллергические проявления) [2, 3, 12].
По данным немногочисленных исследований, риск развития лекарственно-индуцированных нарушений органов и систем, а также электролитного обмена на фоне полихимиотерапии туберкулеза у больных с множественной лекарственной устойчивостью возбудителя отмечается в 86-90% случаев, что в несколько раз чаще, чем у больных с лекарственно-чувствительным к изониазиду и рифампицину возбудителем [1, 2, 5, 10].
Отечественные и международные подходы по ведению больных туберкулезом на фоне полихимиотерапии различаются в отношении применения терапии сопровождения. В международной практике возможно проведение коррекции нежелательных явлений при их возникновении, тогда как в отечественной практике рекомендуют назначение корригирующей терапии одновременно с началом химиотерапии для предотвращения нежелательных явлений, особенно со стороны печени и желудочно-кишечного тракта. Вопрос применения гепатопротекторов остается нерешенным, что связано с отсутствием достаточной доказательной базы, а также клинических исследований по определению эффективности их применения.
Согласно результатам доклинических исследований, на крысах гепатотоксическое влияние изониазида в дозе 100 мг/кг отмечалось уже через 21 день. При приеме ежедневной комбинации изониазида (50 мг/кг) и рифампицина (100 мг/кг) у мышей происходили нарушения окислительно-восстановительной функции печени с апоптотическим повреждением ее клеток. В исследовании не было найдено доказательств того, что прием данных препаратов три раза в неделю снижает риск развития этих реакций [21].
Поскольку изониазид и рифампицин являются высокоэффективными препаратами, их применение при лечении латентной или активной туберкулезной инфекции является оптимальным. Только у пациентов с нестабильным или прогрессирующим заболеванием печени, если уровень аланина аминотрансферазы в сыворотке крови более чем в 3 раза выше нормы уже на исходном уровне, не следует рассматривать совместное применение данных препаратов. Авторами сделан вывод о необходимости сокращения количества гепатотоксических препаратов и длительности их применения в зависимости от тяжести течения заболевания печени [24].
В одном из проспективных исследований, проведенном в Китае на когорте больных туберкулезом (n = 4 488), оценена эффективность применения гепатопротективных препаратов (силимарина, глюкуроновой кислоты, инозина) для предотвращения развития гепатотоксических реакций на фоне противотуберкулезной терапии. Пациенты принимали гепатопротекторы в течение 183 дней и более. Согласно мониторингу биохимических показателей крови, характеризующих функциональное состояние печени, значимых отличий с группой контроля не получавших эти препараты, не обнаружено [27].
Интересны данные метаанализа [19], проведенного по публикациям 1970-2011 гг., обнаруженным в информационных системах, соответствующим обозначенным требованиям. Описаны результаты лечения 40 034 пациентов с туберкулезом легких, из которых у 1 208 (3,1%) были проявления гепатотоксичности на прием препаратов, из них 339 пациентов имели возраст старше 60 лет. Было доказано, что у пациентов старше 60 лет гепатотоксическая реакция чаще всего связана с приемом пиразинамида и несколько реже - рифампицина и изониазида. Однако различия в уровнях трансаминаз на прием каждого из этих препаратов не были статистически значимыми. Полученные данные потребовали пересмотра нормативных документов по лечению туберкулеза в США и улучшения мониторинга проявлений гепатотоксичности у пациентов от 60 лет и старше. Обозначена необходимость проведения мониторинга клинической симптоматики и биохимических показателей каждые две недели у лиц данной категории, чего ранее не проводилось.
В исследовании, проведенном в Англии, изучали сроки повреждения печени на фоне противотуберкулезной терапии, а также были установлены факторы риска и сроки развития лекарственного повреждения печени. Токсическое поражение печени зарегистрировано в 6,9% (105) случаев среди 1 529 пациентов с диагнозом активного туберкулеза. Факторами риска для токсического поражения печени были низкая масса тела пациента, положительный ВИЧ-статус, высокий базовый уровень АЛТ и потребление алкоголя [22].
Сопоставимые данные были в исследовании Суханова Д. С. и др. (2013), которые показали, что применение сукцинатсодержащих инфузионных растворов [меглюмина натрия сукцината (в виде препарата реамберина) и комбинации N-метилглюкамина (меглумина) - 8,725 г; янтарной кислоты -5,280 г; инозина - 2,0 г; метионина - 0,75 г; никотинамида - 0,25 г (в виде препарата ремаксола)] эффективно снимает гепатотоксические реакции, индуцированные применением ПТП у больных туберкулезом легких [14].
В проведенном Д. А. Ивановой исследовании получены данные о факторах риска лекарственного поражения печени, которыми являются: женский пол, лекарственная аллергия в анамнезе, дефицит питания. Ею доказано, что первые две недели противотуберкулезной химиотерапии являются периодом наибольшего риска развития неблагоприятных вариантов лекарственного поражения печени (40,9% всех случаев лекарственного поражения печени, 95%-ный ДИ 33,2-50,3%) [4].
Причины возникновения нежелательных явлений во многом обусловлены не только непосредственным действием лекарственного средства, возрастом и полом больного, но и тяжестью его состояния и спектром сопутствующих заболеваний, длительностью приема и способом введения лекарственного средства, а также взаимодействием препарата в организме (фармакодинамические и фармакокинетические аспекты). Нежелательные явления различной степени тяжести развиваются в 10-30% случаев у пациентов стационара и в 40% - при амбулаторном лечении, а также являются причиной госпитализации от 6 до 16% пациентов. В странах Европы 10-25% бюджета стационаров расходуется на лечение осложнений лекарственной терапии [17, 20].
Аналогичные результаты получены и в других исследованиях. При этом появление нежелательных явлений в виде лекарственного поражения печени являлось основной причиной, препятствующей получению хорошего эффекта противотуберкулезной терапии из-за ее прерывания и коррекции [8, 19].
Положительный эффект применения гепатопротекторов при противотуберкулезной химиотерапии чаще подтверждается по результатам отечественных исследований.
Среди препаратов, применяемых для фармакотерапии различных поражений печени, выделяют относительно небольшую группу лекарственных средств, для которых гепатотропное действие является основным, преобладающим или имеющим самостоятельное клиническое значение. Фармакологическое действие данных препаратов заключается в повышении резистентности печени к повреждающему действию различных патогенов, в восстановлении функциональной активности гепатоцитов и регуляции репаративно-регенераторных процессов [6]. В патогенезе повреждения гепатоцитов при хронических поражениях печени важную роль играет развитие тканевой гипоксии, которая приводит к нарушению функций митохондрий и, как следствие, снижению запасов АТФ с активацией высвобождения свободных радикалов [7, 11].
Сегодня на медицинском рынке представлено большое количество гепатопротекторов различных групп: эссенциальные фосфолипиды, производные метионина, препараты на основе расторопши и других растений, холелитолитики, производные део- и урсоксихолевой кислот. Исследования, доказывающие их эффективность, проведены только по некоторым из них.
Ремаксол является раствором, его наиболее активный компонент янтарная кислота - универсальный энергообеспечивающий интермедиат цикла Кребса. В физиологических условиях она диссоциирована, являясь продуктом пятой и субстратом шестой реакции цикла трикарбоновых кислот Кребса, поэтому название ее аниона - сукцинат - часто используют как синоним янтарной кислоты. При этом мощность системы энергопродукции, использующей сукцинат, в сотни раз превосходит все другие системы энергообразования организма [6, 7].
При проведении рандомизированного многоцентрового плацебо контролируемого клинического исследования на базе 7 клинических центров с включением 494 пациентов с хроническим гепатитом С и В различной степени активности отмечено, что у них после курсового приема ремаксола (раствор для инфузий) зафиксировано снижение уровня трансаминаз в 1,8 раза по сравнению с группой контроля, в том числе за счет антихолестатического эффекта препарата [11].
В исследованиях показано, что, обладая выраженным гепатопротекторным действием, ремаксол улучшает энергетическое обеспечение гепатоцитов, повышая устойчивость мембран клеток к перекисному окислению липидов и восстанавливая активность ферментов антиоксидантной защиты. Это позволяет применять его в качестве терапии сопровождения при различных патологических состояниях. Детоксицирующая активность препарата обеспечивается стимуляцией оттока желчных кислот, предотвращая застой желчи и отравление организма желчными кислотами, в результате чего восстанавливается функция печени, нет влияния на реологические свойства крови. Происходит нормализация показателей, характеризующих степень поражения гепатоцитов (АлТ, АсТ, ЩФ, ГГТП) и функциональное состояние печени за счет уменьшения цитолитического и холестатического синдромов [7, 12].
В исследовании Д. С. Суханова получены доказательства эффективности препаратов ремаксола и реамберина в эксперименте [13]. Так, зафиксировано их положительное влияние на показатели липидного обмена: уровень триглицеридов статистически значимо уменьшился, нормализовались показатели АлАТ и АсАТ. При морфологическом исследовании печени установлено, что параллельно с улучшением биохимических показателей уменьшался некробиоз гепатоцитов с сокращением распространенности жировой дистрофии, которая регистрировалась только на периферии долек и в междольковом пространстве. При применении адеметионина (независимо от способа введения и дозы) в 45,5% случаев обнаруживали очаги некроза различной величины, что свидетельствовало о стимуляции альтерации печеночной ткани, это связано с процессом карбоксиметилирования белков, продуктами которого являются метанол, формальдегид и муравьиная кислота, обладающие цитотоксическим действием [14, 13].
В когортном ретроспективном исследовании Д. А. Ивановой (2018) проведено сравнение эффективности гепатотропной терапии у впервые выявленных больных туберкулезом, где представлены результаты лечения с применением адеметионина, эссенциальных фосфолипидов и фосфоглива в сравнении с контрольной группой больных туберкулезом, которым гепатотропная терапия не проводилась. Доказано, что применение адеметионина при лекарственном поражении печени у больных туберкулезом в 2,25 раза повышало вероятность снижения АЛТ до уровня удвоенной нормы к 14-му дню применения по сравнению с контрольной группой (95%-ный ДИ 1,18-4,29), что позволяло возобновить химиотерапию [4, 5].
В детской практике на фоне полихимиотерапии в 72,2% случаев отмечалось нарушение функции печени, которое отражалось в биохимических показателях крови (повышение уровня общего билирубина, трансаминаз, тимоловой пробы, уровня щелочной и кислой фосфатаз) [9]. Нормализация биохимических показателей на фоне применения гепатопротекторов (Лив 52) отмечалась через 1 мес. в 23% случаев, через 2 мес. - в 67% случаев, к концу 3-го мес. - в 100% случаев, что обусловлено стимулирующим действием на регенерацию гепатоцитов, а также мембраностабилизирующим действием, что особенно ценно при длительной противотуберкулезной терапии. Снижение активности щелочной и кислой фосфатаз свидетельствовало о нормализации функциональной активности печени и функции желчеобразования [15].
Следовательно, применение гепатопротекторов является желательным на фоне лечения туберкулеза, в особенности при появлении нежелательных явлений, связанных с нарушением функции печени. Согласно международным рекомендациям, коррекция нежелательных явлений со стороны печени и желчевыводящих путей должна осуществляться только после появления функциональных нарушений третей и четвертой степени тяжести [17]. Однако отечественные исследователи считают необходимым назначение гепатопротекторов одновременно с применением ПТП не только при появлении нарушений функции печени, но и при тяжелом течении процесса для снятия интоксикационного воздействия на печень [3, 4, 12].
Назначение корригирующей терапии при возникновении нежелательных явлений на фоне лечения туберкулеза (в том числе при сочетании с ВИЧ-инфекцией) в настоящее время является обоснованным [4, 14].
При оценке нежелательных явлений, развивающихся в ходе химиотерапии туберкулеза, следует учитывать, что возможна суммация побочного действия разных ПТП, если они направлены на одни и те же органы-мишени (например, на печень). При серьезных нежелательных явлениях необходима временная отмена и/или замена всей схемы химиотерапии [4, 18].
Согласно проведенным исследованиям, назначение и выбор гепатопротективных препаратов должны проводиться в зависимости от степени повышения биохимических показателей (АЛТ, щелочной фосфатазы и билирубина), а также на основании оценки факторов риска развития нежелательных явлений со стороны печени [4].
Современная фармакотерапия заболеваний печени строится на комплексном использовании нескольких направлений [3, 5-7]:
1) профилактического, призванного обеспечить первичную защиту печени от различных повреждений;
2) этиотропного, направленного на элиминацию патологического возбудителя из организма;
3) патогенетического, нацеленного на коррекцию универсальных мультифакторных звеньев патогенеза заболевания;
4) симптоматического.
Основной целью лечения болезней печени является восстановление морфологической и функциональной полноценности органа.
Заключение
Повышение эффективности лечения туберкулеза легких является одной из важнейших задач в борьбе с туберкулезом. Современные схемы противотуберкулезной терапии включают прием нескольких ПТП, обладающих выраженным токсическим эффектом, вызывающим нарушения функции печени в 70-80% случаев. Применение эффективных гепатопротекторов для профилактики и устранения лекарственного поражения печени при лечении туберкулеза является необходимым и обоснованным.
Препаратом выбора для купирования гепатотоксичности является инфузионный гепатотропный препарат ремаксол, обладающий мультимодальным фармакологическим действием на патогенетические механизмы развития лекарственных и токсических поражений печени.
Конфликт интересов. Авторы заявляют об отсутствии у них конфликта интересов.
Conflict of Interests. The authors state that they have no conflict of interests.
ЛИТЕРАТУРА
1. Абдуллаев Р. Ю., Ваниев Э. В. Каминская Г. О., Васильева И. А., Комиссарова О. Г. Оценка функционального состояния печени у больных с впервые выявленным туберкулезом легких при использовании I и II б режимов химиотерапии // Пробл. туб. - 2009. - № 2. - С. 57-61.
2. Абдуллаев Р. Ю., Чумакова Е. С., Комиссарова О. Г., Одинец В. С. Побочные реакции противотуберкулезных препаратов на печень при лечении больных впервые выявленным МЛУ туберкулезом легких // Фтизиатрия и пульмонология. - 2016. - № 1. - С. 34-35.
3. Баласанянц Г. С. Гепатотоксические реакции и гепатопротективная терапия во фтизиатрии // Туб. и болезни легких. - 2015. - № 8. - С. 48-53.
4. Иванова Д. А. Нежелательные реакции при лечении впервые выявленных больных туберкулезом органов дыхания: профилактика, ранняя диагностика и купирование: Автореф. дис. ... д-ра мед. наук. - М., 2018. - 41 с.
5. Иванова Д. А., Борисов С. Е. Спектр и факторы риска нежелательных побочных реакций при лечении впервые выявленных больных туберкулезом // Туб. и болезни легких. - 2017. - № 6. - С. 46-52.
6. Ильченко Л. Ю., Оковитый С. В. Ремаксол: механизмы действия и применение в клинической практике. Часть 1 / Архив внутренней медицины. -2016. - Т. 6, АВМ-2(28). - С. 16-22.
7. Ильченко Л. Ю., Оковитый С. В. Ремаксол: механизмы действия и применение в клинической практике. Часть 2 / Архив внутренней медицины. -2016. - Т. 6, АВМ-3(29). - С. 8-18.
8. Ливчане Э. Лекарственная непереносимость, методы ее диагностики и коррекции при лечении больных туберкулезом легких противотуберкулезными препаратами резервного ряда: Автореф. дис. ... канд. мед. наук. - М., 2003. - 22 с.
9. Овчинникова Ю. Э., Старшинова А. А., Довгалюк И. Ф. Оптимизация режимов химиотерапии при первичном туберкулезе органов дыхания у детей // Пробл. туб. - 2009. - Т. 89, № 1. - С. 36-39.
10. Павлова М. В. и др. Эффективность комплексной терапии и возможные нежелательные реакции при лечении туберкулеза органов дыхания со множественной лекарственной устойчивостью возбудителя // Туб. и болезни легких. - 2015. - № 12. - С. 61-67.
11. Салогуб Т. В., Суханов Д. С., Петров А. Ю., Коваленко А. Л., Горячева Л. Г., Романцов М. Г. Риск неблагоприятных исходов при фармакоэкономическом анализе и оценка безопасности Ремаксола в терапии хронических вирусных поражений печени (по материалам многоцентровых рандомизированных клинических исследований) // Антибиотики и химиотерапия. - 2010. - С. 1-4.
12. Суханов Д. С. Антиоксидантные свойства ремасола, реамбирина и адеметионина при лекарственных поражениях печени у больных на фоне противотуберкулезной терапии // Экспериментальная и клиническая фармакология. - 2013. - Т. 76, № 4. - С. 45-48.
13. Суханов Д. С. Фармакотерапия лекарственных поражений печени при туберкулезе (экспериментально-клиническое исследование): Автореф д-ра мед. наук. - СПб., 2014. - 48 с.
14. Суханов Д. С., Павлова М. В., Яблонский П. К., Виноградова Т. И. Сравнительная эффективность клинического применения реамбирина, Ремаксола и Адеметионина у больных туберкулезом органов дыхания с лекарственным поражением печени // Антибиотики и химиотерапия. - 2013. - Т. 58, № 1-2. - С. 13-18.
15. Учайкин В. Ф., Чередниченко Т. В., Чаплыгина Г. В., Писарев А. Г. ЛИВ.52 -новый взгляд на эффективность при острых и хронических вирусных гепатитах у детей // Детские инфекции. Ассоциация педиатров-инфекционистов. - 2003. - № 3. - С. 41-44.
16. Чернохаева И. В. и др. Мониторинг нежелательных реакций на фоне терапии туберкулеза органов дыхания со множественной лекарственной устойчивостью возбудителя с применением тиоуреидоиминометилпиридиния (перхлозон) // Мед. альянс. - 2014. - № 2. - С. 59-66.
17. Common Terminology Criteria for Adverse Events V4.03. Cancer Therapy Evaluation Program. June 14, 2010.
18. Companion handbook to the WHO guidelines for the programmatic management of drug-resistant tuberculosis. World Health Organization, 2014, 448 p.
19. Hosford J.D., von Fricken M.E., Lauzardo M., Chang M., Dai Y., Lyon J.A., Shuster J., Fennelly K.P. Hepatotoxicity from antituberculous therapy in the elderly: A systematic review. Tuberculosis, 2015, vol. 95, pp. 112-122.
20. Javadi M.R., Shalviri G., Gholami K. et al. Adverse reactions of antituberculosis drugs in hospitalized patients: incidence, severity and risk factors. Pharmacoepidemiol. Drug Saf., 2007, vol. 16, suppl. 10, pp. 1104-1110.
21. Ramappa V., Guruprasad P. Hepatotoxicity related to anti-tuberculosis drugs: mechanisms and management. Aithal. J. Clin. Exp. Hepatol., 2013, vol. 3, no. 1, pp. 37-49.
22. Saha A., Margaret Shanthi F.X., Blessed Winston A., Saibal Das, Aniket Kumar, Joy S. Michael, T. Balamugesh prevalence of hepatotoxicity from antituberculosis therapy a five-year. J. Primary Care & Community Health, 2016, pp. 171-174.
23. Santhosh S., Sini T.K., Anandan R. et al. Hepatoprotective activity of chitosan against isoniazid and rifampicin-induced toxicity in experimental rats. Eur. J. Pharmacol., 2007, vol. 572, suppl. 1, pp. 69-73.
24. Svensson R.J., Simonsson U. Application of the multistate tuberculosis pharmacometric model in patients with rifampicin-treated pulmonary tuberculosis. CPT Pharmacometrics Syst. Pharmacol., 2016, vol. 5, no. 5, pp. 264-273.
25. Vilarica A., Pina J., Diogo N. et al. Adverse reactions from antituberculosis drugs. Rev. Port. Pneum., 2007, vol. 13, suppl. 6, pp. 21-22.
26. Wong W.M., Wu P.C., Yuen M.F., Cheng C.C., Yew W.W., Wong PC., Tam C.M., Leung C.C., Lai C.L. Antituberculosis drug-related liver dysfunction in chronic hepatitis B infection. Hepatology, 2000, vol. 31, no. 1, pp. 201-206.
27. Wu S., Xia Y., Lv X., Tang S., Yang Z., Zhang Y. еt al. Preventive use of hepatoprotectors yields limited efficacy on the liver toxicity of anti-tuberculosis agents in a large cohort of Chinese patients. J. Gastroenterol. Hepatol., 2015, vol. 30, no. 3, pp. 540-545.
28. Wu S. et al. Adverse events associated with the treatment of multidrug-resistant tuberculosis: a systematic review and meta-analysis. Am. J. Ther., 2016, vol. 23, no. 2, pp. e521-е530.
REFERENCES
1. Аbdullaev R.Yu., Vaniev E.V, Kaminskaya G.O., Vasilyeva I.А., Komissarova O.G. Evaluation of functional liver state in adults suffering from new pulmonary tuberculosis when using I and IIB chemotherapy regimens. Probl. Tub., 2009, no. 2, pp. 57-61. (In Russ.)
2. Аbdullaev R.Yu., Chumakova E.S., Komissarova O.G., Odinets V.S. Side effects of anti-tuberculosis drugs damaging liver during treatment of new cases of pulmonary MDR tuberculosis. Ftisiatriya i Pulmonologiya, 2016, no. 1, pp. 34-35. (In Russ.)
3. Balasanyants G.S. Hepatotoxic reactions and hepatoprotective therapy in tuberculosis control. Tuberculosis and Lung Diseases, 2015, no. 8, pp. 48-53. (In Russ.)
4. Ivanova D.A. Nezhelatelnye reaktsii pri lechenii vpervye vyyavlennykh bolnykh tuberkulezom organov dykhaniya: profilaktika, rannyaya diagnostika i kupirovanie. Avtoref. diss. dokt. med. nauk. [Adverse reactions to treatment of new respiratory tuberculosis cases: prevention, early diagnostics and management. Doct. Diss.]. Moscow, 2018, 41 p.
5. Ivanova DA., Borisov S.E. Profile and risk factors of adverse reactions in new tuberculosis cases receiving treatment. Tuberculosis and Lung Diseases, 2017, no. 6, pp. 46-52. (In Russ.)
6. Ilchenko L.Yu., Okovity S.V. Remaxol: action mechanisms and its use in clinical practice. Part 1. Arkhiv Vnutrenney Meditsiny, 2016, vol. 6, АВМ-2(28), pp. 16-22. (In Russ.)
7. Ilchenko L.Yu., Okovity S.V. Remaxol: action mechanisms and its use in clinical practice. Part 2. Arkhiv Vnutrenney Meditsiny, 2016, vol. 6, АВМ-3(29), pp. 8-18. (In Russ.)
8. Livchane E. Lekarstvennaya neperenosimost, metody eye diagnostiki i korrektsii pri lechenii bolnykh tuberkulezom legkikh protivituberkuleznymi preparatami rezervnogo ryada. Avtoref diss. kand. med. nauk [Drug intolerance, methods of its diagnostics and management during treatment of pulmonary tuberculosis patients with second line drugs. Cand. Diss.]. Moscow, 2003, 22 p.
9. Ovchinnikova Yu.E., Starshinova А.А., Dovgalyuk I.F. Optimization of chemotherapy regimens for new respiratory tuberculosis in children. Probl. Tub., 2009, vol. 89, no. 1, pp. 36-39. (In Russ.)
10. Pavlova M.V. et al. Efficiency of comprehensive therapy and potential side effects when treating respiratory tuberculosis with multiple drug resistance. Tuberculosis and Lung Diseases, 2015, no. 12, pp. 61-67. (In Russ.)
11. Salogub T.V., Sukhanov D.S., Petrov А.Yu., Kovalenko АХ., Goryacheva L.G., Romantsov M.G. The risk of unfavorable outcomes when performing pharmacoeconmic analysis and safety assessment of remaxol in the therapy of chronic viral liver lesions (based on the materials multi-centered randomized clinical trials). Antibiotiki i Khimioterapiya, 2010, pp. 1-4. (In Russ.)
12. Sukhanov D.S. Anti-oxidant properties of remaxol, reamberin and ademetionine in drug-induced liver lesions in the patients receiving tuberculosis therapy. Eksperimentalnaya i Klinicheskaya Urologiya, 2013, vol. 76, no. 4, pp. 45-48. (In Russ.)
13. Sukhanov D.S. Farmakoterapiya lekarstvennykh porazheniy pecheni pri tuberkuleze (eksperimentalno-klinicheskoe issledovanie) Avtoref. diss. dokt. med. nauk. [Pharmacotherapy of drug-induced liver lesions in tuberculosis (experimental clinical trial). Doct. Diss.]. St. Petersburg, 2014, 48 p.
14. Sukhanov D.S., Pavlova M.V., Yablonskiy P.K., Vinogradova T.I. Comparative efficiency of clinical use of reamberin, remaxol and ademetionine in respiratory tuberculosis patients with liver lesions. Antibiotiki i Khimioterapiya, 2013, vol. 58, no. 1-2, pp. 13-18. (In Russ.)
15. Uchaykin V.F., Cherednichenko T.V., Chaplygina G.V., Pisarev А.G. LIV.52 -a new view on its efficiency in acute and chronic viral hepatitis in children. Detskie Infektsii. Assotsiatsiya Pediatrov-Infektsionistov, 2003, no. 3, pp. 41-44. (In Russ.)
16. Chernokhaeva I.V. et al. Monitoring of side effects during therapy of respiratory tuberculosis with multiple drug resistance when using thioureideiminomethyliiridine perchlorate (perchlozon). Med. Alyans, 2014, no. 2, pp. 59-66. (In Russ.)
17. Common Terminology Criteria for Adverse Events V4.03. Cancer Therapy Evaluation Program. - June 14, 2010.
18. Companion handbook to the WHO guidelines for the programmatic management of drug-resistant tuberculosis / World Health Organization; 2014. - 448 р.
19. Hosford J. D., von Fricken M. E., Lauzardo M., Chang M., Dai Y., Lyon J. A., Shuster J., Fennelly K. P. Hepatotoxicity from antituberculous therapy in the elderly: A systematic review // / Tuberculosis. - 2015 - Vol. 95 - P. 112-122.
20. Javadi M.R., Shalviri G., Gholami K. et al. Adverse reactions of antituberculosis drugs in hospitalized patients: incidence, severity and risk factors // Pharmacoepidemiol. Drug Saf. - 2007. - Vol. 16. - Suppl. 10. - P 1104-1110.
21. Ramappa V., Guruprasad P. Hepatotoxicity related to anti-tuberculosis drugs: mechanisms and management // Aithal. J. Clin. Exp. Hepatol. - 2013. - Vol. 3, № 1. - Р 37-49.
22. Saha A., Margaret Shanthi F. X., Blessed Winston A., Saibal Das, Aniket Kumar, Joy S. Michael, T. Balamugesh prevalence of hepatotoxicity from antituberculosis therapy a five-year // J. Primary Care & Community Health. - 2016 - P 171-174.
23. Santhosh S., Sini T. K., Anandan R. et al. Hepatoprotective activity of chitosan against isoniazid and rifampicin-induced toxicity in experimental rats // Eur. J. Pharmacol. - 2007. - Vol. 572 (Suppl. 1). - P. 69-73.
24. Svensson R. J., Simonsson U. Application of the multistate tuberculosis pharmacometric model in patients with rifampicin-treated pulmonary tuberculosis // CPT Pharmacometrics Syst. Pharmacol. - 2016. - Vol. 5, № 5. -P. 264-273.
25. Vilarica A., Pina J., Diogo N. et al. Adverse reactions from antituberculosis drags // Rev. Port. Pneumon. - 2007. - Vol. 13 (Suppl. 6). - P. 21-22.
26. Wong W. M., Wu P. C., Yuen M. F., Cheng C. C., Yew W. W., Wong P. C., Tam C. M., Leung C. C., Lai C. L. Antituberculosis drug-related liver dysfunction in chronic hepatitis B infection // Hepatology - 2000. - Vol. 31, № 1. - P. 201-206.
27. Wu S., Xia Y., Lv X., Tang S., Yang Z., Zhang Y. еt al. Preventive use of hepatoprotectors yields limited efficacy on the liver toxicity of anti-tuberculosis agents in a large cohort of Chinese patients // J. Gastroenterol. Hepatol. - 2015. -Vol. 30, № 3. - Р. 540-545.
28. Wu S. et al. Adverse events associated with the treatment of multidrug-resistant tuberculosis: a systematic review and meta-analysis // Am. J. Ther. - 2016. -Vol. 23, № 2. - P. e521-e530.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 www.polysan.ru
www.polysan.ru
 Рис. Механизмы гепатотоксичности (фармакотерапия лекарственных поражений печени при туберкулезе [13])
Рис. Механизмы гепатотоксичности (фармакотерапия лекарственных поражений печени при туберкулезе [13]) 