Аспекты значимости послеоперационной гепатопротекторной терапии в ургентной хирургии
Статьи
Д.м.н., проф. А.В. Федосеев, к.м.н. С.Ю. Муравьев*, к.м.н. В.Н. Бударев, к.м.н. А.С. Инютин, к.м.н. П.С. Филоненко, С.Н. Лебедев
ФГБОУ ВО «Рязанский государственный медицинский университет им. И.П. Павлова» Минздрава РФ, Рязань, Россия
Цель исследования — определение влияния на эффективность коррекции синдрома энтеральной недостаточности (СЭН) у пациентов с ургентными хирургическими заболеваниями включения в схему комплексной терапии ремаксола. Проанализированы результаты комплексной терапии 227 пациентов (98 человек с распространенным перитонитом и 129 пациентов с острой кишечной непроходимостью). У больных основной группы (n=128) в послеоперационном периоде в схему терапии был включен ремаксол, назначавшийся внутривенно капельно в суточной дозе 400 мл со скоростью 40 капель в минуту, курс — 5 дней. Пациенты контрольной группы (n=99) получили стандартное лечение. Проводилась оценка выраженности СЭН, эндогенной интоксикации, функциональных возможностей печени, уровня прокальцитонина в плазме крови. В ходе исследования установлено, что у пациентов с острыми абдоминальными заболеваниями увеличение тяжести СЭН из-за токсической агрессии и бактериальной транслокации может приводить к печеночной дисфункции. Следовательно, проведение гепатопротекторной терапии является патогенетическим звеном в комплексном лечении таких больных. Включение ремаксола в комплексную терапию больных с острыми абдоминальными заболеваниями позволяет купировать гепаторенальный синдром к 5-му дню, а СЭН к 7-му дню. Более раннее купирование печеночной дисфункции и СЭН с помощью гепатопротекторной терапии дало возможность снизить частоту инфекционных осложнений до 9,7%, летальность до 9,4% и сократить сроки госпитализации с 17,29±1,734 до 12,14±1,385 койко-дня.
Ключевые слова: перитонит, кишечная непроходимость, энтеральная недостаточность, ремаксол.
Aspects of the importance of postoperative hepatoprotector therapy in urgent surgery
A.V. Fedoseev, S.U. Muraviev, V.N. Budarev, A.S. Inutin, P.S. Filonenko, S.N. Lebedev
Pavlov Ryazan State Medical University of Healthcare Ministry of the Russian Federation, Ryazan, Russia
The purpose of this study was to determine the effect on the effectiveness of the correction of enteric insufficiency syndrome in patients with urgent surgical pathology included in the scheme of complex therapy Remaxol. The results of complex therapy of 227 patients (98 people with common peritonitis and 129 patients with acute intestinal obstruction) were analyzed. 128 patients of the main group in the postoperative period were included in the therapy scheme Remaxol: intravenously drip in a daily dose of 400 ml at a rate of 40 drops per minute, a course of -5 days. Patients of the control group (99 people) received standard treatment. The study is devoted to the role of postoperative hepatoprotective therapy in the treatment of patients with urgent surgical pathology. The main attention is paid to the hepatoenteric link of the pathogenesis of polyorganism insufficiency. This approach gives hope for a reduction in the risk of abdominal sepsis and a reduction in mortality among patients with acute abdominal pathology. The study found that in patients with acute abdominal pathology, an increase in the severity of enteric insufficiency syndrome due to toxic aggression and bacterial translocation can lead to hepatic dysfunction. Consequently, the implementation of hepatoprotective therapy is a pathogenetic link in the complex treatment of urgent surgical patients. The obtained results allowed to draw a number of conclusions. In particular, it has been established that the use of hepatoprotective therapy in the complex medical treatment of patients with acute abdominal pathology makes it possible to stop hepatorenal syndrome by the 5th day, and the syndrome of enteric insufficiency by the 7th day. Earlier relief of hepatic dysfunction and enteral insufficiency syndrome due to hepatoprotective therapy allowed to reduce the incidence of infectious complications to 9.7%, to reduce the lethality to 9.4% and to shorten hospitalization from 17.29 to 1.734 to 12.14±1.385 bed/day.
Keywords: peritonitis, intestinal obstruction, enteral insufficiency, remaxol.
Введение
Летальность при перитоните и острой кишечной непроходимости (ОКН) в настоящее время остается довольно высокой, достигая, по данным разных авторов, 11,9—78% [1, 2]. В обоих случаях это связано с развитием декомпенсированной полиорганной недостаточности (ПОН) на фоне прогрессирующего токсикоза [3, 4]. Поскольку токсикоз при перитоните и ОКН имеет микробную этиологию, именно абдоминальный септический шок является основной причиной трагических исходов [5, 6]. Фатальной точкой, провоцирующей ПОН, принято считать энтеральную недостаточность с микробной транслокацией в систему воротной вены и, как следствие, токсическое повреждение клеток печени [7—9]. К сожалению, гепатоэнтеральному звену патогенеза ПОН в современной медицине уделяется недостаточно внимания [10, 11].
Таким образом, коррекция нарушений и поддержание нормального физиологичного состояния желудочно-кишечного тракта и печеночной паренхимы могут уменьшить риск развития абдоминального сепсиса и соответственно снизить летальность при острых абдоминальных заболеваниях.
Цель настоящего исследования — определение влияния на эффективность коррекции синдрома энтеральной недостаточности (СЭН) у пациентов с перитонитом и ОКН включения в схему комплексной терапии ремаксола.
Материал и методы
Проанализированы результаты комплексной терапии 227 пациентов (98 больных с распространенным перитонитом и 129 больных с острой кишечной непроходимостью), находившихся на лечении в ГБОУ Рязанской области «Городская клиническая больница» в 2012—2014 гг. Основную группу составили 128 пациентов (66 больных с механической ОКН и 62 человека с распространенным перитонитом), в схему терапии которых в послеоперационном периоде был включен препарат ремаксол (ООО НТФФ ПОЛИСАН, Санкт-Петербург), назначавшийся внутривенно капельно в суточной дозе 400 мл со скоростью 40 капель в минуту, курс 5 дней. В контрольную группу вошли 99 человек (67 пациентов с механической ОКН и 32 больных с распространенным перитонитом), в комплексном лечении которых гепатопротекторы не использовались.
Сравниваемые группы были статистически идентичны по половому признаку, длительности анамнеза, сопутствующим заболеваниям патологии и тяжести СЭН. Средний возраст пациентов основной группы составил 62,55±2,261 года, контрольной — 63,04±1,965 года (tСт= -0,166; p>0,05).
Критериями исключения являлись острое нарушение мезентериального кровообращения, панкреатогенный перитонит, раковая кахексия, ВИЧ-инфекция и вирусный гепатит.
Для оценки состояния пациентов использовали ряд индексов и шкал: выявление СЭН и определение его тяжести с помощью схемы Н.В. Завада о выраженности эндогенной интоксикации судили на основании гематологического показателя интоксикации (ГПИ) С.В. Васильева и В.И. Комара (1983 г.): ГПИ=ЛИИКлКс, где Кл — поправочный коэффициент на количество лейкоцитов; Кс — поправочный коэффициент на СОЭ. Норма =0,62±0,09. Для определения функциональных возможностей печени при СЭН использовали шкалу MELD, позволяющую оценить степень тяжести состояния пациентов с заболеванием печени.
Из биохимических показателей определяли МНО, концентрацию билирубина и креатинина, уровень прокальцитонина в сыворотке (плазме), количество тромбоцитов крови, подсчитывая их в мазке крови, и концентрацию антитромбина III в плазме крови.
Статистическую обработку данных и построение графического изображения проводили на ПК с применением статистических пакетов Statistica v.9. Из статистических методов корреляционного анализа использовали линейную корреляцию Пирсона, ранговую корреляцию Спирмена. При сравнении исследуемых групп применяли коэффициент Стьюдента.
Результаты и обсуждение
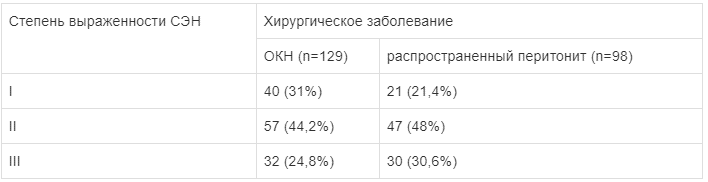
Как показал анализ (табл. 1), у больных с распространенным перитонитом и ОКН частота развития СЭН разной степени выраженности была статистически сопоставима (tСт=2,776, р>0,05), что свидетельствовало о схожести патогенетических процессов основного хирургического заболевания.
Таблица 1.
Частота выявления СЭН у пациентов в зависимости от хирургического заболевания
Аналогичный результат получен при сравнении среднего значения ГПИ при II стадии перитонита/ ОКН и II степени СЭН (t
Ст=2,618, p>0,05), а также ГПИ при III стадии перитонита/ОКН и III степени СЭН (t
Ст= -1,571, p>0,05).
Анализ лабораторных показателей выявил, что динамика концентрации прокальцитонина происходила не линейно, но зависела от стадии основного заболевания и выраженности СЭН (рис. 1).
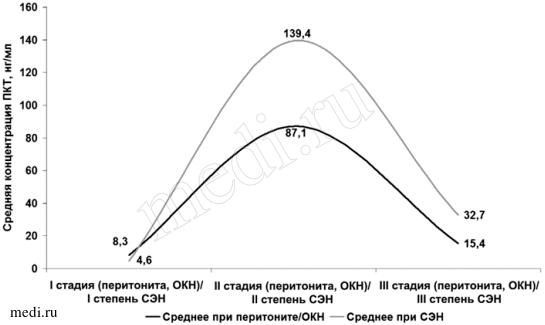 Рис. 1.
Рис. 1. Динамика средней концентрации прокальцитонина в зависимости от стадии перитонита/ОКН и от степени СЭН.
В I стадию перитонита/ОКН концентрация прокальцитонина в крови (8,3±2,175 нг/мл) была выше, чем при I степени СЭН (4,6±0,168 нг/мл) (tСт=0,557, p<0,05), характеризуя сравниваемые явления как последовательные процессы. Во II стадию перитонита/ ОКН наблюдался резкий выброс прокальцитонина (в среднем 87,1±1,067 нг/мл). В то же время при II степени СЭН уровень прокальцитонина был еще выше — 139,4±2,052 нг/мл (tСт=1,372, p<0,05). Это отражает появление второй волны прорыва бактериального барьера и начало бактериальной транслокации во II стадию перитонита/ОКН. У пациентов с III стадией перитонита/ОКН зарегистрировано снижение уровня прокальцитонина в крови до 15,4±1,748 нг/мл, а при III степени СЭН этот показатель у больных была выше — 32,7±1,057 нг/мл (tСт=0,209, p<0,05).
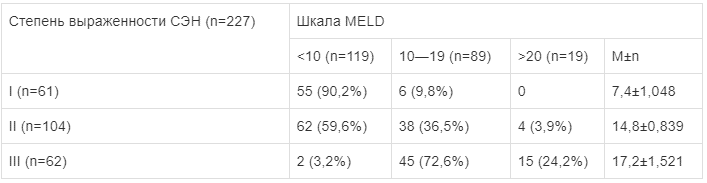
Отмечено, что увеличение токсической агрессии и бактериальной транслокации у пациентов с СЭН ведет к развитию гепаторенального синдрома (r= -1,025, р<0,05). Так, у больных с I степенью СЭН по шкале MELD среднее значение было равно 7,4±1,048 балла, со II степенью СЭН — 14,8±0,839 балла, с III степенью СЭН — 17,2±1,521 балла, т.е. в пределах неблагоприятного прогноза (табл. 2).
Таблица 2.
Выраженность гепаторенального синдрома у больных в зависимости от тяжести СЭН
Одним из ведущих маркеров активности синтетической функции печени является концентрация антитромбина III. В табл. 3 представлены результаты, полученные при анализе изменений концентрации антитромбина III в крови кубитальной вены пациентов в зависимости от тяжести СЭН.
Таблица 3.
Динамика показателей гемостаза у больных в соответствии с тяжестью СЭН (M±n)
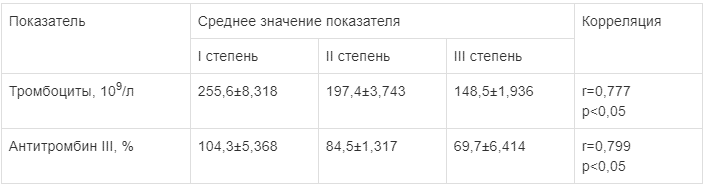
При I степени СЭН значения концентрации антитромбина III были в норме (в среднем 118,4±2,736%). При значении 10—19 баллов по шкале MELD концентрация антитромбина III снизилась до нижних границ (в среднем 84,5±1,317%), что может свидетельствовать о компенсаторных возможностях печени при ее легком реактивном воспалении. Наряду с этим при достижении СЭН III степени выявлено равнозначное снижение концентрации антитромбина III до значения 69,7±2,414% (t
Ст= —1,892, p<0,05). Вместе с тем на фоне развития СЭН снижение концентрации антитромбина III происходит корреляционно с увеличением тяжести по шкале MELD как в кровотоке поврежденной кишки (r=0,762, p<0,05), так и в локтевой вене (r=0,607, p<0,05).
Кроме того, было отмечено, что уровень тромбоцитов сильно колебался в зависимости от выраженности СЭН (см. табл. 2). У пациентов с СЭН I степени зарегистрирован нормальный уровень тромбоцитов — в среднем (255,6±3,318)109/л. При II степени СЭН уровень тромбоцитов был на нижней границе нормы — в среднем (197,4±3,743)109/л. Во время развития III степени СЭН в коагулограмме больных наблюдалась выраженная тромбоцитопения [в среднем (96,3±2,706)109/л].
Таким образом, у пациентов с острым абдоминальным заболеванием увеличение тяжести СЭН из-за токсической агрессии и бактериальной транслокации может приводить к печеночной дисфункции. Этим усугубляются изменения в системе гемостаза, в крайних случаях развиваются ДВС-синдром и ПОН. Следовательно, проведение гепатопротекторной терапии является патогенетическим звеном в комплексном лечении ургентных больных. Фармакодинамика препарата ремаксол основана на ускорении перехода анаэробных процессов в аэробные, улучшении энергетического обеспечения и повышении устойчивости мембран клеток к перекисному окислению липидов и восстановлению активности ферментов антиоксидантной защиты.
Анализ результатов сравниваемых схем терапии показал, что динамика изучаемых параметров имела сходную картину, однако к концу 5-х суток наблюдения у пациентов, получивших ремаксол, средний уровень ГПИ был в 1,3 раза ниже, чем у пациентов контрольной группы (0,79± 1,589 балла против 1,06±0,119 балла; tСт= -1,608, p<0,05). Нормальный уровень гематологического показателя интоксикации в основной группе был достигнут к 7-му дню и в среднем составил 0,62±0,534 балла. В контрольной группе этот показатель оставался выше нормы — 0,97±0,184 балла (tСт=1,167, p<0,05).
На 5-й день послеоперационного периода у пациентов основной группы тромбоциты в крови в среднем были на уровне (192,7±2,943) 109/л, у пациентов контрольной группы (182,3±1,906) 109/л (tСт=3,01, p<0,05) (рис. 2). Через неделю после операции показатель тромбоцитов в крови пациентов в обеих группах был в пределах нормы, но в то же время в основной группе он в среднем был равен (221,7±1,011)109/л, в контрольной — (194,4±0,275) 109/л, что имеет статистически подтвержденную разницу (tСт=26,939, p<0,05).
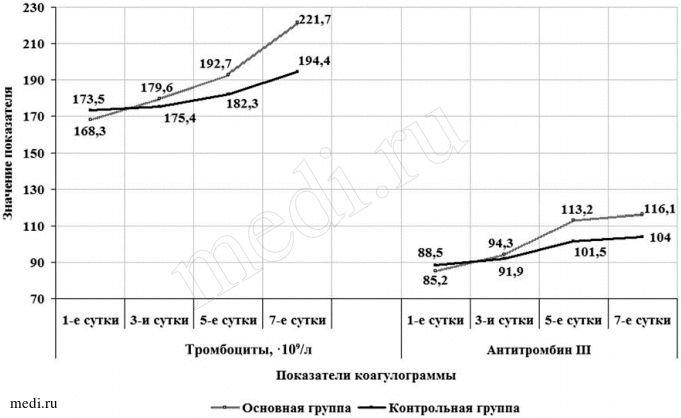 Рис. 2.
Рис. 2. Изменение показателей коагулограммы у больных в зависимости от метода лечения.
Уровень антитромбина III у пациентов, получивших ремаксол, к 5-м суткам терапии повысился до 113,2±0,804%, в то время как у пациентов контрольной группы—лишь до 101,5±1,628% (tСт=6,287, p<0,05) (см. рис. 2). В то же время через 7 дней лечения в обеих группах уровень антитромбина III был в пределах нормы, но в основной группе он оказался достоверно выше (116,1±1,931%), чем в контрольной, — 104,0±2,946% (tСт=3,378,p<0,05).
В нашем исследовании выявлено, что купирование гепаторенального синдрома в основной группе наступило раньше: среднее значение индекса MELD уже на 5-й день снизилось до 8,7±1,907 балла, в контрольной — лишь до 13,7±2,461 балла (tСт=0,558, p<0,05; рис. 3). К 7-м суткам терапии средние значения индекса MELD переместились в зону с благоприятным прогнозом течения гепаторенального синдрома в обеих группах. Однако этому сроку в основной группе они были ниже таковых в контрольной группе — 4,4±2,690 и 9,8±3,51 балла соответственно (tСт= -2,781, p<0,05).
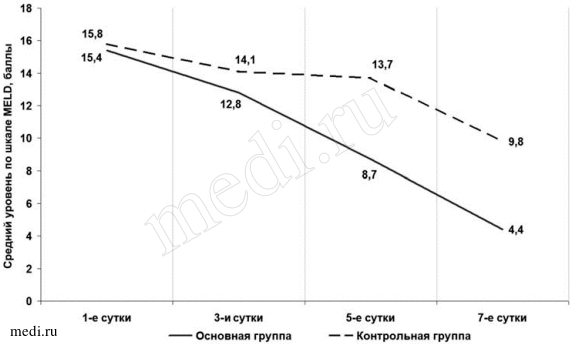 Рис. 3.
Рис. 3. Изменение выраженности гепаторенального синдрома в зависимости от способа и длительности лечения.
В основной группе к 5-му дню терапии резко уменьшилось число больных с уровнем прокальцитонина выше 10 нг/мл. Таких пациентов оказалось 9,1%. В контрольной группе их было 9, что составило 28,1% выборки. При этом в основной группе нормализовавшийся уровень прокальцитонина отмечен у 34,8% больных, в контрольной — лишь у 25%. Средняя концентрация прокальцитонина к 5-м суткам в основной группе составила 9,6±2,093 нг/мл, что было меньше, чем в контрольной, — 17,4±1,992 нг/мл (tСт=1,202, p<0,05).
На 7-й день исследования в основной группе содержание прокальцитонина было в пределах нормальных значений в 56% наблюдений, в контрольной группе — в 37,5% наблюдений со средним значением 2,8±0,334 и 8,1±1,011 нг/мл соответственно (tСт=0,675, p<0,05; рис. 4).
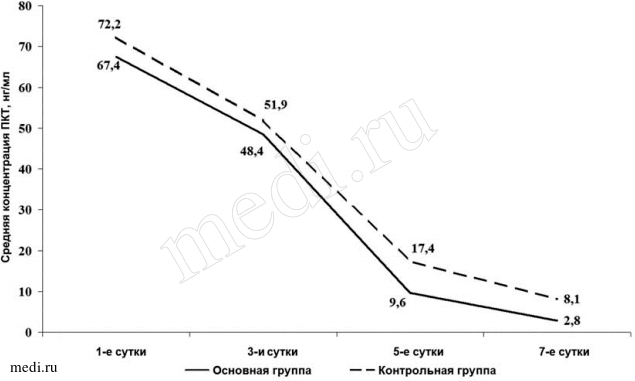 Рис. 4.
Рис. 4. Изменение концентрации прокальцитонина в зависимости от способа и длительности лечения.
Необходимо отметить, что достоверная разница между исследуемыми группами по числу больных с купированным СЭН получена только на 7-е сутки лечения (tСт= -0,098, p<0,05). К этому сроку в основной группе больных с I степенью СЭН было 60,2%, в контрольной — 51,5%, со II степенью СЭН — 37,5 и 41,4% соответственно, с III степенью СЭН — 2,3 и 7,1% (табл. 4).
Таблица 4.
Распределение больных в зависимости от тяжести СЭН
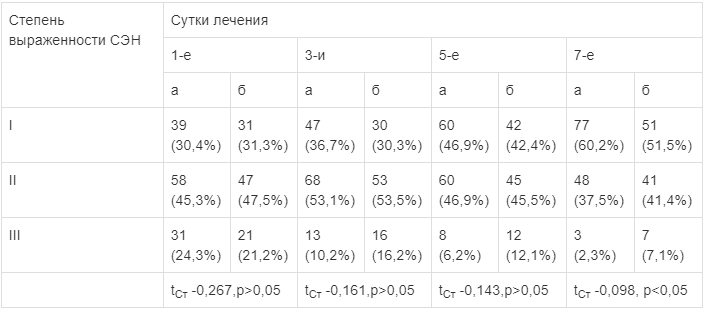
Примечание. а — основная группа (n=128); б — контрольная группа (n=99).
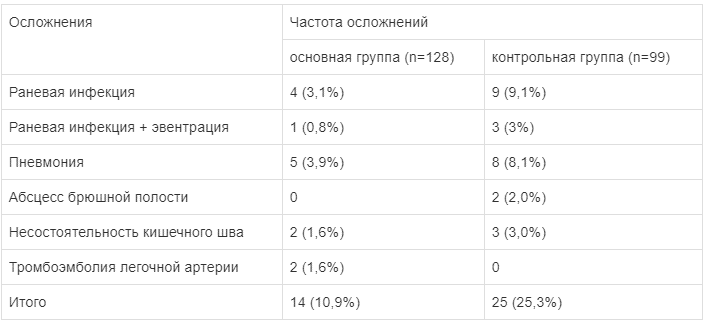
Более раннее купирование печеночной дисфункции и СЭН в основной группе позволило снизить частоту раневой инфекции, которая в основной группе отмечалась в 3,1%, в контрольной группе — в 9,1% наблюдений (tСт=1,053, p<0,05) (табл. 5). Также в основной группе было меньше случаев послеоперационной пневмонии. На введение ремаксола нежелательных реакций не было. Все пациенты получили препарат в полном объеме.
Таблица 5.
Частота послеоперационных осложнений в зависимости от лечения больных
Таким образом, в ходе настоящего исследования СЭН II—III степени был выявлен у 69% пациентов с ОКН, в то время как при распространенном перитоните — у большинства больных (78,6%).
У пациентов с ОКН и перитонитом при СЭН II степени выраженность гепаторенального синдрома по шкале MELD в среднем соответствовала 14,8±0,839 балла и сопровождалась пиковым значением прокальцитонина (139,4±2,052 нг/мл).
У пациентов с ОКН и перитонитом при СЭН III степени отмечено развитие тромбоцитопении [в среднем (96,3±2,706)109/л] и снижение концентрация антитромбина III до 69,7±2,414%.
При этом включение гепатопротекторной терапии (ремаксола) в комплексное лечение больных с острым абдоминальным заболеванием позволяет купировать гепаторенальный синдром к 5-му дню, а СЭН — к 7-му дню, снизить летальность с 12,1 до 9,4% и сократить сроки стационарного лечения больных с 17,29±1,734 до 12,14±1,385 койкодня.
Таким образом, в ходе исследования установлено, что у пациентов с острым абдоминальным заболеванием увеличение тяжести синдрома энтеральной недостаточности из-за токсической агрессии и бактериальной транслокации может приводить к печеночной дисфункции. Следовательно, проведение гепатопротекторной терапии является патогенетическим звеном в комплексном лечении ургентных хирургических больных.
Включение ремаксола в комплексную терапию таких больных позволяет купировать гепаторенальный синдром к 5-му дню, а синдром энтеральной недостаточности к 7-му дню. Более раннее купирование печеночной дисфункции и синдрома энтеральной недостаточности с помощью гепатопротекторной терапии дало возможность снизить частоту инфекционных осложнений до 9,7%, летальность до 9,4% и сократить сроки госпитализации с 17,29±1,734 до 12,14±1,385 койкодня.
Авторы заявляют об отсутствии конфликта интересов.
ЛИТЕРАТУРА/REFERENCES
1. Гостищев В.К., Косинец В.А. Влияние «Омегавена» на структурные изменения внутренних органов при экспериментальном распространенном гнойном перитоните. Вестник экспериментальной и клинической хирургии. 2012;5(4):621-627. [Gostishev VA, Cosinec VK. Vliyanie «Omegavena» na strukturnye izmeneniya vnutrennih organov pri ehksperimental’nom rasprostranennom gnojnom peritonite. Vestnik experimentalnoj i klinicheskoj khirurgii. 2012;5:(4):621-627. (In Russ.)].
2. Чернов В.Н., Белик Б.М., Поляк А.И. Портальная и системная бактериемия как проявление функциональной несостоятельности энтерального барьера при острой непроходимости кишечника. Вестник хирургии им. И.И. Грекова. 1998; 157(4) :46-49. [Chernov VN, Belik BM, Polyak AI. Portal’naya i sistemnaya bakteriemiya kak proyavlenie funkcional’noj nesostoyatel’nosti ehnteral’nogo bar’era pri ostroj neprohodimosti kishechnika. Vestnik khirurgii imeni I.I. Grekova. 1998;157(4):46-49. (In Russ.)].
3. Гологорский В.А., Гельфанд Б.Р., Гельфанд Е.Б. и др. Печеночно-почечный синдром как компонент полиорганной недостаточности у больных с инфекционно-токсическим шоком. Анестезиология и реаниматология. 1985;4:3-7. [Gologorsky VA, Gelfand BR, Gelfand EB et al. Pechenochno-pochechnyj sindrom kak komponent poliorgannoj nedostatochnosti u bol’nyh s infekcionno-toksicheskim shokom. Anesteziologiya i reanimatologiya. 1985;4:3-7. (In Russ.)].
4. Anderson ID, Fearon KC, Grant IS. Laparotomy for abdominal sepsis in the critically ill. Br J Surg. 1996;83:535-539.
5. Рыбачков В.В., Майоров М.И., Маканов О.А. Нейрогуморальные изменения при острой кишечной непроходимости. Вестник хирургии им. И.И. Грекова. 2005;1:25-28. [Ribachkov VV, Mayorov MI, Makanov OA. Nejrogumoral’nye izmeneniya pri ostroj kishechnoj neprohodimosti. Vestnik khirurgii imeni I.I. Grekova. 2005;1:25-28. (In Russ.)].
6. Moore LJ, Moore FA. Epidemiology of sepsis in surgical patients. Surg Clin North Am. 2012;92(6):1425-1443.
7. Шибитов В.А., Власова Т.И., Полозова Э.И., Власов П.А., Анаскин С.Г., Матвеева М.В. Патогенетические основы энтеральной недостаточности Фундаментальные исследования. 2012;4(1): 152-156. [Shibitov VA, Vlasova TI, Polozova EhI, Vlasov PA, Anaskin SG, Matveeva MV. Patogeneticheskie osnovy ehnteral’noj nedostatochnosti. Fundamental’nye issledovaniya. 2012;4:(1):152-156. (In Russ.)].
8. Попова Т.С., Томазашвили Т.Ш., Шестопалов А.Е. Синдром кишечной недостаточности в хирургии. М.: Медицина; 1991. [Popova TS, Tomazashvili TS, Shestopalov AE. Sindrom kishechnoj nedostatochnosti v hirurgii. М.: Medicina; 1991. (In Russ.)].
9. Gando S. Microvascular thrombosis and multiple organ dysfunction syndrome. Crit Care Med. 2010;38:35-42.
10. Llewelyn M, Cohen J. New insights into the pathogenesis and therapy of sepsis and septic shock. Curr Clin Top Infect Dis. 2001;21:148-171.
11. Panna A, Codner Karen J, Brasel Terri A. de Roon-Cassin. Staged abdominal repairs reduce long-term quality of life. Injury. 2012;43(9):1513-1516.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 www.polysan.ru
www.polysan.ru
 Аналогичный результат получен при сравнении среднего значения ГПИ при II стадии перитонита/ ОКН и II степени СЭН (tСт=2,618, p>0,05), а также ГПИ при III стадии перитонита/ОКН и III степени СЭН (tСт= -1,571, p>0,05).
Аналогичный результат получен при сравнении среднего значения ГПИ при II стадии перитонита/ ОКН и II степени СЭН (tСт=2,618, p>0,05), а также ГПИ при III стадии перитонита/ОКН и III степени СЭН (tСт= -1,571, p>0,05).  Рис. 1. Динамика средней концентрации прокальцитонина в зависимости от стадии перитонита/ОКН и от степени СЭН.
Рис. 1. Динамика средней концентрации прокальцитонина в зависимости от стадии перитонита/ОКН и от степени СЭН.  Одним из ведущих маркеров активности синтетической функции печени является концентрация антитромбина III. В табл. 3 представлены результаты, полученные при анализе изменений концентрации антитромбина III в крови кубитальной вены пациентов в зависимости от тяжести СЭН.
Одним из ведущих маркеров активности синтетической функции печени является концентрация антитромбина III. В табл. 3 представлены результаты, полученные при анализе изменений концентрации антитромбина III в крови кубитальной вены пациентов в зависимости от тяжести СЭН.  При I степени СЭН значения концентрации антитромбина III были в норме (в среднем 118,4±2,736%). При значении 10—19 баллов по шкале MELD концентрация антитромбина III снизилась до нижних границ (в среднем 84,5±1,317%), что может свидетельствовать о компенсаторных возможностях печени при ее легком реактивном воспалении. Наряду с этим при достижении СЭН III степени выявлено равнозначное снижение концентрации антитромбина III до значения 69,7±2,414% (tСт= —1,892, p<0,05). Вместе с тем на фоне развития СЭН снижение концентрации антитромбина III происходит корреляционно с увеличением тяжести по шкале MELD как в кровотоке поврежденной кишки (r=0,762, p<0,05), так и в локтевой вене (r=0,607, p<0,05).
При I степени СЭН значения концентрации антитромбина III были в норме (в среднем 118,4±2,736%). При значении 10—19 баллов по шкале MELD концентрация антитромбина III снизилась до нижних границ (в среднем 84,5±1,317%), что может свидетельствовать о компенсаторных возможностях печени при ее легком реактивном воспалении. Наряду с этим при достижении СЭН III степени выявлено равнозначное снижение концентрации антитромбина III до значения 69,7±2,414% (tСт= —1,892, p<0,05). Вместе с тем на фоне развития СЭН снижение концентрации антитромбина III происходит корреляционно с увеличением тяжести по шкале MELD как в кровотоке поврежденной кишки (r=0,762, p<0,05), так и в локтевой вене (r=0,607, p<0,05).  Рис. 2. Изменение показателей коагулограммы у больных в зависимости от метода лечения.
Рис. 2. Изменение показателей коагулограммы у больных в зависимости от метода лечения.  Рис. 3. Изменение выраженности гепаторенального синдрома в зависимости от способа и длительности лечения.
Рис. 3. Изменение выраженности гепаторенального синдрома в зависимости от способа и длительности лечения.  Рис. 4. Изменение концентрации прокальцитонина в зависимости от способа и длительности лечения.
Рис. 4. Изменение концентрации прокальцитонина в зависимости от способа и длительности лечения.  Примечание. а — основная группа (n=128); б — контрольная группа (n=99).
Примечание. а — основная группа (n=128); б — контрольная группа (n=99).  Таким образом, в ходе настоящего исследования СЭН II—III степени был выявлен у 69% пациентов с ОКН, в то время как при распространенном перитоните — у большинства больных (78,6%).
Таким образом, в ходе настоящего исследования СЭН II—III степени был выявлен у 69% пациентов с ОКН, в то время как при распространенном перитоните — у большинства больных (78,6%). 