Реамберин как антиоксидантный метаболический корректор окислительного стресса у больных с тяжелой термической травмой
Статьи
Г.В. Илюкевич, О.Н. Почепень, О.И. Светлицкая, Т.М. Юрага
Белорусская медицинская академия последипломного образования
Для цитирования: Реамберин как антиоксидантный метаболический корректор окислительного стресса у больных с тяжелой термической травмой / Г. В. Илюкевич [et al.] // Вестник интенсивной терапии. - 2007. - N3. - С.66-69.
Актуальность проблемы термической травмы определяется ее высокой распространенностью среди всех возрастных групп населения. Несмотря на определенные успехи, достигнутые в лечении данной патологии, летальность среди тяжелообожженных даже в специализированных стационарах составляет по данным различных авторов от 20 до 70 % в зависимости от ряда отягощающих факторов. Данная ситуация в значительной степени объясняется сложностью и многообразием патогенетических механизмов, лежащих в основе развития, течения и исхода тяжелых ожогов. Противоречивость в оценке различных патогенетических механизмов течения термической травмы, не всегда эффективные, а зачастую и неудовлетворительные результаты ее лечения, заставляют исследователей и клиницистов расширять спектр методов диагностики и лечения этого грозного состояния [2, 8, 12].
Более глубокая разработка проблемы ожогов в целом, внедрение методов интенсивной терапии позволили снизить летальность при развитии ожогового шока, однако практически не повлияли на исход заболевания при формировании сепсиса и синдрома органных дисфункций. В последние годы было показано, что в основе развития любого критического состояния лежит нарушение баланса прооксидантных и антиоксидантных систем, получившее название «окислительного стресса» [6, 7]. Основными механизмами его формирования при тяжелых ожогах являются расстройства общего кровообращения и микроциркуляции, гипоксия и эндогенная интоксикация, инфекция. В остром периоде ожоговой травмы на фоне повышенной сосудистой проницаемости и секвестрации плазмы в интерстициальное пространство формируется относительная и абсолютная гиповолемии, централизация кровообращения. Последняя имеет приспособительный характер, обеспечивая адекватный кровоток в приоритетных органах (мозг, сердце, легкие), но одновременно приводит к существенным нарушениям регионарного и периферического кровотока. Нарастающие нарушения микроциркуляции сопровождаются тканевой гипоксией, активацией анаэробного гликолиза, образованием активных форм кислорода (АФК), которые одновременно запускают процессы свободнорадикального окисления с последующим повреждением клеточных мембран и гибелью клетки. Подобные окислительные реакции идут с образованием токсических метаболитов, в том числе и продуктов перекисного окисления липидов (ПОЛ), которые в норме нейтрализуются в достаточной степени многокомпонентной антиоксидантной системой организма (АОС). Существенный вклад в формирование окислительного стресса вносит и микробный фактор. Массивный выброс в кровоток микробных липополисахаридов сопровождается и активацией нейтрофилов и макрофагов, образованием активных форм кислорода, активацией ПОЛ [5].
В общих чертах формирование состояния окислительного стресса при термической травме рассматривается как последовательные звенья патологической цепи - расстройства кровообращения и микроциркуляции, кислородное голодание, эндогенная интоксикация, микробная нагрузка → гиперпродукция АФК и интенсификация процессов ПОЛ → истощение АОС и развитие антиоксидантной недостаточности → окислительный стресс. В этой связи большой интерес представляет возможность использования при тяжелых ожогах препаратов патогенетической направленности и в первую очередь реамберина, поскольку в последние годы появились сообщения об его антигипоксантном, антиоксидантном и мембраностабилизирующем действии при ряде критических состояний [1, 3, 6].
Целью работы явилось оценка нарушений в системе ПОЛ-АОС у больных с тяжелой термической травмой и возможность метаболической коррекции окислительного стресса инфузией 1,5% раствора реамберина.
Материал и методы. Работа выполнена на базе отделения интенсивной терапии и реанимации Республиканского ожогового центра. В соответствии с задачами проведены исследования у 28 больных (23 мужчины и 5 женщин) с тяжелой термической травмой. Все больные были разделены на 2 клинические группы: 1-я группа (15 пациентов), которым в комплексную интенсивную терапию включались инфузии реамберина и 2-я (13 пациентов), которым в интенсивной терапии реамберин не использовался.
Рандомизация осуществлялась путем случайного включения в группу. Сопоставимость результатов обеспечивалась исключением из группы исследований пациентов, имеющих тяжелую соматическую патологию, отсутствием достоверных различий между группами по возрасту (исключались пациенты моложе 16 и старше 55 лет), отсутствием достоверных различий по площади и глубине термического поражения (исключались пациенты с индексом Франка менее 50 и более 150 ЕД.
Все пациенты находились в периоде острой токсемии, больные в состоянии ожогового шока в исследование не включались.
Реамберин вводили с 3-их суток заболевания на фоне базисной интенсивной терапии в дозе 400 мл 1,5% раствора 1 раз в сутки в течение 7 дней.
Для количественной характеристики ПОЛ использовались показатели УФ-поглощения липидных экстрактов при длине волны 233 нм и 278 нм, соответствующие поглощению соединениями с конъюгированным типом связи (диенконъюгаты ДКО233) и диенкетоновой конфигурации (диенкетоны ДКЕ278) [4, 11]. Расчет проводили в единицах оптической плотности на 1 мл плазмы крови. В плазме крови определяли также содержание малонового диальдегида (МДА) [9]. О состоянии АОС судили содержанию альфа-токоферола (а-ТФ) и ретинола (РЕТ). Содержание а-ТФ и РЕТ в плазме крови исследовали в одной пробе методом спектрофлюориметрии [10]. Данные показатели исследованы в плазме и 15 доноров.
Забор крови у пациентов обеих клинических групп осуществлялся при поступлении в стационар и в динамике на 3, 5 и 7-е сутки заболевания.
Для оценки достоверности полученных результатов весь цифровой материал подвергали статистической обработке. Во всех статистических совокупностях определяли среднюю арифметическую величину (М), среднюю ошибку средней арифметической (m), среднее квадратичное отклонение (δ). Обработка данных производилась с помощью программного обеспечения фирмы «Microsoft»: реляционной базы данных «Access-97» и электронных таблиц «Excel-97». Различия считали достоверными при Р<0,05.
Анализ клинической эффективности терапии включал частоту развития и длительность делириозного состояния, пневмонии, сепсиса, длительность пребывания в критическом состоянии (к/дни в отделении реанимации и интенсивной терапии), а также летальность.
Результаты и обсуждение. Данные о содержании в плазме крови доноров и больных с тяжелой термической травмой в 1 и 2 клинических группах продуктов ПОЛ приведены в табл. 1.
Таблица 1
Состояние системы перекисного окисления липидов плазмы крови больных с термической травмой 1 и 2 клинических групп при поступлении и на 3, 5 и 7 сутки лечения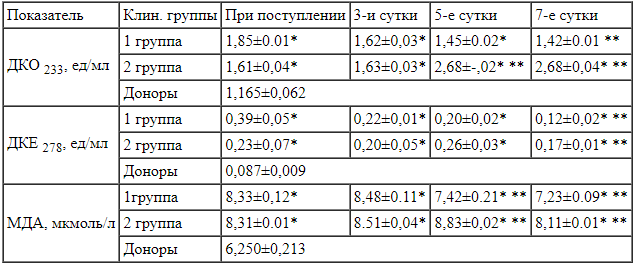 Примечания:
Примечания:
* - достоверность различий показателей по отношению к донорам (Р<0,05).
**-достоверность различий результатов между группами (Р<0,05)
Как видно из табл.1. у больных с термической травмой и 1 и 2 клинических групп отмечается достоверное увеличение в плазме крови уровня как первичных, так и вторичных продуктов ПОЛ. Так, оценка гидроперекисей липидов в плазме крови выявила их повышение: уже на третьи сутки заболевания содержание ДКО было выше, чем у доноров почти на 40% (Р<0,05), а ДКЕ на 120% (Р<0,05), а также возрастание на 36% концентрации одного из конечных продуктов ПОЛ - МДА. Такое существенное возрастание концентраций ДКЕ и ДКО указывает на интенсификацию свободнорадикальных окислительных процессов (СРО).
Как известно, ДКЕ и ДКО являются промежуточными метаболитами высокоскоростных реакций СРО, которые подвергаются превращениям в конечные токсические продукты (МДА) или разлагаются под действием антиокислительных систем. Определенный интерес в этом плане представляло изучение дальнейшего изменения данных показателей на фоне проводимой терапии без и с применением реамберина. Сравнение динамики изменения уровней ДКО и ДКЕ у больных обеих клинических групп на 5 и 7 сутки заболевания выявило существенную разницу: у больных 2 клинической группы отмечен по сравнению с 3 сутками существенный рост уровней ДКО (с 1,63±0,03 ед/мл до 2,68±0,04 ед/мл на 5 и 7-е сутки или на 64%, Р<0,05) и ДКЕ (с 0,20±0,05 ед/мл до 0,26±0,03 ед/мл на 5 сутки или на 30 %, Р<0,05). У больных же 1 клинической группы после проведенной интенсивной терапии с реамберином наоборот отмечено снижение ДКО на 12% (с 1,62±0,03 ед/мл до 1,45±0.02 ед/мл на 5 и до 1,42±0.01 ед/мл на 7-е сутки, Р<0,05) и ДКЕ соответственно на 10 и 83% (с 0,22±0,01 ед/мл до 0,20±0,02 ед/мл на 5 и до 0,12±0,02 ед/мл на 7-е сутки, Р<0,05). Данная тенденция наблюдается и в динамике содержания МДА в плазме больных двух клинических групп.
Анализ полученных данных о содержании ДКО, ДКЕ и МДА у больных 2 клинической группе свидетельствует о сохраняющемся и даже в некоторой степени усиливающемся процессе перекисного окисления липидов в плазме крови больных с тяжелыми ожогами. Проведение же комплексной интенсивной терапии с включением реамберина у больных 1 клинической группы и снижение на ее фоне уровня продуктов ПОЛ свидетельствует о четко наметившейся тенденции к нормализации процесса перекисного окисления липидов.
Для характеристики антиоксидантного статуса изучены уровни ретинола и а-токоферола в плазме крови больных с термической травмой обеих клинических групп. Полученные данные представлены в табл. 2.
Таблица 2.
Динамика изменения уровня ретинола и а-токоферола плазмы крови больных с термической травмой 1 и 2 клинических групп при поступлении и на 3, 5 и 7 сутки лечения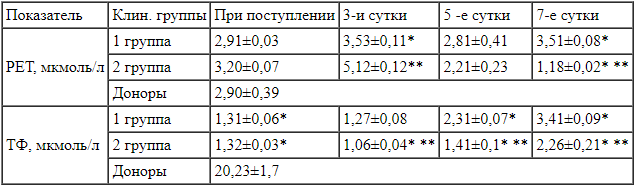 Примечания:
Примечания:
*- достоверность различий показателей по отношению к донорам (Р<0,05).
**- достоверность различий результатов между группами (Р<0,05)
Представленные в табл.2 данные свидетельствуют о нарушении АОС у больных с тяжелой термической травмой. При поступлении уровень РЕТ достоверно не различался между группами. На 3 сутки наблюдался рост уровня РЕТ, причем более значительный у больных 2 группы, что расценено нами как компенсаторная реакция на повышенное содержание ДКО, ДКЕ и МДА. На 5 сутки уровень РЕТ в плазме крови больных обеих групп снизился, однако темпы его снижения были различны: в 1 группе на фоне применения реамберина на 20%, в группе без его использования - на 57% (р<0,05). Совершенно противоположная направленность в динамике изменения данного показателя отмечена нами к 7 суткам. Так, у больных 1 группы отмечался некоторый рост концентрации РЕТ, в то время как у больных 2 группы продолжалось дальнейшее его снижение, свидетельствующее об истощении АОС у больных не получавших реамберин.
Еще более заметные нарушения отмечены в изменении уровня ТФ. Уже при поступлении в обеих группах имело место резкое снижение ТФ, которое, несмотря на проводимую терапию, сохранялась и к 3 суткам (1,27±0,08 и 1,06±0,04 мкмоль/л) . Интересные закономерности выявлены в дальнейшей динамике показателя. Так, к 5 суткам на фоне терапии с реамберином в плазме больных 1 группы отмечено почти двукратное увеличение концентрации ТФ (2,31±0,07 мкмоль/л, Р<0,05), в то время как во 2 группе этой тенденции не наблюдалось (1,41±0,1 мкмоль/л). В дальнейшем наблюдался рост уровня ТФ, который к 7 суткам вырос в 2,6 раза у больных 1 группы (3,41±0,09 мкмоль/л, Р<0,05) и всего в 1,7 раза во 2 группе (2,26±0,21 мкмоль/л, Р<0,05) по отношению к исходным данным.
Анализ динамики изменения уровня ретинола и альфа-токоферола плазмы крови больных с тяжелой термической травмой у больных 1 и 2 клинических групп при поступлении и на 3, 5 и 7 сутки лечения подтвердил свойства реамберина как антиоксидантного корректора метаболического стресса.
Данные клинической эффективности проводимой интенсивной терапии у больных обеих клинических групп представлены в табл.3.
Таблица 3
Клинические критерии эффективности комплексной интенсивной терапии у больных с термической травмой 1 и 2 клинических групп
| Показатели |
1 -я группа ( с реамберином) |
2-я группа (без реамберина) |
| Количество пациентов |
15 |
13 |
| Возраст (лет) |
34,8±4,5 |
32,8±3,8 |
| Общая площадь ожогов (%) |
55,0±6,8% |
52,0±4,6% |
| ИТП (ед) |
87,0±5,7 |
82,0±6,8 |
| Частота пневмоний |
5 (33,3%) |
9 (69,2%) |
| Частота сепсиса |
5 (33,3%) |
9 (69,2%) |
| Частота развития делирий |
7 (46,7%) |
8 (61,5%) |
| Длительность делирия (сут) |
2,2±1,1 |
5,2±2,1 |
| Длительность пребывания в ОИТР |
23,5±3,8 |
26,2±2,5 |
| Умерло |
3 (20%) |
5 (38,5%) |
Анализ данных, приведенных в табл.3, показал эффективность использования реамберина у больных с термической травмой. Так, в 1-й клинической группе в результате проводимой интенсивной терапии с реамберином отмечено меньшее по сравнению с 2-й группой (без применения реамберина) количество пневмоний (соответственно 33,3 и 69,2%) , сепсиса (33,3 и 69,2%) и делирия (46,7 и 61,5%), длительность делирия (2,2±1,1 сут и 5,2±2,1 сут) и пребывания в критическом состоянии (23,5±3,8 и 26,2±2,5 сут), снижение летальности с 38,5% до 20%. Применение патогенетически обоснованной терапии способствовало более быстрому регрессу клинических симптомов, уменьшению количества осложнений и снижению летальности.
Таким образом, полученные данные свидетельствуют о развитии состояния окислительного стресса у больных с тяжелой термической травмой, лабораторными маркерами которого являются показатели, свидетельствующие об интенсификация процессов перекисного окисления липидов и истощении антиоксидантной системы. Проведение комплексной интенсивной терапии с использованием метаболического корректора реамберина снижает интенсивность перекисного окисления липидов и повышает антиоксидантные возможности организма. Данная схема интенсивной терапии является патогенетически обоснованной и высоко эффективной, позволяющей значительно улучшить результаты лечения больных с тяжелой термической травмой.
Литература
1. Абрамченко В.В. Антиоксиданты и антигипоксанты в акушерстве. - СПб.: ДЕАН, 2001. - 400 с.
2. Алексеев А.А. Ожоговый сепсис: диагностика, профилактика, лечение: Автореф. дис. ...д-ра мед. наук. - М., 1993.
3. Афанасьев В.В. Клиническая эффективность реамберина.- СПб., 2005.- 43 с.
4. Гаврилов В.В., Мишкорудная М.И. // Лаб. дело. - 1983. - №3. - С.33.
5. Гринев М.В., Громов М.И., Комраков В.Е. Хирургический сепсис. - СПб.; М., 2001. -315 с.
6. Дубиева Н.З., Багдасарова З.З. // Анестезиология и реаниматология. - 2004. - №2. - С.7376.
7. Зайчик А.Ш., Чурилов Л.П. Основы общей патологии. Ч.1.- СПб.: Элби., 1999. - 624 с.
8. Козлов В.К. // Медицинские новости.- 2004.- №4. - С.1-5.
9. Козлов В.К., Стельмах В.В. // Медицинские новости. - 2004. - №4. - С.5-9.
10. Львовская Е.И. Нарушение процессов липидной пероксидации при термической травме и патогенетическое обоснование лечения антиоксидантами из плазмы крови: Автореф. дис. ...д-ра мед. наук. - М., 1998.
11. Парамонов Б.А., Поремский Я.О., Яблонский В.Г. Ожоги. - СПб.: Спецлит, 2005.-480 с.
12. Суплотов С.Н., Баркова Э.Н. //Лаб. дело.- 1986.- №8.- С.459-463.
13. Черняускене Р.Ч., Варшкавичене З.З., Грибаускас П.С. //Лаб. дело. -1984.-№6. - С. 362365.
14. Шилина Н.И., Чарнавина Т.В. // Вопр. мед. химии. - 1980.- Т.26,№2.- С.190-193.
15. Sherigan R.L., Ryan C. M., Lim L.M. // Burns. - 1998. - №2. - Р. 307-311.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)