Уважаемый посетитель!
Эта информация для специалистов здравоохранения
Нажимая «ПРОДОЛЖИТЬ», Вы подтверждаете, что им являетесь
Реамберин в клинической практике
СтатьиПод общей редакцией М. Г. Романцова, А. Л. Коваленко
Практическое руководство для врачей ОРИТ
Содержание
- Предисловие
- Введение
-
Синдром абдоминального сепсиса (САС)
Синдром системного воспалительного ответа (ССВО)
Синдром полиорганной недостаточности (СПОН)
Синдром острой церебральной недостаточности (ОЦН) - Эффективность реамберина при различных клинических состояниях
- Синдром эндотоксикоза при острых инфекционных деструкциях легких
- Список основных работ по эффективности применения реамберина в клинической практике
Предисловие
Прошло 9 лет с момента поступления в клиническую практику оригинального полифункционального препарата для инфузионной терапии «Реамберина 1,5% раствора для инфузий», спрос на который продолжает увеличиваться.
Первый опыт клинического применения препарата подтвердил не только достоверность результатов доклинических испытаний препарата и обоснованность изначальных рекомендаций по его применению, но и, самое главное, выявил повышенный интерес к нему. Последнее привело к основополагающим доказательным многоцентровым научным исследованиям, что и определило основные направления по его применению, первоочередным из которых явилась медицина критических состояний (МКС), объектом изучения которой является изучение угрожающих жизни состояний.
Инфузионная терапия является важнейшим компонентом ведения больных, находящихся в критических состояниях. Основными задачами инфузионной терапии в практике МКС являются: коррекция объема и реологических свойств крови, биохимическая и коллоидноосмотическая коррекция крови и тканевой жидкости, дезинтоксикация, введение лекарственных средств, парентеральное питание. Для решения этих задач используются различные инфузионные среды, которые, по основным физиологическим свойствам могут быть разделены на гемодинамические кровезаменители, дезинтоксикационные кровезаменители, препараты для парентерального питания, регуляторы водно-солевого и кислотно-основного состояния; кровезаменители с функцией переноса кислорода, инфузионные антигипоксанты, комбинированные препараты.
Среди средств инфузионной терапии 1,5% раствор реамберина занимает особое место, так как он в силу своего состава и особенностей является полифункциональным с дезинтоксикационным свойством средством, регулирующим водно-солевое и кислотно-основное состояние. Главное же отличительное свойство препарата, обусловлено включением янтарной кислоты (субстратного антигипоксанта) в сбалансированный полиионный раствор, что определяет его основополагающие свойства как метаболического и энергетического корректора. С. В. Оболенский
Президент Ассоциации анестезиологов и реаниматологов, президент научнопрактического общества анестезиологов и реаниматологов Санкт-Петербурга, доктор медицинских наук, профессор кафедры анестезиологии и реаниматологии Санкт-Петербургской медицинской академии последипломного образования.
Введение
Инфузионная терапия является важнейшим компонентом ведения больных, находящихся в критическом состоянии. Новой действенной группой средств метаболической коррекции критических состояний в клинической практике являются сукцина Т-содержащие растворы — переносчики кислорода, увеличивающие кислородную емкость крови и нормализующие кислородный режим организма и метаболизм. К данной группе препаратов относится реамберин (меглумина натрия сукцинат).
По классификации Т. Г. Кожока1 реамберин относится к субстратам энергетического обмена. В состав раствора для инфузий входят соль янтарной кислоты и микроэлементы (магния, калия, натрия хлориды). Инфузионная среда обладает антиоксидантным и антигипоксантным, энергопротективным эффектами, уменьшает продукцию свободных радикалов, утилизирует жирные кислоты и глюкозу в клетках, нормализует кислотно-щелочной баланс и газовый состав крови. Стандартная доза препарата составляет у взрослых до 800 мл в сутки (по 400 мл 2 раза), детям старше года препарат назначается из расчета 10 мл/кг массы тела, новорожденным и детям первого года жизни — 1 мл/кг массы тела. Препарат служит базовым раствором при применении других лекарственных средств.
Показанием к использованию реамберина является его влияние на основные звенья патогенеза критических состояний, состоящие из трех основных патофизиологических процессов: гипоксии, интоксикации и иммунопрессии. Реамберин широко используется в медицине критических состояний, независимо от этиологии их возникновения (кровопотеря, эндотоксикоз, гипоксия и пр.).
Лекарственная форма: раствор для инфузий 1,5%. Флаконы по 400 мл (для взрослых) и по 200 мл (для детей).
Показания к применению: острые интоксикации различной этиологии у взрослых и детей в качестве антигипоксического и дезинтоксикационного средства.
Фармакотерапевтическая группа: РАСТВОРЫ, ЭЛЕКТРОЛИТЫ, СРЕДСТВА КОРРЕКЦИИ КИСЛОТНОГО РАВНОВЕСИЯ. ГРУППА ХIХ.
Дезинтоксикационное средство. Код АТХ — В05ВВ.
Препарат включен распоряжением (№ 376-р от 29 марта 2007 г.) Правительства Российской Федерации в Перечень жизненно необходимых и важнейших лекарственных средств.
Использование антиоксидантов в комплексном лечении больных реанимационного профиля является обоснованным, так как у них преобладает выраженная активация окислительных процессов с одновременным угнетением антиоксидантной защиты. Однако следует учитывать, что в отделении реанимации и интенсивной терапии получают лечение пациенты с разнородной патологией, разной степенью тяжести основного синдрома и различным состоянием гомеостаза, следовательно, и патогенез повреждающего воздействия свободных радикалов на клетки и организм в целом будет иметь свои особенности. Поэтому, включать препараты с антиоксидантными свойствами в комплексную терапию необходимо с учетом этих особенностей, только в этом случае антиоксидантная терапия будет максимально эффективна.
Представляет интерес сравнительное исследование активности наиболее доступных и достаточно применяемых в медицинской практике антиоксидантов (Груздева И. М., Чеминаза Н. С.). К таким антиоксидантам можно отнести реамберин (субстратный антиоксидант); витамин Е (заместительный антиоксидант); солкосерил, актовегин, пирацетам (обладают регуляторным и заместительным антиоксидантным эффектом); мексидол (комбинированный антиоксидант).
Исследовали кровь 52 пациентов с синдромами абдоминального сепсиса (САС), системного воспалительного ответа (ССВО), полиорганной недостаточности (СПОН), церебральной недостаточности (СЦН). Рандомизация осуществлялась методом случайной выборки по поступлению в ОРИТ — «случай — синдром».
Пациенты разделены на группы в соответствии с балльной оценкой по системе АРАСНЕ II, с учетом прогноза летальности:
1-я группа — 0–14 баллов (прогноз: летальность 8–10%);
2-я группа — 15–24 балла (прогноз: летальность 22–30%);
3-я группа — 25 баллов и выше (прогноз: летальность 50% и выше).
Исследование состояло в инкубации крови пациентов с антиоксидантами с последующим анализом на свободнорадикальное окисление (СРО).
Синдром абдоминального сепсиса (САС)
- Использование антиоксидантов эффективно на ранних стадиях САС.
- По степени эффективности действия при данном синдроме антиоксиданты можно расположить в порядке убывания эффекта: реамберин, актовегин, витамин Е;
- Использование других препаратов (пирацетам, солкосерил, мексидол) при данном синдроме (САС) не повышает антиоксидантный потенциал.
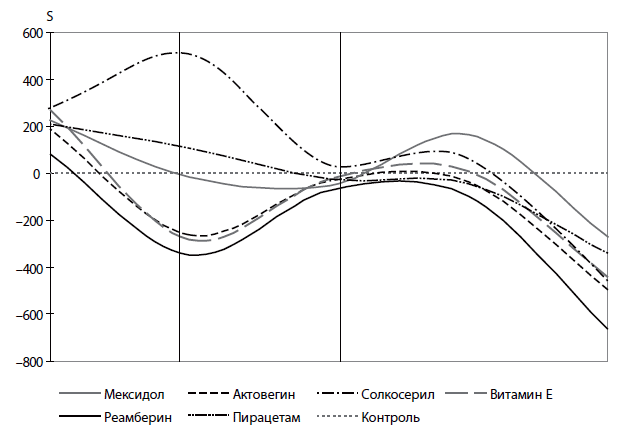
Рис. 1. Динамика относительных показателей светосуммы (S) у больных с САС
Синдром системного воспалительного ответа (ССВО)
- Эффективно действующим антиоксидантом, независимо от величины АРАСНЕ II, является реамберин.
- Солкосерил имеет меньший антиоксидантный эффект. Выявлено положительное качество препарата — повышение эффекта на фоне роста баллов АРАСНЕ II.
- Пирацетам значительно ухудшает антиоксидазные свойства мембран эритроцитов.
- Мексидол, актовегин, витамин Е имеют временный, «преходящий» эффект.
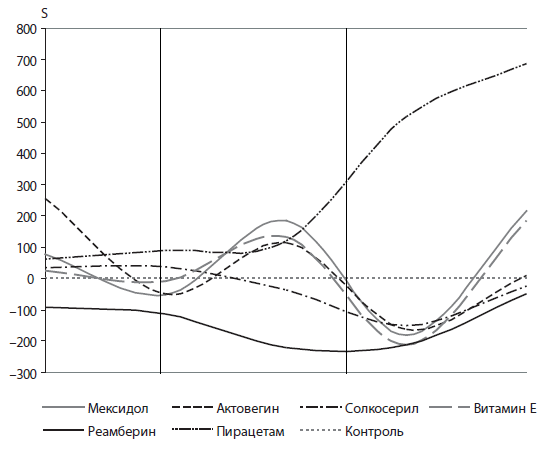
Рис. 2. Динамика относительной величины светосуммы (S) в клинической группе с ССВО
Синдром полиорганной недостаточности (СПОН)
- Антиоксидантом, эффективно действующим, независимо от величины АРАСНЕ II, является реамберин.
- Актовегин обладает выраженным антиоксидантным эффектом только для пациентов 1-й и 2-й групп.
- Действие витамина Е и мексидола ограничивается только 1-й группой пациентов.
- Солкосерил не наносит вреда пациенту.
- Пирацетам ухудшает антиоксидазные свойства мембран эритроцитов.
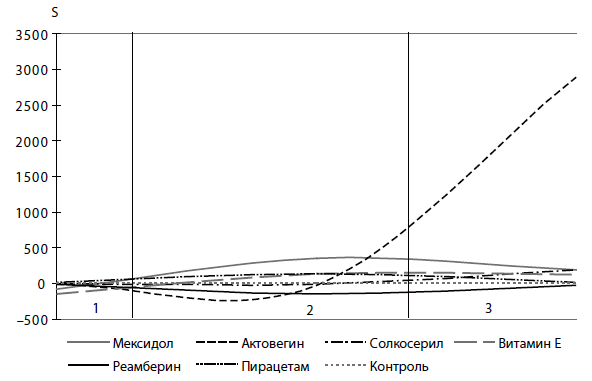
Рис. 3. Динамика относительных показателей светосуммы (S) по группам больных с СПОН
Синдром острой церебральной недостаточности (ОЦН)
- Реамберин является препаратом выбора для всех групп больных по синдрому ОЦН, причем мембраностабилизирующий эффект уменьшается с увеличением баллов АРАСНЕ II.
- Актовегин имеет выраженный эффект протекции клеточной мембраны только для 2-й и 3-й групп больных с ОЦН.
- Витамин Е имеет выраженный эффект стабилизации клеточной мембраны только для пациентов 1-й группы.
- Мексидол обладает сравнительно умеренным эффектом только для пациентов 1-й и 2-й групп.
- Пирацетам обладает позитивным эффектом лишь на ранних стадиях угнетения сознания.
- Солкосерил, подобно пирацетаму, действует только у пациентов 1-й группы и, в отличие от него, обладает мембраностабилизирующим действием у пациентов с тяжелыми формами ОЦН (3-я группа).
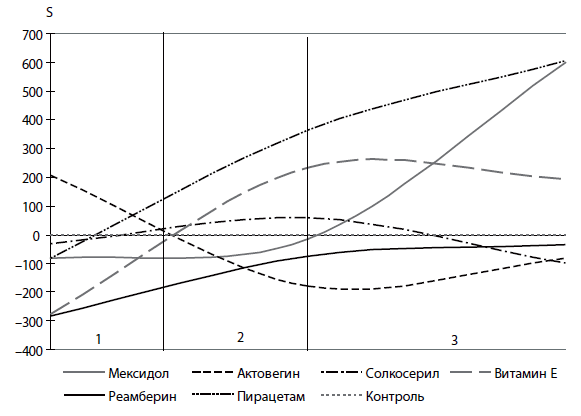
Рис. 4. Относительный показатель светосуммы (S) в клинической группе с СОЦН
Эффективность реамберина при различных клинических состояниях
Антиоксиданты обладают мембраностабилизирующим эффектом. Существуют достоверные различия в мембраностабилизирующем эффекте антиоксидантов в зависимости от клинического синдрома и степени тяжести. Исходя из проведенных исследований по мембраностабилизирующему действию антиоксидантов для клинических синдромов и групп (АРАСНЕ II) больных установлено, что:
А. Реамберин действует эффективнее других антиоксидантов при САС; при ССВО и СПОН действует эффективно независимо от величины АРАСНЕ II, является препаратом выбора для всех групп больных по синдрому ОЦН.
Б. Мексидол обладает сравнительно умеренным эффектом для пациентов 1-й и 2-й групп при ОЦН, эффективен у пациентов 1-й группы при СПОН, использование его при САС не повышает антиоксидантный потенциал, а при ССВО отмечен «преходящий» эффект.
В. Актовегин — второй по эффективности препарат при САС, обладает выраженным антиоксидантным эффектом для пациентов 1-й и 2-й групп при СПОН и для 2-й и 3-й групп больных с ОЦН, но имеет временный эффект при ССВО.
Г. Солкосерил имеет меньший антиоксидантный эффект по сравнению с реамберином (ССВО). Выявлено положительное качество препарата — повышение эффекта на фоне роста баллов АРАСНЕ II; подобно пирацетаму, действует у пациентов 1-й группы и, в отличие от него, обладает мембраностабилизирующим действием у пациентов с тяжелыми формами ОЦН (3-я группа), использование же его при САС и СПОН не повышает антиоксидантный потенциал.
Д. Витамин Е имеет выраженный эффект стабилизации клеточной мембраны, но только у пациентов 1-й группы при ОЦН, имеет временный эффект при ССВО, действие его при СПОН ограничивается 1-й группой пациентов.
Е. Пирацетам обладает позитивным эффектом лишь на ранних стадиях угнетения сознания при ОЦН, неэффективен при САС, ухудшает антиоксидазные свойства мембран эритроцитов при ССВО и СПОН.
Таким образом, можно рекомендовать реамберин к использованию в отделении реанимации и интенсивной терапии в комплексном лечении синдромов абдоминального сепсиса, системного воспалительного ответа, полиорганной и церебральной недостаточности Острая кровопотеря при язвенных гастродуоденальных кровотечениях (ЯГДК) остается важнейшей проблемой экстренной хирургии желудочно-кишечного тракта, летальность составляет от 5 до 14%. Патологические эффекты острой кровопотери связаны с двумя важнейшими факторами — снижением объема циркулирующей крови (ОЦК) и уменьшением количества гемоглобина. Следствием этого являются нарушения периферического кровотока, развитие ишемии (гипоксии) органов и тканей. Прогрессирование тканевой ишемии сопровождается накоплением недоокисленных кислородом продуктов обмена. В митохондриях (Мх) метаболические процессы переходят на анаэробный путь окисления, который вызывает накопление лактата, что способствует развитию метаболического ацидоза. С. С. Моргуновым2 (Ижевск) изучена клиническая эффективность реамберина у больных с гастродуоденальным кровотечением. В обследование включены пациенты с ЯГДК в возрасте от 17 до 80 лет (46,9±18,1), поступившие в экстренном порядке с признаками геморрагического шока и тяжелой степенью кровопотери (дефицит ОЦК — 30–40% и ГО — 50–60%).
Больные разделены на две группы, тяжесть состояния которых не различалась по шкалам APACHE II (от 21 до 25 баллов) и SAPS II (52,1±2,5 балла) при поступлении. Основная группа состояла из пациентов, которым наряду со стандартной интенсивной терапией проводили инфузии реамберина 1,5% по 400 мл 2 раза в сутки (1-я группа), и группы больных (2-я), лечение которых проводили по традиционной схеме. Этапы исследования: при поступлении — I этап, II — через 24 часа, III — через 48 часов, IV — через 72 часа.
При включении в интенсивную терапию реамберина сокращалось время пребывания пациентов в ОРИТ, уменьшалась частота осложнений, снижались летальные случаи (см. таблицу). Применение реамберина у больных с тяжелой степенью кровопотери показало клиническую эффективность препарата, что проявилось снижением в 1,6 раза летальных исходов, частоты развития осложнений, сокращением периода нахождения в ОРИТ (соответственно в 1,5 и 1,3 раза).
Таблица
Клинические критерии эффективности раствора реамберина
| Показатель эффективности | 1-я группа (больные, получавшие реамберин) | 2-я группа (больные, получавшие базовую терапию) |
|---|---|---|
| Длительность нахождения пациентов в ОРИТ, сутки | 4,6±0,4 | 5,7±0,4 |
| Частота развития осложнений (ОРДС, НК, ОПН, ДВС, ПОН), % | 45,2 | 71,9 |
| Летальность, % | 12,5 | 20,0 |
Реамберин удовлетворительно переносится больными. Реакций и осложнений при использовании реамберина во время и после инфузии не отмечалось.
Нарушения метаболизма в организме при критических состояниях (полиорганная недостаточность, сепсис) нередко сопровождаются изменениями кислотно-щелочного состояния, как и наоборот, серьезные сдвиги кислотно-щелочного гомеостаза оказывают влияние на состояние метаболических процессов организма. С. В. Синьковым, К. Д. Зыбиным (Краснодар) изучено влияние реамберина на метаболические процессы при сепсисе.
В исследование включено 28 пациентов с септической патологией. Возраст пациентов колебался от 24 до 65 лет. Верификация тяжести септического процесса осуществлялась по критериям R. C. Bone (1992) с выделением таких состояний, как синдром системного воспалительного ответа (ССВО), сепсис, тяжелый сепсис и септический шок.
В зависимости от состояния кислотно-щелочного гомеостаза в исследование вошли пациенты с субкомпенсированным метаболическим ацидозом (рН не ниже 7,2).
Пациенты разделены на 2 группы: в 1-ю группу вошли лица, получающие на фоне стандартной интенсивной терапии реамберин в дозе 10–20 мл/кг/сут в течение 5 дней, во 2-ю группу — пациенты, получающие стандартную интенсивную терапию.
Применение реамберина показало свою эффективность, позволив добиться нормализации кислотно-щелочного состояния, азотного баланса, снизить эндогенную интоксикацию, а как следствие, уменьшить тяжесть состояния больных вследствие нормализации метаболических процессов у критических пациентов.
Выраженные метаболические нарушения, возникающие при сахарном диабете, являются основой для развития осложнений со стороны ЦНС. В основе патофизиологических изменений в развитии диабетического кетоацидоза лежат нарушения обмена веществ, в первую очередь углеводного, и энергетики клетки. Когда речь идет о сахарном диабете, для избежания полипрагмазии целесообразно выбирать препараты, сочетающие эффекты активации метаболизма, улучшения гемодинамики и нормализации углеводного обмена. Таким условиям отвечает реамберин — стимулятор утилизации кислорода и глюкозы в условиях ишемии и гипоксии, увеличивающий транспорт и накопление глюкозы в клетках, улучшающий аэробный синтез макроэргических соединений и повышающий энергетические ресурсы нейронов, препятствуя их гибели. В. А. Сединкин, Е. Н. Клигуненко3 (Днепропетровск) провели оценку роли реамберина в интенсивной терапии диабетического кетоацидоза.
Под наблюдением находилось 59 больных сахарным диабетом 1-го типа (23 мужчины и 36 женщин) в возрасте от 17 до 55 лет (средний возраст 37 лет). У всех больных течение сахарного диабета осложнилось диабетическим кетоацидозом, сопровождающимся расстройствами сознания (до комы или прекомы). В зависимости от интенсивной терапии больные были разделены на две группы. 1-я группа (30 человек) получала лечение по традиционной схеме. Больным 2-й группы (29 человек) в интенсивную терапию был включен реамберин. Препарат вводили внутривенно капельно в дозе 400 мл 1,5% раствора 1 раз в день до 5 суток на фоне традиционной базисной интенсивной терапии. Традиционная интенсивная терапия включала регидратацию, коррекцию вводно-электролитных нарушений, инсулинотерапию, терапию, направленную на улучшение микроциркуляции, лечение инфекционно-воспалительных заболеваний, симптоматическую терапию.
Использование реамберина способствовало улучшению показателей обмена кислорода, центральной гемодинамики и функций ЦНС, что свидетельствовало об улучшении газообменной функции легких, позволяя уменьшить степень гипоксического повреждения головного мозга и улучшить утилизацию кислорода клетками головного мозга. Это подтверждалось сравнительной оценкой когнитивных функций. В группе больных, получавших реамберин, коэффициент устойчивости внимания (КУВ) с 3-х суток от момента наблюдения стабильно превышал значения его у больных, получавших традиционную терапию. Определялся достоверный рост КУВ к 5-м и 28-м суткам соответственно на 30,2 и 67,9% по сравнению с 3-ми сутками. При исследовании вербальной памяти у больных 2-й группы отмечался рост количества правильных повторений, проявляющийся в ускорении запоминания и увеличении количества правильно запоминаемых слов к 28-м суткам. На фоне традиционной терапии темп восстановления мыслительных процессов был ниже, чем у больных, получавших реамберин. Под влиянием реамберина отмечался рост количества правильных ответов на 5-е и 28-е сутки наблюдения соответственно на 45,8 и 73,8%, что свидетельствовало о более высокой сохранности мыслительных процессов после перенесенного эпизода мозговой гипоксии.
Таким образом, реамберин обеспечивает улучшение доставки и увеличение потребления кислорода клетками головного мозга. Нейропротективное действие реамберина на головной мозг у больных с диабетическим кетоацидозом, осложнившимся прекомой и комой, проявляется в ускорении процессов восстановления когнитивных функций как в раннем, так и в отдаленном от перенесенного эпизода мозговой гипоксии периоде.
Сахарный диабет (CД) относится к распространенным заболеваниям. Им страдает около 3–4% населения. Ожидаемая распространенность СД к 2010 году составит около 215 млн человек. СД тип 1 составляет 15–20% от всех больных диабетом. В настоящее время, несмотря на появляющиеся эпидемиологические данные и результаты многоцентровых исследований, свидетельствующие о наличии патогенетической взаимосвязи между метаболическими расстройствами при СД и его осложнениями, современные клинические руководства и международные рекомендации не уделяют достаточного внимания новым методам лечения СД, эффективно воздействующим на метаболические процессы. Дискуссионным остается вопрос, касающийся применения лекарственных средств, обладающих метаболическим действием и способствующих улучшению нейронального метаболизма, стабилизации физиологических механизмов ауторегуляции мозгового, кардиального и почечного кровообращения, которые нарушены в условиях энергетического дисбаланса при СД тип 1. На примере популяции пациентов с сахарным диабетом (СД тип 1), находящихся в стадии декомпенсации, И. В. Сарвилиной4 (Ростов-на-Дону) разработана схема оценки фармакодинамических эффектов и предложена новая методика оценки фармакокинетических показателей инфузионной среды «Реамберин 1,5% для инфузий». Применение реамберина привело к снижению среднесуточного, максимального и минимального уровней глюкозы, концентрации малонового диальдегида (МДА), уменьшению продолжительности скорости образования диеновых конъюгат (ДК) с увеличением СОД и содержания глутаминовой кислоты в крови. Выявлено уменьшение выраженности протеинурии, концентрации креатинина в сыворотке крови и снижение отношения альбумин/креатинин мочи. В группе пациентов, получавших интенсивную инсулинотерапию (ИИ) и реамберин, отмечалось выраженное уменьшение ионов Na+, К+ и хлора в сыворотке крови при увеличении соотношения Na+/K+, Mg++ и Ca++. Выявлено снижение утренней и вечерней концентрации АКТГ при увеличении содержания кортизола и утренних и вечерних показателей Т3 и Т4 и уменьшение ТТГ. В группе больных, принимавших реамберин, увеличивалось количество пациентов с удовлетворительным качеством жизни (по шкале the Diabetes Quality of Life).
Обнаружен высокий терапевтический эффект реамберина 1,5% раствора для инфузий, связанный с гормонально-метаболическим и антиоксидантным действием активного вещества. Основной причиной поражения органов-мишеней (сердце, головной мозг, почки, глазное дно) при СД тип 1 является поражение сосудов. Основная роль в развитии сосудистых осложнений СД принадлежит неферментативному аутоокислительному гликозилированию и окислительному стрессу. При терапии реамберином увеличивается чувствительность инсулиновых рецепторов к инсулину и уменьшается гипергликемия, что устраняет механизмы активации окислительного стресса. Увеличение чувствительности к экзогенному инсулину связано с положительным действием сукцината на оксигенацию внутриклеточной среды, стабилизацию структуры и функции митохондрий, ионный обмен в клетке, о чем косвенно свидетельствуют внеклеточные изменения Na+/K+, Са++, хлора, Mg++. Обнаружены сопряженные изменения функционирования оси гипофиз—надпочечники и системы ПОЛ—АОС на фоне приема реамберина. Наиболее вероятной мишенью представляются глюкокортикоидные рецепторы II и III типа. Механизм их ингибирования (концепция G. Vallette) обеспечивается вторым неспецифическим локусом, расположенным вне пределов специфического глюкокортикоидного локуса глюкокортикоидного рецептора II и III типа, что вызывает трансформацию специфического глюкокортикоидного локуса, которая является причиной снижения глюкокортикоид-связывающей способности рецептора II и III типа. Возможными механизмами реализации кардио- и вазопротективного эффекта реамберина (у пациентов с СД тип 1) являются: 1) устранение неблагоприятных эффектов гипергликемии — угнетение активности гликозилирования, пероксидации белков и радикала NO; 2) влияние на биохимические процессы — бетаокисление жирных кислот, окислительное фосфорилирование глюкозы в миокарде, синтез АТФ, синтез коллагена в сердце; 3) опосредованное изменение уровня функционирования нейроэндокринной регуляции (инсулин, кортизол, Т3).
Уменьшение активности ПОЛ у пациентов с СД тип 1 в ходе приема реамберина свидетельствует о снижении образования продуктов неферментативного гликозилирования белков — оснований Шиффа (обратимых), слабо-обратимых (продуктов Амадори) и необратимых конечных продуктов гликозилирования. На уровне нефроцита представляется вероятным возникновение, на фоне приема реамберина, адаптационного резерва, связанного с активностью глутаматдегидрогеназного комплекса (происходит снижение активности глутаматдегидрогеназы, что вызвано увеличением содержания NAD•Н2, в результате торможения активности ферментов NAD•Н-дегидрогеназы и цитохромоксидазы в митохондриях почек). Возможно накопление пиридиннуклеотида за счет генетически опосредованного синтеза, являющегося аллостерическим регулятором глутаматдегидрогеназы, что обращает ферментативную реакцию в сторону образования глутаминовой кислоты, которая способна связать аммиак. Другим важным следствием обращения этой реакции является генерирование окисленного NAD, наличие которого обеспечивает возможность катализа дегидрирования субстратов. На уровне нефроцита происходит убывание глутамата в цикле Робертса, что способствует предохранению сукцинатдегидрогеназы от ингибирующего действия оксалоацетата и обеспечивает достаточно высокий уровень энергопродукции для клеток органа. Увеличение окисления глутамата приводит к шунтированию α-кетоглутарата с преобразованием последнего в цикле Кребса. Наблюдающаяся активация гликолиза ня АТФ, являющегося поставщиком субстратов окисления для цикла Кребса.
Механизмы реализации психокорригирующего эффекта реамберина, лежащего в основе улучшения качества жизни, связаны с основными путями синтеза ГАМК с учетом эффекта Вэлша (компартментализация метаболизма глутамата, глутамина и ГАМК). Представляется возможным влияние реамберина на активность окислительного декарбоксилирования α-кетоглутарата с образованием сукцинил—КоА, так как данная реакция обеспечивает поддержание суммарной концентрации метаболитов цикла на стационарном уровне. Образование α-кетоглутарата способствует его дальнейшему участию как в цикле трикарбоновых кислот, так и в глутаматдегидрогеназной и трансаминазной реакциях. Сукцинатдегидрогеназная реакция обеспечивает поддержание энергетического баланса ткани, особенно на пиридиннуклеотидном участке дыхательной цепи. Основными энергозависимыми процессами, функция которых улучшается при приеме реамберина, являются: проведение нервных импульсов; поддержание пространственной ориентации и конформации структурных единиц нейрона; образование синаптических структур, функционирование синапсов; нейрологическая память; трансмембранный перенос субстратов, нейромедиаторов; аксональный и ретроградный ток.
При тяжелых формах послеродового эндометрита важную роль в патогенезе заболевания играют реологические свойства крови. И. А. Салов, А. В. Романовская (Саратов) провели изучение реологических свойств крови при различных формах послеродового эндометрита с оценкой эффективности препарата «Реамберин 1,5% для инфузий» на гемореологические показатели. Под наблюдением находилось 79 родильниц с послеродовым эндометритом, в возрасте от 15 до 37 лет, в палате интенсивной терапии 1-й городской клинической больницы г. Саратова.
В зависимости от выраженности клинических симптомов интоксикации, гемодинамических нарушений больные разделены на 2 группы. В 1-ю группу входили 52 женщины с выраженными клиническими признаками интоксикации: гектическая температура (38,9±0,7°С) с повторными ознобами, тошнота, рвота, гемодинамические нарушения в виде бледности кожных покровов, периоральный периорбитальный цианоз, стойкая тахикардия (110±6,5 в 1 мин.), одышка (26–32 в 1 мин.). Во 2-й группе больных (27 чел.) симптомы интоксикации были менее выражены: гипертермия (37,8±0,5°С), вялость, адинамия, снижение аппетита, тошнота, умеренная тахикардия.
У родильниц выявлены показатели интоксикации, изменения вязкостных свойств крови, нарушение тромбоцитарного гемостаза, которые зависели от тяжести состояния, выраженности послеродового эндометрита. При тяжелой интоксикации с гемодинамическими нарушениями развивались изменения реологических свойств крови по типу синдрома высокой вязкости крови: повышение вязкости крови при всех скоростях сдвига, вязкости плазмы (р<0,01), увеличение гематокритного числа, фибриногена (р<0,05), в связи с чем уменьшается способность эритроцитов обеспечивать адекватную капиллярную перфузию.
Инфузионно-трансфузионная терапия больным с тяжелым послеродовым эндометритом должна быть индивидуальной, включать в себя дезинтоксикационные препараты и препараты, нормализующие реологические свойства крови. Больные 1-й группы (52 чел.) нуждались в инфузионной терапии. В качестве дезинтоксикационного раствора применяли «Реамберин 1,5% для инфузий» в дозе 400 мл внутривенно капельно. В группе сравнения использовали только глюкозо-солевые растворы.
На фоне терапии реамберином отмечено снижение уровня фибриногена в группе больных, получавших реамберин (p<0,05). К 5-му дню наблюдалось снижение вязкости плазмы и вязкости крови при различных скоростях сдвига [при 20 1/с (p<0,001), при 100 1/с (p<0,05), при 200 1/с (p<0,01)] и снижение индекса агрегации эритроцитов (p<0,001) у пациентов основной группы в сравнении с пациентами, получавшими глюкозо-солевые растворы.
Применение реамберина позволило добиться более быстрой нормализации реологических характеристик крови, без дополнительного назначения других антиагрегантных препаратов, с целью реокоррекции, а так как известно, что он обладает дезинтоксикационным действием, то можно избежать назначения нескольких препаратов, уменьшив стоимость лечения.
Сравнительная оценка результатов лечения больных острыми вирусными гепатитами (А, В и С), проведенная Г. А. Гипаевой, С. А. Пашаевой, Д. Р. Ахмедовым (Дагестан), указывает на то, что реамберин нормализует антиоксидантную систему, сокращает продолжительность клинических симптомов, более быстро нормализует биохимические показатели, что приводит к сокращению сроков пребывания больных в стационаре. Никаких побочных реакций при использовании реамберина не наблюдалось.
Улучшение результатов лечения больных острым панкреатитом (ОП) остается одной из актуальных проблем неотложной абдоминальной хирургии и интенсивной терапии. Современный подход к решению этой сложной задачи характеризуется дифференцированным применением как консервативных, так и оперативных методов в зависимости от морфологической формы заболевания. Оперативные вмешательства у этой категории больных в ранние сроки от начала заболевания при асептическом течении панкреонекроза заканчиваются летально в 90% случаев. Снижение уровня летальности у лиц старше 60 лет может быть достигнуто путем совершенствования консервативной терапии, ключевыми направлениями которой, в силу возрастных особенностей патогенеза заболевания, должны считаться купирование эндогенной интоксикации (ЭИ), органной гипоксии, иммунодепрессивного и синдрома окислительного стресса, функциональных нарушений жизненно важных органов и систем.
Тяжесть состояния больных ОП и необходимость синхронного воздействия на все механизмы прогрессирования заболевания требуют одновременного применения большого количества медикаментов различных фармакологических групп, что повышает вероятность их нежелательных взаимодействий и возникновения побочных эффектов. Исследованиями А. П. Власова с соавт. (2007)5 показано существенное снижение риска развития панкреонекроза при применении реамберина. Показано, что своевременность коррекции липидного метаболизма реамберином — основа его лечебной эффективности.
Эти обстоятельства послужили поводом для применения раствора реамберина больным острым панкреатитом (Блахов Н. Ю., Минск). Оказывая антиоксидантное, антигипоксическое и дезинтоксикационное действие, препарат способствует повышению резистентности организма к гипоксии и уменьшению клинических проявлений синдрома ПОН, что определяет его перспективность в качестве компонента интенсивной терапии у больных острым панкреатитом старше 60 лет. Обследовано и пролечено 96 больных ОП пожилого и старческого возраста в 432 ГВКГ г. Минска. Согласно классификации ОП, принятой на Международном симпозиуме в г. Атланта (США), больных интерстициальным отечным панкреатитом было 65 (67,7%), некротическим панкреатитом — 31 (32,3%). Мужчин было 62 (64,6%), женщин — 34 (35,4%). Среди больных каждой из морфологических форм заболевания были выделены по 2 группы. В контрольные группы вошли 54 больных (37 — отечным панкреатитом, 17 — некротическим), получавших стандартное лечение: при отечном панкреатите — базисный комплекс в сочетании с лечебно-диагностической лапароскопией и экстракорпоральными методами. 42 больных (28 — отечным панкреатитом, 14 — некротическим), в лечении которых дополнительно применялся реамберин, составили основные группы.
Препарат назначался с 1-х суток по 400–800 мл внутривенно или внутриартериально в течение 3–8 дней, при этом дозировка, кратность и сроки использования определялись динамикой клинического состояния больного и результатов лабораторных и инструментальных методов исследования.
Применение реамберина при ОП у лиц пожилого и старческого возраста способствует нормализации функционального состояния печени, увеличению антикоагулянтной и фибринолитической активности и потенциала антиоксидантной системы. Реамберин является эффективным средством оптимизации интенсивной терапии при остром панкреатите у больных пожилого и старческого возраста. При отечном панкреатите реамберин назначают по 400 мл внутривенно 1 раз в сутки в течение 2–5 дней, при некротическом — по 400 мл внутривенно или внутриартериально 1–2 раза в сутки в течение 3–8 дней.
Критериями продолжительности терапии реамберином служат стабилизация функционального состояния печени, нормализация антикоагулянтной и фибринолитической активности, устойчивая тенденция к возрастанию антиоксидантного потенциала.
Роль реамберина в модуляции метаболического ответа и острофазовой реакции печени у больных с тяжелым сепсисом и септическим шоком изучалась А. В. Коломоец, Н. Н. Мосенцевым6 (Днепропетровск). К настоящему времени сформулирована новая, радикально меняющая взгляд на патогенез сепсиса парадигма, которая рассматривает нарушения гомеостаза как неконтролируемый каскад изменений в системах коагуляции, воспаления и фибринолиза, происходящие одновременно, как цикл автоматического наложения взаимообусловленных процессов с последующими нарушениями микроциркуляции и тканевой оксигенации, развитием метаболических расстройств, вследствие митохондриальной дисфункции. Это состояние определяется как микроциркуляторно-митохондриальный дистресссиндром.
Принимая во внимание важность воздействия на метаболический ответ и острофазовую реакцию при сепсисе, авторами предпринята попытка модуляции этих процессов с применением раствора реамберина. В контексте исследования представляет интерес прямое влияние янтарной кислоты на клеточный метаболизм и транспорт свободного кислорода в ткани, нормализация аэробной фазы тканевого дыхания, восстановление функции печени и синтеза ею белков. В основу рабочей гипотезы положено предположение, что экзогенное пополнение пула интермедиатов цикла трикарбоновых кислот, в частности янтарной кислоты, оказывает каталитическое действие на метаболизм субстратов в цикле Кребса, приводя к нормализации аэробной фазы тканевого дыхания, способствуя устранению митохондриальной дисфункции в тканях, особенно в печени, с восстановлением синтеза положительных белков острой фазы (альбумина, трансферина, протеинов С и S, и других). Работа выполнена в клинике анестезиологии и интенсивной терапии Днепропетровской государственной медицинской академии (директор клиники — член-корр. АМН Украины, проф. Л. В. Новицкая-Усенко), на базе специализированного отделения интенсивной терапии сепсиса (ОИТС) Днепропетровской областной клинической больницы им. И. И. Мечникова.
Существенные различия выявлены между группами сравнения в частотах развития органных нарушений после завершения лечения (рис. 5).
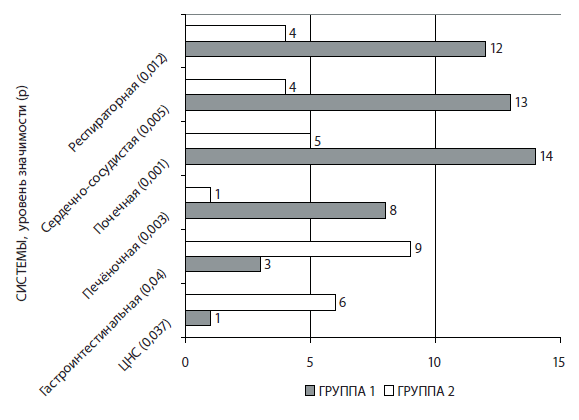
Рис. 5. Частота развития органных нарушений
Оценка результатов лечения по конечным пунктам выявила достоверные различия, связанные с проведенным видом терапии (рис. 6). Длительность лечения в ОИТС и летальность после завершения лечения отличались, но не были достоверными, тогда как выявленные различия в частоте персистирующих органных нарушений до 28-го дня болезни были определяющими для выживаемости пациентов до 28-го дня, восстановления качества жизни до 35-го дня заболевания.
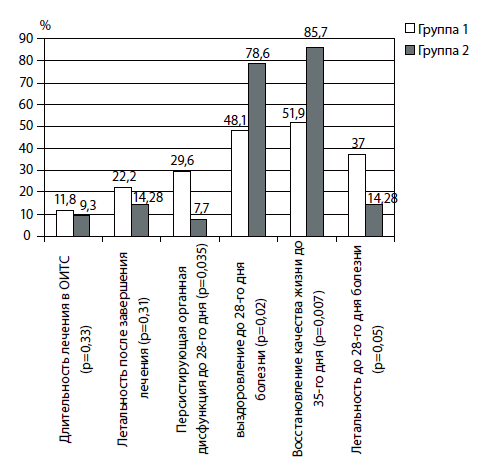
Рис. 6. Оценка результатов лечения с применением реамберина по конечным точкам
Степень метаболического стресса значительно выражена у больных 1-й группы, но под влиянием терапии реамберином метаболический стресс определялся как умеренный (КИ<5 ед) уже на 2-е сутки лечения. Лактатпируватный индекс более быстро нормализовался у больных во 2-й группе и уже на 3-и сутки был меньше 10,0 ед. Повышенная концентрация лактата сохранялась значительно дольше у больных 1-й группы, ведь избыток лактата у больных сепсисом объясняется замедлением его печеночного клиренса.
О нарушении митохондриального статуса свидетельствует увеличение соотношения ацетата к гидроксибутирату более 0,4, что наблюдается при повышении концентрации последнего выше 0,07 мкмоль/л, указывая на наличие митохондриальной дисфункции, а в сочетании с микроциркуляторными нарушениями — микроциркуляторно-митохондриального дистресс-синдрома (ММДС). Под влиянием реамберина восстановление митохондриальной функции наблюдалось более отчетливо и быстро. Одновременно с устранением митохондриальной дисфункции у больных в группе реамберина наблюдалось существенное увеличение концентрации мочевой кислоты в сыворотке крови — конечного продукта деградации адениловых нуклеотидов, что свидетельствует об увеличении общего пула макроэргических соединений в результате их интенсивного синтеза в процессе аэробного дыхания.
Применение реамберина больным с тяжелым сепсисом и септическим шоком оказывает модулирующее влияние на метаболизм, сопровождается катализацией аэробного дыхания с пополнением общего пула макроэргических соединений, восстановлением цитоплазматического и митохондриального редокси-статуса, устранением митохондриальной дисфункции и ограничением гиперметаболического ответа на воспаление.
Медикаментозную профилактику нарушений гомеостаза при хроническом калькулезном холецистите путем применения препарата «Реамберин 1,5% раствор» больным с сопутствующей сердечнососудистой патологией в раннем послеоперационном периоде проводили А. Г. Буткеева, С. И. Чистяков.
Объектом клинического исследования явились 22 больных хроническим калькулезным холециститом с сопутствующей сердечно-сосудистой патологией, в возрасте 65±8 лет. Сопутствующая патология представлена ишемической болезнью сердца с недостаточностью кровообращения I–IIA и артериальной гипертензией различного генеза (3 человека); ИБС с недостаточностью кровообращения IIБ и артериальной гипертензией различного генеза (4 человека); гипертонической болезнью с нарушениями сердечного ритма в виде мерцательной аритмии (2 человека), частой желудочковой экстрасистолии (3 человека); гипертонической болезнью — (10 человек).
Первая группа больных получала инфузии Sol. Ringeri (5–7 мл/кг внутривенно).
Пациентам второй группы вводился раствор реамберина в дозе 5–7 мл/кг внутривенно капельно.
У больных, получавших реамберин, более чем в 1,5 раза сокращалось время восстановления адекватного дыхания после тотальной внутривенной анестезии. У данной группы пациентов практически не отмечалось постнаркозных нарушений дыхания в виде кратковременных периодов апноэ, брадипноэ и неэффективного поверхностного дыхания, сопровождающихся выраженным снижением сатурации кислорода.
Инфузии реамберина (в дозе 5 мл/кг) в раннем послеоперационном периоде после лапароскопической холецистэктомии приводят к нормализации основных клинико-биохимических показателей крови у больных с сопутствующей сердечно-сосудистой патологией. Реамберин в раннем послеоперационном периоде, после лапароскопической холецистэктомии (в дозе 5 мл/кг) приводит к быстрой и стойкой стабилизации артериального давления, сердечного выброса и сатурации кислорода у больных с сопутствующей сердечно-сосудистой патологией. Введение реамберина значительно сокращает время восстановления адекватного дыхания и сознания после общей анестезии, что особенно важно при оказании хирургической помощи большому числу пострадавших при возникновении чрезвычайных ситуаций в мирное время.
Ярким признаком, характеризующим современную ситуацию во фтизиатрии, можно считать рост заболеваемости, появление остро прогрессирующих форм туберкулеза (ОПФТ), учащение случаев лекарственно-устойчивого (ЛУ) и множественно лекарственноустойчивого (МЛУ) туберкулеза у больных с хроническими туберкулезными процессами и с впервые выявленными туберкулезными процессами. Вышеперечисленные формы туберкулеза протекают на фоне выраженной интоксикации, иммунодефицита, синдрома дыхательных расстройств. При нормальном обеспечении организма кислородом питательные вещества проходят метаболические превращения, в ходе которых образуется энергия, необходимая для работы функциональных систем организма, реакции замыкаются на цикле Кребса или аэробном гликолизе. При гипоксии, сопровождающей туберкулезный процесс, скорость аэробного гликолиза и окислительного фосфорилирования существенно снижается, вызывая целый ряд метаболических нарушений в организме, что приводит к расстройству обмена веществ в митохондриях.
Таким образом, борьба с гипоксией и интоксикацией занимает одно из первых мест в лечении тяжелых форм туберкулеза. Вторым, не менее важным моментом является коррекция осложнений химиотерапии.
Для коррекции развивающихся побочных эффектов химиотерапии реамберин использовался О. В. Трибунской7 у пациентов с туберкулезом: из них: 42 человека (35%) — впервые выявленные пациенты (группа А) и 78 человек (65%) — пациенты с хроническими формами туберкулеза (группа В). В группе А у 21 пациента (50%) удалось обойтись без коррекции схемы химиотерапии, у 10 пациентов (24%) был отменен один противотуберкулезный препарат, у 9 пациентов (21%) — 2–3 противотуберкулезных препарата, у 2 пациентов (5%) потребовалось временное прекращение химиотерапии. В группе В у 28 пациентов (36%) удалось обойтись без коррекции схемы химиотерапии, у 9 пациентов (11,5%) был отменен один противотуберкулезный препарат, у 32 пациентов (41%) — 2–3 противотуберкулезных препарата, у 9 пациентов (11,5%) потребовалось временное прекращение химиотерапии.
Анализ применения реамберина для коррекции состояний, обусловленных наличием у пациентов сопутствующей патологии, проводился на всей группе пациентов (192 человека). Сопутствующая патология представлена хроническим холецистопанкреатитом (58%), сахарным диабетом 1-го типа (11%) и 2-го типа (7%), хроническим алкоголизмом (9%), язвенной болезнью желудка (10%), гипертонической болезнью (3%), хроническим бронхитом (5%) и пиелонефритом (4%). Применение реамберина в 100% случаев приводило к улучшению самочувствия больных, исчезновению или уменьшению жалоб. В 82% случаев отмечалась положительная динамика лабораторных показателей уже на фоне 1–2 инфузий препарата.
Современные особенности течения туберкулезного процесса диктуют необходимость использования в схеме фармакотерапии новых средств патогенетической терапии, одним из которых является раствор реамберина. Применение его на ранних сроках химиотерапии позволяет купировать проявления «бактериального криза» и сохранить полный объем противотуберкулезной терапии. Применение реамберина для коррекции побочных эффектов химиотерапии у впервые выявленных пациентов в 50% случаев позволяет обойтись без отмены противотуберкулезных препаратов, что значительно снижает риск развития лекарственно-устойчивого туберкулеза. Применение реамберина для коррекции побочных эффектов химиотерапии у пациентов с хроническими формами туберкулеза позволяет сохранить полный или частично уменьшенный объем противотуберкулезной терапии, что для данной категории больных всегда является весьма проблематичным (в силу наличия выраженных изменений со стороны многих органов и систем). Применение реамберина для коррекции состояний, обусловленных наличием сопутствующей патологии у больных с различными формами туберкулеза, позволяет добиться улучшения качества жизни пациентов и, в значительном проценте случаев, улучшения показателей лабораторного исследования. Применение реамберина позволяет строго соблюдать основные принципы химиотерапии, сформулированные А. Е. Рабухиным: «раннее начало, комбинированность, непрерывность, регулярность, контролируемость, своевременная коррекция побочных эффектов».
О. В. Тихомировой, О. И. Нырковой, Л. В. Говоровой8, а также Е. В. Михайловой, Т. К. Чудаковой9 изучены особенности метаболических сдвигов и разработаны клинико-лабораторные критерии диагностики интоксикационного синдрома при бактериальной дизентерии у детей. Проведено комплексное клинико-лабораторное обследование 142 детей в возрасте от 1-го года до 14 лет с тяжелой и среднетяжелой формами шигеллеза.
Детям в комплексную терапию острого периода дизентерии включен инфузионный раствор реамберина 1,5%. Препарат назначали с первых дней стационарного лечения из расчета 10 мл/кг массы тела в сутки, в течение 2–3 дней. Группу сравнения составили 44 ребенка, получавшие глюкозо-солевые растворы.
Применение реамберина (рис. 7) сокращает длительность интоксикации [вялость (2,8±0,3 против 4,1±0,4, p<0,05); анорексия (2,5±0,4 против 4,3±0,5), купирует лихорадочный период (1,8±0,3 против 2,2±0,4 дня), тахикардию (2,1±0,3 и 2,8±0,4 дня) и гемоколит (1,7±0,3 против 2,3±0,2 дня)]. Наибольший клинический эффект препарата наблюдался у больных с тяжелыми формами инфекции и высокими показателями эндотоксемии (рис. 8). Так, в группе детей (с уровнем ВНСММ более 20 УЕ) установлена отчетливая тенденция к сокращению лихорадочного периода в стационаре до 2,4±0,3 дня (против 3,1±0,4 дня в группе сравнения), периода вялости (2,5±0,4 против 3,6±0,5 дня), анорексии и тахикардии (2,7±0,4 и 2,0±0,3 дня против 4,0±0,6 и 2,8±0,4 дня соответственно).
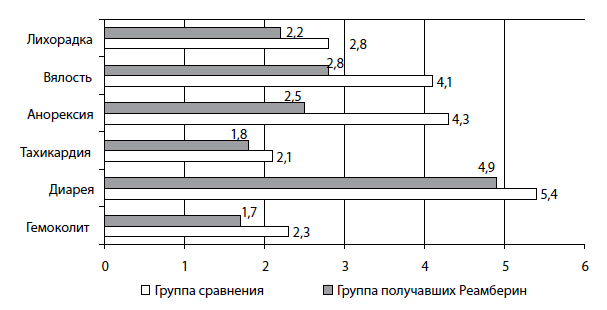
Рис. 7. Длительность клинических проявлений дизентерии у детей
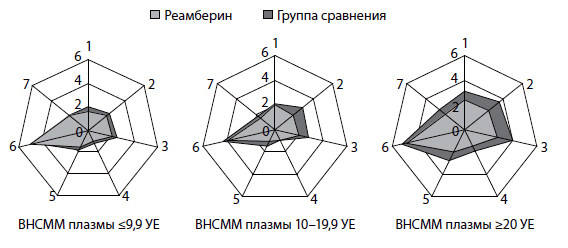
Рис. 8. Длительность клинических проявлений дизентерии в зависимости от уровня ВНСММ плазмы и варианта инфузионной терапии
Обозначения: 1. Лихорадка. 2. Вялость. 3. Анорексия. 4. Головная боль. 5. Тахикардия. 6. Диарея. 7. Гемоколит
Параллельное изучение лабораторных маркеров эндотоксикоза позволило установить, что при использовании реамберина параметры ВНСММ плазмы и индекса распределения приближались к значениям здоровых детей уже к 3-му дню стационарного лечения, тогда как в группе сравнения в эти сроки изучаемые показатели превышали нормальные значения в 1,5 раза. Аналогичные изменения отмечались в динамике ЛИИ (снижение у больных, получавших реамберин). Отчетливого влияния дезинтоксикационной терапии на содержание сывороточного альбумина не выявлено. Только к 7-му дню терапии, уровень альбумина у больных, получавших реамберин, был сопоставим со значениями здоровых детей (52,7±4,5 г/л, p>0,05).
Антиоксидантное действие реамберина обеспечивало снижение интенсивности оксидативных процессов в острый период дизентерии у больных с высокой активацией СРО уже к 3–5-му дню стационарного лечения (рис. 9).
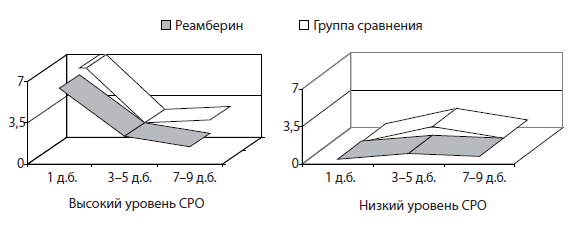
Рис. 9. Динамика показателей ХЛ плазмы у больных
Объективными лабораторными маркерами интоксикационного синдрома являются показатели веществ низкой и средней молекулярной массы плазмы, индекс распределения и концентрация сывороточного альбумина, отражающие степень эндотоксемии в острый период заболевания и обусловливающие тяжесть инфекционного процесса. Использование в комплексной терапии среднетяжелых и тяжелых форм дизентерии инфузионного раствора реамберина способствует сокращению продолжительности основных клинических проявлений заболевания, нормализуя уровень эндогенной интоксикации и свободнорадикального окисления.
Изучена (Горячева Л. Г. с соавт.10) клиническая эффективность препарата «Реамберин 1,5% для инфузий» у детей, больных желтушным вариантом острого вирусного гепатита. Под наблюдением находились пациенты с желтушным вариантом острого вирусного гепатита различной этиологии.
Показана эффективность препарата «Реамберин 1,5%» в качестве дезинтоксикационного средства у детей, больных вирусным гепатитом, протекающим с нарушением пигментного обмена. При его применении наблюдалось уменьшение длительности симптомов интоксикации, по сравнению с контрольной группой, сокращался период пребывания детей в стационаре на 3,5 койко-дня. Инфузионная среда «Раствор реамберина 1,5%», в качестве дезинтоксикационного средства рекомендована для лечения больных острыми вирусными гепатитами, независимо от этиологии заболевания, с выраженными признаками интоксикации.
Общепризнанным универсальным неспецифическим патогенетическим звеном в развитии атопического дерматита является усиление перекисного окисления липидов (ПОЛ) мембран, в результате чего нарушается их структурная целостность, повышается проницаемость и изменяется функциональное состояние. Активация ПОЛ ведет к нарушению центральных механизмов регуляторных систем, развитию метаболического ацидоза, гипоксии, что является одной из причин, вызывающих воспалительный процесс кожных покровов, на этом фоне снижается антиоксидантная защита.
Применение известных антиоксидантов как прямого, так и не прямого действия у больных атопическим дерматитом ограничено вследствие нарушения всасывания в кишечнике, возникновения аллергических реакций как на сами препараты, так и на их метаболиты, плохой проницаемости большинства из них через биологические мембраны.
Под наблюдением О. Д. Куликовой11 находилось 59 детей с атопическим дерматитом в возрасте от 10 до 15 лет. Тяжесть течения заболевания оценивалась по индексу SCORAD. Давность заболевания составляла от 9 до 14 лет. Субъективно всех детей беспокоил интенсивный зуд, особенно в ночное время (даже при легком течении заболевания).
Реамберин вводился внутривенно, капельно из расчета 10 мг/кг массы. Курс лечения состоял из 5 инфузий. Общая курсовая доза препарата составила 32–60 мг/кг массы.
После лечения реамберином клиническая ремиссия наблюдалась у 25,4% детей, значительное улучшение — у 49,2% и улучшение — у 23,7% пациентов. Не выявлено положительной динамики у 1 больного с тяжелым течением (1,7%).
По соотношению значений малонового диальдегида и показателей общей антиокислительной активности рассчитывали индекс пероксидации (ИП), а по соотношению продуктов ПОЛ и уровней церулоплазмина и токоферола высчитывали интегральный показатель соотношения ПОЛ/АОА, коэффициент «К».
До начала терапии реамберином у всех больных выявлено повышение уровня токоферола по сравнению с контролем, причем максимально высоким этот показатель был у детей с легкой и средней тяжестью течения заболевания, превышая контрольные значения в 2 раза, тогда как у больных с тяжелым течением этот показатель был увеличен в 1,7 раза. Общая антиокислительная активность сыворотки у больных с легким течением заболевания была выше контрольных значений в 1,3 раза, а при средней степени тяжести и тяжелом течении — в 1,2 и 1,4 раза соответственно. Индекс пероксидации до начала лечения превышал таковой в контрольной группе в 1,8, 2,4 и 2,1 раза.
Таким образом, при атопическом дерматите у детей усилены процессы перекисного окисления липидов на фоне увеличения показателей антиоксидантной системы.
В группе больных с тяжелым течением заболевания констатировали клиническую ремиссию у 4 больных, значительное улучшение — у 19 больных, улучшение у 8 пациентов. Надо отметить, что практически у всех пациентов после первой инфузии значительно уменьшился зуд, побледнела эритема, а после четвертой инфузии уменьшилась инфильтрация и лихенизация. К окончанию курса терапии документировано улучшение цвета кожи, уменьшение сухости и отсутствие шелушения.
Во второй группе больных, со средней тяжестью течения заболевания, констатировали клиническую ремиссию у 5 детей, значительное улучшение у 7 пациентов и улучшение у 7 детей. В этой группе, как и в предыдущей, после первой инфузии реамберина значительно уменьшился или полностью прекратился зуд, после окончания лечения практически все очаги инфильтрации и лихенизации разрешались.
Среди больных с легким течением клиническая ремиссия наступила у 6, значительное улучшение у 3 детей.
Следует отметить, что после первой и второй инфузии у всех пациентов улучшалось общее состояние, повышалось настроение, нормализовался сон и аппетит.
Изучены показатели перекисного окисления липидов (ПОЛ) и антиоксидантной системы (АОС) сыворотки до и после лечения. После проведения курса лечения реамберином наблюдали достоверное снижение уровня токоферола у больных с легким течением в 1,7 раза, у больных со средней степенью тяжести в 1,8 раза, а при тяжелом течении снижение этого показателя было недостоверным.
Показатели общей антиокислительной активности после проведенной терапии имели четкую тенденцию к повышению (в среднем в 1,5 раза). Индекс пероксидации после лечения, напротив, уменьшился в 1,5 раза при легком течении, в группе больных со средней степенью тяжести в 1,6 раза, при тяжелом течении в 1,2 раза.
Анализируя динамику лабораторных показателей и клиническую эффективность, патогенетически обоснованным является использование реамберина в терапии атопического дерматита. В процессе проводимой терапии не отмечено побочных реакций и осложнений, все больные хорошо переносили лечение. Реамберин способствует смягчению течения заболевания, удлиняя при этом сроки ремиссии, нормализуя антиоксидантную защиту организма.
С. О. Рогаткиным12 (с соавт.) проведено изучение клинической эффективности препарата реамберин для профилактики и терапии постгипоксических поражений ЦНС у новорожденных детей и установлены оптимальные сроки его назначения. Под наблюдением находились 89 недоношенных новорожденных, родившихся в тяжелом состоянии, нуждавшихся в проведении интенсивной терапии после оказания первичной реанимационной помощи. Дети первой группы получали терапию реамберином, которая была начата в первые 12 часов жизни; а дети 2-й группы (22 ребенка) начали получать лечение препаратом от 24–48 часов жизни; остальные дети составили группу контроля. Резюмируя результаты исследования, авторы приходят к выводу, что у препарата четко проявляется церебропротекторный эффект. В группе детей с ранним началом терапии отмечено достоверное сокращение сроков пребывания на ИВЛ и более низкие уровни сывороточных концентраций нейроспецифических антигенов. Применение инфузионных растворов на основе сукцината натрия снижает частоту и тяжесть гипоксически-ишемических поражений головного мозга у недоношенных новорожденных.
Раннее назначение (через 2–12 часов после рождения) раствора реамберина оказывает достоверно более выраженный церебропротекторный эффект по сравнению с его отсроченным назначением (24–48 часов) у недоношенных детей, перенесших перинатальную гипоксию. Системное антигипоксическое и антиоксидантное действие реамберина позволяет сократить продолжительность ИВЛ и снизить частоту осложнений, связанных с ее проведением. Применение реамберина снижает частоту возникновения перивентрикулярных лейкомаляций у недоношенных новорожденных, нуждающихся в проведении ИВЛ и интенсивной терапии.
В. В. Лазаревым, В. А. Михельсоном, А. У. Лекмановым13, 14 изучена эффективность применения реамберина у детей с целью устранения постнаркозной депрессии и активации (ускорения) периода восстановления адекватного спонтанного дыхания после искусственной вентиляции легких.
В исследование включались дети всех возрастных категорий до 14 лет. Они были распределены на две группы. В первую группу (основную) вошли 32 ребенка, которым на этапе окончания анестезии внутривенно вводился реамберин 1,5% раствор для активизации вывода ребенка из наркоза за 10 минут до окончания оперативного вмешательства (дважды с интервалом в 10 минут) в дозе 2 мл/кг веса ребенка. Второй группе (37 детей) препарат не вводился. В обеих группах в анестезиологическом пособии использовалась общая анестезия препаратами атаралгезии (реланиум, фентанил), ГОМК, а также ингаляция закиси азота в газовой смеси при искусственной вентиляции легких.
После введения реамберина у детей 1-й группы отмечалось сокращение времени, необходимого для восстановления адекватного спонтанного дыхания, последующей успешной экстубации и восстановления сознания. Клинически это проявлялось в увеличении глубины и частоты дыхания, что свидетельствовало о повышении минутной вентиляции легких и, соответственно, внешнего газообмена. Активнее восстанавливался мышечный тонус, о чем можно было судить по времени появления активных движений конечностей, сокращения мимической мускулатуры, открывания глаз на фоне постоянной звуковой стимуляции (громкий разговор анестезиолога с пациентом) у детей старшего возраста. Данные по исследованию кислотно-основного состояния крови и напряжения газов в крови свидетельствовали о положительном влиянии реамберина. Так, на 10-й минуте после повторного введения препарата в основной группе отмечалось стойкое повышение напряжения кислорода в крови, а также стабильные в пределах нормальных величины СО2, что свидетельствовало об адекватности спонтанного дыхания.
Использование реамберина 1,5% раствора для инфузий эффективно у детей в анестезиологическом обеспечении для устранения постнаркозной депрессии, что, несомненно, имеет большую актуальность в повседневной практической деятельности. Препарат оказывает положительное действие в устранении побочного влияния нейролептиков и наркотических анальгетиков.
Ранняя активация сознания, устранение последействия наркотических анальгетиков и нейролептиков на фоне программируемого регулирования энергетики тканей головного мозга, восстановления баланса между прооксидантными и антиоксидантными системами в условиях возможной послеоперационной гипоксии является, несомненно, важным компонентом в профилактике периоперационных поражений центральной нервной системы.
Использовать реамберин для устранения постнаркозной депрессии у детей следует согласно схеме: двукратная медленная инфузия препарата в течение 2 минут внутривенно в дозе 2 мл/кг с интервалом в 10 минут после первого введения, которое выполняется за 10 минут до окончания оперативного вмешательства.
Реамберин может быть использован при критических состояниях у детей в качестве эффективного антигипоксического и дезинтоксикационного средства, поскольку в лечении таких пациентов помимо эффективной респираторной и инфузионной поддержки все большее место занимает метаболическая коррекция, направленная на воздействие непосредственно на клетки с помощью субстратных антигипоксантов. Число детей с критическими состояниями не уменьшается, сохраняется высокая летальность, а у значительной части выживших детей перенесенное гипоксическое состояние вызывает тяжелые неврологические нарушения.
Реамберин был применен (Лазарев В. В., Михельсон В. А., Лекманов А. У.) при угрозе развития (или уже развившемся) критического состояния у 30 детей (от 1 года до 14 лет), в связи с тяжелой ожоговой травмой (более 30% поверхности тела), сочетанной травмой и черепно-мозговой травмой (без признаков отека головного мозга), при септических состояниях и энцефалопатиях, связанных с токсикозами.
У детей выявлены различные виды нарушения сознания, от сопора до развития коматозного состояния различной степени. Более, половине больных при назначении реамберина проводилась искусственная вентиляция легких. Инфузию реамберина начинали в течение 1–З суток с момента начала заболевания в суточной дозе 10 мл/кг веса со скоростью 3–4 мл/мин, но не более 400 мл. Как правило, суточную дозу разделяли на 2 приема в течение суток. Курс применения препарата составлял 5 суток.
Использование реамберина оказывало положительное влияние на течение заболевания (улучшение сознания у 80% детей с тяжелой ожоговой и сочетанной травмой). Процессы активации сознания и выхода из коматозного (или сопорозного) состояния были более быстрыми, чем при ретроспективной оценке у подобных больных, ранее находившихся в отделении и не получавших реамберин.
В группе детей с тяжелой черепно-мозговой травмой, не сопровождающейся отеком головного мозга, положительный эффект выявлен у половины больных. Благоприятное влияние препарата заключалось в быстрой динамике активации сознания. Отсутствие положительного эффекта у части больных связано с поражением ствола и подкорковых структур головного мозга.
Введение реамберина сопровождалось умеренным диуретическим эффектом, после инфузии препарата усиливался темп диуреза, соответственно чему усиливался и дезинтоксикационный эффект. Авторами не зафиксировано токсического воздействия препарата на систему кровообращения и дыхания. Аллергические реакции, связанные с инфузией препарата, не наблюдались.
Синдром эндотоксикоза при острых инфекционных деструкциях легких
У больных острыми инфекционными деструкциями легких наблюдаются, выраженные в различной степени, все виды гипоксии (респираторная, гемическая, гемодинамическая), приводящие к тканевой гипоксии с непосредственным повреждением клеточных структур и активацией процессов перекисного окисления липидов. Пероксидация приводит к повреждению клеточных мембран, усиливая энергетическое голодание клеток и тканевую гипоксию, а сочетание токсемии, гипоксии и патологической активации свободнорадикальных процессов определяет тяжесть течения и исход инфекционно-воспалительного эндотоксикоза. Е.Е. Фуфаевым15, 16 с целью повышения эффективности лечения больных острыми инфекционными деструкциями легких (в острой фазе гнойно-деструктивного процесса) применен сукцинатсодержащий раствор для инфузий — 1,5% реамберина.
Под его наблюдением находилось 87 больных острыми инфекционными деструкциями легких (клиника госпитальной хирургии ВМедА). Из числа обследованных пациентов у 51 был диагностирован острый абсцесс легкого, у 27 — гангренозный абсцесс, у 9 — распространенная гангрена легкого. Преобладали (67,3%) больные наиболее трудоспособного возраста — от 20 до 49 лет. Среди них — мужчины (80,4%), женщины составляли 19,6% от общего числа наблюдавшихся больных. Состояние большинства пациентов до начала интенсивного лечения было среднетяжелым и тяжелым, составив по шкале АРАСНЕ II 13,7±0,3 балла.
Фаза острого легочного нагноения сопровождается выраженной патологической активацией процессов свободнорадикального окисления (установлено на основании результатов исследования клиниколабораторных данных наблюдаемых больных). Активность ПОЛ превышала норму в 1,5–2 раза. Максимальные значения люминесценции крови и образования МДА отмечались у больных гангренозными формами легочного нагноения, что обусловлено выраженным эндотоксикозом (в результате наличия высоковирулентной и инвазивной патогенной микрофлоры) и сниженной способностью организма обеспечить эффективное отграничение гнойно-деструктивного процесса. Пиковые значения активации ПОЛ имели место не столько в начальном периоде эндотоксикоза, сколько в начале интенсивного лечения и восстановления кровотока в ишемизированных зонах за счет снятия блока микроциркуляции.
Автором выделена группа больных острыми инфекционными деструкциями легких, для которых характерно патологическое повышение генерации АФК и активизации процессов ПОЛ на фоне угнетения антиоксидантной системы. Это, прежде всего, больные гангренозными формами легочных нагноений с выраженным эндотоксикозом и СВР. Этим пациентам необходимо усиливать антиоксидантную защиту путем применения лекарственных средств из группы сукцинатсодержащих энерготропных препаратов. Более того, оказалось, что определяемый уровень активности генерации АФК отражает тяжесть эндотоксикоза и заболевания в целом и может служить критерием оценки характера течения гнойно-деструктивного процесса в легких, а также показателем эффективности проводимого лечения.
У 33 больных острыми инфекционными деструкциями легких в составе комплексной терапии применяли сукцинатсодержащий антиоксидант/антигипоксант «Реамберин для инфузий 1,5%». У пациентов отмечалось снижение уровня АФК крови, о чем свидетельствовало уменьшение люминесценции крови, по сравнению с таковой больных контрольной группы, уже на 3-и сутки лечения (Imax (к) = 4,7±0,12 мВ, Imax (о) = 3,6±0,13 мВ, р<0,01). Регистрировалось повышение активности антиоксидантной системы (АОС(к) = 7,25±0,2 отн. ед., АОС(о) = 8,24±0,2 отн. ед., р<0,05). На фоне применения реамберина наблюдалась активизация метаболических процессов в тканях, о чем свидетельствует повышение разницы напряжения кислорода в артериальной и венозной крови в процессе лечения у больных наблюдаемых групп, указывая на повышение экстракции кислорода в зонах тканевого массообмена. Наиболее значимый лечебный эффект отмечен у больных с тяжелыми формами ОИДЛ, при которых наблюдаются выраженные нарушения свободнорадикального окисления (рис. 10).
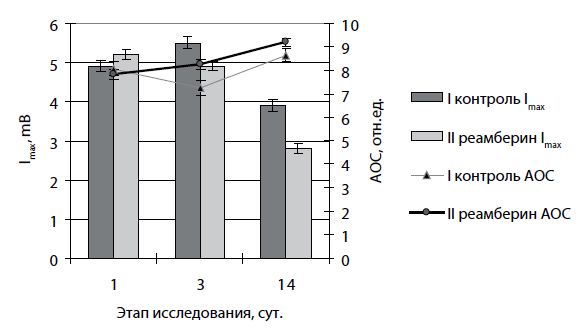
Рис. 10. Динамика хемилюминесценции (Imax) и антиоксидантной активности (АОС) венозной крови у больных гангренозными формами нагноения I (контрольной) и II (реамберин) групп
Учитывая «дренирующий» эффект экстракорпоральных детоксицирующих операций, вызывающих «синдром реперфузии» (с повышенной генерацией АФК), а также неселективную элиминацию и разрушение факторов антиоксидантной защиты крови (в период проведения предперфузионной подготовки), в базовую терапию пациентам вводился реамберин, обеспечивающий быстрое восстановление антиоксидантной активности и благоприятное течение постперфузионного периода.
У пациентов, получавших антиоксидантную терапию, улучшались общие результаты лечения, уменьшалось количество переходов заболевания в хроническую форму, чаще наступало полное и клиническое выздоровление (рис. 11) с сокращением сроков лечения. Так, средняя продолжительность лечения больных контрольной группы составила 38,1±1,8 суток, а пациентов, получавших реамберин, 33,4±1,2 суток, указывая на высокую эффективность реамберина в лечении больных острыми инфекционными деструкциями легких.
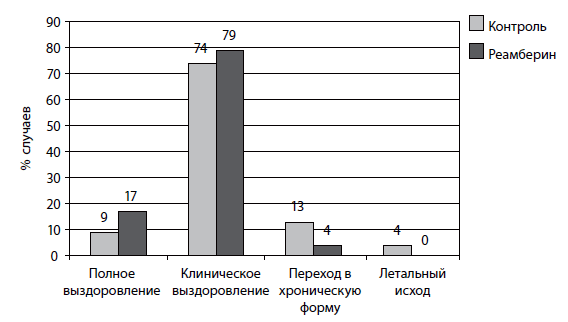
Рис. 11. Распределение больных в зависимости от исхода заболевания
Активизация процессов перекисного окисления липидов и угнетение факторов антиоксидантной защиты тесно кореллирует с прогрессированием гнойно-деструктивного процесса в легких и эндотоксикозом. Включение в программу комплексного лечения острых инфекционных деструкций легких сукцинатсодержащего корректора «Реамберин» (меглумина натрия сукцинат) обеспечивает эффективное устранение нарушений процессов свободнорадикального окисления, ускоряет время купирования эндотоксикоза, уменьшает частоту перехода заболевания в хроническую форму и сокращает сроки стационарного лечения.
У онкологических больных с выраженными явлениями интоксикации при наличии механической желтухи, при опухолях гепатобиллиарной системы, перитонитах, при диффузных поражениях печени, а также при наличии метастатических процессов показано применение реамберина в качестве дезинтоксикационного средства. Раствор реамберина также показан онкологическим больным при гипоксических состояниях миокарда, истощенным пациентам, а также целесообразно его применение для снятия явлений интоксикации при лучевой и полихимиотерапии.
Совокупность проведенных исследований, выполненных под руководством профессора В. Н. Анисимова (НИИ онкологии МЗ РФ), позволяет предполагать, что соль янтарной кислоты, используемая в реамберине, может быть эффективным противоопухолевым средством, поскольку при введении препарата экспериментальным животным наблюдается уменьшение частоты спонтанных опухолей, увеличение максимальной продолжительности жизни, снижение частоты развития новообразований.
Одной из причин отчетливо тормозящего действия возникновения опухолей у мышей может быть нормализующее влияние на энергетику митохондрий, пораженных патологическим процессом.
Существенную роль играет нормализующее действие сукцината на энергообеспечение центров нейроэндокринной системы (ЯК способна снижать порог чувствительности гипоталамо-гипофизарной системы к гомеостатическим сигналам). Ряд факторов свидетельствует и в пользу того, что возрастное повышение порога чувствительности гипоталамуса к гомеостатическим стимулам лежит в основе нейроэндокринной программы развития старения и формирования возрастной патологии, включая возникновение опухолей. В пользу этого предположения свидетельствуют данные В. Н. Анисимова об аналогичном действии ЯК на продолжительность жизни и частоту спонтанных опухолей под влиянием фенформина и дефенина, также обладающих свойством снижать порог чувствительности гипоталамуса к действию эстрогенов.
1 Кожока Т. Г. Лекарственные средства в фармакотерапии патологии клетки. М., 2007..
2 Моргунов С. С. Коррекция реамберином тканевой гипоксии у хирургических больных с гастродуоденальным кровотечением // Вестник интенсивной терапии. 2006. № 3.
3 Сединкин В. А., Клигуненко Е. Н. Реамберин в интенсивной терапии диабетического кетоацидоза // Вестник интенсивной терапии. 2006. № 2.
4 Сарвилина И. В. Разработка индивидуальных режимов дозирования реамберина // Вестник СПбГМА им. И. И. Мечникова. 2006. № 1.
5 Воасов А. П. с соавт. О влиянии антиаксидантов на течение экспериментального панкреатита // Экспериментальная и клиническая фармакология. 2007. № 3.
6 Коломоец А. В., Мосенцев Н. Н. Роль реамберина в модуляции метаболического ответа у больных сепсисом // Вестник СПбГМА им. И. И. Мечникова. 2006. №1.
7 Трибунская О. В. Антигипоксант в практике противотуберкулезного стационара // Вестник СПбГМа им. И. И. Мечникова. 2006. № 1.
8 Ныркова О. И., Тихомирова О. В., Говорова Л. В. Состояние свободнорадикальных процессов в острый период бактериальной дизентерии у детей и подходы к патогенетической терапии // Вестник СПбГМА им. И. И. Мечникова. 2005. № 4.
9 Михайлова Е. В.,Чудакова Т. К. Патогенетическая инфузионная терапия острых кишечных инфекций у детей // Вестник СПбГМА им. И. И. Мечникова. 2006. № 4.
10 Горячева Л. Г. с соавт. Терапия вирусных гепатитов с использованием препаратов различного механизма действия // Вестник СПбГМА им. И. И. Мечникова. 2005. № 4.
11 Куликова О. Д. с соавт. Эффективность реамберина в терапии атопического дерматита у детей // Вестник СПбГМа им. И. И. Мечникова. 2005. № 3.
12 Рогаткин С. О., Людковская Е. В., Володин Н. Н. Лечение детей, перенесших перинатальную гипоксию в периоде ранней неонатальной адаптации // Вопросы акушерства, гинекологии и перинатологии. 2005. № 3.
13 Первый опыт применения реамберина в анестезиологическом пособии новорожденных // Детская хирургия. 2003. № 6.
14 Влияние реамберина на антиоксидантную активность плазмы крови в постнаркозном периоде у детей // Вестник интенсивной терапии. 2004. № 4.
15 Фуфаев Е. Е., Бельских А. Н., Тулупов А. Н. Коррекция реамберином свободнорадикального окисления при деструкциях легких // Вестник интенсивной терапии. 2007. № 1.
16 Фуфаев Е. Е., Тулупов А. Н. Реамберин в комплексном лечении острых инфекционных деструкций легких // Вестник СПбГМА им. И. И. Мечникова. 2005. № 1.
Список основных работ по э ффективности применения реамберина в клинической практике
- Яковлев А. Ю. Коррекция метаболизма больных перитонитом — к вопросу о средствах и тактике применения антигипоксантов // Вестник интенсивной терапии, 2007, № 1.
- Исаков В. А. с соавт. Патогенез и терапия серозных менингитов // Вестник Новгородского государственного университета: серия «Медицинские науки»-2006. № 35.
- Фуфаев Е. Е. Коррекция свободнорадикального окисления у больных острыми инфекционными деструкциями легких сукцинатсодержащими средствами. Автореф. дис. … к. м. н. СПб. 2006.
- Беляевский А. Д., Исаян Л. А. О целесообразности использования реамберина и цитофлавина в интенсивной терапии ожоговой болезни // Вестник интенсивной терапии. 2006. № 5.
- Власов А. П. с соавт. Гепатопротекторное действие реамберина при остром панкреатите // Журнал хирургической гепатологии. 2006. № 3.
- Дегтярева Е. А. с соавт. Парентеральные метаболические препараты в комплексной терапии сердечной недостаточности при инфекционных и постгипоксических повреждениях миокарда у детей раннего возраста // Современные технологии в педиатрии и детской хирургии. Материалы конгресса. М., 24–26 октября 2006.
- Галенко-Ярошевский В. П. с соавт. Протекторное действие реамберина на функциональную активность митохондрий в условиях ишемии кожи // Бюллетень экспериментальной биологии и медицины. 2005. № 10.
- Яковлев А. Ю. Реамберин в коррекции гиперкатаболизма и эндотоксикоза // Врач. 2005. № 6.
- Гаин Ю. М. с соавт. Реамберин в комплексном лечении больных с тяжелой интраабдоминальной инфекцией // Медицинские новости. 2005. № 6.
- Ливанов Г. А. с соавт. Пути коррекции гипоксических поражений головного мозга в ранней фазе острых отравлений нейротропными ядами // Анестезиология и реаниматология. 2005. № 4.
- Привалов А. А. с соавт. Применение реамберина у больных с ОНМК по ишемическому типу // Консилиум. 2005. № 4.
- Ливанов Г. А. с соавт. Коррекция критических состояний при острых отравлениях ядами нейротропного действия на раннем госпитальном этапе // Скорая медицинская помощь. 2005. № 1.
- Костянова Е. Н. Роль гипоксических изменений и эндогенной интоксикации в патогенезе псориаза и их коррекция реамберином // Автореф. дис. … к. м. н. М., 2005.
- Трофимова И. Б. с соавт. Некоторые вопросы патогенеза и лечения псориаза // Вестник дерматологии и венерологии. 2004. № 6.
- Галушка С. В. с соавт. Применение раствора реамберина в комплексном лечении тяжелого гестоза // Анестезиология и реаниматология. 2004. № 6.
- Аитов К. А. с соавт. Реамберин при интенсивной терапии клещевого боррелиоза // Актуальные вопросы интенсивной терапии. 2004, вып. 1 (3314–15).
- Применение реамберина в комплексной терапии хронических гепатитов. Методические рекомендации. СПб. 2003.
- Тихомирова О. В. с соавт. Эффективность использования реамберина и циклоферона в терапии кишечных инфекций у детей. Методические рекомендации. СПб. 2003.
- Николаев А. А. с соавт. Кардиопротекторное действие реамберина в коронарной хирургии на работающем сердце // Регионарное кровообращение и микроциркуляция. 2002. № 2.
- Михайлова Е. В., Чудакова Т. К. Патогенетическая инфузионная терапия острых кишечных инфекций у детей // Вестник Санкт-Петербургской государственной медицинской академии им. И. И. Мечникова. 2006. № 4.
- Вебер В. Р. с соавт. Перспективы клинического применения реамберина в терапии поражений печени у наркозависимых больных //Вестник СПбГМА им. И. И. Мечникова. 2006. № 4.
- Коломоец А. В., Мосенцев Н. Н. Роль реамберина в модуляции метаболического ответа у больных сепсисом // Вестник СПбГМА им. И. И. Мечникова. 2006. № 1.
- Разработка индивидуальных режимов дозирования реамберина // Вестник СПбГМА им. И. И. Мечникова. 2006. № 1.
- Привалов А. А. с соавт. Применение реамберина в лечении больных с нарушением мозгового кровообращения по ишемическому типу // Вестник СПбГМА им. И. И. Мечникова. 2006. № 1.
- Ржеутская Р. Е. Интенсивная терапия больных с тяжелой внебольничной пневмонией // Вестник СПбГМА им. И. И. Мечникова. 2006. № 1.
- Чудакова Т. К., Романовская А. В. Клинико-лабораторная эффективность реамберина в качестве корректора при инфекционных токсикозах // Вестник СПбГМА им. И. И. Мечникова. 2006. № 1.
- Мазина Н. К. с соавт. Системные эффекты реамберина при резекции печени. Клинико-фармакоэкономическик аспекты // Вестник СПбГМА им. И. И. Мечникова. 2005. № 4.
- Резникова Е. А. с соавт. Новые подходы к лечению местнораспространенного рака молочной железы с применением препарата реамберин // Вестник СПбГМА им. И. И. Мечникова. 2005. № 2.
- Гаин Ю. М. с соавт. Реамберин в комплексном лечении больных с тяжелой интраабдоминальной инфекцией // Вестник СПбГМА им. И. И. Мечникова. 2005. № 1.
- Сухоруков В. П. с соавт. Фармакоэкономический анализ применения реамберина в комплексном лечении диабетической макроангиопатии нижних конечностей и синдрома диабетической стопы // Вестник СПбГМА им. И. И. Мечникова. 2005. № 1.