Влияние реамберина на показатели окислительного гомеостаза у больных острым деструктивным холециститом
Статьи
К.м.н. С.В. Якубовский, д.м.н., проф. С.И. Леонович, д.м.н., проф. Г.Г. Кондратенко
Белорусский государственный медицинский университет, Минск
Ключевые слова: острый деструктивный холецистит, свободнорадикальные процессы, окислительный гомеостаз, реамберин.
Цитирование: Якубовский, С. В. Влияние реамберина на показатели окислительного гомеостаза у больных острым деструктивным холециститом / С. В. Якубовский, С. И. Леонович, Г. Г. Кондратенко // Хирургия. Журнал им. Н.И. Пирогова. – 2012. – № 8. – С. 65-68. – EDN PEJYAH.
The influence of Reamberine on the oxidative homeostasis in patients with the acute destructive cholecystitis
S.V. Yakubovskiy, S.I. Leonovich, G.G. Kondratenko
Key words: destructive cholecystitis, Reamberine.
Введение
В настоящее время острый холецистит (ОХ) является одним из наиболее распространенных острых хирургических заболеваний органов брюшной полости [6, 9, 17, 23].
Несмотря на совершенствование хирургической тактики, уровень летальности и количество послеоперационных осложнений при этом заболевании не имеют тенденции к снижению, что особенно характерно для лиц пожилого и старческого возраста с деструктивными формами ОХ [6, 19].
Основными причинами послеоперационных летальных исходов в последние десятилетия являются инфаркт миокарда, сердечно-сосудистая и дыхательная недостаточность [8, 23]. Существенное влияние на возникновение послеоперационных летальных исходов на желчевыводящих путях оказывает эндогенная интоксикация (ЭИ) и полиорганная недостаточность [7, 13, 14, 26].
Значимым фактором, влияющим на развитие эндотоксикоза независимо от его этиологии, является активация свободнорадикальных процессов, реализующаяся в виде перекисного окисления липидов (ПОЛ), окислительной модификации белков (ОМБ), нуклеиновых кислот [3]. Усиление этих процессов приводит к нарушению существующего в физиологических условиях баланса между анти- и прооксидантными системами в сторону повышения активности последних, т.е. к возникновению окислительного стресса [4]. Необходимость диагностики и возможность коррекции окислительного стресса как одной из причин ЭИ у больных хирургического профиля имеют существенное значение в условиях современной клиники. В последние годы все большее внимание исследователей привлекают препараты на основе янтарной кислоты, обладающие анти-гипоксантными и антиоксидантными свойствами [1]. Работами последних лет доказана высокая эффективность применения сукцинатсодержащих препаратов, оказывающих антиоксидантное и анти-гипоксантное действие, при лечении больных острыми абдоминальными заболеваниями [2, 5]. Несмотря на наличие публикаций, свидетельствующих о положительных результатах применения антиоксидантов в комплексном лечении больных ОХ [11, 18], использование их имеет эпизодический характер. Отсутствие в доступной литературе достаточного количества данных не позволяет обосновать целесообразность и оценить эффективность использования сукцинатсодержащих препаратов в комплексном лечении таких больных.
Нашей целью явилось изучение показателей эндогенной интоксикации и окислительного гомеостаза у больных острым деструктивным холециститом (ОДХ), а также возможности их коррекции с использованием сукцинатсодержащего препарата реамберина.
Материал и методы
Обследованы 35 пациентов, оперированных в ГКБ №10 Минска по поводу ОДХ; у всех больных при гистологическом исследовании операционных препаратов были выявлены деструктивные изменения в желчном пузыре.
В соответствии с задачами исследования были сформированы контрольная и основная группы пациентов. Контрольную группу составили 20 больных ОДХ, которым проводили стандартную консервативную терапию, основную группу — 15 больных, у которых в комплексе лечебных мероприятий в пред- и послеоперационном периоде был использован реамберин 1,5% для инфузий в дозе 400 мл.
Отсутствие положительной клинико-лабораторной динамики в течение 24—48 ч, признаки деструкции желчного пузыря при ультразвуковом исследовании явились у всех обследованных основанием для срочного хирургического вмешательства. Во всех наблюдениях применялась традиционная холецистэктомия с последующим дренированием брюшной полости.
Основная и контрольная группы были сопоставимы по полу, возрасту, времени, прошедшему от начала заболевания до поступления в стационар. Исследование производили при поступлении, а также после операции — на 2—3-и и на 7—8-е сутки.
Интенсивность ПОЛ оценивали по уровню накопления малонового диальдегида (МДА). Его содержание в гемолизатах крови определяли методом T. Asakava и S. Matsushita [21]. Состояние антиоксидантной системы (АОС) оценивали по активности супероксиддисмутазы (СОД), каталазы. Активность СОД в гемолизатах крови определяли методом M. Nishikimi и соавт. [25] в модификации В.Н. Чумакова и Л.Ф. Осинской [20], активность каталазы — методом Н.С. Мамонтова и соавт. [15]. Исследования проведены на базе лаборатории биохимических методов исследования ЦНИЛ БГМУ.
Степень эндогенной интоксикации определяли путем спектрофотометрической оценки уровня олигопептидов (ОП) в сыворотке крови по методу В.Б. Гаврилова и соавт. [10] при длине световой волны 290 нм, а также путем вычисления лейкоцитарного индекса сдвига по Н.И. Ябучинскому (ЛИЯ).
Содержание восстановленного глутатиона (G-SH) в гемолизатах крови изучали по реакции с аллоксаном при длине волны 305 нм [16], активность глутатионредуктазы (ГР) — методом I. Calberg и B. Mannervik [22].
Окислительную модификацию белков сыворотки крови регистрировали по накоплению битирозина, продуктов неферментативного гликозилирования белков (ПНГБ). Флуоресценцию битирозина в сыворотке крови измеряли при λвозб=325 нм и λисп. =416 нм [12]. Содержание гликозилированных белков в сыворотке крови определяли флуориметрическим методом при λвозб=370 нм и λисп=445 нм [24]. Интенсивность флуоресценции выражали в условных единицах. Измерения выполнены на спектрофлуориметре СМ 2203 (ЗАО «Солар», Беларусь) на базе Республиканского научно-практического центра гигиены.
Нормальные значения всех показателей были изучены у 15 доноров.
Статистическую обработку результатов проводили с применением пакета прикладных программ MS Excel и Statistica 6.0 (StatSoft Inc., США). Данные представлены в виде M±m, где M — среднее выборочное, m — ошибка среднего. Для количественных нормально распределенных признаков оценку статистической достоверности проводили с помощью критерия Стьюдента (t). При отличном от нормального распределении признаков использовали непараметрические критерии. Различия считали достоверными при вероятности ошибки p<0,05.
Результаты и обсуждение
Как видно из табл. 1, при поступлении в клинику у больных обеих групп было выявлено статистически достоверное увеличение содержания ОП в сыворотке крови, а также уровня ЛИЯ, что свидетельствовало о наличии явлений эндогенной интоксикации. У больных контрольной группы на протяжении всего послеоперационного периода сохранялось достоверное повышение содержания ОП и уровня ЛИЯ по сравнению с нормой. У больных основной группы повышение содержания ОП и уровня ЛИЯ сохранялось лишь на 2-е сутки и снижалось до нормальных значений на 7-е сутки послеоперационного периода. Следует отметить, что у больных контрольной группы уровень ЛИЯ на 7-е сутки был достоверно выше такового у пациентов основной группы.
Таблица 1.
Динамика уровня эндогенной интоксикации у больных ОДХ при различных способах лечения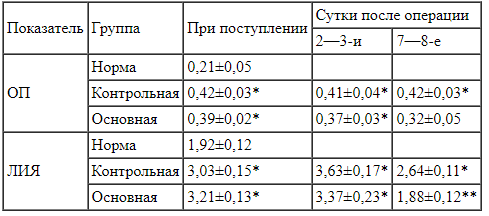 Примечание. * — достоверно по сравнению с нормой (p<0,05); ** — достоверно по сравнению с контрольной группой (p<0,05).
Примечание. * — достоверно по сравнению с нормой (p<0,05); ** — достоверно по сравнению с контрольной группой (p<0,05).
Как видно из табл. 2, у всех обследованных нами больных ОДХ при поступлении отмечалось достоверное увеличение содержания МДА по сравнению с нормальными значениями. На 2—3-и сутки послеоперационного периода в контрольной группе отмечалось дальнейшее увеличение содержания МДА, достоверно превышавшее таковое при поступлении, что подтверждает данные литературы о влиянии операционного стресса на усиление процессов ПОЛ [27]. В дальнейшем, на 7—8-е сутки послеоперационного периода, содержание МДА снижалось, однако сохранялось достоверно повышенным по сравнению с нормой.
Таблица 2.
Динамика показателей ПОЛ, ОМБ и АОС у больных с ОДХ при различных способах лечения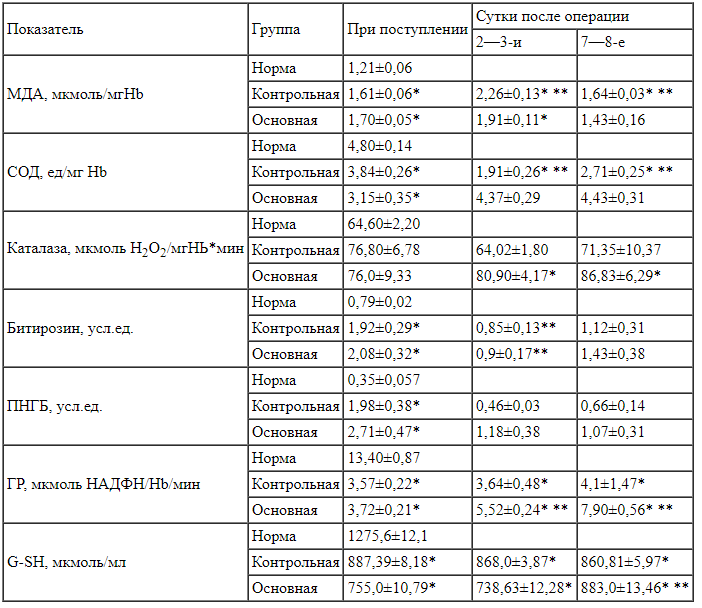 Примечание. * — достоверно по сравнению с нормой (p<0,05); ** — достоверно по сравнению с предыдущим измерением (p<0,05).
Примечание. * — достоверно по сравнению с нормой (p<0,05); ** — достоверно по сравнению с предыдущим измерением (p<0,05).
У пациентов основной группы на 2—3-и сутки послеоперационного периода дальнейшего повышения содержания МДА по сравнению с уровнем его, отмеченным при поступлении, не выявлялось; сохранялось лишь его достоверное превышение нормальных показателей. На 7—8-е сутки послеоперационного периода уровень МДА достигал нормальных значений.
У пациентов обеих групп при поступлении в стационар активность ферментативных составляющих АОС (СОД, ГР) была достоверно ниже нормальных значений. В контрольной группе через 2—3 сут после операции отмечалось дальнейшее снижение активности СОД, которое сменялось достоверным ее нарастанием к 7-м суткам послеоперационного периода, а также сохранение низкого уровня активности ГР. На протяжении всего послеоперационного периода у больных контрольной группы активность СОД и ГР сохранялась достоверно сниженной.
У больных основной группы уже на 2—3-и сутки послеоперационного периода отмечалось нарастание активности СОД, которая не отличалась от нормальных значений на протяжении всего послеоперационного периода. Активность ГР повысилась на 2—3-и сутки после операции, тем не менее оставалась достоверно сниженной на протяжении всего послеоперационного периода (см. табл. 2).
В обеих группах активность каталазы при поступлении достоверно не отличалась от нормальных значений. В контрольной группе на протяжении всего послеоперационного периода активность каталазы сохранялась в пределах нормы, в основной группе в послеоперационном периоде наблюдалось достоверное повышение активности фермента по сравнению с нормальными показателями.
Данные, представленные в табл. 2, свидетельствуют, что при поступлении содержание продуктов ОМБ (битирозина и ПНГБ) было достоверно повышенным у больных обеих групп. В послеоперационном периоде наблюдалось снижение их содержания до нормальных значений.
Содержание G-SH — неферментативного звена АОС — было достоверно сниженным у больных обеих групп на протяжении всего срока пребывания в стационаре. Можно, однако, отметить нарастание содержания G-SH к моменту выписки у больных основной группы.
Таким образом, полученные нами данные свидетельствуют, что у больных ОДХ возникают выраженные изменения гомеостаза, проявляющиеся развитием эндогенной интоксикации, накоплением продуктов ПОЛ, ОМБ и снижением активности СОД, ГР и содержания G-SH.
У больных контрольной группы оперативное вмешательство в значительной степени усугубляло нарушения окислительного гомеостаза, что проявлялось накоплением маркера ПОЛ—МДА при одновременном выраженном снижении активности СОД и ГР. Полученные данные подтверждают высказанное в литературе мнение о том, что оперативное вмешательство активирует ОС, снижая резервные возможности АОС и поддерживая таким образом эндогенную интоксикацию [27]. Указанные изменения сохранялись на протяжении всего послеоперационного периода. Так, несмотря на активацию СОД и ГР и соответствующее снижение интенсивности ПОЛ, отмеченные нами на 7—8-е сутки после операции, эти показатели достоверно отличались от нормальных значений. Приведенные данные свидетельствуют, что стандартная консервативная терапия при ОДХ эффективно не влияла на показатели ЭИ и окислительного гомеостаза.
В основной группе пациентов, у которых стандартная консервативная терапия была дополнена введением реамберина, к 7—8-м суткам послеоперационного периода отмечалось купирование явлений ЭИ, что выражалось в нормализации содержания ОП и уровня ЛИЯ, а также возникновении достоверной разницы в уровнях ЛИЯ в контрольной и основной группах. Введение реамберина сопровождалось нормализацией содержания МДА на 7-е сутки послеоперационного периода, а также нормализацией активности СОД и повышением активности каталазы и ГР уже на 2-е сутки после операции.
Таким образом, установленное у больных острым деструктивным холециститом нарастание явлений эндогенной интоксикации, сопровождающееся повышением содержания в крови продуктов перекисного окисления липидов и белков, снижением активности ферментативных и уровня неферментативных составляющих антиоксидантной системы, усугубляемое оперативным вмешательством, обосновывает целесообразность использования антиоксидантных препаратов. Включение реамберина в комплексную терапию больных острым деструктивным холециститом способствует уменьшению проявлений эндогенной интоксикации, снижению содержания продуктов свободнорадикального окисления, восстановлению активности ферментативного звена антиоксидантной системы и таким образом скорейшей реабилитации больных в послеоперационном периоде.
ЛИТЕРАТУРА
1. Агафонов Н.П., Башилов В.П. Хирургическое лечение острого холецистопанкреатита. Кремлевская медицина. Клин вестн 2000; 2: 15—25.
2. Алексеев С.А., Шахрай С.В. Применение реамберина в комплексном лечении больных с интраабдоминальной инфекцией. Вестн СПбГМА 2004; 2: 122—124.
3. Афанасьев В.В. Клиническая фармакология реамберина: пособие для врачей. СПб 2005; 45.
4. Бебуришвили А.Г., Зюбина Е.Н., Мандриков В.В., Лозовой А.В. Принципы лечения больных острым холециститом с максимально высоким операционно-наркозным риском. Материалы выездного пленума пробл. комиссии «Неотложная хирургия» и Всерос. научно-практич. конф., посвященной 60-летию научного общества на КМВ. М—Пятигорск 2005; 18—20.
5. Блахов Н.Ю., Варамицкая Н.М., Кукулянская Т.А. Оценка эффективности препарата реамберин в лечении панкреонекроза у больных пожилого и старческого возраста. Мед новости 2004; 4: 15—20.
6. Борисов А.Е., Земляной В.П., Левин Л.А. и др. Современное состояние проблемы лечения острого холецистита. Вестн хир 2001; 160: 6: 92—95.
7. Борисов А.Е., Федоров А.В., Земляной В.П. Ошибки, осложнения и летальность у больных с острыми хирургическими заболеваниями органов брюшной полости. СПб: Наука 2000; 162.
8. Бражникова Н.А. Возраст и осложнения — причины риска оперативного лечения больных желчнокаменной болезнью. Анналы хир гепатол 2002; 1: 91.
9. Ветшев П.С. Желчнокаменная болезнь и холецистит. Клинические перспективы гастроэнтерол, гепатол 2005; 1: 16—23.
10. Гаврилов В.Б., Лобко Н.Ф., Гаврилова А.Р. и др. Определение тирозинсодержащих пептидов в плазме крови с коррекцией фонового поглощения. Резкое повышение чувствительности теста к интоксикации организма. Клин лаб диагностика 2004; 6: 19—22.
11. Гейниц А.В. Применение антиоксиданта мексидола в комплексной терапии больных острым холециститом. Вестн интенсивной терапии 2003; 2: 77—80.
12. Дубинина Е.Е., Гавровская С.В., Кузьмич Е.В. и др. Окислительная модификация белков: окисление триптофана и образование битирозина в очищенных белках с использованием системы Фентона. Биохимия 2002; 67: 413—421.
13. Жидовинов А.А., Зурнаджьянц В.А., Жидовинов Г. И. Значение лабораторных маркеров эндотоксикоза и цитокинового профиля в диагностике и эффективности лечения осложненных форм острого холецистита. Цитокины и воспаление 2006; 5: 3: 27—33.
14. Лупальцов В.И. Органная недостаточность как фактор риска в хирургии желчнокаменной болезни. Анналы хир гепатол 2002; 1: 127.
15. Мамонтова Н.С., Белобородова Э.Н., Тюкалова Л.Н. Активность каталазы при хроническом алкоголизме. Клин лаб диагностика 1994; 1: 27—28.
16. Прохорова М.И. Методы биохимических исследований. Л: Изд-во Ленинградского ун-та 1982; 272.
17. Прудков М.И., Стол.ин А.В., Кармацких А.Ю. Экспресс-диагностика гнойно-деструктивных форм острого калькулезного холецистита. Хирургия 2005; 5: 32—34.
18. Феофилов Г.Л., Воробьев И.В., Семенюк А.В. и др. Антиоксиданты в комплексном лечении острого холецистита у больных пожилого и старческого возраста. Вестн хир 1992; 151: 1: 16—21.
19. Харламов Б.В. Холецистэктомия из минидоступа в лечении острого холецистита у больных пожилого и старческого возраста: Автореф. дис. ... канд. мед. наук. М 2007.
20. Чумаков В.Н., Осинская Л.Ф. Количественный метод определения активности цинк-медь-зависимой супероксиддисмутазы в биологическом материале. Вопр мед химии 1977; 27: 5: 712—715.
21. Asakava Т, Matsushita S. Colorus condition of thiobarbituric acid test for detecting lipid hydroperoxides. Lipids 1980; 5: 3: 137—140.
22. Calberg I., Mannervik B. Purification and characterization ofthe flavoenzyme glutation reductase from rat liver. J Biol Chem 1975; 250: 14: 5475—5480.
23. Kimura Y., Takada Т, Kawarada Y. et al. Definition, pathophysiology, and epidemiology of cholangitis and cholecystitis. J Hepatobiliary Pancreat Surg 2007; 14: 15—26.
24. Munch G., Keis R., Wessels A. et al. Determination of advanced glycation end products in serum fluorescence spectroscopy and competitive ELISA. Eur J Clin Chem Clin Biochem 1997; 35: 669—677.
25. Nishikimi M.N., Appaji R., Vagi K. The occurrence of superoxide an-ione in the reaction of reduced phenazine methosulfate and molecular oxygen. Biochem Biophys Research Communs 1971; 46: 2: 849—854.
26. Singer A., McCracken G., Henry M.C. et al. Correlation among clinical, laboratory and hepatobiliary scanning findings in patients with suspected acute cholecystitis. Ann Emerg Med 1996; 28: 3: 267—272.
27. Stipancic I., Zarkovic N., Servis D. Oxidative stress markers after laparoscopic and open cholecystectomy. J Laparoendosc Adv Surg Tech A 2005;15: 4: 347—352.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)