Фармакокинетические свойства, безопасность и переносимость реамберина с новым режимом дозирования у здоровых добровольцев
Статьи
A. Л. Коваленко1, Ю. А. Пфаргер1, О. С. Кетлинская1, B. Б. Василюк2, М. В. Фарапонова2
1 ООО “НТФФ “ПОЛИСАН”, Россия, 192102, Санкт-Петербург, ул. Салова, д. 72, к. 2, лит. А.
2 ООО “Научно-исследовательский центр Экобезопасность”, Россия, 196143, Санкт-Петербург, пр. Юрия Гагарина, 65.
В ходе открытого рандомизированного исследования изучена безопасность и переносимость препарата реамберин (ООО “НТФФ “ПОЛИСАН”) с различными режимами дозирования, а также фармакокинетика препарата при внутривенном введении объемом 2000 мл со скоростью 10 мл/мин у здоровых добровольцев. В исследование включено 78 здоровых добровольцев мужского пола в возрасте от 18 до 45 лет, которые были рандомизированы на 2 группы: группа 1 - 39 добровольцев, получавших реамберин объемом 2000 мл со скоростью 10 мл/мин; группа 2-39 добровольцев, получавших препарат объемом 1000 мл со скоростью 15 мл/мин. Результаты проведенного исследования показали благоприятный профиль безопасности и удовлетворительную переносимость реамберина при исследуемых режимах дозирования. Оценка нежелательных побочных эффектов у добровольцев группы 1 показала 23 из 70 нежелательных явлений (32,9 %), а в группе 2 - 47 из 70 (67,1 %). При анализе нежелательных эффектов по органам и системам было установлено, что в группе 2 доля нежелательных явлений при оценке кожных покровов и слизистых, а также сердечно-сосудистой системы была достоверно больше, чем в группе 1, и составила 46,2 %, в сравнении с 12,8 % (р = 0,024), а также 15,4 % в сравнении с 0 % (р = 0,025), соответственно. По остальным изучаемым органам и системам, включая отклонения лабораторных показателей, значимых различий между группами не установлено. Значения фармакокинетических показателей для янтарной кислоты по медиане составили: Сmах — 62,08 мкг/мл; Tmах — 2,50 ч; AUC0-24 —196,82 (мкг ч)/мл; AUC0-∞ — 198,14 (мкг ч)/мл; AUMC0-24- 433,80 (мкг ч2)/мл; MRT — 2,13 ч; Т1/2 - 1,47 ч; Vdss — 113,17 л и С1b — 53,30 л/ч. Установлено, что фармакокинетическая модель янтарной кислоты соответствует однокамерной модели, т.е. вещество быстро и равномерно распределяется по всему объему крови добровольцев и переносится обратно из кровотока в ткани, а ограничивающее влияние периферических камер незначительно и может не учитываться.
Ключевые слова: реамберин; янтарная кислота; фармакокинетические клинические исследования; ВЭЖХ-МС/МС; побочные эффекты; безопасность; переносимость.
Pharmacokinetics, safety, and tolerability of reamberin with new dosing regime in healthy volunteers
A. L. Kovalenko1, Yu. A. Pfarger1, O. S. Ketlinskaya1, V. B. Vasilyuk2, and M. V. Faraponova2
1 POLYSAN Scientific and Technological Pharmaceutical Company, ul. Salova 72/2A, St. Petersburg, 192102 Russia
2 ECOSAFETY Research Center Ltd., Yuri Gagarin prosp. 65, St. Petersburg, 196143 Russia
The safety and tolerability of reamberin (POLYSAN Ltd.) were studied in an open randomized trial with various dosage regimens. The pharmacokinetics of reamberin was studied upon a single infusion of 2000 ml at a rate of 10 ml/min in healthy volunteers. The test involved 78 healthy male volunteers aged 18-45 years, which were randomized into 2 groups: 39 volunteers in group 1 received an infusion of reamberin in a volume of 2000 ml at a rate of 10 ml/min; 39 volunteers in group 2 received an infusion of reamberin in a volume of 1000 ml at a rate of 15 ml/min. Results of the study showed favorable safety profile and satisfactory tolerability of reamberin under the studied dosage regimens. Monitoring of the adverse events showed 23 cases out of 70 (32.9%) in group 1 and 47 cases out of 70 (67.1%) in group 2. An analysis of the adverse events as distributed over organs and systems showed that the share of adverse events observed during evaluation of the skin and mucous membranes as well as in the cardiovascular system was significantly higher in group 2 than in group 1 and amounted to 46.2% versus 12.8% (p = 0.024) as well as 15.4% versus 0%, respectively. With respect to other evaluated organs and systems (with allowance for deviations in laboratory indicators), no significant differences between the two groups were identified. The pharmacokinetic profile of the succinic acid (the active metabolite of the drug reamberin) generally characterizes the intravenous route of administration of the drug infused at a constant rate over a short period of time (short-tern intravenous infusion of the drug). The median values of the pharmacokinetic parameters for succinic acid were: Cmax = 62.08 μg/ml; Tmax = 2.50h; AUC0-24 = 196.82 (μg h)/ml; AUC0-∞ = 198.14 (μg h)/ml; AUMC0_24 = 433.80 (μg h2)/ml; MRT= 2.13 h; Tl/2 = 1.47 h; Vdss = 113.17 1; and Clb = 53.30 1/h. It was found that the observed kinetics corresponds to a single-chamb distributed throughout the blood volume of volunteers and is transferred from the bloodstream to tissues, and the limiting effect of peripheral chambers is insignificant and can be ignored.
Keywords: reamberin; succinic acid; pharmacokinetics; clinical trials; HPLC-MS/MS side effects; safety; tolerability.
Введение
Среди лекарственных средств дезинтоксикационной терапии хорошо себя зарекомендовал в клинической практике препарат реамберин 1,5 % раствор для инфузий (ООО “НТФФ “ПОЛИСАН”) [2, 3, 5, 6, 8-10]. Препарат представляет собой полиионный раствор, содержащий активное вещество — янтарную кислоту и вспомогательные вещества — микроэлементы [11]. В литературе имеются многочисленные работы, свидетельствующие о высокой эффективности препарата при различных критических состояниях (хирургия, геронтологическая практика, комбустиология, травматология при сочетанной травме, сепсис, нейрохирургия). Использование реамберина в программе комплексной интенсивной терапии приводило к более раннему купированию проявлений синдрома системной воспалительной реакции и эндотоксемии, стабилизации жизненно важных функций, улучшению лабораторных показателей, коррекции процессов свободнорадикального окисления, нормализации водно-электролитного баланса и кислотно-основного равновесия [2, 3, 5, 6, 8 - 10].
Согласно инструкции по применению, средняя суточная доза реамберина для взрослых составляет 10 мл/кг с курсом терапии до 11 дней. По данным литературы, важным моментом интенсивной терапии у больных, находящихся в реактивно-токсической стадии эндогенной интоксикации, является предупреждение развития стадии токсемии посредством управляемой гемодилюции, на фоне которой происходит улучшение реологии крови, нормализуется соотношение вязкость/гематокрит, в результате роста ударного объема сердца увеличивается минутный объем. При этом рекомендованная скорость введения составляет 15 -25 мл/мин, общий объем растворов — 25-40 мл/кг [1].
Поэтому настоящее исследование проведено с целью оценки безопасности и переносимости реамберина объемом 2000 мл со скоростью 10 мл/мин и 1000 мл со скоростью 15 мл/мин, а также фармакокинетики препарата в объеме 2000 мл со скоростью 10 мл/мин у здоровых добровольцев (протокол № RB-I-2017 версия 1.0 от 02.04.2018 г.). Режим дозирования реамберина объемом 2000 мл со скоростью 10 мл/мин может быть использован в программах интенсивной терапии неотложных состояний, в патогенезе которых ведущую роль играют нарушения параметров гомеостаза, в то же время режим дозирования реамберина объемом 1000 мл со скоростью 15 мл/мин предполагает быстрое восстановление объема циркулирующей крови и гемодинамических параметров.
Методы исследования
Открытое рандомизированное клиническое исследование проводили под контролем Совета по этике при Минздраве России и в соответствии с ICH GCP Е6 R1 по организации проведения клинического исследования в соответствии с этическими принципами, изложенными в Хельсинской Декларации Всемирной Медицинской Ассоциации (Форталеза, 2013 г.), Федерального закона Российской Федерации РФ от 12.04.2010 г. № 61-ФЗ “Об обращении лекарственных средств” (с изменениями и дополнениями), Приказом Минздрава России РФ от 01.04.2016 г. № 200н “Об утверждении правил надлежащей клинической практики”, Национальным стандартом Российской Федерации ГОСТ R 52379-2005 “Надлежащая клиническая практика” и другими действующими нормативными документами. Исследование выполняли на базе ООО “НИЦ Эко-безопасность” (Санкт-Петербург). Дата начала исследования — 26.07.2018 г. Дата завершения исследования — 06.10.2018 г. Спонсор исследования — ООО “НТФФ “ПОЛИСАН”. Для участия в исследовании было включено 78 добровольцев. Все добровольцы проходили процедуры скрининга в течение 12 дней до госпитализации.
Критерии включения добровольцев в исследование: подписанное информированное согласие; мужчины в возрасте от 18 до 45 лет; индекс массы тела в пределах от 22,5 до 30 кг/м2 при массе тела от 60 до 90 кг; верифицированный диагноз “здоров” (отсутствие отклонений от нормы при врачебном осмотре, включающем измерение основных жизненных показателей, ЭКГ в 12 отведениях, клинических лабораторных исследований); согласие не заниматься тяжелыми физическими нагрузками и интенсивными занятиями спортом в течение исследования; согласие использовать надежные методы контрацепции в ходе всего исследования и 90 дней после окончания участия в исследовании.
Здоровые добровольцы были рандомизированы на 2 группы: группа 1 - 39 добровольцев, получавших реамберин (внутривенно) объемом 2000 мл со скоростью 10 мл/мин; группа 2-39 добровольцев, получавших реамберин объемом 1000 мл со скоростью 15 мл/мин.
Фармакокинетические исследования были проведены у добровольцев первой группы. Количественное определение янтарной кислоты в плазме крови добровольцев осуществляли согласно требованиям руководства по экспертизе лекарственных средств [4] валидированным методом ВЭЖХ-МС/МС с учетом того, что янтарная кислота является эндогенным соединением. Определение осуществляли в режиме контроля множественных реакций (MRM) [12, 13]. Нижний предел количественного определения янтарной кислоты в плазме крови составил 0,1 мкг/мл; линейный диапазон 0,1-100 мкг/мл.
Для поиска параметров модели (константы скорости элиминации, константы скоростей обмена между камерами) использовали метод оптимизации, основанный на методе поиска производных (метод Гира) [7]. В качестве показателя адекватности построенной модели использована среднеквадратическая ошибка модели (MSE), которая представляет собой отклонения экспериментальных данных от полученных в ходе оптимизации теоретических кривых и рассчитывается по формуле: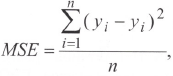 где yi -n экспериментальное значение концентрации метаболита в точке забора крови; у — теоретическое значение концентрации метаболита в точке забора крови; п — количество экспериментальных точек забора крови.
где yi -n экспериментальное значение концентрации метаболита в точке забора крови; у — теоретическое значение концентрации метаболита в точке забора крови; п — количество экспериментальных точек забора крови.
Математико-статистический анализ результатов осуществлен с использованием пакетов программ Microsoft Excel 2010 с надстройкой AtteStat, MATLAB 12 и Statistica 10.0. Значения параметров представлены в виде Me — медиана, UQ — верхнего и LQ — нижнего квартилей, Mean — среднего арифметического, SD — стандартного отклонения. Для определения нормальности использовали критерий Шапиро — Уилка. Для сравнения количественных данных, не подчинявшихся закону нормального распределения, был рассчитан L-критерий Манна — Уитни для независимых выборок и критерий Вилкоксона для зависимых выборок. Для сравнения количественных данных, подчинявшихся закону нормального распределения, был рассчитан t-критерий Стьюдента для независимых выборок и критерий Стьюдента для зависимых выборок. Для оценки различий между исследуемыми группами в динамике использовали дисперсионный анализ повторных наблюдений (Repeated Measures ANOVA). Для сравнения качественных показателей (долей) и оценки достоверности обнаруженных различий в частоте их появления использовали точный критерий Фишера. Статистически значимыми считали различия при р < 0,05.
Результаты и их обсуждение
По данным скрининга у всех добровольцев (100 %) по результатам осмотра по органам и системам не отмечены отклонения. Исследование безопасности и переносимости реамберина показало в целом благоприятный профиль безопасности. При сравнении режимов дозирования реамберина в рамках межгруппового анализа нс было выявлено статистически значимых различий жизненно важных показателей и показателей инструментальных исследований между исследуемыми группами. Кроме показателей частоты сокращений сердца (ЧСС) в точке 12:00 (р = 0,012) и температуры тела в точке 04:00 (р = 0,040), а также уровень ЧСС ЭКГ, который статистически значимо различался на визите последующего наблюдения (р = 0,037). Межгрупповое сравнение лабораторных показателей выявило статистически значимые различия количества моноцитов в точке - 01:00 (р = 0,043), доли базофилов в точке 24:00 (р = 0,026) и доли эозинофилов на визите последующего наблюдения (р = 0,049). Для показателей биохимического анализа крови были выявлены статистически значимые различия единичных параметров, таких как уровень Na+ в точке -01:00 (р = 0,020) и концентрация глюкозы в точке 24:00 (р = 0,011). Межгрупповой анализ показателей кислотно-основного состояния крови и общего анализа мочи не выявил существенных различий в группах.
В ходе оценки безопасности и переносимости реамберина при изучаемых режимах дозирования был проведен анализ нежелательных эффектов (НЭ). Всего было зарегистрировано 70 случаев НЭ: 61 (87,1 %), связанных с соматическим статусом, и 9 (12,9 %), связанных с отклонениями лабораторных показателей. В 50 из 70 случаев (71,4 % от общего количества) причинно-следственная связь с препаратом оценена как “возможная”, в 18 случаев (25,7 %) -— “определенная” и в 2 случаях (2,9 %) — “вероятная”. Основная часть действий, предпринятых при возникновении НЭ, 68 из 70 (97,1 %) была отнесена к категории “никаких действий не предпринималось”. В 2 из 70 случаев (2,9 %) была назначена лекарственная терапия для лечения НЭ (добровольцы из группы 2 выбыли из исследования в связи с развитием НЭ). По степени тяжести 67 из 70 случаев (95,7 %) отнесены к “легкой степени тяжести”, 2 случая (2,9 %) — к “тяжелой степени тяжести” и 1 случай (1,4 %) — к “средней степени тяжести”. Исходом 61 из 70 случаев (87,1 %) стало “полное разрешение”, в 9 из 70 случаев (12,9 %) исход НЭ, связанных с отклонениями лабораторных показателей, неизвестен (данные отклонения выявлены на завершающем визите, расценены как клинически незначимые и дальнейшее наблюдение не проводилось).
Оценка НЭ показала, что у добровольцев группы 1 было зарегистрировано 23 из 70 НЭ (32,9 %), а группы 2-47 из 70 (67,1 %). При анализе НЭ по органам и системам было установлено, что в группе 2 доля НЭ при оценке кожных покровов и слизистых, а также деятельности сердечно-сосудистой системы была достоверно больше, чем в группе 1, и составила 46,2 % в сравнении с 12,8 % (р = 0,024), а также 15,4 % в сравнении с 0 % (р = 0,025), соответственно. По остальным изучаемым органам и системам, включая отклонения лабораторных показателей, значимых различий между группами не установлено (табл. 1).
Таблица 1.
Сравнительная характеристика нежелательных эффектов по органам и системам в исследуемых группах
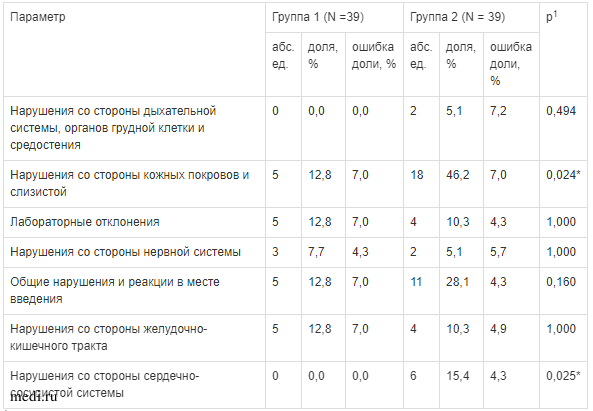 1 значение р-уровня значимости в Fisher exact р между группами 1 и 2;
1 значение р-уровня значимости в Fisher exact р между группами 1 и 2;
* различия статистически значимы (р < 0,05);
N — количество человек в группе.
Анализ фармакокинетических данных установил значительный разброс показателя концентрации янтарной кислоты в плазме крови добровольцев группы 1, но при этом в целом ее фармакокинетический профиль а был характерен для внутривенного введения препарата с постоянной скоростью в течение короткого промежутка времени (рис. 1).
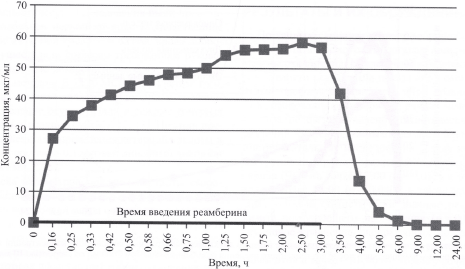 Рис. 1. Концентрация янтарной кислоты в плазме крови у добровольцев после внутривенного введения реамберина объемом 2000 мл со скоростью 10 мл/мин с вычетом эндогенного содержания на линейной шкале.
Рис. 1. Концентрация янтарной кислоты в плазме крови у добровольцев после внутривенного введения реамберина объемом 2000 мл со скоростью 10 мл/мин с вычетом эндогенного содержания на линейной шкале.
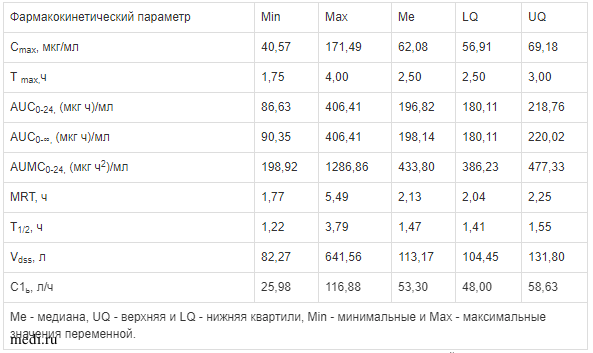
Анализ обобщенных данных для янтарной кислоты (табл. 2) показал, что значения фармакокинетических показателей по медиане составили: максимальная концентрация в плазме крови (Сmах) — 62,08 мкг/мл; время достижения максимальной концентрации в плазме крови (Тmах) — 2,50 ч; площадь под фармакокинетической кривой “концентрация — время” от начального момента времени до отбора последнего образца крови через 24 ч (AUC0-24) — 196,82 (мкг ч)/мл; AUC0-∞ — 198,14 (мкг ч)/мл; AUMC0-24 - 433,80 (мкг ч2)/мл; среднее время удержания в плазме крови (MRT) — 2,13 ч; период полувыведения из плазмы крови (Т1/2) — 1,47 ч; кажущийся объем распределения в стационарном состоянии (Vdss) — 113,17 л и клиренс из плазмы крови (С1b) — 53,30 л/ч.
Таблица 2.
Обобщенные фармакокинетические параметры янтарной кислоты в плазме крови добровольцев после однократного внутривенного введения реамберина объемом 2000 мл со скоростью 10 мл/мин с вычетом эндогенного содержания
Экспериментальные и модельные графики зависимости концентрации янтарной кислоты от времени представлены на рис. 2. Ошибка модели (MSE) для однокамерной модели составила — 6,719; для двухкамерной — 17,245.
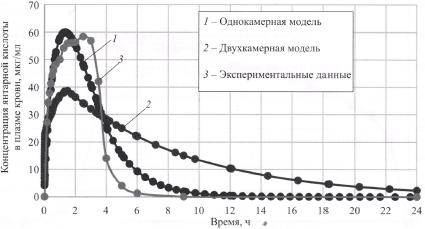 Рис. 2. Усредненные экспериментальные и модельные (одно- и двухкамерные) графики зависимости концентрации янтарной кислоты в плазме крови у добровольцев после внутривенного введения реамберина объемом 2000 мл со скоростью 10 мл/мин.
Рис. 2. Усредненные экспериментальные и модельные (одно- и двухкамерные) графики зависимости концентрации янтарной кислоты в плазме крови у добровольцев после внутривенного введения реамберина объемом 2000 мл со скоростью 10 мл/мин.
Визуальный анализ представленных кривых и значения показателя ошибки модели (MSE) одно- и двухкамерных моделей зависимости концентрации янтарной кислоты в плазме крови от времени у здоровых добровольцев после однократного внутривенного введения реамберина объемом 2000 мл со скоростью 10 мл/мин позволили высказать предположение о том, что оптимальной является однокамерная фармакокинетическая модель. Для трехкамерной модели оказалось невозможным подобрать параметры для получения переходных констант между камерами. Таким образом, можно сделать заключение о быстром и равномерном распределении исследуемого препарата по всему объему крови.
Выводы
1. Результаты проведенного исследования показали благоприятный профиль и удовлетворительную переносимость реамберина при однократном внутривенном введении объемом 2000 мл со скоростью 10 мл/мин и 1000 мл со скоростью 15 мл/мин. Достоверные различия жизненно-важных показателей и параметров лабораторных исследований добровольцев в отдельных временных точках исследования, по сравнению с исходными данными на скрининге и до введения препарата, имели разнонаправленный характер и не повлияли на профиль безопасности изучаемых режимов дозирования исследуемого препарата.
2. Значения фармакокинетических показателей для янтарной кислоты по медиане составили: Сmах — 62,08 мкг/мл; Тmах — 2,50 ч; AUC0-24 — 196,82 (мкг ч)/мл; AUC0_∞ — 198,14 (мкг ч)/мл; AUMC0-24 - 433,80 (мкг ч2)/мл; MRT — 2,13 ч; T1/2_ 1,47 ч; Vdss — 113,17 л и С1b — 53,30 л/ч. Фармакокинетический профиль метаболита янтарной кислоты соответствует однокамерной модели, т.е. вещество быстро и равномерно распределяется по всему объему крови добровольцев и переносится обратно из кровотока в ткани.
ЛИТЕРАТУРА
1. Б. Р. Гельфанд, А. И. Салтанов (ред.), Интенсивная терапия: национальное руководство, ГЭОТАР-Медиа, Москва (2011), с. 1744.
2. В. А. Завьялкин, М. А. Барская, А. В. Варламов и др., Хирургия. Ж. им. Н. И. Пирогова, № 12, 88-92 (2016).
3. Г. А. Ливанов, А. Н. Лодягин, Б. В. Батоцыренов и др.. Клин. мед., 94(5), 339-346 (2016).
4. А. Н. Миронов, Руководство по экспертизе лекарственных средств, Часть первая, Москва (2013), с. 323.
5. А. В. Смирнов, О. Б. Нестерова, Р. В. Голубев, Нефрология, 18(2), 33-41 (2014).
6. И. И. Спичак, Е. В. Копытова, Онкология. Ж. им. П. А. Герцена, 7(5), 47-55 (2018).
7. В. В. Тарасик, Математическое моделирование технических систем, Москва (2013), с. 584.
8. Е. О. Тихонова, Е. П. Ляпина, А. А. Шульдяков, Эксперим. и клин. фармакол., 76(1), 11 - 13 (2013).
9. А. Б. Толкач, В. Т. Долгих, Бюл. сибирской мед., 11(3), 69 - 76 (2012).
10. Б. Н. Шах, В. Н. Лапшин, А. Г. Кырнышев и др., Общая реаниматол., 10(1), 33 -37 (2014).
11. С. А. Шахмарданова, О. Н. Гулевская, Я. А. Хананашвили и др., Ж. фундам. мед. и биол., № 3, 16 - 30 (2016).
12. Н. Мао, W. Wei, W. Xiong, et al., Clin. Biochem., 43(13 - 14), 1141 - 1147(2010).
13. E. M. Mineva, M. Zhang, D. J. Rabinowitz, et al., Anal. Bioanal. Chem., 407(11), 2955-2964 (2015).
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)