Иммунорегулирующие свойства реамберина в комплексном лечении распространенного гнойного перитонита
Статьи
Опубликовано в журнале:
Хирургия 7, 2013
В.А. Косинец
Первый Московский государственный медицинский университет им. И.М. Сеченова
The immunoregulating action of reamberine and its use in the treatment of duffuse peritonitis
V.A. Kosinets
Изучено влияние реамберина на динамику функционального состояния митогенс-индуцированных иммунокомпетентных клеток крови у пациентов с распространенным гнойным перитонитом. Установлено, что исследуемые иммунокомпетентные клетки оказывают регулирующее действие на миграцию нейтрофильных лейкоцитов при распространенном гнойном перитоните в течение всего послеоперационного периода. Фитогемагглютинин-активированные мононуклеарные клетки не вызывают ингибицию миграции нейтрофильных гранулоцитов, наблюдаемую в норме. В то же время липополисахарид-активированные моноциты приводят к усилению миграции нейтрофильных гранулоцитов по сравнению с данными, полученными в норме. Использование реамберина у пациентов с распространенным гнойным перитонитом оказывает корригирующее действие на иммунокомпетентные клетки, изменяя их свойства регуляции миграционной активности нейтрофильных гранулоцитов. Выявленные эффекты при использовании реамберина наиболее выражены к 7—10-м суткам послеоперационного периода.
Ключевые слова: распространенный гнойный перитонит, реамберин, нейтрофилы, мононуклеары, моноциты, лимфоциты, ФГА, ЛПС.
Influence of reamberin on dynamics of functional condition of mitogen-induced immunocompetent blood cells at patients with widespread purulent peritonitis is studied. It is established that investigated immunocompetent cells have regulating effect on migration of neutrophil leukocytes at widespread purulent peritonitis during all postoperative period. PHA-activated mononuclear cells don’t cause inhibition of migration of neutrophil granulocytes, observed in norm. At the same time the LPS-activated monocytes lead to migration strengthening of neutrophil granulocytes, in comparison with the data received in norm. Usage of reamberin at patients with widespread purulent peritonitis renders corrective action on immunocompetent cells, changing their properties of regulation of migratory activity of neutrophil granulocytes. The revealed effects at use of reamberin most expressed by the 7—10th days of the postoperative period.
Key words: widespread purulent peritonitis, reamberin, neutrophils, mononuclear cells, monocytes, lymphocytes, PHA, LPS.
Введение
Распространенный гнойный перитонит, как и многие годы ранее, занимает ведущую проблемную позицию в абдоминальной хирургии [6, 7, 9, 17, 20, 24]. Стабильно высокая летальность при данном заболевании определяет актуальность поиска новых путей совершенствования его лечения. Знание ключевых патогенетических звеньев и возможность оказывать на них влияние открывают новые перспективы снижения неблагоприятных исходов при перитоните [7, 8].
Очевидно, что успех лечения при распространенном перитоните не может ограничиваться только хирургической составляющей и во многом зависит от мероприятий интенсивной терапии в послеоперационном периоде.
Большая площадь и высокая всасывающая способность брюшинного покрова обусловливают быстрое проникновение бактериальных токсинов в кровоток и развитие системных негативных изменений в организме [5]. В связи с этим многие авторы отмечают, что перитонит ассоциируется с абдоминальным сепсисом [1, 11, 20].
Прогрессирование перитонита сопровождается многокомпонентной общей иммунодепрессией, одной из причин которой являются системные нарушения метаболизма [10, 13—15, 21, 25]. Основными факторами развития метаболической иммунодепрессии являются гиперпродукция катехоламинов и глюкокортикоидов, стимуляция липолиза и системная гипоксия [3, 4, 11, 12, 14, 19, 26]. Совокупность этих изменений приводит к недостаточности процессов окислительного фосфорилирования, росту дефицита макроэргических соединений и, как следствие, к гипоэргозу иммунокомпетентных клеток [10, 14, 15, 18, 21, 23].
В медицинских учреждениях Российской Федерации в настоящее время широко применяется полиионный инфузионный раствор «Реамберин». Его основным биологически активным компонентом является натриевая соль янтарной кислоты. В условиях стресса и воспаления окисление янтарной кислоты в митохондриях служит основным и наиболее эффекэргических соединений [16].
Исходное направление применения данного раствора — антигипоксическая и дезинтоксикационная терапия [2]. Однако клинические наблюдения показали, что его свойства значительно более многогранны и определяют необходимость изучения других направлений его эффективного применения.
Цель исследования — изучение влияния препарата реамберин, содержащего янтарную кислоту, на иммунокомпетентные клетки крови пациентов с распространенным гнойным перитонитом.
Материал и методы
Проведено комплексное лечение и обследование 36 пациентов с распространенным гнойным перитонитом.
Для определения распространенности и стадии перитонита использовали шкалу и классификацию В.К. Гостищева.
Пациенты были разделены на две группы — основную и контрольную. Контрольную и основную группы формировали методом слепой рандомизации. Критерии включения пациентов в исследование: возраст 17—85 лет, верифицированный интраоперационно распространенный гнойный перитонит, занимающий более двух анатомических областей брюшной полости с Мангеймским перитонеальным индексом не менее 10 баллов, наличие мутного выпота в брюшной полости. В исследование не включали пациентов с распространенным перитонитом панкреатогенной этиологии.
Отличие основной группы (n=24) от контрольной (n=12) заключалось в том, что на фоне традиционного лечения в течение 5 сут послеоперационного периода дополнительно применяли препарат реамберин в дозе 400—800 мл в сутки внутривенно капельно в зависимости от степени тяжести состояния пациентов. Среди 24 пациентов, получавших комплексное лечение с применением реамберина (основная группа), мужчин было 11 (45,84%), женщин — 13 (54,16%). В контрольной группе было 5 (41,66%) мужчин и 7 (58,34%) женщин. Основная и контрольная группы были сопоставимы по возрастному составу, полу, нозологическим формам заболевания. За норму были приняты показатели практически здоровых добровольцев-доноров (n=15).
Для иммунологического исследования выполняли забор венозной крови на 1, 3—5 и 7—10-е сутки послеоперационного периода. Из полученной крови выделяли мононуклеары, моноциты и лимфоциты по ранее описанной методике [22].
Митоген-индуцированную цитокинпродуцирующую активность иммунокомпетентных клеток изучали в реакции торможения миграции нейтрофильных лейкоцитов (РТМЛ) в прямом капиллярном тесте [22]. Для этого в три ячейки круглодонного планшета для иммунологических исследований вносили по 0,2 мл суспензии соответствующих иммунокомпетентных клеток. В первую ячейку добавляли 10 мкл фитогемагглютинина (ФГА) (40 мкг/ мл), во вторую — 10 мкл липополисахарида (ЛПС) Е. coli (10 мкг/мл), в третью — 10 мкл среды RPMJ1640. Планшет инкубировали при 37 °С, 5% СО2 в течение 1,5 ч с последующей элиминацией митогенов путем двукратного центрифугирования при 1000 об/мин в течение 3 мин. К осадку добавляли 0,1 мл (107/мл) суспензии нейтрофильных лейкоцитов (НЛ), приготовленных на культуральной среде. Затем клетки ресуспендировали и выполняли РТМЛ в прямом капиллярном тесте.
Результаты РТМЛ выражали в индексе миграции (ИМ), который определяли по формуле:

Статистическая обработка данных проведена в соответствии с требованиями, предъявляемыми к исследованиям в области медицины с использованием электронных пакетов анализа Statistica 6.0, MedCalc 10.2.0.0 и MS Excel. Рассчитывали медиану Me, доверительный интервал для медианы с вероятностью 95%, размах минимальных и максимальных значений (размах min—max), межквартильный интервал (25—75-й процентиль), критерий Манна—Уитни (уровень достоверности
р<0,05).
Результаты
Исследовано влияние реамберина — препарата, содержащего янтарную кислоту, на функциональное состояние митоген-индуцированных иммунокомпетентных клеток крови при распространенном гнойном перитоните. Результаты исследования представлены в таблице.
Влияние препарата реамберин на митоген-индуцированную активность иммунокомпетентных клеток крови пациентов в послеоперационном периоде при распространенном гнойном перитоните
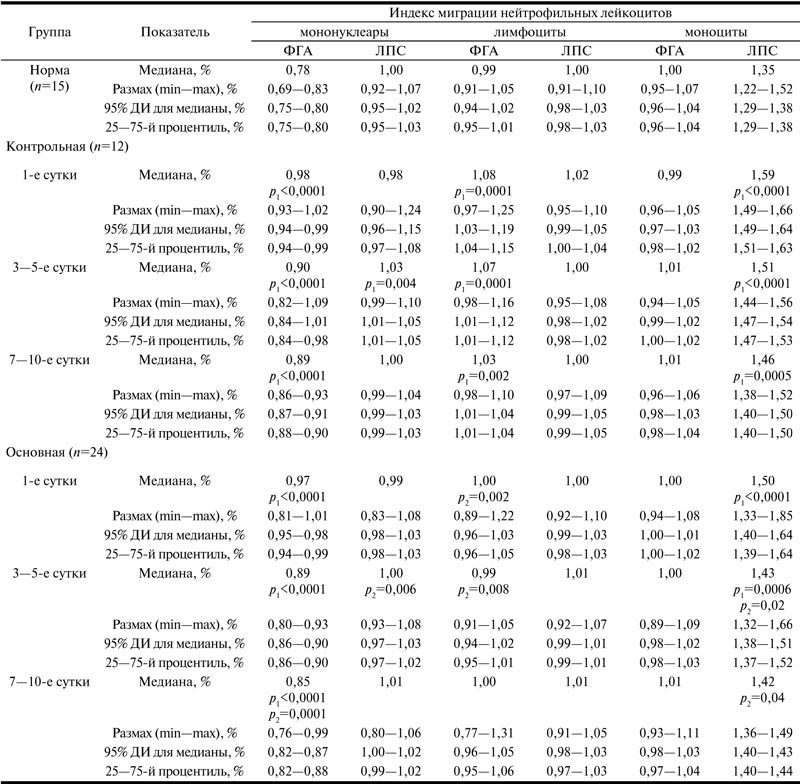
Примечание. p1 — по сравнению с нормой; p2 — по сравнению с контрольной группой аналогичных суток.
Установлено, что в норме моноциты, мононуклеары и лимфоциты по-разному изменяли миграционные свойства нейтрофильных лейкоцитов в ответ на антигенную стимуляцию. ФГА-стимулированные мононуклеары вызывали ингибирование миграции нейтрофильных лейкоцитов, в то время как ЛПС-активированные моноциты стимулировали их миграционную активность.
С 1-х суток послеоперационного периода в исследуемых группах с распространенным гнойным перитонитом наблюдалось наличие способности иммунокомпетентных клеток регулировать миграционные свойства нейтрофильных гранулоцитов. Моноциты, активированные ФГА, утрачивали способность подавлять миграционные свойства нейтрофилов, в то время как ЛПС-активированные моноциты еще в большей степени усиливали их миграцию. Лимфоциты после активации митогенами по-разному изменяли миграционные свойства нейтрофильных лейкоцитов. В отличие от ФГА их стимуляция ЛПС Е. coli оказывала меньшее влияние на миграцию тест-клеток.
В контрольной группе это сопровождалось достоверным увеличением ИМ нейтрофильных гранулоцитов по сравнению с нормальными значениями, с Ме=0,78 до Ме=0,98 (р<0,0001) (ФГА-стимулированные мононуклеарные клетки), с Ме=1,35 до Ме=1,59 (р<0,0001) (ЛПС-индуцированные моноциты) и с Ме=0,99 до Ме=1,08 (р=0,0001) (ФГА-индуцированные лимфоциты).
На 3—5-е сутки послеоперационного периода у пациентов контрольной группы наблюдалось снижение ИМ под действием ФГА-активированных мононуклеаров и ЛПС-активированных моноцитов до Ме=0,90 (р<0,0001) и Ме=1,51 (р<0,0001) соответственно. При этом отмечалось статистически достоверное по сравнению с нормой увеличение ИМ нейтрофильных гранулоцитов под действием ЛПС-активированных мононуклеаров с Ме=1,00 до Ме=1,03 (р=0,004). По сравнению с предыдущими сутками существенного влияния на ИМ ФГА-индуцированные лимфоциты не оказывали — Ме=1,07 (р=0,0001).
На 7—10-е сутки послеоперационного периода в контрольной группе ИМ под действием ФГА-активированных мононуклеаров и лимфоцитов, а также ЛПС-активированных моноцитов по-прежнему превышал показатели нормы и составил Ме=0,89 (р<0,0001), Ме=1,03 (р=0,002) и Ме=1,46 (р=0,0005) соответственно.
Эффект применения реамберина отмечался на 3—5-е сутки послеоперационного периода. Наблюдалось статистически достоверное по сравнению с контрольной группой ингибирование миграции нейтрофильных гранулоцитов крови под действием лимфоцитов, активированных ФГА. Эффект характеризовался достоверным снижением ИМ нейтрофильных гранулоцитов до Ме=0,99 (р=0,008). Отмечалось выраженное иммунотропное действие реамберина на миграцию тест-клеток под влиянием ЛПС-активированных моноцитов венозной крови. Эффект характеризовался более низким значением ИМ нейтрофильных гранулоцитов по сравнению с контрольной группой (Ме=1,43, р=0,02).
На 7—10-е сутки послеоперационного периода в основной группе практически все исследуемые показатели не отличались от нормы. При этом наблюдалось статистически достоверное по сравнению с контрольной группой снижение ИМ нейтрофильных гранулоцитов под действием ФГА-активированных мононуклеаров до Ме=0,85 (р=0,0001), а ЛПС-активированных моноцитов до Mе=1,42 (р=0,0001).
Таким образом, результаты исследования указывают на способность реамберина оказывать положительное воздействие на регуляторные свойства иммунокомпетентных клеток по отношению к миграционной активности нейтрофильных гранулоцитов. Применение реамберина в послеоперационном периоде у пациентов с распространенным гнойным перитонитом позволило в определенной степени корригировать миграционные свойства нейтрофильных лейкоцитов под действием фитогемагглютинин-активированных мононуклеарных клеток крови и обеспечило восстановление регуляторных свойств липополисахарид-индуцированных моноцитов, наиболее выраженное к 7—10-м суткам. Предположительно установленный эффект связан с возможностью энерготропного препарата восстанавливать энергетический статус иммунокомпетентных клеток, что сопровождается нормализацией их функциональной активности.
Литература
- Абдоминальная хирургическая инфекция: клиника, диагностика, антимикробная терапия: Практическое руководство. Под ред. В.С. Савельева, Б.Р. Гельфанда. М: Литтерра 2006; 168.
- Афанасьев В.В. Клиническая фармакология реамберина. СПб 2005; 44.
- Брискин Б.С., Хачатрян Н.Н., Савченко З.И. Иммунные нарушения и иммунокоррекция при интраабдоминальной инфекции. Хирургия 2004; 2: 6: 24—27.
- Булыгин Г.В., Камзалакова Н.И., Андрейчиков А.В. Метаболические основы регуляции иммунного ответа. Новосибирск: СО РАМН 1999; 346.
- Гаин Ю.М., Леонович С.И., Алексеев С.А. Синдром энтеральной недостаточности при перитоните: теоретические и практические аспекты, диагностика и лечение. Молодечно 2001; 265.
- Гельфанд Е.Б., Гологорский В.А., Гельфанд Б.Р. Абдоминальный сепсис: интегральная оценка тяжести состояния больных и полиорганной дисфункции. СПб: Анест и реаниматол 1998; 21.
- Гостищев В.К., Сажин В.П., Авдовенко А.Л. Перитонит. М: ГЭОТАР-Медиа 2002; 238.
- Гусев Е.Ю., Юрченко Л.Н. Системное воспаление как типовой патологический процесс. Вестн мед акад науки 2004; 4: 17—20.
- Ерюхин И.А., Шляпников С.А., Ефимова И.С. Перитонит и абдоминальный сепсис. Инф в хир 2004; 2: 2—7.
- Ефименко Н.А., Розанов В.Е., Болотников А.И. Иммунопатогенез и концепция современной иммунотерапии перитонита у пострадавших с тяжелой сочетанной травмой живота. М: ООО «АВТОГРАФ» 2008; 302.
- Завада Н.В., Гаин Ю.М., Алексеев С.А. Хирургический сепсис: учебное пособие. Минск: Новое знание 2003; 237.
- Гаин Ю.М. и др. Иммунный статус при перитоните и пути его патогенетической коррекции: Руководство для врачей. Минск: ООО «Юнипресс» 2001; 256.
- Караулов А.В. Клиническая иммунология. М: Медицина 2008; 602.
- Козлов В.К. Сепсис: этиология, патогенез, концепция современной иммунотерапии. Изд. 2-е. СПб: Диалект 2008; 296.
- Козлов В.К. Иммунопатогенез и цитокинотерапия хирургического сепсиса: пособие для врачей. СПб: Ясный свет 2002; 48.
- Кондрашова М.Н. Янтарная кислота — источник энергии в организме. Норма-пресс 1991; 9: 17—18.
- Ларичев А.Б., Волков А.В. Распространенный послеоперационный перитонит: стратегия и тактика (методическое пособие для врачей). Ярославль 2004; 40.
- Лукьянова Л.Д. Фармакологическая коррекция митохондриальной дисфункции при гипоксии. В кн.: Проблемы гипоксии — молекулярные, физиологические и медицинские аспекты. Под ред. Л.Д. Лукьяновой, И.Б. Ушакова. М 2004; 456—487.
- Матвеев Д.В., Сергеева Н.А., Гельфанд Б.Р. Нарушение метаболизма при перитоните: гемодинамика или клетка. Сов мед 1991; 8: 3—8.
- Савельев B.C. Перитонит: практическое руководство. Под общ. ред. В.С. Савельева, Б.Р. Гельфанда, М.И. Филимонова. М: Литтерра 2006; 208.
- Сарап П.В. Метаболическая иммунокоррекция в лечении больных с распространенным перитонитом: Автореф. дис. ... канд. мед. наук. Красноярск 2003; 148.
- Сачек М.Г., Косинец А.Н., Адаменко Г.П. Иммунологические аспекты хирургической инфекции. Витебск 1994; 140.
- Багненко С.Ф. и др. Фармакологическая коррекция метаболических нарушений при разлитом перитоните: пособие для врачей. СПб: НИИ скорой медицинской помощи им. Джанелидзе 2007; 20.
- Шуркалин Б.К. Гнойный перитонит. М: Два Мира Принт 2000; 224.
- Heel K.A., Hall J.C. Peritoneal defences and peritoneum-associated lymphoid tissue. Br J Surg 1996; 83: 1031—1036.
- Steffers C.P., Dahn M.S., Lange M.P. Oxygen transport-dependent splanchnic metabolism in the sepsis syndrome. Arch Surg 1994; 129: 46—52.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)