Уважаемый посетитель!
Эта информация для специалистов здравоохранения
Нажимая «ПРОДОЛЖИТЬ», Вы подтверждаете, что им являетесь
 pikfarma.ru
pikfarma.ru
Элькар® - метаболическое средство пациентов с хронической ишемией мозга и патологией сердца / постинфекционной астенией, далее...
Лечение постинфекционной астении и постковидного синдрома
Реалии и перспективы применения L-карнитина в кардиологии
СтатьиОпубликовано:
Российский кардиологический журнал 2013, 5 (103): 73–80
Аронов Д. М. Карнитин — соединение, близкое к витаминам группы В. Он участвует в выработке энергии в митохондриях. L-карнитин контролирует скорость окисления длинно-цепочечных жирных кислот, выступая в качестве специфического кофактора, облегчающего их перенос через внутреннюю мембрану митохондрий. Он участвует в удалении их избытка из митохондрий, а затем и из цитоплазмы. Эти эффекты предупреждают развитие цитотоксического эффекта.
В обзоре представлены исследовательские работы, отвечающие требованиям доказательной медицины.
Установлено, что у больных ОИМ L-карнитин приводил к меньшей некротизации миокарда и улучшению течения ИМ (число конечных точек в основной группе равнялось 15,6%, в контрольной — 26%).
В первые 5 дней лечения ОИМ L-карнитином было выявлено достоверное снижение смертности у больных основной группы.
У больных стабильной стенокардией L-карнитин уменьшает общую смертность повторные ИМ, желудочковые нарушения ритма. При перемежающейся хромоте L-карнитин приводит к достоверному увеличению расстояния, проходимого без боли. Препарат хорошо переносится, серьёзные побочные эффекты не встречались.
Ключевые слова: L-карнитин, ОИМ, перемежающаяся хромота.
ФГБУ “ГНИЦ ПМ” Минздрава РФ, Москва, Россия
Аронов Д. М. — д. м.н., профессор, заслуженный деятель науки РФ, руководитель лаборатории кардиологической реабилитации.
Автор, ответственный за переписку (Corresponding author): aronovdm@mail.ru; daronov@gnicPM.ru
АПФ — ангиотензинпревращающий фермент, ИМ — инфаркт миокарда, ОКС/ ОИМ — острый коронарный синдром/острый инфаркт миокарда, ОР — относительный риск, ХСН — хроническая сердечная недостаточность, ЭДО — энддиастолический объем, ЭСО — эндсистолический объем.
L-carnitine in cardiology: reality and perspectives
Aronov D. M. Carnitine is a substance close to vitamins B, which participates in the mitochondrial energy synthesis. L-carnitine controls the rate of the long-chain fatty acid oxidation and acts as a specific co-factor facilitating their transport via the internal mitochondrial membrane. It also participates in the elimination of long-chain fatty acid excess from mitochondria and cytoplasm. These effects prevent cytotoxicity.
This review presents the results of the studies which comply with the standards of evidence-based medicine.
It has been shown that in patients with acute myocardial infarction (AMI), L-carnitine therapy was associated with a reduction in myocardial necrosis and an improved clinical course of AMI (end-point incidence in the main and control groups was 15,6% and 26%, respectively).
In the first 5 days of L-carnitine therapy, there was a significant reduction in mortality in the main group of AMI patients.
In patients with stable angina, L-carnitine reduces the risk of all-cause mortality, repeat AMI, and ventricular arrhythmias. In patients with intermittent claudication, L-carnitine significantly increases the pain-free walking distance. This medication is well tolerated, with no registered major adverse effects.
Key words: L-carnitine, acute myocardial infarction, intermittent claudication.
Russ J Cardiol 2013, 5 (103): 73–80
N. I. Pirogov Russian National Medical Research University, Moscow, Russia.
Существует ряд биологических субстанций, которые могут быть полезными при остром коронарном синдроме или остром инфаркте миокарда (ОКС/ОИМ), но формально находящихся как бы в подвешенном состоянии. Имеется в виду, что официальные рекомендации не упоминают их вовсе или упоминают в пределах II С уровней доказанности.
Между тем, имеются теоретические предпосылки к тому, чтобы надеяться на их эффективность ввиду того, что эти субстанции участвуют в дыхательном цикле Кребса, в процессах энергообмена в клетках, в том числе и в миокарде, а также в подавлении оксидативного стресса. Соответственно существует достаточная литературная база, основанная на результатах экспериментальных исследований (как правило, с положительным эффектом, в том числе при экспериментальной ишемии/реперфузии). Имеются также клинические исследования, как правило, с достоверным положительным эффектом, но, с точки зрения современной доказательной медицины, не соответствующие ее критериям (главным образом из-за отсутствия двойных — слепых рандомизированных исследований с включением достаточного числа больных, с продолжительным сроком наблюдения). К подобным препаратам относится ряд известных в медицине биохимических субстанций — такие, как коэнзим Q10, неотон, L-карнитин и другие.
Классическим образцом такого рода исследований может служить рандомизированное двойное слепое, перекрестное исследование [1], в котором больные со стабильной стенокардией (n=18) получали в течение 30 дней пропионил-L-карнитин. Исследовались результаты повторной нагрузочной пробы, давшие достаточно скромный, но все же положительный результат. В заключении авторы сообщают: “Похоже, что пропионил-L-карнитин оказывает эффект, подобный антиишемическому (antiischemic like effect) — возможно, за счёт своей метаболической активности”.
В нашем обзоре представлены исследовательские работы по применению в кардиологии L-карнитина, которые отличаются достаточной строгостью протокола и доказанностью достигнутых эффектов при лечении больных. Недостаточная концентрация этой субстанции в миокарде при экспериментальной ишемии миокарда была выявлена еще в 70–80-е годы прошлого века [2–4].
Известно, что карнитин — соединение, близкое к витаминам группы В. Биологической активностью обладает его L-изомер, или L-карнитин (левокарнитин), который частично образуется в организме и частично поступает с пищей. L-карнитин играет важную роль в выработке энергии в митохондриях. В условиях ишемии в митохондриях накапливается ацетилкоэнзим А, баланс которого со свободным коэнзимом А поддерживается за счет работы так называемого карнитинового челнока, транспортирующего ацильные остатки жирных кислот. L-карнитин контролирует скорость окисления длинно-цепочечных жирных кислот, выступая в качестве специфического кофактора, облегчающего их перенос через внутреннюю мембрану митохондрий. Он участвует в удалении их избытка из митохондрий, а затем и из цитоплазмы. Эти эффекты предупреждают развитие цитотоксического эффекта. Удаляя из митохондрий избыток ацильных групп, L-карнитин способствует образованию малонил-коэнзима А, который тормозит работу карнитининового челнока, тем самым в условиях ишемии он снижает скорость бета — окисления [5].
Клинические исследования с L-карнитином при остром инфаркте миокарда
Наиболее ранним и весьма продуктивным оказалось многоцентровое рандомизированное плацебо — контролируемое исследование CEDIM [6]. По замыслу авторов ставилась задача изучить на самых ранних стадиях развития ОИМ возможность предотвращения дилятации полости левого желудочка сердца с целью предупреждения постинфарктной ХСН, являющейся наиболее частой причиной летальных исходов.
В исследование было включено 472 больных ОИМ передней локализации. В основной группе после рандомизации оказалось 233, в контрольной — 239 больных. Лечение (стандартное + плацебо для больных контрольной группы; стандартное + L-карнитин для больных основной группы) начиналось в среднем через 12,7±7,17 часов от начала болевого приступа. Тромболизис был произведён у 79% больных основной и 77% больных контрольной группы. Больные с ОИМ после 5 дней в/в вливания 9 г L-карнитина в последующем получали per os 6 г препарата в течение 1 года.
Следует обратить внимание на то, как в те времена лечились больные ОИМ в стационаре (табл. 1).
Таблица 1
Медикаментозная терапия больных перед выпиской из стационара
| Лекарства | L-карнитин количество больных (%) | Плацебо количество больных (%) |
| Дигиталис | 24 (10,3) | 23 (9,6) |
| Мочегонные | 40 (17,2) | 44 (18,4) |
| Антиагреганты | 163 (70) | 167 (69,9) |
| Антикоагулянты | 65 (27,9) | 63 (26,4) |
| Ингибиторы АПФ | 16 (6,9) | 20 (8,4) |
| Бета-блокаторы | 75 (32,2) | 91 (38,1) |
| Нитраты | 137 (58,8) | 142 (59,4) |
| Антагонисты кальция | 59 (25,3) | 56 (23,4) |
| Антиаритмики | 19 (8,2) | 11 (4,6) |
Напоминаем, что исследование проводилось в начале девяностых годов прошлого века и, как видно, оно разительно отличается от современных подходов к лечению. Так, ингибиторы АПФ получали 6,7% и 8,4% больных в основной и контрольной группе. Бета-блокаторы — 32,2% и 38,1% больных. Статины не применялись вовсе. Нитраты получали около 60% больных, что косвенно свидетельствует о значительном распространении стенокардии среди пациентов. Мы специально останавливаемся на этих вопросах, чтобы подчеркнуть роль L-карнитина в кардиопротекции при ОИМ в период, когда не применялись такие хорошо известные теперь препараты с отличными кардиопротективными свойствами как статины, бета-блокаторы, ингибиторы АПФ/блокаторы ангиотензиновых рецепторов. Следует также особо остановиться на отношении организаторов к выполнению эхокардиографического исследования. Оно было главным инструментом в оценке сохранности миокарда в процессе лечения и наблюдения. Применялась сложная система объективной оценки результатов ЭхоКГ, вплоть до того, что измеренные параметры стандартно отправлялись в специальную лабораторию, специализирующуюся на высококачественной оценке ультразвуковых параметров сердца.
Как видно из таблицы 2 и рисунка 1, у больных основной группы через 3 месяца терапии выявляются значительные преимущества в состоянии сердечной мышцы и её сократительной способности.
Таблица 2
Величина увеличения энддиастолического объема (ЭДО) и эндсистолического объема (ЭСО) и фракции выброса (ФВ) левого желудочка сердца к концу первого года наблюдения
| L-карнитин | Плацебо | P | |
| 12 месяцев | n=176 | n=172 | |
| ЭДО (ml) | 19,1± 2,7 | 28,5± 3,1 | 0,02 |
| ЭСО (ml) | 29,0± 3,9 | 39,9± 4,2 | 0,05 |
| ФВ (%) | - 5,0± 1,2 | - 5,6± 1,2 | 0,70 |
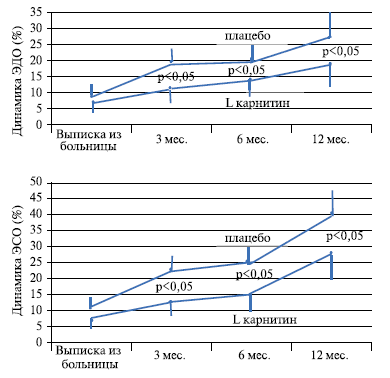
Рис. 1. Динамика энддиастолического (верхняя часть рисунка) и эндсистолического (нижняя часть рисунка) объёмов сердца у больных групп плацебо и L-карнитина в течение 12 месяцев.
Объёмы сердца в конце диастолы и систолы у больных основной группы были на 16% и 15% меньше, чем у больных контрольной группы. Хорошо известно, что сердечная недостаточность развивается тем чаще и в большей степени выраженности, чем больше потеря кардиомиоцитов вследствие некроза [7, 8]. В процесс компенсации частичной утраты сократительной способности сердца вступает неповрежденная часть миокарда. Недостаточная сократимость миокарда компенсируется симпатической стимуляцией здоровой части миокарда. Работа в условиях тахикардии и усиления напряжения стенки левого желудочка сердца способствует растяжению миокардиальных волокон в неинфарцированной зоне сердца. Так начинается процесс ремоделирования левого желудочка после ИМ.
Поэтому авторы делают совершенно обоснованный вывод о том, что исследование CEDIM говорит о возможности предотвращения ремоделирования левого желудочка сердца после перенесённого ОИМ, если больной в ранние сроки острого периода болезни будет получать естественный биологический агент — L-карнитин. Уменьшение объёма некротизированной ткани в процессе развивающегося некроза и сохранение большего количества кардиомиоцитов ведёт к сохранению функциональной способности сердца и предотвращению развития в последующем ХСН [9]. В рассматриваемом исследовании случаи ХСН развились у 1,7% больных основной и у 4,2% — контрольной группы.
Это означало, что у больных, получивших L-карнитин, было частично предотвращено постинфарктное ремоделирование левого желудочка сердца, которое является основой возникновения ХСН и, возможно, гибели от нее. Это тем более важно, что к окончанию исследования CEDIM [6] еще не пользовались ингибиторами АПФ и не были известны результаты исследования SAVE, показавшего, что именно вследствие применения ингибитора АПФ у больных с ХСН произошло предотвращение ремоделирования левого желудочка сердца, удалось снизить постинфарктную СН и летальность от нее.
Видно, что на всех сроках исследования (за исключением первичного) показатели энддиастолического и эндсистолического объемов левого желудочка сердца достоверно ниже у больных, получавших L-карнитин на протяжении 12 месяцев. Этот факт является наиболее сильным аргументом в пользу утверждения доказанности предотвращения патологического ремоделирования сердца у больных с первичным передним ИМ с подъемом сегмента ST под влиянием L-карнитина.
Следовательно, исследование CEDIM [6] практически было первым, показавшим, что добавление к терапии больных с острым передним ИМ естественной субстанции — L-карнитина — эффективно защищает сердце от дегенеративных изменений, ведущих к ХСН и смерти.
Заслуживает внимания исследование по применению L-карнитина при ОИМ, выполненное индийскими авторами [11]. Практически это исследование выполнялось в то же время, что и исследование CEDIM итальянских авторов. Кроме того, это исследование представляет интерес тем, что включенные в него больные ОИМ пользовались гораздо меньшей дозой L-карнитина — 2 г/в день per os., а общий срок наблюдения за больными авторы ограничили 28 днями. В остальном исследование выполнено достаточно строго: рандомизированное, двойное слепое, плацебо — контролируемое. Число включенных в исследование больных — 51 в группе карнитина, 50 — в группе плацебо. Исследовали в динамике миокардиальные ферменты, пероксидазы липидов (т. е. показатели перекисного окисления), повторно производили суточное мониторирование ЭКГ для изучения нарушений ритма. Ставилась задача выявить влияние карнитина на величину некроза миокарда (по динамике креатинина и МВ креатинкиназы).
Для этого забор крови на энзимы миокарда производился через каждые 4 часа в первый, через 6 часов — во второй, далее — 1 раз в день в последующие 8 дней. Кроме того, исследовали динамику шкалы QRS ЭКГ. При поступлении в стационар разницы между 2 группами больных по исследуемым параметрам не обнаружено, включая прием медикаментов до поступления в стационар.
С первого дня поступления больные получали либо плацебо, либо 2 г/день L-карнитина в течение 28 дней в дополнение к стандартной терапии. Мониторировались уровни миокардиальных ферментов, показатели перекисного окисления липидов.
К 28-му дню объём некротизированного миокарда был достоверно меньше у получавших L-карнитин (7,4±1,2 vs 10,7±2,0), индекс QRS был значительно снижен по сравнению с показателями больных контрольной группы. Было обнаружено, что в группе получавших карнитин, величина некроза миокарда достоверно (р<0,01) была меньше, индекс шкалы QRS ЭКГ был также достоверно (р<0,01) ниже, чем в группе плацебо. Величины аспартат-трансферазы, лактат дегидрогеназы, липидпероксидазы также были достоверно (р<0,05) ниже, чем в группе плацебо. Клинические данные были достоверно лучше по таким показателям как частота приступов стенокардии (снижение относительного риска (ОР) на 51%), ухудшение функции сердца (снижение ОР на 35%), наличие аритмии (снижение ОР на 51%), повторный ИМ (снижение ОР на 44%) и общее число кардиальных осложнений (снижение ОР на 40%). Лактатдегидрогеназа через 6–7 дней болезни возрастала достоверно реже, чем у больных на плацебо. Клинические показатели были благоприятнее у получавших L-карнитин, чем плацебо. В частности, стенокардия отмечалась в 17,6% vs 28%, соответственно у больных основной и контрольной группы; больных с тяжелыми функциональными классами (III–IV ФК ХСН) и расширением полости левого желудочка было соответственно 23,4% vs 36,6%, с аритмиями –13,7% vs 28%. Общее количество серьезных сердечно-сосудистых событий наблюдалось в 15,6% vs 26%, соответственно.
Таким образом, эта работа [11], законченная в 1996 г., показала, что при наблюдении в течение 28 дней у больных ОИМ, получавших весьма умеренную дозу L-карнитина (2 г/день per os) было достоверно установлено уменьшение ЭКГ — признаков поражения миокарда, уменьшение активности перекисного окисления липидов, и, главное, значительное улучшение течения ОИМ (почти в 2 раза меньшее число серьезных кардиальных осложнений).
Особенностью работы авторов явилось то, что больным назначали самую меньшую дозу L-карнитина (2 г/день per os). Обращает также на себя внимание то обстоятельство, что больные наблюдались короткий период времени (28 дней).
Грузинские авторы [12] провели с L-карнитином исследование почти по протоколу исследования CEDIM (1995). Под их наблюдением находились 2 группы больных ОИМ передней локализации, рандомизированных в группу L-карнитина (по 3 г в/в 3 раза в день в течение первых 5 дней, далее — по 2 г 2 раза в день per os в течение 180 дней) и группу плацебо.
Изучали динамику сердечных ферментов, ФВ левого желудочка, клинические осложнения и исходы. Рандомизация больных происходила в течение 24 часов в сутки в специальном центре по телефону. В группе карнитина было 45, в группе плацебо — 53 больных.
Число умерших в течение наблюдения составило 9,7% в группе карнитина, 12,35 — в группе плацебо; (р<0,05).
Повторные ИМ + смерть в группе получавших карнитин случались реже на 15,7%, чем в группе плацебо. Развитие СН произошло на 43,7% реже, чем в группе плацебо (к сожалению, авторы не представили сведений о достоверности различий).
Иначе говоря, это исследование методически было хорошо организовано и окончилось недвусмысленным положительным результатом — достоверным снижением 6-месячной общей летальности, случаев ИМ + смерть и развития СН на значительный процент при применении L-карнитина.
Группа авторов [10] организовала крупное современное исследование СЕDIM-2, полностью соответствующее стандартам доказательной медицины. По протоколу исследования оно практически повторяет протокол исследования CEDIM от 1995г [6]. Поэтому авторы позволили себе придать своему исследованию название CEDIM-2, хотя эти два исследования выполнены абсолютно разными группами исследователей и в совершенно разных медицинских учреждениях. Исследование CEDIM выполнено в Нидерландах, а исследование CEDIM-2 — в Италии. Оно было рандомизированным, двойным — слепым, многоцентровым, плацебо контролируемым. При запланированном включении в исследование 4000 больных ОИМ исследование было приостановлено после включения 2300 больных в связи с несоблюдением предполагавшихся сроков включения больных. Тем не менее, 2300 больных ОИМ, прослеженных в течение 6 мес., представляют серьезный материал для анализа.
Первичной целью исследования являлось изучение частоты летальных исходов, развитие ХСН, вторичная цель — изучение летальности в первые 5 дней наблюдения в рандомизированных группах больных, дополнительно к стандартной терапии получавших в первые 5 суток либо плацебо, либо 9,0 г L-карнитина в/в, далее по 4 г/день внутрь в течение 6 месяцев. В контрольной группе больные получали плацебо. Рандомизация производилась по телефону централизованно. Участвовали в исследовании 153 медицинских центра (один центр выбыл из исследования в начале работы, включив 1 больного, который не был включен в статистический анализ). По антропометрическим данным, клиническим, анамнестическим данным больные двух групп (1168- на L-карнитине, 1162 — на плацебо) были равноценны. Поступление больных в стационар происходило через 5,3 и 5,26 часов от начала приступа. Тромболизис был произведён 76,9% больных в основной и 78,0% в контрольной группе больных. Внутрикоронарное вмешательство — в 11,9% и 10,9% случаев.
За 6 месяцев в основной и контрольной группах (рис. 2) летальный исход наступил у 67 и 75 больных, соответственно. Разница в летальности между двумя группами за весь период наблюдения была недостоверна и составила 12% (Р=0,26). Тем не менее летальность за первые 5 дней была достоверно ниже в основной группе (2,3% vs 3,8%, Р<0,041). Лечение L-карнитином не было отменено ни одному больному. Как видим, в исследовании получено достоверное снижение ранней смертности в госпитальный период и недостоверное снижение смертности в течение 6 месяцев.
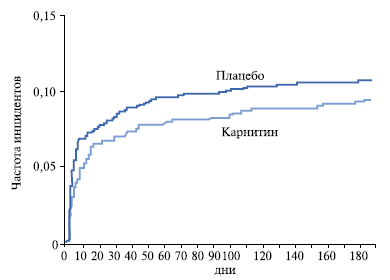
Рис. 2. Кривые летальности больных основной и контрольной групп в исследовании CEDIM-2 [10].
Следует отметить, что по предварительным расчетам для получения достоверных различий в достижении первичной конечной точки — снижения летальности в течение 6 месяцев на 20% — необходимо было включить в исследование не менее 4000 больных ОИМ. За период с 24 июня 1997г по 15 декабря 2002г всего в исследование было включено 2330 больных, т. е. расчетная мощность исследования не была достигнута в связи с тем, что темп включения больных в исследование не соответствовал требованиям протокола. Наблюдательным комитетом было решено прекратить исследование досрочно. Следует обратить внимание на кривые выживаемости больных, представленные на рисунке 2. Их расхождение начинается буквально после 5–6 дней. Дистанция между кривыми (в процентном отношении) на протяжении всего срока наблюдения достаточно ощутима; по крайне мере, нет тенденции к их слиянию.
Тем не менее, исследование CEDIM-2 [10] при всей его незавершенности по организационным причинам имеет вполне положительный результат — снижение уровня летальности в течение 5 дней от момента госпитализации при добавлении L-карнитина к стандартной терапии ОИМ в сравнении с добавлением плацебо. Возможно также, что после прекращения введений L-карнитина внутривенно по 9 г/сутки, его дальнейшее назначение в дозе 4 г/день, принимаемых per os, оказалось недостаточным для проявления полного эффекта лечения [10].
Метаанализы исследований L-карнитина
DiNicolantonio JS [13, 14] из клиники Mayo (США) произвели отбор и системный анализ статей, посвященных применению L-карнитина во вторичной профилактике у коронарных больных. У авторов были строгие требования к рассматриваемым ими статьям. Из 153 статей, включенных в первичный анализ, оказались годными для окончательного анализа лишь 13.
Исследования были контролируемые, рандомизированные. В контрольных группах больные получали плацебо или обычное лечение. Обе группы больных получали одинаковую базисную терапию, не имели существенных различий по антропометрическим и основным медицинским параметрам. Срок наблюдения колебался в пределах 0,7–12 месяцев.
В 11 статьях были представлены сведения, годные для получения летальности под влиянием L-карнитина в сравнении с плацебо или контролем (N=3579 больных). Общая летальность под влиянием L-карнитина оказалась достоверно сниженной на 27%. р<0,001).
В 5 статьях (n=829) изучали частоту повторных инфарктов миокарда. Снижение частоты повторных инфарктов миокарда имело место в 22% случаев, но разница между группами оказалась недостоверной (р=0,45). У 261 больного ИБС авторы исследовали влияние L-карнитина на частоту приступов стенокардии. Имело место 40%-е снижение частоты приступов (р<0,0001).
Особое внимание уделено применению L-карнитина у больных ОИМ с СН. В 7 работах, посвященных этому вопросу, установлена лишь слабая тенденция к сокращению этого осложнения (–15%, р=0,20). В статье не представлены дозы назначавшегося L-карнитина. Тем не менее, в обсуждении указывается, что минимальная эффективная доза препарата 2 г/день, а оптимальная — 6,0–9,0 г/день.
Таким образом, этот мета-анализ статей [13], включенных в исследование по изучению эффекта L-карнитина в сравнении с плацебо или с обычным лечением, показал достаточную эффективность препарата в предотвращении серьезных последствий ИБС после перенесенного ОИМ. Установлено, что L-карнитин снижает на 27% (р<0,001) общую смертность, уменьшает частоту желудочковых нарушений ритма на 65% (р<0,001), не оказывает достоверного влияния на повторность инфаркта миокарда (20%, р=0,40) и значительно снижает частоту развития приступов стенокардии (40%, р<0,0001).
Переносимость препарата была хорошей; не было случаев его отмены. Заканчивают авторы свою статью призывами к организации более крупного “достойного” рандомизированного исследования [13].
Перемежающаяся хромота и L-карнитин
В 2013г [14, 15] произвели обзор статей, посвященных применению L-карнитина при перемежающейся хромоте. В анализ включали рандомизированные исследования. Качественную оценку статьям давали по шкале Jadal. Среди первоначально отобранных 40 статей 23 были исключены из-за несоответствия критериям включения.
Больные основной группы на фоне стандартной терапии, обязательной для контрольной и основной групп, получали L-карнитин в дозе 300–2000 мг в течение 90 дней. В 7 исследованиях изучали динамику расстояния, проходимого без боли и общее проходимое расстояние. Под влиянием лечения препаратом установлена прибавка расстояния, проходимого без боли и общего проходимого больным расстояния на 71–135 м.
В 22 других исследованиях длительностью до 1 года лечения 600–3000 мг L-карнитина (n=485 больных) было установлено, что под влиянием лечения в 7 из 8 рандомизированных исследований обнаружено статистически достоверное увеличение проходимого без боли расстояния на 31–54 м и общего расстояния — на 9–86 метров.
В 4 других перекрестных исследованиях установлено увеличение безболевой дистанции ходьбы на 23–132 м и общей проходимой дистанции на 104 м.
Авторы установили также, что внутривенное введение препарата более эффективно, чем употребление его per os и что терапевтический эффект выражен больше у больных с тяжелой перемежающейся хромотой.
Таким образом, это исследование дает возможность считать, что по результатам мета — анализа получены доказательства эффективности L-карнитина при перемежающейся хромоте — класс доказательности А: применение L-карнитина при периферическом атеросклерозе, протекающем с перемежающейся хромотой, достоверно увеличивает расстояния, проходимые больными.
Отечественные исследования
Семиголовский Н. Ю. и соавт. [16] применили в пилотном исследовании внутривенное введение препарата L-карнитина отечественного производства (Элькар, компания “ПИК-ФАРМА”) при остром инфаркте миокарда. Ставилась задача выяснить возможную эффективность парентального введения элькара в первые 5 дней ОИМ передней локализации с низкой фракцией выброса (<40%) для воздействия на функцию миокарда левого желудочка. В динамике в первые и на 5–7-е сутки ИМ у больных определяли ФВ левого желудочка по Simpson и активность тропонина I, КФК, МВ-КФК. В основной группе было 35, в контрольной — 24 больных ОИМ. Группы были идентичны по антропометрическим и основным медицинским параметрам за исключением несколько большего процента больных с повторным ИМ в основной группе (р<0,05).
Как показал анализ, средняя продолжительность пребывания в отделении реанимации у больных, получавших элькар, имела тенденцию к снижению по сравнению с контрольной, а ФВ ЛЖ у них ускоренно нарастала к 5–7 м суткам введения препарата по сравнению с таковой у пациентов контрольной группы (с 35,5±0,9 до 45,4±1,2% против 35,8±0,7 до 40,1±0,9%; р<0,05). Выявлен дозо-зависимый эффект элькара — положительная достоверная корреляция суммарной дозы препарата, полученной каждым пациентом, с повторно определенной на 5–7-е сутки заболевания ФВ ЛЖ (r=0,67; р<0,05).
Что касается механизмов фармакологического защитного действия элькара, то по результатам исследования можно предположить наличие у него кардиопротективного, мембраностабилизирующего свойств. Активность всех изучавшихся ферментов крови (тропонин I, КФК, КФК-МВ) у лиц основной группы в динамике была во всех случаях достоверно ниже, чем у больных контрольной. Меньшее повреждение кардиомиоцитов (по быстрой и выраженной динамике показателей миокардиальных ферментов, по более высоким показателям функциональной способности левого желудочка сердца), произошедшее за первую неделю от начала ОИМ, свидетельствует о весьма позитивном влиянии элькара на больных ОИМ с выраженной дисфункцией сердца. За период наблюдения скончались 2 и 1 больной в контрольной и основной группе, соответственно.
Практически это первое исследование в России, выявившее положительное влияние L-карнитина на миокард при ОИМ. Эти данные обнадеживают нас. Конечно, было бы вполне естественно после этого пробного исследования организовать и выполнить рандомизированное многоцентровое исследование с применением препарата не только в остром периоде, но и в последующие месяцы. В случае положительного результата за счет дополнительного эффекта метаболической терапии (L-карнитина) нам удалось бы значительно улучшить течение ОИМ, уменьшить повторные госпитализации и, возможно, отдаленную летальность при этом заболевании.
Оценивая в целом результаты работ по применению L-карнитина при ОИМ, мы убедились в том, что добавление L-карнитина к стандартной терапии оказалось успешным как в первые 5 дней заболевания (острейший и острый период заболевания), так и в раннем (первый месяц заболевания) и в более отдаленном периоде болезни (6–12 месяцев). Минимально эффективная доза препарата — 2 г/день. Следует отметить, что выявлен дозо-зависимый эффект действия L-карнитина, а также зависимость этого эффекта от способа введения препарата (лучший эффект при внутривенном введении препарата в первые 5–10 дней болезни).
Особого внимания заслуживает тот факт, что ни в одной статье не выявлена непереносимость L-карнитина и какие-либо (даже незначительные) осложнения.
Заключение
В приведенном нами обзоре использовались клинические исследования и мета-анализы, соответствующие критериям доказательной медицины. Анализ показывает, что L-карнитин является важной биологической субстанцией, принимающей активное участие в тканевом дыхании (как участник цикла Кребса) в энергоообразовании в митохондриях клеток и в регулировании окисления свободных жирных кислот.
В условиях ишемии или некроза миокарда введение экзогенного L-карнитина в виде лекарственного средства приводит к уменьшению потери кардиомиоцитов и предотвращению ремоделирования левого желудочка сердца, являющегося предиктором развития ХСН и, возможно, преждевременной гибели больного.
Кардиопротективный эффект препарата проявляется уже в первые 5 дней от начала ОИМ при условии его раннего назначения в дозе до 9 г внутривенно ежедневно.
При продолжении лечения до 12 месяцев (прием препарата per os в дозе от 2,0г до 4,0г (день) кардиопротективный эффект наращивается (о чем свидетельствует достоверное снижение летальных случаев в группе больных, принимавших препарат, в сопоставлении с больными контрольной группы (снижение относительного риска общей смертности на 27%, желудочковых нарушений ритма сердца на 65%, снижение частоты развития приступов стенокардии на 40%).
При лечении больных стенозирующим атеросклерозом артерий нижних конечностей и перемежающейся хромотой наблюдали увеличение проходимого больными расстояния до появления боли в ногах на 71–135 м, а также увеличение общего расстояния ходьбы.
Имеются обнадеживающие результаты применения отечественного препарата L-карнитина (Элькар, компания “ПИК-ФАРМА”) при остром инфаркте миокарда.
Приведенные сведения заслуживают пристального внимания, но последних явно недостаточно, чтобы врачи широко могли использовать их в клинической практике.
Все цитировавшиеся авторы считали, что имеется необходимость в организации “достойных” исследований по применению L-карнитина при ОИМ, инсульте головного мозга и при других сердечнососудистых заболеваниях (стабильная стенокардия, периферический атеросклероз, ХСН). Под “достойными” понимаются исследования рандомизированные, двойные слепые, плацебо-контролируемые с достаточным (по статистическим расчетам) количеством включаемых больных в зависимости от ожидаемой эффективности по снижению основных конечных точек. Напоминаем, что при выполнении незавершенного исследования CEDIM-2 [10] расчеты показали, что для получения 20%-ной достоверной разницы между основной и контрольной группами по снижению смертности при наблюдении больных в течение 6 месяцев, было необходимо включить в исследование 4000 больных ОИМ. Также представляется сомнительным, что найдется еще один спонсор для проведения дорогостоящего крупномасштабного клинического исследования по влиянию на прогноз такой молекулы как L-карнитин, которая широко используется во всем мире и не подлежит патентной защите.
Лечение больных ОИМ находится под тщательным контролем международных, региональных и национальных обществ. Без их участия в решении данного вопроса широкое внедрение метаболических препаратов типа L-карнитина невозможно.
Ключевые фигуры в кардиологическом сообществе должны пробудить внимание инвесторов, специалистов, национальных кардиологических обществ к решению данной проблемы. Эффективное решение ее даст возможность улучшить лечение ОИМ и других серьезных заболеваний, снизить летальность и возможность развития ХСН.
Литература
- Cherchi A., Lai C., Onnis E., et al. Propionyl carnirine in stable effort angina. Cardiovasc Drugs Ther., 1990; Apr; 4 (2):481–6.
- Shug A. L., Thоmsen J. H., et al. Changes in tissue levels of carnitine and metabolites during myocardial schemia and anoxia. Arch. Biochem. Biophys.1978; 187, (1):25–33.
- Opie L. H. Role of carnitine in fatty acid metabolism of normal and ischemie myocardium. Am Heart J 1979; 97:375–88.
- Spagnoli L. G., Corsi M., Villaschi S., et al. Myocardial carnitine deficiency in acute myocardial infarction. Lancet 1982; 1419–20.
- Astashkin E. I., Glezer M. G. Role of L-carnitine in energy metabolism cardiomyocytes and treatment of diseases of cardiovascular system. Cardiology and cardiovascular surgery, 2012, 6,2:58–65. Russian (Асташкин Е. И., Глезер М. Г. Роль L-карнитина в энергетическом обмене кардиомиоцитов и лечении заболеваний сердечно-сосудистой системы. Кардиология и сердечно-сосудистая хирургия, 2012, 6,2:58–65).
- Iliceto S., Scrutinio D., Bruzzi P., et al. Effects of carnitine administration on left ventricular remodeling after acute anterior myocardial infarction: the L-carnitine Ecocardiografia Digitalizzata Infarto Miocardico (CEDIM) Trial. J Am Coll Cardiol. 1995 26 (2):380–7.
- White H. D., Norris R. M., Brown M. A., et al. Left ventricular dysfunction and — systolic volume as the major determinant of survival after recovery from myocardial infarction. Circulation 1987; 76:44–51.
- Braunwald E. Myocardial reperfusion, limitation of infarct size, reduction of left ventricular dysfunction, and improved survival. Should the paradigm be expanded? Circulation 1989; 79:441–4.
- Rebuai A. G., Schiavoni G., Amico C. M., et al. Beneficial effect of L-carnitine in the reduction of necrotic area in acute myocardial infarction. Drugs Exp Clin Res 1984; 10: 219–223.
- Tarantini G., Scrutinio D., Bruzzic P., et al. Metabolic Treatment with L-carnitine in Acute Anterior ST Segment Elevation Myocardial Infarction. Cardiology 2006, 106:215–23.
- Singh R. B., Niaz M. A., Agarwal P., et al. A randomised, double-blind, placebo-controled trial of L-carnitine in suspected acute myocardial infarction. Postgrad MedJ 1996; 72:45–50.
- Kobulia B., Chapichadze Z., Andriadze G., et al. Effects of carnitine on 6-Month Incidence of Mortality and Heart Failure in Patients with Acute Myocardial Infarction. Annals of biomedical research and education. 2002; 2, 3:240–2.
- DiNicolantonio J. J., Lavie C. J., Fares H., et al. L-carnitine in the Secondary Prevention of Cardiovascular Disease: Systematic Review and Meta-analysis. Mayo Clin. Proc 2013: 1–8.
- Delaney C. L., Spark J. L., Thomas J., et al. A systematic review to evaluate the effectiveness of carnitine supplementation in improving walking performance among individuals with intermittent claudication. Atherosclerosis 2013; Mar 15. p: S0021–9150 (13) 00179–2.
- Brass E. P., Koster D., Hiatt W. R., et al. A systematic review and meta-analysis of propionylL-carnitine effects on exercise performance in patients with claudication. Vase Med. 2013 Feb; 18 (1):3–12.
- Semigolovskiy N. Yu., Vertsinskiy E. K., Azanov B. A. et al. Experience application of infusion of the domestic product of the left-carnitine deficiency syndrome small release of patients with acute myocardial infarction. Bul. Bakulev them. A. N. Bakuleva RAMS 2012; 3:69–72. Russian (Семиголовский Н. Ю., Верцинский Е. К., Азанов Б. А. и др. Опыт применения инфузионного отечественного препарата левокарнитина при синдроме малого выброса у больных острым инфарктом миокарда. Бюлл НЦССХ им. А. Н. Бакулева РАМН 2012; 3:69–72).

