Уважаемый посетитель!
Эта информация для специалистов здравоохранения
Нажимая «ПРОДОЛЖИТЬ», Вы подтверждаете, что им являетесь
 pikfarma.ru
pikfarma.ru
Элькар® - метаболическое средство пациентов с хронической ишемией мозга и патологией сердца / постинфекционной астенией, далее...
Лечение постинфекционной астении и постковидного синдрома
Посмотреть другую форму
Метаболическая терапия l-карнитином при переднем остром инфаркте миокарда с подъемом сегмента ST. Рандомизированное клиническое исследование
СтатьиОпубликовано в
Российском кардиологическом журнале № 4 (90) / 2011
G. Tarantini1, D. Scrutinio2 , P.Bruzzi, L. Boni3 , P. Rizzon4 , S. Iliceto1
Кардиологическое отделение Торакальных и Сосудистых исследований, Университет Падуи1 , Падуя;
Кардиологическое отделение "S. Maugeri Foundation", IRCCS , Бари; Отделение клинической эпидемиологии и клинических исследований, Национальный институт исследования опухолей3 , Генуя; Кардиологический институт Бари4 , Италия
Резюме
Известно, что терапия L-карнитином у пациентов с передним острым инфарктом миокарда (ОИМ) обладает протективным действием в отношении ремоделирования левого желудочка. Целью данного исследования была оценка влияния терапии L-карнитином на показатели смертности и частоты развития сердечной недостаточности у больных с передним ОИМ.
Исследование CEDIM 2 являлось многоцентровым рандомизированным, двойным слепым, плацебо-контролируемым клиническим испытанием, выполненным у больных с передним ОИМ. Запланированное число участников составляло 4000. Исследование было прекращено досрочно вследствие меньшей, чем ожидалось, скорости набора пациентов. В целом, в исследование были включены 2330 больных. Основной комбинированной конечной точкой являлась частота развития сердечной недостаточности либо летального исхода в течение 6 месяцев. Дополнительной конечной точкой являлась смертность в течение 5 дней.
В течение 6месяцев наблюдения частота основной конечной точки в группах L-карнитина и плацебо достоверно не различалась (9,2% против 10,5% соответственно; р=0,27). Среди больных, принимавших L-карнитин, наблюдалось снижение смертности в течение 5 дней (отношение рисков (ОР) = 0,61; 95% доверительный интервал (ДИ) 0,37-0,98;р=0,041).
В исследовании CEDIM 2 терапия L-карнитином приводила к снижению показателей ранней смертности (дополнительная конечная точка) у больных с передним ОИМ. Через 6 месяцев от момента рандомизации в группе L-карнитина не наблюдалось достоверного снижения риска смерти либо сердечной недостаточности (основная конечная точка).
Ключевые слова: острый инфаркт миокарда; инфаркт миокарда; фармакотерапия, метаболическая протекция.
Терапия, направленная на поддержание жизнеспособности ишемизированного миокарда, ограничение размера зоны инфаркта и замедление прогрессирования дилатации левого желудочка (ЛЖ), не только способствует сохранению глобальной сократимости ЛЖ, но и снижает смертность и частоту развития сердечной недостаточности у больных с острым инфарктом миокарда (ОИМ). В настоящее время эти терапевтические цели достигаются за счет тромболизиса либо первичной транслюминальной коронарной ангиопластики, а также блокады бета-адренорецепторов и ингибирования ангиотензин-превращающего фермента [1-4]. Тем не менее, несмотря на успехи реваскуляризации и снижающей нагрузку на ЛЖ медикаментозной терапии, показатели смертности у больных с ОИМ остаются высокими. Продолжается активный поиск дополнительных методов лечения, направленных на сохранение жизнеспособности миокарда, замедление прогрессиро-вания дисфункции ЛЖ и улучшение выживаемости после ОИМ.
Метаболическая протекция ишемизированного миокарда способна уменьшать выраженность неблагоприятных эффектов ишемии и реперфузии, что обусловливает дополнительные клинические преимущества этого терапевтического подхода у пациентов с ОИМ [5-8].
Карнитин (L-карнитин) является природным соединением, которое играет существенную роль в энергообразовании клетки на митохондриальном уровне. Известно, что карнитин препятствует индуцированному ишемией повышению концентрации длинно-цепочечных жирных кислот и, тем самым, ограничивает их токсический эффект ухудшающий функционирование клеток [9]. Было показано, что как в ишемизированном, так и в инфарцированном миокарде отмечается быстрое снижение запасов карнитина [10], и что назначение карнитина положительно влияет как на механические, так и на электрические свойства миокарда [11-16]. Кроме того, в многоцентровом рандомизированном исследовании CEDIM [17] было продемонстрировано, что назначение L-карнитина препятствует прогрессированию ремоделирования ЛЖ у пациентов с передним ОИМ. В течение года после развития ОИМ у участников исследования CEDIM наблюдалось достоверное уменьшение прогрессирования дилатации ЛЖ. С учетом благоприятного влияния L-карнитина на электрические и механические свойства миокарда, а также более медленного прогрессирования ремоделирования ЛЖ при приеме L-карнитина, нами было высказано предположение, что терапия L-карнитином способна улучшать клинический статус и показатели выживаемости у больных с передним ОИМ. Целью многоцентрового исследования CEDIM 2 было изучить, насколько оправдано это предположение.
Методы
Данное многоцентровое, рандомизированное, плацебо-контролируемое исследование было выполнено на базе 153 клинических центров. Протокол исследования был одобрен этическими комитетами каждого из участвующих центров. Перед включением в исследование у каждого участника было получено информированное согласие.
Участники исследования
Критериями включения в исследование были следующие признаки: типичная боль в грудной клетке продолжительностью не менее 30 минут, не купируемая при сублингвальном либо внутривенном назначении нитратов; развитие симптомов ОИМ в течение 12 часов, предшествовавших рандомизации; сохраняющийся подъем сегмента ST на >0,2 мВ в двух и более соседних грудных отведениях. Критерии исключения при госпитализации включали: возраст старше 80 лет; поражение клапанов сердца; гипертрофическую кардиомиопатию; врожденные пороки сердца; заболевания почек и печени с тяжелым клиническим течением; иные тяжелые заболевания, потенциально ограничивающие продолжительность жизни пациентов; географические и другие факторы, затрудняющие участие в исследовании; участие в иных клинических испытаниях; алкоголизм; беременность и лактация; отказ от предоставления информированного согласия на участие в исследовании.
Дизайн исследования
При поступлении в кардиологическое отделение пациенты рандомизировались в отношении приема L-карнитина либо плацебо. L-карнитин назначался внутривенно, в суточной дозе 9 г в течение первых 5 дней. В течение последующих 6 месяцев препарат принимался перорально в суточной дозе 4 г. В каждом из клинических центров L-карнитин или плацебо назначались как дополнение к стандартной терапии. Рандомизация выполнялась централизованно и была стратифицирована лишь по одному признаку — клиническому центру. Сопоставимый объем групп L-карнитина и плацебо в каждом из клинических центров достигался за счет выполнения рандомизации в блоках различной длины.
Врачи-исследователи получали информацию о рандомизации по телефону с помощью компьютерной программы, которая была доступна круглосуточно 7 дней в неделю. Программа исходного обследования пациентов включала сбор анамнеза, общее физикальное обследование, обследование сердечно — сосудистой системы и сбор данных об ОИМ. Последующие визиты в клинику выполнялись через 1, 2, 3, 4 и 6 месяцев от включения в исследование.
Конечные точки
Основной комбинированной конечной точкой исследования была частота развития сердечной недостаточности либо смерти от любых причин в течение 6 месяцев наблюдения. Оценка наличия признаков сердечной недостаточности выполнялась не ранее, чем через 4 дня от включения в исследование. Критериями сердечной недостаточности были (1) одышка, хрипы в легких, рентгенологические признаки застоя в малом круге кровообращения в сочетании с одним из следующих параметров: (2) эхокардиографические признаки систолической дисфункции ЛЖ — фракция выброса ЛЖ <0,40 (метод Симпсона) или индекс подвижности стенки ЛЖ <1,2 [18], либо (3) потребность в назначении сердечных гликозидов, диуретиков и/или ингибиторов ангиотензин-превращающего фермента, а также необходимость увеличения доз этих препаратов, если они были назначены ранее в связи с сердечной недостаточностью. Решение о наличии сердечной недостаточности принималось экспертным комитетом в составе трех врачей-кардиологов, которые не знали о том, к какой группе рандомизации относился пациент. Оценка рентгенологических и эхокардиографических признаков сердечной недостаточности также выполнялась слепым методом. В случае разногласий экспертное решение принималось коллегиально. Дополнительной конечной точкой было влияние терапии L-карнитином на смертность в течение 5 дней. Лишь для двух участников исследования отсутствовала информация о жизненном статусе через 5 дней от начала исследования.
Размер выборки
Ожидалось, что включение 4000 пациентов и их последующее наблюдение в течение 6 месяцев обеспечит мощность исследования не менее 90% и позволит выявить относительное снижение частоты основной конечной точки на 20% (с 20% до 16%) в группе L-карнитина по сравнению с плацебо (уровень значимости 0,05 для двустороннего критерия).
Статистический анализ
Анализ данных был выполнен в группах рандомизации (intention-to-treat). Основной анализ данных включал сравнение 6-месячных кривых выживаемости Каплана-Мейера, отражавших кумулятивную частоту сердечной недостаточности либо смерти от любых причин с помощью однофакторного лог-ранк теста. При дополнительном анализе данных аналогичный метод применялся для оценки иных конечных точек и/или иных временных промежутков. Кроме того, с помощью многофакторного регрессионного анализа Кокса оценивалась частота развития комбинированной конечной точки либо смерти от любых причин с целью устранения возможного несоответствия между группами вмешательства в отношении изучаемых независимых переменных, а также для выявления статистического взаимодействия между характером терапии и теми или иными прогностическими факторами. В регрессионную модель были включены следующие независимые переменные: группа рандомизации (L-карнитин либо плацебо); возраст (5 возрастных групп: до 50 лет, 50-60, 60-65, 65-70 и старше 70 лет); гипертензия в анамнезе; сахарный диабет в анамнезе; частота сердечных сокращений; систолическое артериальное давление; диастолическое артериальное давление; класс сердечной недостаточности по Killip (I либо >I); время от развития клинической симптоматики до госпитализации (3 группы — до 3 часов, 4-6 часов и более 6 часов). Наличие значимого взаимодействия между группой вмешательства и прогностическими факторами выявлялось с помощью включения соответствующих параметров взаимодействия в статистическую модель. Все значения p соответствовали двусторонним критериям значимости. Поскольку для всех изученных прогностических факторов не было выявлено статистического взаимодействия с группой вмешательства, и результаты многофакторного анализа были близки к данным, полученным в ходе однофакторного анализа, ниже представлены лишь результаты многофакторного анализа. Промежуточный анализ данных
Промежуточный анализ данных не был запланирован заранее. Тем не менее, к июлю 2002 г. число рандомизированных пациентов было менее 2300, что свидетельствовало о недостаточно быстром наборе участников исследования. В связи с этим, Рабочей Группой исследования была рассмотрена возможность досрочного прекращения клинического испытания. Поскольку это решение требовалось принять на основании объективных данных, был выполнен промежуточный анализ полученных результатов. Целью этого анализа была основанная на промежуточных результатах оценка вероятности того, что при продолжении набора участников и достижении запланированного объема выборки могут быть выявлены достоверные различия между группой активного вмешательства и группой плацебо. В отличие от стандартных методов промежуточного анализа, эта методика оценки "условной мощности исследования" ("conditional power", [19]) не требует поправки уровней значимости: исследование прекращается досрочно лишь при высокой вероятности отрицательных результатов. Во избежание нарушения слепого сбора информации у продолжавших наблюдение больных, в анализ вошли лишь данные 2047 пациентов, включенных в исследование до 31-го июля 2001 г
К 31-му августа 2002 г. было зарегистрировано 206 клинических событий, в том числе 107 в группе плацебо и 99 в группе карнитина (6-месячная кумулятивная частота 10,5% и 9,7% соответственно; р=0,54). Относительное снижение частоты основной конечной точки на 8% в группе L-карнитина не позволяло окончательно опровергнуть гипотезу о снижении частоты конечной точки на 20%. Тем не менее, анализ условной мощности исследования продемонстрировал крайне низкую вероятность выявления статистически значимого благоприятного эффекта L-карнитина, даже при существенном увеличении объема выборки. В частности, для достижения мощности исследования близкой к 80% было необходимо добиться объема выборки свыше 5600 больных. Таким образом, с учетом результатов промежуточного анализа данных (отсутствие статистически значимого влияния терапии L-карнитином на частоту комбинированной конечной точки), снижающихся темпов рандомизации и невозможности набора более 3000 пациентов в ограниченные сроки, Рабочей Группой было принято решение о досрочном прекращении исследования. После того, как Рабочая Группа остановила набор новых участников (см. Результаты), слепая фаза исследования была прекращена (15-го декабря 2002 г.). К этому времени в исследование было включено 2300 больных. В мае 2003 г. данные о выживаемости пациентов со сроком наблюдения менее 6 месяцев были обновлены путем контакта с лечащими врачами либо муниципалитетами по месту жительства участников. Анализ данных выполнялся с помощью статистического пакета SPSS 9.0.
Результаты
В целом, в исследование вошли 2330 пациентов (1168 в группе L-карнитина и 1162 в группе плацебо). Набор больных осуществлялся на базе 153 клинических центров с 24-го июня 1997 г. по 15-е декабря 2002 г. В одном из центров был рандомизирован лишь один пациент (группа плацебо), который в последующем отказался от продолжения участия в исследовании. Исходные данные и результаты наблюдения для этого пациента были исключены из анализа. Обе группы рандомизации были сопоставимы по исходным параметрам. Демографические и клинические характеристики участников исследования представлены в табл.1.
Таблица 1. Исходные демографические и клинические характеристики участников исследования
|
|
Группа плацебо |
Группа L-карнитина |
|
Возраст, лет |
61,4+0,31 |
61,1+0,32 |
|
Мужчины (%) |
913 (78,6) |
919 (78,7) |
|
Сахарный диабет в анамнезе (%) |
197 (16,9) |
189 (16,2) |
|
Гипертензия в анамнезе (%) |
480 (41,4) |
479 (41) |
|
Курение (%) |
497 (42,8) |
537 (46) |
|
Гиперхолестеринемия в анамнезе (%) |
395 (34) |
397 (34) |
|
Инфаркт миокарда в анамнезе (%) |
110(9,5) |
93 (8) |
|
Чрескожное коронарное вмешательство в анамнезе (%) |
23 (2,0) |
12 (1,5) |
|
Аортокоронарное шунтирование в анамнезе (%) |
110 (9,5) |
93 (8,1) |
|
Класс по Killip (%) |
|
|
|
I |
987 (85) |
993 (85) |
|
II |
139 (12) |
128 (11) |
|
III-IV |
35 (3) |
47 (4) |
|
Время от развития клинической симптоматики |
5,3+0,1 |
5,26+0,11 |
Примечание: различия между группами рандомизации не были статистически значимыми.
Среди участников преобладали мужчины (78%); средний возраст больных составлял 61 год. У 8,8% пациентов в анамнезе имелся ранее перенесенный инфаркт миокарда, и у 10,5% ранее была выполнена коронарная реваскуляризация — аортокоронарное шунтирование (8,8%) либо чрескожная коронарная ангиопластика (1,7%). Шестнадцать больных страдали сопутствующим сахарным диабетом, 44% были курильщиками, у 41,1% и 34% в анамнезе выявлялись артериальная гипертензия и гиперхолестеринемия соответственно. У 14,9% больных класс сердечной недостаточности по Killip был не ниже II. Среднее время от развития клинической симптоматики до начала вмешательства составляло 5,3 часа в обеих группах. Описание внутрибольничной терапии представлено в табл. 2. Следует отметить, что тромболизис был выполнен у 77,4% больных, 79% получали ингибиторы ангиотензин-превращающего фермента, и 68% принимали бета-блокаторы.
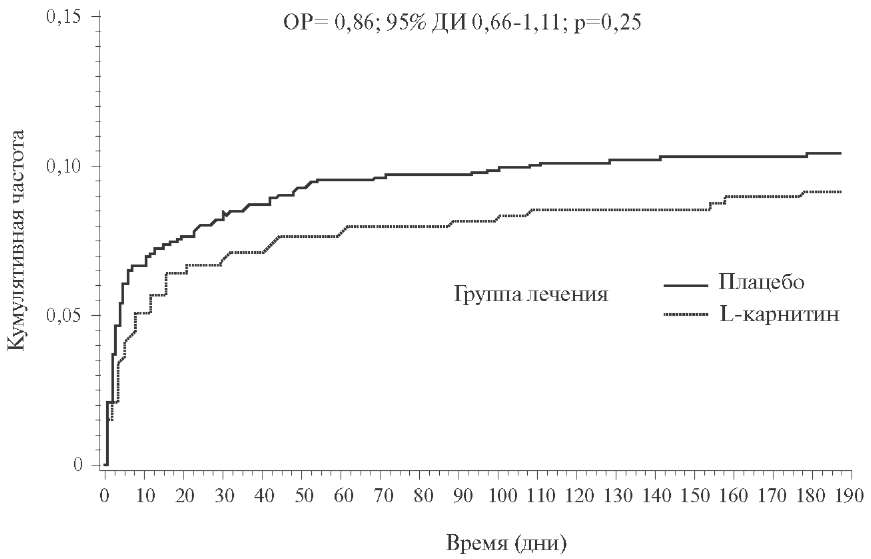
В течение 6 месяцев наблюдения частота основной комбинированной конечной точки (развитие сердечной недостаточности либо смерть от любых причин) достоверно не различалась между группами L-карнитина и плацебо (р=0,27). Соответствующие кривые кумулятивной частоты основной конечной точки представлены на рис.1.
Рис. 1. Кривые выживаемости Каплана-Мейера: кумулятивная частота основной комбинированной конечной точки (смерть от любых причин либо сердечная недостаточность) в группах L-карнитина и плацебо на протяжении 6 месяцев наблюдения.
При дифференцированной оценке эффективности терапии L-карнитином у пациентов с I и II-IV классом сердечной недостаточности по Killip (n=1980 и 349, соответственно) было обнаружено, что у больных с I классом благоприятное действие приема карнитина (ОР=0,83; ДИ — 0,60-1,13; р=0,20) выражено сильнее, чем у участников со II-IV классом (ОР =1.0; 95% ДИ — 0,63-1,59; р=0,99).
Согласно результатам многофакторного анализа, достоверными предикторами 6-месячной частоты основной комбинированной конечной точки являлись следующие показатели: сахарный диабет в анамнезе (р<0,001); гиперхолестеринемия в анамнезе (р=0,005); ИМ в анамнезе (р=0,001); аортокоронарное шунтирование в анамнезе (р=0,001); возраст (р<0,001); класс сердечной недостаточности по Killip при госпитализации (р<0,001). По данным многофакторного анализа, ОР для группы рандомизации (L-карнитин либо плацебо) составило 0,87; ДИ — 0,67-1,13; р=0,31).
Таблица 2 Внутригоспитальная терапия
|
|
Группа плацебо |
Группа L-карнитина |
|
Тромболизис (%) |
893 (76,9) |
911 (78,0) |
|
Аспирин (%) |
1058 (91) |
1065 (91,2) |
|
Другие антиагреганты (%) |
200 (17,2) |
222 (19) |
|
Ингибиторы ангиотензин-превращающего фермента (%) |
917 (78,9) |
920 (78,8) |
|
Бета-блокаторы (%) |
799 (68,8) |
786 (67,3) |
|
Гепарин (%) |
779 (67) |
769 (65,8) |
|
Нитраты (%) |
1009 (86,8) |
1015 (86,9) |
|
Сердечные гликозиды (%) |
74 (6,4) |
60 (5,1) |
|
Диуретики (%) |
424 (36,5) |
417 (35,7) |
|
Антагонисты кальция (%) |
91 (7,8) |
88 (7,5) |
|
Чрескожное коронарное вмешательство (%) |
138 (11,9) |
127 (10,9) |
|
Аортокоронарное шунтирование (%) |
6 (0,5) |
6 (0,5) |
|
Статины (%) |
900 (77,5) |
899 (76,9) |
Примечание: различия между группами рандомизации не были статистически значимыми.
Анализ показателей смертности
В течение 6 месяцев наблюдения умерло 142 пациента: 75 в группе плацебо и 67 в группе L-карнитина. Кумулятивная 6-месячная частота смерти составила 6,5% и 5,7% соответственно; снижение смертности на 12% в группе L-карнитина не было статистически значимым (р=0,48). При этом межгрупповые различия по частоте смерти были наиболее выражены в ранние сроки после рандомизации (табл. 3).
Частота дополнительной конечной точки (смертность в течение 5 дней после рандомизации) достоверно снижалась в группе L-карнитина (ОР= 0,61; ДИ — 0,37-0,98; р=0,041) (табл.3). Снижение показателей смертности в период с 7-го по 180-й день наблюдения было сопоставимым в обеих группах вмешательства (табл. 3).
Таблица 3. Кумулятивная смертность в течение различных периодов времени от момента рандомизации
Дни | Группа плацебо | Группа L-карнитина | Отношение рисков | p | ||
n | % | n | % |
|
| |
0-5 | 44 | 3,8 | 27 | 2,3 | 0,61 (0,37-0,98) | 0,041 |
0-7 | 46 | 4,0 | 31 | 2,7 | 0,66 (0,42-1,05) | 0,083 |
| 0-15 | 50 | 4,3 | 42 | 3,6 | 0,83 (0,54-1,26) | 0,396 |
0-30 | 59 | 5,1 | 47 | 4 | 0,78 (0,53-1,16) | 0,234 |
0-60 | 66 | 5,7 | 55 | 4,7 | 0,82 (0,56-1,18) | 0,305 |
0-90 | 68 | 5,9 | 59 | 5,1 | 0,85 (0,60-1,22) | 0,412 |
0-180 | 75 | 6,5 | 67 | 5,7 | 0,88 (0,63-1,24) | 0,489 |
Частота развития побочных эффектов не различалась между группами L-карнитина и плацебо. Ни в одной из групп не были зарегистрированы случаи досрочного прекращения участия в исследовании вследствие развития побочных эффектов. Подавляющее большинство тяжелых побочных эффектов было обусловлено прогрессированием основного заболевания либо его осложнениями. Частота побочных эффектов, не связанных с основным заболеванием, была сопоставимой в обеих группах вмешательства.
Обсуждение
В экспериментальных и клинических исследованиях было убедительно показано, что на фоне сохраняющейся ишемии миокарда зона некроза постепенно распространяется на всю толщину стенки желудочка [20-21] и что сохранение жизнеспособности миокарда и поддержание функции ЛЖ являются основными детерминантами выживаемости после ОИМ [22].
Тем не менее, несмотря на существенные успехи медикаментозной и интервенционной терапии, показатели смертности у пациентов с ОИМ остаются высокими. Это связано не только с организационными аспектами обеспечения минимального интервала от начала трансмуральной ишемии до реваскуляризации, но и с отрицательными эффектами реперфузионного повреждения миокарда. Реперфузионное повреждение в той или иной степени ослабляет положительное влияние восстановления кровотока в ишемизированном миокарде [23].
Таким образом, "идеальная" стратегия терапии должна быть направлена на достижение следующих целей: (1) сокращение временного интервала от развития синдрома боли в грудной клетке до реваскуляризации; (2) протекция ишемизированного миокарда до момента реперфузии; (3) защита миокарда от реперфузионного повреждения. Последние две цели могут быть достигнуты при медикаментозной терапии, направленной на протекцию миокарда как во время ишемии, так и в фазу реперфузии [24]. Способность метаболической терапии обеспечить достижение этих целей подтверждается результатами экспериментальных и клинических исследований, продемонстрировавших благоприятные клинические и функциональные эффекты метаболических препаратов [23].
Цели и результаты клинических исследований CEDIM 1 и CEDIM 2
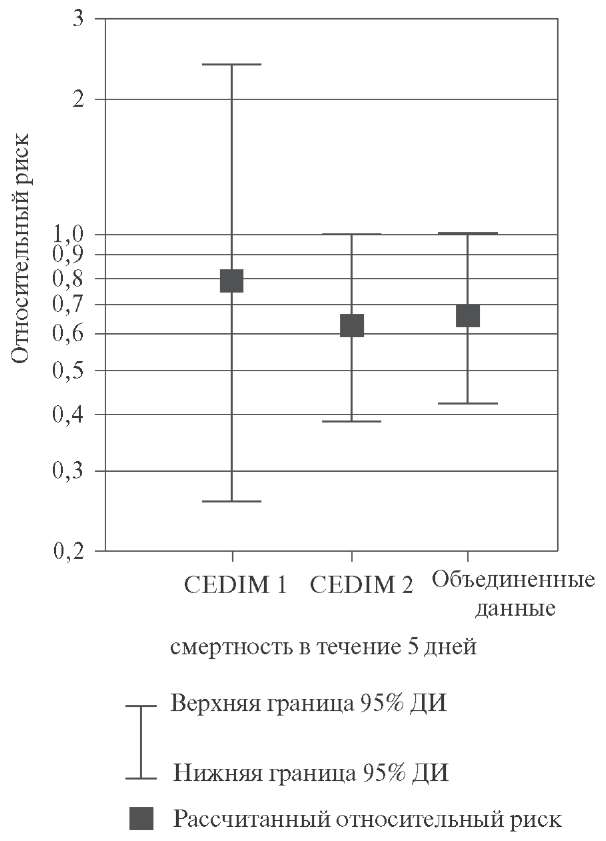
При ОИМ отмечается быстрое повышение плазменных уровней свободных жирных кислот, что оказывает токсическое действие на ишемизированный миокард и приводит к усилению мембранного повреждения, клеточному отеку, компрессии микрососудов, аритмиям, метаболической недостаточности и прогрессирующему нарушению функции миокарда [25]. Карнитин является основным фактором, регулирующим обмен жирных кислот в митохондриях. На фоне персистирующей ишемии миокарда наблюдается быстрое истощение запасов карнитина [25]. Благоприятное механическое действие при назначении карнитина обусловлено ограничением размеров зоны инфаркта [26], более быстрым восстановлением функции миокарда в постишемический период [27] и уменьшением выраженности ремоделирования ЛЖ после ОИМ [28]. Целью исследования CEDIM 1 было изучение влияния острого и длительного назначения L-карнитина на ремоделирование ЛЖ у пациентов с впервые развившимся передним ОИМ [17]. Согласно результатам этого многоцентрового клинического испытания, у пациентов, принимавших L-карнитин в сочетании со стандартной терапией, прогрессирующее увеличение конечнодиастолического и конечносистолического объемов ЛЖ через 3, 6 и 12 месяцев наблюдения было достоверно менее выраженным, чем в группе плацебо. Известно, что увеличение конечносистолического объема является важным предиктором выживаемости после ОИМ [22] и что терапия, направленная на предупреждение прогрессирования ремоделирования ЛЖ, эффективно снижает смертность у пациентов с передним ОИМ. С учетом этих данных, нами было решено изучить клинические эффекты терапии L-карнитином при ОИМ. В исследовании CEDIM 2 отмечалось статистически недостоверное снижение частоты основной комбинированной конечной точки (6-месячная частота развития сердечной недостаточности либо летального исхода) на 14% при приеме L-карнитина. Поскольку вероятность выявления положительного эффекта активной терапии была низкой (отчасти вследствие меньшей, чем ожидалось, частоты конечных точек и медленного набора участников), было решено прекратить включение больных в исследование досрочно, без достижения целевого объема выборки (4000 пациентов). По нашему мнению, заслуживает внимания эффект терапии L-карнитином в отношении частоты дополнительной конечной точки. В частности, у пациентов, которым L-карнитин назначался внутривенно, наблюдалось достоверное снижение смертности в течение 5 дней (27 смертей, по сравнению с 44 смертями в группе плацебо; ОР = 0,61; 95% ДИ — 0,37-0,98; р=0,041). Межгрупповые различия этих показателей были наиболее выражены в острую фазу ИМ; начиная с 7-го дня и до окончания периода наблюдения, уровни смертности были сопоставимы в обеих группах вмешательства. Эти результаты заставили нас повторно проанализировать данные исследования CEDIM 1, в котором изучалось влияние терапии L-карнитином на постинфарктное ремоделирование ЛЖ. Следует отметить, что временные особенности и характер снижения смертности в исследовании CEDIM 1 были сходными с таковыми в исследовании CEDIM 2. При объединении результатов этих двух исследований с использованием стандартных методов мета-анализа было подтверждено благоприятное влияние L-карнитина на показатели смертности в ранний постинфарктный период (рис.2).
Рис. 2. Снижение относительного риска смертности к 5 дню от момента рандомизации, рассчитанное на основании результатов исследований CEDIM 1, CEDIM 2 и анализа объединенных данных этих исследований. ДИ — доверительный интервал.
Метаболическая терапия при остром инфаркте миокарда: механизмы действия и клиническое значение.
Результаты исследования CEDIM 2 соответствуют данным, полученным в ходе исследования GIK у пациентов после первичной чрескожной транслюминальной коронарной ангиопластики [8]. Так же, как и в исследовании CEDIM 2, снижение смертности у участников исследования GIK, получавших глюкозоинсулинкалиевую смесь, наблюдалось в первые 5 дней. Эти благоприятные функциональные и клинические эффекты метаболической терапии, по всей видимости, обусловлены ограничением прогрессирования локальной и глобальной дискинезии ЛЖ при ишемическом повреждении миокарда. Положительные эффекты метаболической терапии при ОИМ не ограничиваются протекцией ишемизированного миокарда в острую фазу ишемии и реперфузии, но также включают уменьшение нагрузки на неинфарцированный миокард желудочков. В экспериментальной модели инфаркта миокарда (лигирование передней нисходящей ветви и 50%-ный стеноз огибающей ветви левой коронарной артерии), соответствующей клиническому ОИМ при мультисосудистой коронарной патологии, было показано, что метаболическая терапия (введение глюкозоинсулинкалиевой смеси) способствует сохранению функции жизнеспособного, не инфарцированного миокарда, предупреждает нарушение глобальной сократимости ЛЖ и предотвращает прогрессирование левожелудочковой недостаточности [29].
Ограничения исследования CEDIM 2
Основное ограничение исследования CEDIM 2 заключается в том, что снижение смертности в ранний постинфарктный период не являлось основной конечной точкой. Таким образом, для подтверждения результатов исследования CEDIM 2 и объединенного анализа данных CEDIM 1 и CEDIM 2 необходимо выполнение нового клинического исследования, изучающего влияние L-карнитина на показатели смертности в ранние сроки после острого инфаркта миокарда. Это новое исследование также должно подтвердить, что снижение смертности на фоне терапии L-карнитином не обусловлено случайной ошибкой. Кроме того, следует отметить, что в исследовании CEDIM 2 прием L-карнитина продолжался в течение 6 месяцев. Тем не менее, было убедительно продемонстрировано, что благоприятный эффект L-карнитина отмечается в самые ранние сроки лечения. Таким образом, можно предположить, что назначение L-карнитина особенно эффективно в первую неделю после развития переднего ОИМ.
Заключение
Как и для других терапевтических подходов, впоследствии оказавшихся эффективными, первые результаты исследований метаболической терапии достаточно противоречивы. В исследовании CEDIM 2 прием L-карнитина приводил к снижению ранних показателей смертности у пациентов с передним ОИМ, однако не влиял на риск развития сердечной недостаточности либо смерти от любых причин на протяжении 6 месяцев наблюдения. Если в будущих клинических испытаниях подтвердятся результаты как исследования CEDIM 2, так и объединенного анализа данных CEDIM 1 и CEDIM 2, это позволит рассматривать раннее назначение L-карнитина как новую терапевтическую стратегию при лечении пациентов с ОИМ.
Все авторы заявляют об отсутствии какого-либо конфликта финансовых интересов при подготовке данной статьи.
Литература
1. Armstrong PW, Collen D: Fibrinolysis for acute myocardial infarction. Current status and new horizons for pharmacological reperfusion. Part I. Circulation 2001; 103; 2862-2866.
2. Armstrong PW, Collen D: Fibrinolysis for acute myocardial infarction. Current status and new horizons for pharmacological reperfusion. Part II. Circulation 2001; 103; 2987-2992.
3. Topol EJ: Current status and future prospects for acute myocardial infarction therapy. Circulation 2003; 108(suppl 1): Ш6—Ш13.
4. Boersma E, Mercado N, Poldermans D, Gardien M, Vos J, Simoons ML: Acute myocardial infarction. Lancet 2003; 361: 847—858.
5. Opie LH: Proof that glucose-insulin-potassium provides metabolic protection of ischemic myocardium? Lancet 1999; 353: 768—769.
6. Apstein CS: Increased glycolytic substrate protection improves ischemic cardiac dysfunction and reduces injury. Am Heart J 2000; 139: S107—S114.
7. Fath-Ordoubadi F, Beatt KJ: Glucose-insulinpotassium therapy for treatment of acute myocardial infarction. Circulation 1997; 96: 11521156.
8. Van der Horst IC, Zijlstra F, van't Hof AWJ, Doggen CJ, de Boer MJ, Suryapranata H, Hoorntje JC, Dambrik JHE, Gans RJB, Bilo HJG; and Zwolle Infarct Study Group: Glucose-insulin-potassium infusion in patients treated with primary angioplasty for acute myocardial infarction. The glucose-insulin-potassium study: a randomized trial. J Am CollCardiol 2003; 42: 784—791.
9. Opie LH: Role of carnitine in fatty acid metabolism of normal and ischemic myocardium. Am Heart J 1979; 97: 375—388.
10. Spagnoli LG, Corsi M, Villaschi S, et al.: Myocardial carnitine defi ciency in acute myocardial infarction. Lancet 1982; 1: 1419—1420.
11. Fujiwara M, Nakano T, Tamato S, Yamada Y, Fukai M, Takada K, Ashida H, Shimada T, Ishihara T, Seki I: Effects of L-carnitine in patients with ischemic heart disease. Am J Cardiol 1991; 21: 493—504.
12. Lopaschuk G: Regulation of carbohydrate metabolism in ischemia and reperfusion. Am Heart J 2000; 139: S115—S119.
13. Lango R, Smolenski RT, Narkiewicz M, Suchorzewska J, Lysiak-Szydlowska W: Infl uence of L -carnitine and its derivatives on myocardial metabolism and function in ischemic heart disease and during cardiopulmonary bypass. Cardiovasc Res 2001; 51: 21—29.
14. Arsenian MA: Carnitine and its derivatives in cardiovascular disease. Prog Cardiovasc Dis 1997; 40: 265—286.
15. Rodgers RL, Christie ME, Tremblay GC, Babson JR, Daniels T: Insulin-like effects of a physiologic concentration of carnitine on cardiac metabolism. Mol Cell Biochem 2001; 226: 97—105.
16. Cui J, Das DK, Bertelli A, Tosaki A: Effects of L -carnitine and its derivatives on postischemic cardiac function, ventricular fi brillation and necrotic and apoptotic cardiomyocyte death in isolated rat hearts. Mol Cell Biochem 2003; 254: 227—234.
17. Iliceto S, Scrutinio D, Bruzzi P, D'Ambrosio G, Boni L, Di Biase M, Biasco G, Hugenholtz PG, Rizzon P: Effects of L-carnitine administration on left ventricular remodeling after acute anterior myocardial infarction: the L — Carnitine Ecocardiografi a Digitalizzata Infarto Miocardico (CEDIM) trial. J Am Coll Cardiol 1995; 26: 380—387.
18. Kober L, Torp-Pedersen C: Clinical characteristics and mortality of patients screened for entry into the Trandolapril Cardiac Evaluation (TRACE) study. Am J Cardiol 1995; 76: 1—5. 19. Andersen PK: Conditional power calculations as an aid in the decision whether to continue a clinical trial. Control Clin Trials 1987; 8: 67—74.
20. Reimer KA, Heide RSV, Richard VJ: Reperfusion in acute myocardial infarction: effect of timing and modulating factors in experimental models. Am J Cardiol 1993; 72: 13G—21G.
21. Raitt MH, Maynard C, Wagner GS, Wagner GS, Cerqueira MD, Selvester RH, Wever WD: Relation between symptom duration before thrombolytic therapy and fi nal infarct size. Circulation 1996; 93: 48—53.
22. White HD, Norris RM, Brown MA, Brandt PWT, Whitlock RML, Wild CJ: Left ventricular end-systolic volume as the major determinant of survival after recovery from myocardial infarction. Circulation 1987; 76:44—51.
23. Lee L, Horowitz J, Frenneaux M: Metabolic manipulation in ischaemic heart disease, a novel approach to treatment. Eur Heart J 2004; 25: 634—641.
24. Reffelmann T, Hale SL, Li G, Kloner RA: Relationship between no refl ow and infarct size as infl uenced by the duration of ischemia and reperfusion. Am J Physiol Heart Circ Physiol 2002; 282: H766— H772.
25. Carvajal K, Moreno-Sanchez R: Heart metabolic disturbances in cardiovascular disease. Arch Med Res 2003; 34: 89—99.
26. Ura K, Hironaka Y Sakurai I: Effect of carnitine on size limitation of experimental myocardial infarct. Am J Cardiovasc Pathol 1990; 3: 131—142.
27. Liedtke AJ, Demaison L, Nellis SH: Effects of L-propionyl-L-carnitine on mechanical recovery during refl ow in intact hearts. Am J Physiol 1988; 255: H169—H176.
28. Micheletti R, Di Paola E, Schiavone A, English E, Benati P, Capoasso JM, Anversa P, Bianchi G: Propionyl- L -carnitine limits chronic ventricular dilatation after myocardial infarction in rats. Am J Physiol 1993; 264: H1111—H1117.
29. Beyersdorf F, Acar C, Buckberg GD, Partington MT, Okamoto F, Allen BS, Young HH, Bugyi HI: Studies on prolonged acute regional ischemia. V. Metabolic support of remote myocardium during left ventricular power failure. J Thorac Cardiovasc Surg 1989; 98: 567-579.
Abstract
Administration of L-carnitine in patients with anterior acute myocardial infarction (AMI) prevents left ventricular remodelling. Current study was aimed to assess the effect of L-carnitine administration on mortality and heart failure in patients with anterior AMI.
CEDIM 2 trial was a randomized, double-blind, multicentre, placebo-controlled trial planned to enrol 4,000patients with acute anterior AMI. The trial was interrupted after the enrolment of2,330patients because of the lower than expected enrolment rate. The primary end point was a composite of death and heart failure at 6 months; 5-day mortality was the secondary end point.
During the 6-month follow-up, the primary endpoint was not significantly different between the L-carnitine and placebo group (9,2 vs. 10,5%, p=0,27). A reduction in mortality was seen in the L-carnitine arm on day 5 (secondary end-point) from randomization (HR=0,61, 95% CI0,37-0,98, p=0,041).
In CEDIM2 trial L-carnitine therapy led to a reduction in early mortality (secondary end-point) without affecting the risk of death and heart failure at 6 months in patients with anterior AMI, leading to a non-significant finding with respect to the primary end-point.
Key words: Acute myocardial infarction, myocardial infarction, pharmacotherapy, metabolic protection.

