Интракоронарное применение левокарнитина при стентировании коронарных артерий у пациентов высокого риска
Статьи
Н. Ю. Семиголовский1’2’3, М. Ф. Баллюзек1’2, А. Б. Гуслев1’2, С. О. Мазуренко1, А. В. Козаев2, И. Г. Семёнова2, Е. М. Никольская3, А. Н. Щеглов4
1 Санкт-Петербургский государственный университет, Санкт-Петербург, Россия
2 Санкт-Петербургская клиническая больница Российской академии наук, Санкт-Петербург, Россия
3 Клиническая больница Северо-Западного окружного научно-клинического центра имени Л. Г. Соколова Федерального медико-биологического агентства, Санкт-Петербург, Россия
4 Центральная клиническая больница с поликлиникой Управления делами президента России, Москва, Россия
Основные причины послеоперационной летальности при выполнении чрескожных коронарных вмешательств со стентированием коронарных артерий — периоперационный инфаркт миокарда, аритмии и острая сердечная недостаточность вследствие неадекватной защиты миокарда от ишемии/ реперфузии. Стандартная терапия включает бета-адреноблокаторы, антикоагулянты, дезагреганты. Описаны два клинических случая успешного внутривенного применения левокарнитина с целью кардиопротекции у пациентов старческого возраста с острыми формами ишемической болезни сердца при многососудистом поражении. Послеоперационный период протекал гладко, отмечалась сглаженность динамики биомаркеров (тропонин I, креатинфосфокиназа, МВ-фракция креатинфосфокиназы), ишемические сдвиги ЭКГ были мало выражены. Ожидаемые результаты применения методики — снижение интраоперационных и послеоперационных осложнений ишемии/реперфузии и повышение эффективности клинических результатов стентирования у пациентов высокого риска.
Ключевые слова: ишемическая болезнь сердца, острый коронарный синдром, острый инфаркт миокарда, ишемия/реперфузия, чрескожные коронарные вмешательства, левокарнитин, внутрикоронарное введение
Финансирование: работа выполнена в рамках Государственного задания 075-01609-23-04 «Адъювантная цитопротекция левокарнитином методом интракоронарного введения при реваскуляризации у больных с острым и хроническим коронарным синдромом (FUEM-2023-0018). Номер НИОКТР 1022040701249-2-3.2.4. Соглашение 075-03-2023-695/1 от 21.04.2023
Вклад авторов: Н. Ю. Семиголовский — концепция и дизайн исследования, обзор литературы, написание текста; А. В. Козаев, Е. М. Никольская, И. Г. Семёнова — сбор и обработка материала; С. О. Мазуренко — анализ материала, обзор литературы, редактирование; А. Б. Гуслев, А. Н. Щеглов — анализ материала; М. Ф. Баллюзек — анализ материала, редактирование.
Для цитирования: Н. Ю. Семиголовский, М. Ф. Баллюзек, А. Б. Гуслев с соавт. Интракоронарное применение левокарнитина при стентировании коронарных артерий у пациентов высокого риска // Медицина экстремальных ситуаций. 2024. т.26. №1. с. 106-111
Чрескожные коронарные вмешательства (ЧКВ) в настоящее время ежегодно в мире выполняют не менее чем у 5 000 000 больных ишемической болезнью сердца (ИБС) [1], из них более 200 000 ежегодно — в России [2]. Среди основных причин послеоперационной летальности при этом — периоперационный инфаркт миокарда (ИМ), аритмии и острая сердечная недостаточность вследствие неадекватной защиты миокарда в условиях баллонного расширения и стентирования пораженных коронарных артерий от синдрома ишемии/реперфузии.
В последних Клинических рекомендациях Европейского кардиологического общества 2023 г. по лечению острого коронарного синдрома (ОКС) [3] указано, что в доклинических и клинических исследованиях активно изучаются различные стратегии защиты миокарда при ЧКВ: коронарное посткондиционирование, дистанционное ишемическое кондиционирование, раннее внутривенное введение метопролола, ингибиторов гликопротеина IIb/IIIa, IIIa, препаратов, призванных сохранять целостность митохондрий, продукцию оксида азота. В качестве кардиопротекторов рассматривают аденозин, модуляторы глюкозы, гипотермию и другие методики. Таким образом, средства дополнительной кардиопротекции в наши дни крайне востребованы, а стратегии уменьшения ишемии/ реперфузионного повреждения в целом остаются неудовлетворенной клинической потребностью.
Весьма перспективным средством защиты миокарда, с нашей точки зрения, является левокарнитин (L-карнитин, ү-триметиламино-в-гидроксибутират, ЛК) — естественный эндогенный компонент тканей млекопитающих. Антиоксидантный эффект ЛК при ишемии/реперфузии может быть обусловлен оптимизацией обмена свободных жирных кислот и ослаблением ингибирующего действия активных форм кислорода на аэробный метаболизм [4]. Доказано, что уровень ЛК резко снижается в ишемизированном миокарде, при остром ИМ, кардиомиопатиях и сердечной недостаточности различного генеза [5, 6].
Практически первым исследованием в России, выявившим положительное влияние ЛК на миокард при остром ИМ [7], стала работа по изучению протекторных свойств внутривенно вводимого ЛК при ОКС с критерием включения — снижение фракции выброса левого желудочка (ФВЛЖ) менее 40% [8].
Положительное влияние ЛК на течение ОКС было подтверждено и другими авторами. Так, внутривенная терапия ЛК снижала дисперсию корригированного интервала QT, повышалась биодоступность NO [9, 10]. Положительный эффект применения ЛК у пациентов с ОКС отмечен именно в ранние сроки, наряду с хорошей переносимостью препарата [11]. При остром ИМ достоверно снижались средние пиковые подъемы маркеров некроза миокарда в крови (МВ-КФК и тропонина) [12]. Внутривенное введение ЛК оказалось эффективным как при ишемически-реперфузионном повреждении миокарда, так и при желудочковой дисфункции, аритмиях сердца и токсическом повреждении миокарда. Благоприятные эффекты ЛК были отмечены как у младенцев, подростков, молодых людей и взрослых, так и у пожилых пациентов с острой и хронической сердечной недостаточностью (ХСН) [13-15].
Ранее для адъювантной кардиопротекции при чрескожных вмешательствах использовали триметазидин [16] и фосфокреатин (Неотон) [17], что не вполне оправдало себя и не стало широко распространенной методикой защиты миокарда.
Описание клинических случаев
Ранее мы приводили результаты первого клинического применения левокарнитина внутрикоронарно у больного с острым ИМ [18]. Ниже приведем еще два случая использования методики при экстренных ЧКВ у пациентов старческого возраста.
Наблюдение 1
Пациент Х., 76 лет, находился на лечении в стационаре СПБ больницы РАН в кардиологическом отделении с 20.09.2023 по 26.09.2023. В анамнезе указано, что Х. несколько лет страдает умеренной артериальной гипертензией. ОИМ, ОНМК отрицает. В 2018 г. выявлен рак сигмовидной кишки, выполнено оперативное лечение, проходил курс химиотерапии. В 2019 г. выявлен рак предстательной железы, в связи с чем раз в 3 месяца пациент получает гормональную терапию. С 2017 г. наблюдается ангиохирургами по поводу аневризмы инфраренального отдела аорты. Ранее было проведено стентирование ПМЖА. С ночи 20.09.2023 появились рецидивирующие приступы ангинозных болей, в связи с чем пациент трижды принимал нитроспрей с положительным эффектом. Утром 20.09.2023 была проведена экстренная госпитализация и выполнена диагностическая коронарография с одномоментным стентированием RCA (три стента BioMatrix Flex; Сингапур). С целью уменьшения объема ишемического повреждения интракоронарно введен раствор ЛК (Элькар) 1000 мг C 20.09.2023 по 26.09.2023 получал Элькар в дозе 500 мг в сутки (№ 7). По данным эхокардиографии (ЭхоКГ), ФВЛЖ от 20.09.2023 составила 53%, от 22.09.2023 — 56%. Данные электрокардиографии (ЭКГ) в динамике представлены на рис. 1, ангиограммы — на рис. 2, динамика уровня биомаркеров ишемии/некроза миокарда — в табл. 1.
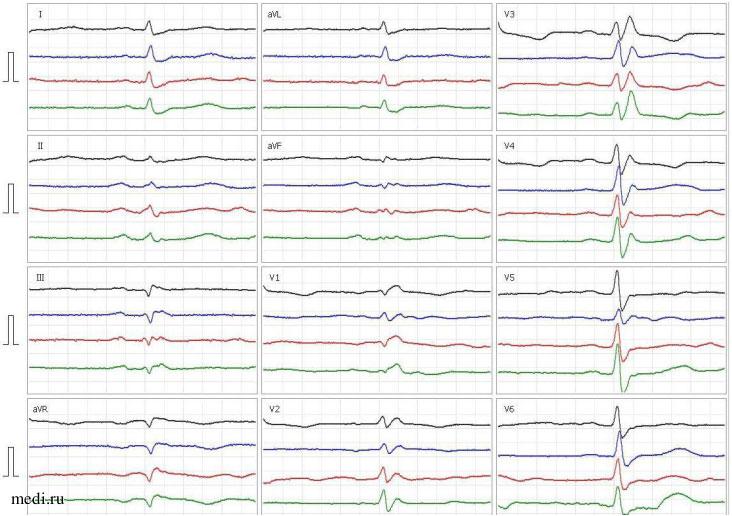 Рис. 1. ЭКГ в динамике пациента Х., 76 лет: зеленым цветом показаны результаты ЭКГ от 20.09.2023 (до введения ЛК); красным — от 21.09.2023, синим — от 25.09.2023 и черным — от 26.09.2023 (после введения ЛК)
Рис. 1. ЭКГ в динамике пациента Х., 76 лет: зеленым цветом показаны результаты ЭКГ от 20.09.2023 (до введения ЛК); красным — от 21.09.2023, синим — от 25.09.2023 и черным — от 26.09.2023 (после введения ЛК)
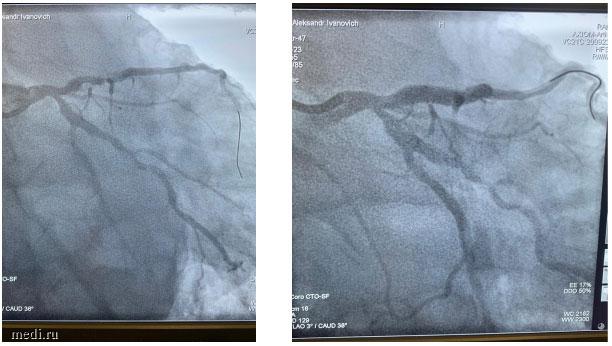 Рис. 2. Ангиограммы пораженной коронарной артерии пациента Х. до (слева) и после (справа) имплантации стентов
Рис. 2. Ангиограммы пораженной коронарной артерии пациента Х. до (слева) и после (справа) имплантации стентов
Таблица 1.
Динамика уровня биомаркеров ишемии/некроза миокарда пациента Х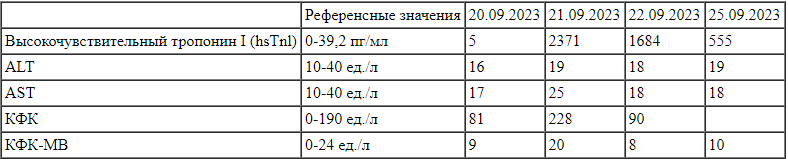 Примечание: ALT—аланинаминотрансфераза, AST — аспартатаминотрансфераза, КФК — креатинфосфокиназа, КФК-МВ — мышечно-мозговая фракция КФК.
Примечание: ALT—аланинаминотрансфераза, AST — аспартатаминотрансфераза, КФК — креатинфосфокиназа, КФК-МВ — мышечно-мозговая фракция КФК.
Наблюдение 2
Пациентка Л., 78 лет, находилась на лечении в стационаре СПБ больницы РАН с 25.09.2023 по 30.09.2023. В анамнезе: гипертоническая болезнь много лет, в 2006 г. диагностирован сахарный диабет 2-го типа. Дебют ИБС произошел в 2017 г., было выполнено стентирование огибающей ветви (ОА) левой коронарной артерии (ЛКА) (два стента). Ухудшение состояния наступило с марта 2023 г.: появились одышка и боль в грудной клетке при физической нагрузке. Амбулаторно в дополнение к стандартной терапии был назначен курс препаратом мельдоний, добавлена мочегонная терапия. Но состояние прогрессивно ухудшалось. В августе 2023 г. при ЭхоКГ выявлено снижение ФВЛЖ до 30%. В ночь на 25.09.2023 пациентка отметила появление жгучих болей в области сердца в состоянии покоя. Диагностирован ОКС без подъема сегмента ST ЭКГ и по экстренным показаниям выполнена диагностическая коронарография (стеноз ствола ЛКА 90%, субокклюзия устья ОА), а затем ангиопластика со стентированием ОА. С целью уменьшения объема ишемического повреждения интракоронарно введен раствор ЛК (Элькар) 1000 мг.
C 26.09.2023 по 30.09.2023 принимала Элькар в дозе 500 мг в сутки внутривенно капельно (№ 5). По данным ЭхоКГ от 25.09.2023 ФВЛЖ составила 36%, 27.09.2023 — 39%. Данные ЭКГ в динамике представлены на рис. 3, ангиограммы — на рис. 4.
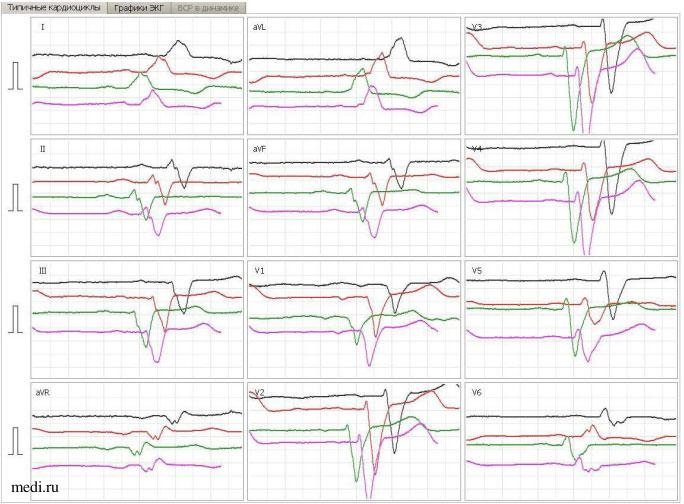 Рис. 3. ЭКГ в динамике у пациентки Л., 76 лет: черным цветом показаны результаты ЭКГ 25.09.2023 в 10:32 до введения ЛК (Элькар); красным — от 25.09.2023 в 18:52 после введения ЛК (Элькар), зеленым — от 26.09.2023, розовым — от 29.09.2023
Рис. 3. ЭКГ в динамике у пациентки Л., 76 лет: черным цветом показаны результаты ЭКГ 25.09.2023 в 10:32 до введения ЛК (Элькар); красным — от 25.09.2023 в 18:52 после введения ЛК (Элькар), зеленым — от 26.09.2023, розовым — от 29.09.2023
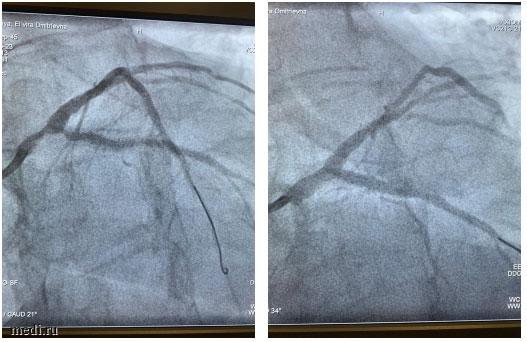 Рис. 4. Ангиограммы пораженной коронарной артерии пациентки Л. до имплантации стентов (слева) и после имплантации (справа)
Рис. 4. Ангиограммы пораженной коронарной артерии пациентки Л. до имплантации стентов (слева) и после имплантации (справа)
Динамика уровня биомаркеров ишемии/некроза миокарда больной Л. представлена в табл. 2.
Таблица 2.
Динамика уровня биомаркеров ишемии/некроза миокарда пациентки Л.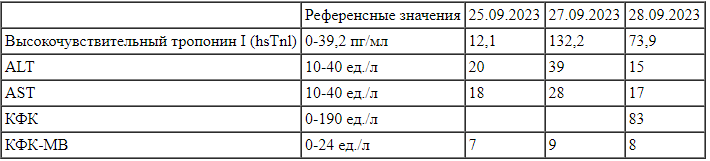 Примечание: ALT — аланинаминотрансфераза, AST — аспартатаминотрансфераза, КФК — креатинфосфокиназа, КФК-МВ — мышечно-мозговая фракция КФК.
Примечание: ALT — аланинаминотрансфераза, AST — аспартатаминотрансфераза, КФК — креатинфосфокиназа, КФК-МВ — мышечно-мозговая фракция КФК.
Обсуждение клинических случаев
Представленные выше данные литературы по успешному внутривенному применению с целью кардиопротекции препарата ЛК у больных ИБС служат обоснованием для изучения внутрикоронарного пути введения препарата, поскольку эта природная субстанция имеет ярко выраженные протекторные свойства, доказанные in vivo и in vitro (антиоксидантные, антиишемические и метаболические, т. е. связанные с энергообеспечением клетки). Именно при проведении ЧКВ у больных высокого риска (пациенты пожилого и старческого возраста, при многососудистом поражении коронарного русла) можно было бы в сравнении с группой контроля оценить эффективность, быстродействие, безопасность и вероятную дозозависимость такой защиты.
Еще одним поводом к изучению эффективности ЛК у пожилых больных ИБС высокого риска является то обстоятельство, что уровень ЛК в тканях снижается с возрастом и при хронических, и, особенно, при острых ее формах [19]. Немаловажно также, что при использовании ЛК в составе комплексной фармакотерапии препарат обладает повышенным профилем безопасности у коморбидных пациентов, не оказывая действия на цитохром Р450 [20, 21].
С учетом данных крупного метаанализа 13 рандомизированных контролируемых исследований (РКИ) по вторичной профилактике сердечно-сосудистых заболеваний (сравнение ЛК с плацебо) можно ожидать и снижения частоты желудочковых аритмий и приступов стенокардии у пациентов, перенесших ИМ [22]. Вполне вероятным представляется и уменьшение проявлений сердечной недостаточности при использовании описанной методики, поскольку, согласно данным метаанализа 17 РКИ по применению ЛК у пациентов с ХСН [23], после введения препарата были выявлены увеличение ФВЛЖ, оптимизация конечно-диастолического размера и конечно систолического объема ЛЖ, значительное снижение уровней мозгового натрийуретического пептида (BNP) в крови и N-терминального мозгового натрийуретического пропептида (NT-proBNP) [24].
Послеоперационный период, как видно, протекал в обоих наших случаях сравнительно гладко, были отмечены сглаженность динамики биомаркеров (тропонин I, креатинфосфокиназа, МВ-фракция креатинфосфокиназы, трансаминазы), стабильность систолической функции миокарда, а ишемические сдвиги ЭКГ были мало выражены.
Заключение
Таким образом, предлагаемая технология введения ЛК внутрикоронарно в ходе ЧКВ у пациентов высокого риска может стать эффективной для защиты миокарда от осложнений ишемии/реперфузии, что позволит улучшить результаты реваскуляризации и снизить частоту осложнений. Ввиду немногочисленности пока имеющихся наблюдений убедительные выводы можно будет представить только после накопления и анализа достаточного объема материала в рамках запланированных будущих исследований.
Литература
1. Serruys PW, Rutherford JD. The birth, and evolution, of percutaneous coronary interventions: a conversation with Patrick Serruys. Circulation. 2016; 134: 97-100.
2. Matskeplishvili S, Kontsevaya A. Cardiovascular Health, Disease, and Care in Russia. Circulation. 2021; 144 (8): 586-8.
3. Byrne RA, et al. 2023 ESC Guidelines for the management of acute coronary syndromes: Developed by the task force on the management of acute coronary syndromes of the European Society of Cardiology (ESC). European Heart Journal. 2023; 44 (38): 3720826.
4. Moghaddas A, Dashti-Khavidaki S. Potential protective effects of l-carnitine against neuromuscular ischemia-reperfusion injury: From experimental data to potential clinical applications. Clinical Nutrition. 2016; 35 (4): 783-90.
5. Верткин А. Л. L-карнитин в медицинской практике: доказанные эффекты. Неврология и ревматология. 2012; 1: 83-86.
6. Yoshihisa A, Watanabe S, Yokokawa T, Misaka T, Sato T, Suzuki S, et al. Associations between acylcarnitine to free carnitine ratio and adverse prognosis in heart failure patients with reduced or preserved ejection fraction. ESC Heart Fail. 2017; 4 (3): 360-4.
7. Аронов Д. М. Реалии и перспективы применения L-карнитина в кардиологии. Российский кардиологический журнал. 2013; 5 (103): 73-80.
8. Семиголовский Н. Ю., Верцинский Е. К., Азанов Б. А., Иванова Е. В. Положительные инотропные свойства левокарнитина при синдроме малого выброса у больных острым инфарктом миокарда. Кардиология и cердечно-сосудистая хирургия. 2013; (3): 43-46.
9. Глезер М. Г., Киселева А. Е., Асташкин Е. И. Влияние L-карнитина на дисперсию интервала QT у пациентов с острым коронарным синдромом. Кардиология. 2015; 55 (3): 4-9.
10. Zhao M, Jiang Q, Wang W, Geng M, Wang M, Han Y, et al. The roles of reactive oxygen species and nitric oxide in perfluorooctanoic acid-induced developmental cardiotoxicity and l-carnitine mediated protection. Int J Mol Sci. 2017; 18 (6). pii:E1229.
11. Пасечник И. Н., Скобелев Е. И. Перспективы метаболической терапии критических состояний. Доктор.Ру 2015; 109 (8)-110 (9): 2227.
12. Xue YZ, Wang LX, Liu HZ, et al. L-carnitine as an adjunct therapy to percutaneous coronary intervention for non-ST elevation myocardial infarction. Cardiovasc Drugs Ther. 2007; 21: 445-8.
13. Семиголовский Н. Ю., Азанов Б. А., Иванова Е. В., Быков П. В. Случай успешного стентирования ствола левой коронарной артерии у больной с рецидивирующим инфарктом миокарда, осложненным кардиогенным шоком и полиорганной недостаточностью. Клиническая больница. 2017; 21 (3): 36-41.
14. Wang ZYu, Liu YY, Liu GH, Lu HB, Mao CY. l-Carnitine and heart disease. Life Sci. 2018; 194: 88-97.
15. Семиголовский Н. Ю., Мазуренко С. О., Семиголовский С. Н., Шабалина М. О. Случай успешного лечения полной атриовентрикулярной блокады, осложненной внезапной аритмической смертью, у больного старческого возраста с тромбоцитопенией в постковидном периоде. Атеротромбоз. 2021; 11 (2): 103-20.
16. Kober G, Buck T, Sievert H, Vallbracht C. Myocardial protection during percutaneous transluminal coronary angioplasty: effects of trimetazidine. Eur Heart J. 1992; 13 (8): 1109-15.
17. Iosseliani DG, Koledinsky AG, Kuchkina NV. Does intracoronary injection of phosphocreatine prevent myocardial reperfusion injury following angioplasty of infarct-related artery in acute-stage of myocardial infarction? J Interv Cardiol. 2004; (6): 10-14.
18. Воронин М. С., Баллюзек М. Ф., Семиголовский Н. Ю. Цитопротективное действие левокарнитина при интракоронарном введении в ходе чрескожных коронарных вмешательств у острых коронарных больных. Сб. научн. трудов СПб больницы РАН 2022. СПб.: ПОЛИТЕХ-ПРЕСС, 2022; c. 113-20.
19. Costell M, O'Connor JE, Grisolia S. Age-dependent decrease of carnitine content in muscle of mice and humans. Biochem Biophys Res Commun. 1989; 161 (3): 1135-43.
20. Махова А. А., Шумянцева В. В., Ших Е. В., Булко Т В., Супрун, Е. В., Кузиков А. В., и др. Регуляция активности ферментов метаболизма лекарственных препаратов — цитохромов Р450 3А4 и 2С9 — биологически активными соединениями. Молекулярная медицина. 2013; 5: 49-53
21. Makhova AA, Shich EV, Kukes VG, Sizova OS, Ramenskaya GV Shumyantseva VV, et al. Electroanalysis of cytochrome P450 3A4 catalytik properties with nanostructured electrodes: the influence of vitamin B group on diclofenac metabolism. BioNanoScience. 2011; 1 (1-2): 46-52.
22. DiNicolantonio JJ, Lavie CJ, Fares H, Menezes AR, O'Keefe JH. L-Carnitine in the secondary prevention of cardiovascular disease: systematic review and meta-analysis. Mayo Clin Proc. 2013; 88 (6): 544-51.
23. Song X, Qu H, Yang Z, Rong J, Cai W, Zhou H. Efficacy and Safety of L-Carnitine Treatment for Chronic Heart Failure: A MetaAnalysis of Randomized Controlled Trials. BioMed Research International. 2017; Article ID 6274854, 11 p.
24. Ефремова Ю. Е. Эффективность и безопасность применения L-карнитина при хронической сердечной недостаточности: метаанализ рандомизированных контролируемых исследований (реферат). РМЖ. 2017; 20: 1471-80.
Intracoronary use of levocarnitine for coronary artery stent insertion in high-risk patients
Semigolovskii NYu1’2’3 Balluzek MF1’2, Guslev AB1’2, Mazurenko SO1, Kozaev AV2, Semenova IG2, Nikolskaya EM3, Scheglov AN4
1 Saint Petersburg State University, Saint Petersburg, Russia
2 Saint Petersburg Clinical Hospital of the Russian Academy of Sciences, Saint Petersburg, Russia
3 Clinical Hospital of the Sokolov North-Western District Scientific and Clinical Center of the Federal Medical Biological Agency, Saint Petersburg, Russia
4 Central Clinical Hospital with a Polyclinic of the Administrative Directorate of the President of the Russian Federation, Moscow, Russia
The main causes of postoperative mortality associated with percutaneous coronary interventions involving the coronary artery stent insertion are perioperative myocardial infarction and acute heart failure due to inadequate protection of the myocardium against ischemia/reperfusion. The standard therapy includes beta blockers, anticoagulants, antiplatelet drugs. Two clinical cases of successful use of intravenous levocarnitine for cardioprotection in senile patients with acute forms of coronary heart disease with multivessel lesions are reported. The postoperative period went well, smooth dynamics of biomarker levels (troponin I, creatine phosphokinase, MB fraction of creatine phosphokinase) was observed, and ischemic ECG changes were relatively small. The expected results of the technique application include reduction of intraoperative and postoperative complications of ischemia/reperfusion and the increase in effectiveness of the stent insertion clinical outcomes in high-risk patients.
Keywords: coronary heart disease, acute coronary syndrome, myocardial infarction, ischemia/reperfusion, percutaneous coronary interventions, levocarnitine, intracoronary administration
Funding: the study was performed as part of the State Assignment No. 075-01609-23-04 “Adjuvant Cytoprotection by Intracoronary Levocarnitine Administration during Revascularization in Patients with Acute and Chronic Coronary Syndrome” (FUEM-2023-0018). Research project No. 1022040701249-2-3.2.4. Agreement No. 075-03-2023-695/1 dated 21.04.2023.
References
1. Serruys PW, Rutherford JD. The birth, and evolution, of percutaneous coronary interventions: a conversation with Patrick Serruys. Circulation. 2016; 134: 97-100.
2. Matskeplishvili S, Kontsevaya A. Cardiovascular Health, Disease, and Care in Russia. Circulation. 2021; 144 (8): 586-8.
3. Byrne RA, et al. 2023 ESC Guidelines for the management of acute coronary syndromes: Developed by the task force on the management of acute coronary syndromes of the European Society of Cardiology (ESC). European Heart Journal. 2023; 44 (38): 3720826.
4. Moghaddas A, Dashti-Khavidaki S. Potential protective effects of l-carnitine against neuromuscular ischemia-reperfusion injury: From experimental data to potential clinical applications. Clinical Nutrition. 2016; 35 (4): 783-90.
5. Vertkin AL. L-karnitin v medicinskoj praktike: dokazannye jeffekty. Nevrologija i revmatologija. 2012; 1: 83-86. Russian.
6. Yoshihisa A, Watanabe S, Yokokawa T, Misaka T, Sato T, Suzuki S, et al. Associations between acylcarnitine to free carnitine ratio and adverse prognosis in heart failure patients with reduced or preserved ejection fraction. ESC Heart Fail. 2017; 4 (3): 360-4.
7. Aronov DM. Realii i perspektivy primenenija L-karnitina v kardiologii. Rossijskij kardiologicheskij zhurnal. 2013; 5 (103): 73-80. Russian.
8. Semigolovskii NYu, Vertinskiy EK, Azanov BA, Ivanova EV. Polozhitel'nye inotropnye svojstva levokarnitina pri sindrome malogo vybrosa u bol'nyh ostrym infarktom miokarda. Kardiologija i cerdechno-sosudistaja hirurgija. 2013; (3): 43-46. Russian.
9. Glezer MG, Kiseleva AE, Astashkin EI. Vlijanie L-karnitina na dispersiju intervala QT u pacientov s ostrym koronarnym sindromom. Kardiologija. 2015; 55 (3): 4-9.
10. Zhao M, Jiang Q, Wang W, Geng M, Wang M, Han Y, et al. The roles of reactive oxygen species and nitric oxide in perfluorooctanoic acid-induced developmental cardiotoxicity and l-carnitine mediated protection. Int J Mol Sci. 2017; 18 (6). pii:E1229.
11. Pasechnik IN, Skobelev EI. Perspektivy metabolicheskoj terapii kriticheskih sostojanij. Doktor.Ru. 2015; 109 (8) — 110 (9): 22-27.
12. Xue YZ, Wang LX, Liu HZ, et al. L-carnitine as an adjunct therapy to percutaneous coronary intervention for non-ST elevation myocardial infarction. Cardiovasc Drugs Ther. 2007; 21: 445-8.
13. Semigolovskii NYu, Azanov BA, Ivanova EV, Bykov PV Sluchaj uspeshnogo stentirovanija stvola levoj koronarnoj arterii u bol'noj s recidivirujushhim infarktom miokarda, oslozhnennym kardiogennym shokom i poliorgannoj nedostatochnost'ju. Klinicheskaja bol'nica. 2017; 21 (3): 36-41.
14. Wang ZYu, Liu YY, Liu GH, Lu HB, Mao CY. l-Carnitine and heart disease. Life Sci. 2018; 194: 88-97.
15. Semigolovskii NYu, Mazurenko SO, Semigolovskii SN, Shabalina MO. Sluchaj uspeshnogo lechenija polnoj atrioventrikuljarnoj blokady, oslozhnennoj vnezapnoj aritmicheskoj smert'ju, u bol'nogo starcheskogo vozrasta s trombocitopeniej v postkovidnom periode. Aterotromboz. 2021; 11 (2): 103-20. Russian.
16. Kober G, Buck T, Sievert H, Vallbracht C. Myocardial protection during percutaneous transluminal coronary angioplasty: effects of trimetazidine. Eur Heart J. 1992; 13 (8): 1109-15.
17. Iosseliani DG, Koledinsky AG, Kuchkina NV. Does intracoronary injection of phosphocreatine prevent myocardial reperfusion injury following angioplasty of infarct-related artery in acute-stage of myocardial infarction? J Interv Cardiol. 2004; (6): 10-14.
18. Voronin MS, Balluzek MF, Semigolovskii NYu. Citoprotektivnoe dejstvie levokarnitina pri intrakoronarnom vvedenii v hode chreskozhnyh koronarnyh vmeshatel'stv u ostryh koronarnyh bol'nyh. Sb. nauchn. trudov SPb bol'nicy RAN 2022. SPb.: POLITEH-PRESS, 2022; c. 113-20. Russian.
19. Costell M, O'Connor JE, Grisolia S. Age-dependent decrease of carnitine content in muscle of mice and humans. Biochem Biophys Res Commun. 1989; 161 (3): 1135-43.
20. Mahova AA, Shumjanceva VV, Shih EV Bulko TV, Suprun EV, Kuzikov AV et al. Reguljacija aktivnosti fermentov metabolizma lekarstvennyh preparatov — citohromov R450 3A4 i 2S9 — biologicheski aktivnymi soedinenijami. Molekuljarnaja medicina. 2013; 5: 49-53.
21. Makhova AA, Shich EV, Kukes VG, Sizova OS, Ramenskaya GV, Shumyantseva VV, et al. Electroanalysis of cytochrome P450 3A4 catalytik properties with nanostructured electrodes: the influence of vitamin B group on diclofenac metabolism. BioNanoScience. 2011; 1 (1-2): 46-52.
22. DiNicolantonio JJ, Lavie CJ, Fares H, Menezes AR, O'Keefe JH. L-Carnitine in the secondary prevention of cardiovascular disease: systematic review and meta-analysis. Mayo Clin Proc. 2013; 88 (6): 544-51.
23. Song X, Qu H, Yang Z, Rong J, Cai W, Zhou H. Efficacy and Safety of L-Carnitine Treatment for Chronic Heart Failure: A MetaAnalysis of Randomized Controlled Trials. BioMed Research International. 2017; Article ID 6274854, 11 p.
24. Efremova YuE. Jeffektivnost' i bezopasnost' primenenija L-karnitina pri hronicheskoj serdechnoj nedostatochnosti: metaanaliz randomizirovannyh kontroliruemyh issledovanij (referat). RMZh. 2017; 20: 171-80. Russian.
Author contribution: Semigolovskii NYu — study concept and design, text development, literature review; Kozaev AN, Nikolskaya EM, Semenova IG — Election and processing of material; Mazurenko SO — literature review, material analysis, editing; Guslev AB, Scheglov AN — material analysis; Balluzek MF — material analysis, editing.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 pikfarma.ru
pikfarma.ru
 pikfarma.ru
pikfarma.ru
