 www.binnopharmgroup.ru
www.binnopharmgroup.ru

Максилак® - это широкая линейка продуктов для взрослых и детей с рождения, для коррекции дисбактериоза и подержания баланса микрофлоры кишечника в любых ситуациях ее нарушения с удобным приемом 1 раз в день.
Максилак® – максимум для микрофлоры с заботой о себе и о семье с первого дня.
Синбиотики в комплексной терапии детей с атопическим дерматитом и пищевой аллергией
СтатьиС.Г.Макарова1'2, Е.Е.Емельяшенков1, А.П.Фисенко1, О.А.Ерешко1, И.Г.Гордеева1, Д.С.Ясаков1, Т.Р.Чумбадзе1, Р.И.Абайханов1, О.И.Мурадова1
1Национальный медицинский исследовательский центр здоровья детей Минздрава России, Москва, Российская Федерация;
2Московский государственный университет им. М.В.Ломоносова, Москва, Российская Федерация
Цель. Оценить безопасность и эффективность синбиотических биокомплексов при их применении в дополнение к стандартной терапии у пациентов с атопическим дерматитом (АтД) и пищевой аллергией.
Пациенты и методы. В открытое проспективное наблюдательное исследование были включены 120 детей в возрасте от 4 мес. до 5 лет с легкими или среднетяжелыми клиническими проявлениями АтД. Все дети в течение 30 дней получали стандартную терапию в соответствии с клиническими рекомендациями. Дети основной группы (n = 60) в течение 30 дней также получали исследуемые продукты. Все дети осмотрены и проконсультированы врачом. Также у них проведены оценка кожных симптомов по шкале SCORAD-TIS, оценка кала по Бристольской шкале, оценка качества жизни с помощью опросника FLIP.
Результаты. На фоне лечения отмечены значимые положительные изменения стула у детей, принимавших синбиотик, по сравнению с детьми, получавшими только стандартную терапию: число детей с 3-м и 4-м типами стула по Бристольской шкале увеличилось на 33,7% (р = 0,02 и р = 0,02 соответственно). Также в группе детей, получавших синбиотик, значимо уменьшились доли детей с 5-м и 6-м типами кала (р = 0,007 и р = 0,005 соответственно) и с неустойчивым стулом (р = 0,015). Применение синбиотика положительно отразилось на качестве жизни семей детей с пищевой аллергией: в возрасте до 1 года жизни по показателю «Повседневная жизнь» (р = 0,028) и в возрасте 1-3 лет по общему числу баллов (р = 0,035) и показателю «Эмоции и здоровье» (р = 0,028).
Заключение. Полученные результаты позволяют говорить о безопасности и эффективности использования исследованных синбиотических биокомплексов в дополнение к базисной терапии детей с АтД и пищевой аллергией.
Ключевые слова: аллергия, атопический дерматит, диета, дети, пробиотики, пребиотики, синбиотики
Для цитирования: Макарова С.Г., Емельяшенков Е.Е., Фисенко А.П., Ерешко О.А., Гордеева И.Г., Ясаков Д.С., Чумбадзе Т.Р., Абайханов Р.И., Мурадова О.И. Синбиотики в комплексной терапии детей с атопическим дерматитом и пищевой аллергией. Вопросы детской диетологии. 2021; 19(6): 16-25. DOI: 10.20953/1727-5784-2021-6-16-25
Synbiotics in complex therapy for atopic dermatitis and food allergy in children
S. G.Makarova1'2, E.E.Emelyashenkov1, A.P.Fisenko1, O.A.Ereshko1, I.G.Gordeeva1, D.S.Yasakov1, T. R.Chumbadze1, R.I.Abaykhanov1, O.I.Muradova1
1National Medical Research Center for Children’s Heath, Ministry of Health of the Russian Federation, Moscow, Russian Federation;
2Lomonosov Moscow State University, Moscow, Russian Federation
Objective. To evaluate the efficacy and safety of synbiotics as an add-on to standard therapy for atopic dermatitis (AD) and food allergies (FA).
Patients and methods. An open-label prospective observational study included 120 children aged 4 months to 5 years with mild or moderate clinical manifestations of AD. All children received standard therapy for 30 days in accordance with clinical guidelines. Children in the main group (n = 60) also received the products under study for 30 days. All children underwent an examination and consultation with a physician. The SCORAD-TIS scale to assess skin symptoms, the Bristol stool scale, and the FLIP questionnaire for the quality-of-life assessment were used.
Results. Significant positive stool changes were observed in children taking synbiotics compared with children receiving only standard therapy: the number of children with types 3 and 4 according to the Bristol stool scale increased by 33.7% (p = 0.02 and p = 0.02, respectively). There was also a significant decrease in the proportion of chiidren with types 5 and 6 (p = 0.007 and p = 0.005, respectively) and unstable stools (p = 0.015) in the group of children treated with synbiotics. The use of synbiotics had a positive effect on the quality of life of families of children with food allergies: under 1 year of age on the «Daiiy ilfe» parameter (p = 0.028) and at 1-3 years of age on to the total score (p = 0.035) and on the «Emotions and health» parameter (p = 0.028).
Conclusion. The results obtained suggest the safety and efficacy of using the studied synbiotics in addition to standard therapy for atopic dermatitis and food allergy in children.
Key words: allergy, atopic dermatitis, diet, children, probiotics, prebiotics, synbiotics
For citation: Makarova S.G., Emelyashenkov E.E., Fisenko A.P., Ereshko O.A., Gordeeva I.G., Yasakov D.S., Chumbadze T.R., Abaykhanov R.I., Muradova O.I. Synbiotics in complex therapy for atopic dermatitis and food allergy in children. Vopr. det. dietol. (Pediatric Nutrition). 2021; 19(6): 16-25. (In Russian). DOI: 10.20953/1727-5784-2021-6-16-25
Микробиота (или микробиоценоз) кишечника является фактором, в значительной степени определяющим здоровье человека. В последнее время стало понятно, что огромное значение имеет микробиота и для формирования иммунного ответа ребенка, и для осуществления механизмов формирования пищевой толерантности [1].
В настоящее время накоплено значительное количество результатов исследований, изучавших особенности раннего периода формирования микробиоты у детей, развивших и не развивших аллергию в дальнейшем. Показано, что для детей с аллергическими заболеваниями характерно низкое общее разнообразие микробиоты уже в возрасте 1 мес. (р = 0,004), низкое разнообразие типов Bacteroidetes (р = 0,02) и рода Bacteroides (р = 0,01) в 1 мес., снижение общего количества и разнообразия Proteobacteria в 12 мес. (р = 0,02) [2]. В когортном исследовании Azad M.B. (Канада) [3] показано, что низкое разнообразие микробиоты в 3 мес. ассоциировано c повышенным риском сенсибилизации к одному и более пищевым аллергенам к возрасту 1 года. При этом каждый квартиль снижения многообразия увеличивал риск сенсибилизации на 52% (aOR 0,45, 95% CI 0,23-0,87) [3]. Еще одним показателем, ассоциированным с сенсибилизацией, было соотношение Enterobacteriaceae/Bacteroidaceae, при этом каждый квартиль повышения этого индекса увеличивал риск сенсибилизации вдвое (OR 1,89, 1,03-3,47) [3].
Эти результаты согласуются с данными исследований Wang et al. и Abrahamsson et al., показавших, что низкое разнообразие микробиоты в раннем возрасте (1 нед. и 1 мес.) сопряжено с повышенным риском развития атопического дерматита (АтД) [2, 4]. Разнообразие кишечной микробиоты в возрасте 7 дней было значимо ниже у детей, имевших к 12 мес. проявления экземы, как у детей с отягощенным, так и с неотягощенным наследственным анамнезом по аллергической патологии [5]. У детей, имевших к возрасту 5 лет симптомы аллергии, в раннем возрасте значимо реже в составе кишечной микробиоты встречались такие бактерии, как Lactobacillus (L.) rhamnosus, L. casei, L. paracasei, Bifidobacterium adolescentis и Clostridium difficile. Также показано, что дети, колонизированные несколькими видами бифидобактерий, росли в более многочисленных семьях [6]. В то же время в исследованиях Ling et al. и Nylund et al. было показано, что снижение разнообразия микробиоты в 5- и 6-месячном возрасте уже не ассоциировано с развитием АтД в дальнейшем [7, 8].
Представители семейств Bacteroidaceae и Ruminococcaceae участвуют в выработке и деградации муцина, который является важнейшим защитным фактором кишечного барьера [9]. Низкое содержание в микробиоте бактерий этих семейств у детей с пищевой сенсибилизацией, выявленное в исследовании Azad M.B. et al. [3], согласуется с результатами других работ. Дефицит Bacteroidetes в раннем возрасте описан у детей, в дальнейшем развивших пищевую аллергию и АтД [2, 7, 8], и является частым у детей после кесарева сечения [10].
Интересно, что прогноз формирования толерантности к пищевым белкам у детей, уже имеющих аллергию, также может быть связан с ранними этапами формирования кишечной микробиоты. Так, в проспективном наблюдательном исследовании, в которое были включены 226 детей первого года жизни с аллергией к белкам коровьего молока, было проведено изучение кишечной микробиоты в возрасте 3 и 16 мес. методом секвенирования 16S рРНК. Уровень специфических IgE к белкам коровьего молока определялся в 6 и 12 мес. и затем ежегодно до 8 лет. К возрасту 8 лет 128 (56,6%) из 226 детей сформировали толерантность к молочным белкам. Было показано, что для детей, сформировавших толерантность к молочным белкам к 8 годам, было характерно более высокое содержание в кишечной микробиоте на первом году жизни бактерий родов Clostridia и Firmicutes (η 2 = 0,43; ANOVA p = 0,034) [11].
Изучается возможность использования различных пробиотических штаммов, а также пребиотиков как для профилактики, так и в составе комплексной терапии атопичесих заболеваний. Современное определение пробиотиков было дано рабочей группой Всемирной организации здравоохранения в 2001 г. и сохраняет свою актуальность [12, 13]: пробиотики - это живые микроорганизмы, которые при применении в адекватных количествах вызывают улучшение здоровья организма-хозяина. Важно, что это определение включает главные требования, предъявляемые к препаратам и штаммам, которые претендуют на то, чтобы быть отнесенными к пробиотикам: сохранность живых микробов, их достаточное количество и доказанная эффективность. Большинство пробиотиков - это микроорганизмы, являющиеся продуцентами молочной кислоты, относящиеся к типичным представителям нормальной микробиоты человека: лактобактерии, которые являются факультативными анаэробами, и бифидобактерии - облигатные анаэробы [14-16], а также представители субдоминирующих видов -Streptococcus thermophylus и Enterococcus faecium.
В 2015 г. был опубликован согласительный документ Всемирной аллергологической организации (WAO), в котором проанализирована доказательная база по использованию пробиотиков для профилактики аллергии и даны рекомендации [17]. На основании проведенного анализа доказательной базы группа экспертов WAO предлагает использовать пробиотики у младенцев с высоким риском развития аллергии, поскольку даже с учетом всех критических замечаний есть данные в отношении положительного эффекта, связанного с профилактикой экземы (условная рекомендация, данные с очень низким качеством).
Пребиотики, согласно определению, - это «селективно ферментируемый ингредиент, который вызывает специфические изменения как в составе, так и в функциональной активности микробиоты желудочно-кишечного тракта, оказывающий положительное влияние на здоровье организма хозяина» [18-20]. Чтобы вещество считалось пребиотиком, оно должно обладать следующими свойствами: не подвергаться воздействию соляной кислоты желудка, лизису ферментами и абсорбции в желудочно-кишечном тракте; подвергаться ферментации кишечной микробиотой; селективно стимулировать рост и/или активность бактерий, которые могут быть связаны со здоровьем и благополучием человека [20].
Согласительный документ WAO рекомендует сапплементацию пребиотиками детям, получающим искусственное или смешанное вскармливание при наличии риска развития аллергии (условная рекомендация, низкая достоверность доказательств) [18].
При сочетании АтД и пищевой аллергии решающая роль в лечении принадлежит элиминационной диете, заключаю щейся в исключении из рациона ребенка или из питани матери (при грудном вскармливании) причинно-значимы:. продуктов [21, 22], а также проведению наружной терапии, целью которой является купирование воспаления, зуда, восстановление водно-липидного слоя и барьерной функции кожи [23]. Однако имеющиеся данные о важности кишечной микробиоты диктуют необходимость проведения исследований по эффективности включения «биотиков» в комплексную терапию заболевания.
Цель исследования: оценить безопасность и эффективность синбиотических биокомплексов при их применении в дополнение к стандартной терапии у пациентов с атопическим дерматитом и пищевой аллергией.
Пациенты и методы
Открытое проспективное наблюдательное исследование проведено в период с февраля 2019 г. по ноябрь 2020 г. на базе отдела профилактической педиатрии Центра профилактической педиатрии и консультативно-диагностического центра ФГАУ «НМИЦ здоровья детей» Минздрава России (Москва). В исследование были включены 120 детей в возрасте от 4 мес. до 5 лет с легкими или среднетяжелыми клиническими проявлениями АтД, которые были разделены на 2 группы: основную (группа 1, n = 60) и группу сравнения (группа 2, n = 60). Родителями / законными представителями пациентов были подписаны информированные согласия на участие в исследовании.
Пациенты могли быть исключены из исследования в случае нежелания родителей / законных представителей пациента дальнейшего участия в исследовании, а также при отказе ребенка от приема биологически активной добавки (БАД), развитии у пациента нежелательных явлений, препятствующих дальнейшему участию в исследовании, или появлении острого инфекционного заболевания.
Все дети в течение 30 дней получали стандартную терапию в соответствии с клиническими рекомендациями «Пищевая аллергия» (2018) и «Атопический дерматит» (2020), включавшую наружное лечение и элиминационную диету. Дети основной группы в течение 30 дней также получали исследуемые продукты в зависимости от возраста: 40 детей в возрасте до 3 лет получали БАД в виде саше, 20 детей в возрасте старше 3 лет - БАД в виде капсул.
Исследование включало 2 обязательных визита пациента: 1-й визит - исходный; 2-й визит - заключительный (день 24 ± 6). В ходе каждого визита проводился врачебный осмотр ребенка, сбор жалоб и данных анамнеза, физикальное обследование (измерение роста и массы тела, оценка кожных симптомов по шкале SCORAD-TIS, оценка формы и консистенции кала по Бристольской шкале, оценка гастроинтестинальных симптомов пищевой аллергии с использованием шкалы COMISS [24], оценка качества жизни с помощью опросника FLIP [25]), оценка наличия критериев исключения. На 1-м визите осуществляли выдачу изучаемого БАД детям основной группы в зависимости от возраста ребенка.
Описание исследуемых препаратов
Состав двух исследованных комплексов (БАД к пище «Максилак», содержащая лиофилизат пробиотических бактерий + пребиотик, в виде капсул для приема внутрь и БАД к пище «Максилак Бэби», содержащая лиофилизат пробиотических бактерий + пребиотик, в виде порошка (саше) для приема внутрь) приведен в табл. 1, 2.
Таблица 1.
Содержание компонентов в суточной дозе БАД 1 («Максилак»)
Table 1.
Components in a daily dose of dietary supplement No. 1 («Maxilac»)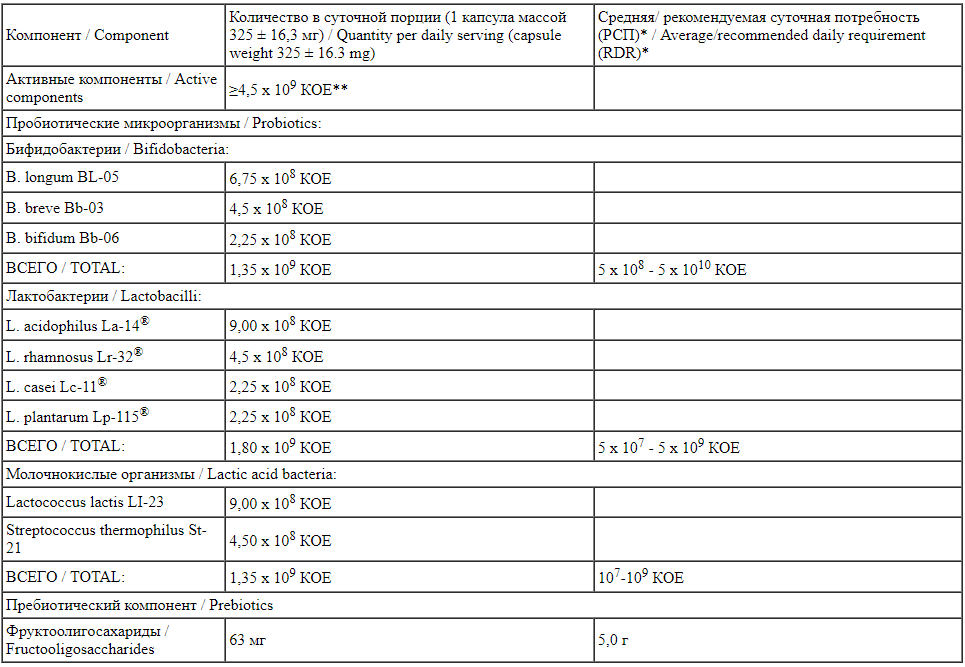 *Приложение 2 к техническому регламенту Таможенного союза «Пищевая продукция в части ее маркировки» / *Appendix No. 2 to the Technical Regulations of the Customs Union “Food products in terms of its labeling".
*Приложение 2 к техническому регламенту Таможенного союза «Пищевая продукция в части ее маркировки» / *Appendix No. 2 to the Technical Regulations of the Customs Union “Food products in terms of its labeling".
**КОЕ - колониеобразующая единица (показатель количества жизнеспособных микроорганизмов) /
**COU - colony-forming unit (a unit for estimating the number of viable bacteria).
Вспомогательные вещества: микрокристаллическая целлюлоза, магния стеарат, диоксид кремния, титана диоксид, гипромеллоза / Excipients: microcrystalline cellulose, magnesium stearate, silicon dioxide, titanium dioxide, hypromellose.
Описание: порошок от белого до кремового цвета / Description: powder from white to cream color.
Таблица 2.
Содержание компонентов в суточной дозе БАД 2 («Максилак Бэби»)
Table 2.
Components in a daily dose of dietary supplement No. 2 ("Maxilac Baby") *Приложение 2 к техническому регламенту Таможенного союза «Пищевая продукция в части ее маркировки» / *Appendix No. 2 to the Technical Regulations of the Customs Union "Food products in terms of its labeling".
*Приложение 2 к техническому регламенту Таможенного союза «Пищевая продукция в части ее маркировки» / *Appendix No. 2 to the Technical Regulations of the Customs Union "Food products in terms of its labeling".
**КОЕ - колониеобразующая единица (показатель количества жизнеспособных микроорганизмов) / **COU - colony-forming unit (a unit for estimating the number of viable bacteria).
БАД к пище включались в ежедневный состав рационов и принимались во время еды, предпочтительно вечером, в количестве 1 капсулы/саше ежедневно.
Статистическая обработка результатов проводилась с помощью пакета программ IBM SPSS Statistics 20 (IBM SPSS Statistics for Windows, Version 20.0. Armonk, NY: IBM Corp.). Полученные данные проверялись на соответствие нормальному распределению с помощью критерия Шапиро-Уилка. В случае правильного распределения данных определяли средние величины (М) и стандартное отклонение (SD), для оценки различий применялся t-критерий Стьюдента. Для выборок, не подчиняющихся нормальному распределению, определяли медиану, а также 25-й и 75-й перцентили, различия между группами определяли при помощи критерия Манна-Уитни. Для сравнения качественных данных применяли метод х2 Пирсона, точный критерий Фишера. Полученные результаты считали статистически значимыми при р < 0,05.
Результаты исследования и их обсуждение
Возрастно-половой состав группы детей показан в табл. 3. Набор в группы проведен методом пар соответственно возрастному составу.
Таблица 3.
Возрастно-половой состав обследованных детей
Table 3.
Age and sex composition of the examined children Распределение детей в зависимости от диагноза по Международной классификации болезней и степени тяжести заболевания в группах значимо не отличалось.
Распределение детей в зависимости от диагноза по Международной классификации болезней и степени тяжести заболевания в группах значимо не отличалось.
Большинство детей в анамнезе получали грудное вскармливание. Его длительность между 1-й и 2-й группами детей значимо не отличалась (p = 0,94) и составляла в среднем 9,3 ± 7,6 мес. и 9,4 ± 8,3 мес. соответственно. Семейный аллергоанамнез был отягощен у большинства обследованных детей (рис. 1).
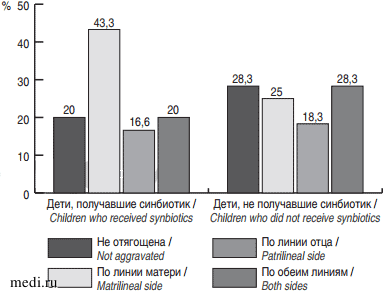 Рис. 1. Наследственность по аллергическим заболеваниям в группах детей.
Рис. 1. Наследственность по аллергическим заболеваниям в группах детей.
Fig. 1. Genetics of allergic diseases in groups of children.
Пищевая аллергия у большинства детей в обеих группах дебютировала в возрасте до 6 мес. жизни и проявлялась в виде кожных высыпаний: у 70% детей, получавших синбиотик, и у 93,3% детей группы сравнения. В меньшем числе у детей были смешанные проявления пищевой аллергии: у 30% детей основной группы и 6,6% детей группы сравнения.
В структуре причинно-значимых аллергенов у детей обеих групп превалировали белки коровьего молока. Среди других аллергенов были такие пищевые продукты, как яблоко, соя, курица, говядина и рис. При этом у трети и четверти детей 1-й и 2-й группы соответственно имела место множественная пищевая аллергия (рис. 2).
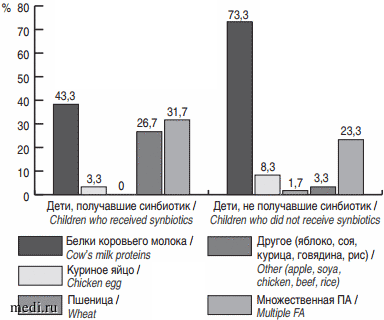 Рис. 2. Основные причинно-значимые аллергены в обследованной группе детей.
Рис. 2. Основные причинно-значимые аллергены в обследованной группе детей.
Fig. 2. Main causative allergens in the studied group of children.
Оценка эффективности терапии по шкале SCORAD-TIS
Результаты оценки состояния детей по шкале SCORAD-TIS как до, так и после исследования между группами значимо не отличались. При этом внутри обеих групп выявлена значимая положительная динамика в виде уменьшения выраженности проявлений АтД согласно оценке по шкале SCORAD-TIS. Так, показатели распространенности, интенсивности и индекса у детей в обеих группах значимо снизились (р < 0,0001). Статистически значимой разницы параметров до или после исследования между детьми разных исследуемых групп выявлено не было.
Оценка эффективности терапии по шкале COMISS
Оценка гастроинтестинальных проявлений пищевой аллергии у детей первого года жизни по шкале COMISS показала выраженную положительную динамику в обеих группах, при этом также не выявлена значимая разница по данному критерию между группами.
Оценка эффективности терапии по динамике изменения характера стула с использованием Бристольской шкалы
Большинство значимых различий в характере стула на фоне терапии произошло у детей, принимавших синбиотик: число детей с 3-м и 4-м типами стула по Бристольской шкале, характеризующих нормальную консистенцию кала, увеличилось на 33,7% (р = 0,02 и р = 0,02 соответственно). Также значимо уменьшились доли детей 1-й группы с 5-м и 6-м типами кала (р = 0,007 и р = 0,005 соответственно), а также уменьшилось число детей с неустойчивым стулом (р = 0,015, рис. 3).
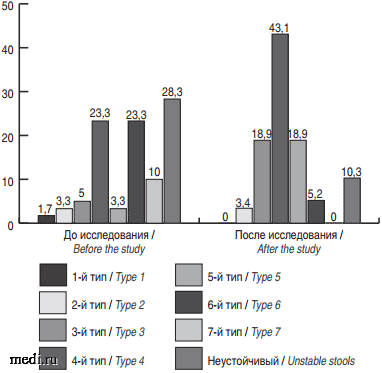 Рис. 3. Тип стула по Бристольской шкале до и после исследования у детей 1-й группы.
Рис. 3. Тип стула по Бристольской шкале до и после исследования у детей 1-й группы.
Fig. 3. Type of stools according to the Bristol scale before and after the study in children in group 1.
У детей 2-й группы увеличение доли детей с 3-м и 4-м типами по Бристольской шкале произошло в меньшей степени - на 10% (рис. 4), без значимых различий до и после исследования.
Статистически значимые различия во 2-й группе детей выявлены только в динамике неустойчивого стула и стула 5-го типа (р = 0,007).
Важно отметить, что доля детей с нормальными типами стула до исследования была выше среди детей, не получавших синбиотический комплекс, по сравнению с детьми 1-й группы. При этом статистическая разница находилась на уровне тенденции (53,3% против 36,7%, р = 0,07). Значимой разницы по числу детей с нормальными типами кала после исследования не выявлено.
Таким образом, у детей, получавших синбиотик, произошло статистически значимое улучшение показателей, характеризующих консистенцию стула, особенно в отношении его нормальных типов.
Оценка качества жизни с помощью вопросника FLIP
Результаты опроса с помощью вопросника FLIP показали улучшение качества жизни семей детей с пищевой аллергией группы 1, значимые различия до и после исследования получены в отношении показателей «Эмоции и здоровье», «Повседневная жизнь». Выявлена тенденция к значимым различиям по показателю «Питание» (табл. 4).
Таблица 4.
Сравнение оценки качества жизни членов семьи детей обследованных групп с помощью вопросника FLIP в возрастной группе до 1 года
Table 4.
Comparison of the quality-of-life assessment in families of children in the studied groups using the FLIP questionnaire in the age group under 1 year of age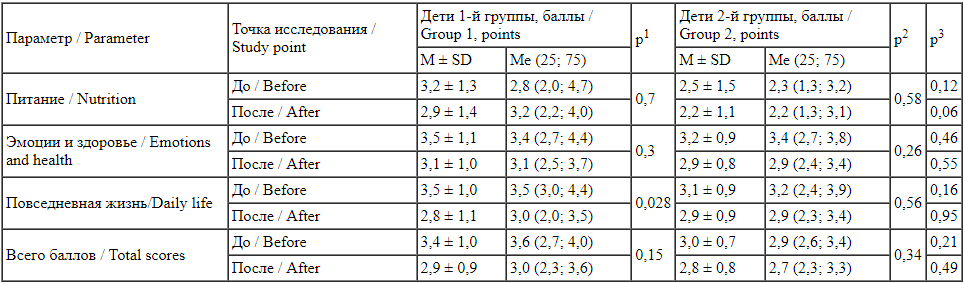 р1 - статистически значимая разница между параметрами до и после исследования у детей группы 1; р2 - статистически значимая разница между параметрами до и после исследования у детей группы 2; р3 - статистически значимая разница параметра до или после исследования между детьми разных исследуемых групп.
р1 - статистически значимая разница между параметрами до и после исследования у детей группы 1; р2 - статистически значимая разница между параметрами до и после исследования у детей группы 2; р3 - статистически значимая разница параметра до или после исследования между детьми разных исследуемых групп.
p1 - statistically significant difference between the parameters before and after the study in group 1; p2 - statistically significant difference between the parameters before and after the study in group 2; p3 - statistically significant difference in the parameter before or after the study between the children of different study groups.
Улучшение качества жизни выявлено также в семьях детей группы 2, значимые различия до и после исследования получены в отношении всех показателей (табл. 4).
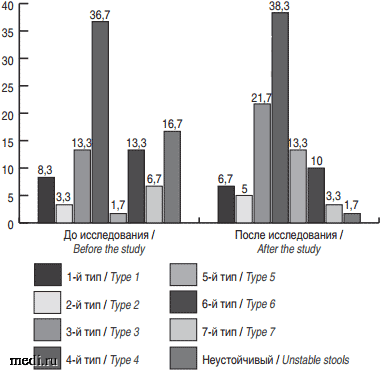 Рис. 4. Тип стула по Бристольской шкале до и после исследования у детей 2-й группы.
Рис. 4. Тип стула по Бристольской шкале до и после исследования у детей 2-й группы.
Fig. 4. Type of stools according to the Bristol scale before and after the study in children in group 2.
Оценка качества жизни семей детей в возрасте до 1 года показала наличие значимой разницы до и после исследования в 1-й группе только по показателю «Повседневная жизнь» (табл. 4).
Результаты анализа качества жизни у детей в возрасте 1-3 лет показали значимые различие до и после исследования внутри групп по общему числу баллов, а также отдельно по показателям «Эмоции и здоровье». Во 2-й группе значимые различия были выявлены также по показателю «Повседневная жизнь» (табл. 5). Таким образом, на фоне проводимой комплексной терапии улучшались показатели качества жизни семей как в основной, так и в контрольной группе.
Таблица 5.
Сравнение показателей качества жизни членов семьи детей, получавших и не получавших синбиотик, с помощью вопросника FLIP в возрастной группе 1-3 года
Table 5.
Comparison of the quality-of-life parameters in families of children who received and did not receive synbiotics using the FLIP questionnaire in the age group 1-3 years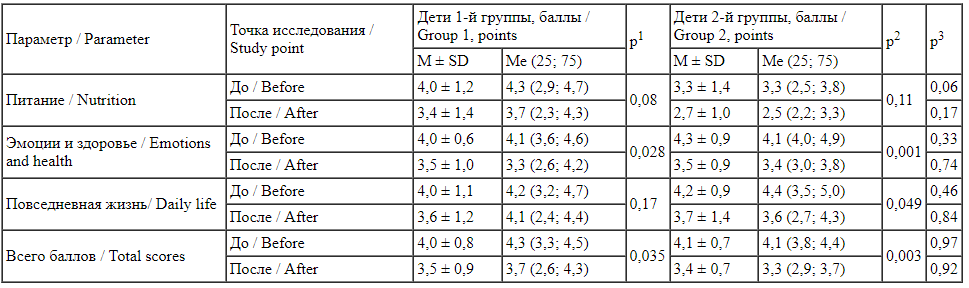 р1 - статистически значимая разница между параметрами до и после исследования у детей группы 1; р2 - статистически значимая разница между параметрами до и после исследования у детей группы 2; р3 - статистически значимая разница параметра до или после исследования между детьми разных исследуемых групп.
р1 - статистически значимая разница между параметрами до и после исследования у детей группы 1; р2 - статистически значимая разница между параметрами до и после исследования у детей группы 2; р3 - статистически значимая разница параметра до или после исследования между детьми разных исследуемых групп.
p1 - statistically significant difference between the parameters before and after the study in group 1; p2 - statistically significant difference between the parameters before and after the study in group 2; p3 - statistically significant difference in the parameter before or after the study between the children of different study groups.
Среди семей детей в возрасте 3-5 лет значимые различия до и после исследования выявлены только в группе сравнения.
Переносимость исследуемых продуктов «Максилак Бэби» и «Максилак» оценена как хорошая. Нежелательных реакций в ходе исследования не отмечено. Прежде всего, хорошая переносимость продуктов имела отражение в результатах проведенного исследования: у всех детей без значимых различий между обследованными группами произошло улучшение результатов оценки по шкалам SCORAD-TIS и COMISS. Более того, у детей, принимавших синбиотик, произошли более значимые положительные изменения типа стула по сравнению с детьми, получавшими только стандартную терапию.
В клинических рекомендациях по ведению пищевой аллергии и анафилаксии Европейской академии аллергологии и клинической иммунологии (EAACI) отмечается, что пробиотики не имеют достаточной доказательной базы в лечении пищевой аллергии [23]. Также считается, что поскольку пробиотические препараты содержат следы молочных сред, они должны с осторожностью применяться у больных с аллергией на белки коровьего молока [26]. Однако многочисленные данные говорят о безопасности про- и пребиотиков [17, 18, 27], и, по мнению экспертов, если семьи предпочитают использовать пре- или пробиотики, они вряд ли смогут причинить вред в долгосрочной перспективе. И очевидно, что решающее значение имеет состав каждого определенного препарата. Результаты настоящего исследования согласуются с результатами зарубежных работ: несмотря на то, что в основной группе детей, получавших синбиотик, 38% детей имели аллергию к белкам коровьего молока, ни у одного участвовавшего ребенка не произошло ухудшения симптомов АтД при одновременном применении стандартной терапии и синбиотика. Кроме того, значимое уменьшение выраженности симптомов пищевой аллергии произошло в обеих группах вне зависимости от применения синбиотика.
Также накапливаются данные об иммуномодулирующих эффектах пробиотических штаммов, позволяющие говорить о перспективах применения их при АтД и респираторной аллергии в качестве дополнения к основному лечению [28-30]. Результаты мета-анализа (22 исследования, 1420 детей), проведенного филиппинскими учеными, показали эффективность в снижении симптомов АтД у 3 из 28 изученных пробиотических препаратов: микса штаммов Bifidobacterium animalis, B. longum и L. casei (mix1), микса штаммов B. bifidum, L. acidophilus, L. casei и L. salivarius (Mix6) и L. casei. При использовании Mix1 уменьшение выраженности симптомов дерматита происходило в 2 раза интенсивнее по сравнению с группой плацебо (SMD -1,94, 95% CI -2,65...-1,24), в меньшей степени - при использовании Mix6 (SMD -0,85, 95% CI -1,50. -0,20). Применение L. casei отдельно не обладало высокой степенью значимости для снижения симптомов заболевания (SMD -1,35, 95% CI -2,04.-0,65). В то же время содержание L. casei в составе mix1 и mix6 указывает на синергизм штаммов в отношении эффективности терапии заболевания [31].
Обращает на себя внимание то, что состав mix6 содержит те же пробиотические бактерии, что и исследованные синбиотические биокомплексы «Максилак Бэби» и «Максилак»: B. bifidum, L. acidophilus, L. casei. «Максилак Бэби» помимо этого содержит L. salivarius.
Заключение
В настоящем исследовании, посвященном переносимости синбиотических биокомплексов «Максилак Бэби» и «Максилак», эффективность применяемого продукта показана в отношении качества стула у детей: в группе, получавшей синбиотик, динамика улучшения стула была значимо выше по сравнению с группой детей, не получавших синбиотик. Так, большинство значимых различий в характере стула на фоне терапии произошло у детей, принимавших синбиотик: значимо увеличилось число детей с 3-м и 4-м типами стула по Бристольской шкале. Также значимо уменьшились доли детей 1-й группы с 5-м и 6-м типами кала, а также уменьшилось число детей с неустойчивым стулом. При этом значимых различий между группами в отношении динамики кожных высыпаний не выявлено.
Безопасность исследованных синбиотиков «Максилак Бэби» и «Максилак» была показана также в результате анализа гастроинтестинальных проявлений пищевой аллергии у детей до 1 года жизни с помощью шкалы COMISS. Так, в обеих обследованных группах детей произошло статистически значимое снижение баллов без значимой разницы между группами. Ни у одного из пациентов не зарегистрированы нежелательные явления либо сопутствующие заболевания в период участия пациента в исследовании.
Анализ оценки качества жизни семей детей с пищевой аллергией показал отсутствие значимых различий по показателям «Питание», «Эмоции и здоровье», «Повседневная жизнь» и общему количеству баллов между обследованными группами. При этом анализ по возрастным группам показал улучшение некоторых показателей качества жизни в семьях с детьми в возрасте до 1 года и с детьми 1-3 лет, которые применяли синбиотики «Максилак Бэби» и «Максилак», что особенно важно, учитывая ранний возраст детей.
Таким образом, полученные результаты позволяют говорить о безопасности и эффективности использования исследованных синбиотических биокомплексов в дополнение к базисной терапии детей с АтД и пищевой аллергией.
Информация о соавторах:
Макарова Светлана Геннадиевна, доктор медицинских наук, руководитель Центра профилактической педиатрии Национального медицинского исследовательского центра здоровья детей Минздрава России, профессор кафедры многопрофильной клинической подготовки факультета фундаментальной медицины Московского государственного университета им. М.В.Ломоносова
Емельяшенков Евгений Евгеньевич, аспирант отдела профилактической педиатрии Центра профилактической педиатрии Национального медицинского исследовательского центра здоровья детей Минздрава России
Фисенко Андрей Петрович, доктор медицинских наук, профессор, директор Национального медицинского исследовательского центра здоровья детей Минздрава России
Ерешко Оксана Александровна, кандидат медицинских наук, врач-аллерголог отдела профилактической педиатрии Центра профилактической педиатрии Национального медицинского исследовательского центра здоровья детей Минздрава России
Гордеева Ирина Григорьевна, младший научный сотрудник отдела профилактической педиатрии Центра профилактической педиатрии Национального медицинского исследовательского центра здоровья детей Минздрава России
Чумбадзе Тамара Робертовна, кандидат медицинских наук, старший научный сотрудник отдела профилактической педиатрии Центра профилактической педиатрии Национального медицинского исследовательского центра здоровья детей Минздрава России Адрес: 119991, Москва, Ломоносовский пр-т, 2, стр. 1
Абайханов Расул Иосифович, кандидат медицинских наук, руководитель консультативно-диагностического центра Национального медицинского исследовательского центра здоровья детей Минздрава России
Мурадова Ольга Исламовна, кандидат медицинских наук, старший научный сотрудник лаборатории развития современных технологий в амбулаторных условиях Национального медицинского исследовательского центра здоровья детей Минздрава России
Information about co-authors:
Svetlana G. Makarova, MD, PhD, DSc, Head of the Center for Preventive Pediatrics, National Medical Research Center for Children’s Health, Ministry of Health of the Russian Federation; Professor, Department of Multidisciplinary Clinical Training, Faculty of Fundamental Medicine, Lomonosov Moscow State University
Evgeny E. Emelyashenkov, Postgraduate Student, Department of Preventive Pediatrics, Center for Preventive Pediatrics, National Medical Research Center for Children's Health, Ministry of Health of the Russian Federation
Andrey P. Fisenko, MD, PhD, DSc, Director of the National Medical Research Center for Children’s Health, Ministry of Health of the Russian Federation
Oksana A. Ereshko, MD, PhD, Allergist, Department of Preventive Pediatrics, Center for Preventive Pediatrics, National Medical Research Center for Children’s Health, Ministry of Health of the Russian Federation
Irina G. Gordeeva, Junior Researcher, Department of Preventive Pediatrics, Center for Preventive Pediatrics, National Medical Research Center for Children’s Health, Ministry of Health of the Russian Federation
Tamara R. Chumbadze, MD, PhD, Senior Researcher, Department of Preventive Pediatrics, Center for Preventive Pediatrics, National Medical Research Center for Children’s Health, Ministry of Health of the Russian Federation
Rasul I. Abaykhanov, MD, PhD, Head of the Consulting and Diagnostic Center, National Medical Research Center for Children’s Health, Ministry of Health of the Russian Federation
Olga I. Muradova, MD, PhD, Senior Researcher, Laboratory of the Development of Modern Technologies in Outpatient Settings, National Medical Research Center for Children’s Health, Ministry of Health of the Russian Federation
Литература / References
1. Lee KH, Song Y, Wu W, Yu K, Zhang G. The gut microbiota, environmental factors, and links to the development of food allergy. Clin Mol Allergy. 2020 Apr 2;18:5.
2. Abrahamsson TR, Jakobsson HE, Andersson AF, Bjorksten B, Engstrand L, Jenmalm MC. Low diversity of the gut microbiota in infants with atopic eczema. J Allergy Clln Immunol. 2012 Feb;129(2):434-40,440.e1-2.
3. Azad MB, Konya T, Guttman DS, Field CJ, Sears MR, HayGlass KT, et al.; CHILD Study Investigators. Infant gut microbiota and food sensitization: associations in the first year of life. Clin Exp Allergy. 2015 Mar;45(3):632-43.
4. Wang M, Karlsson C, Olsson C, Adlerberth I, Wold AE, Strachan DP, et al. Reduced diversity in the early fecal microbiota of infants with atopic eczema. J Allergy Clln Immunol. 2008 Jan;121(1):129-34.
5. Ismail IH, Oppedisano F, Joseph SJ, Boyle RJ, Licciardi PV, Robins-Browne RM, et al. Reduced gut microbial diversity in early life is associated with later development of eczema but not atopy in high-risk infants. Pediatr Allergy Immunol. 2012 Nov;23(7):674-81.
6. Sjogren YM, Jenmalm MC, Bottcher MF, Bjorksten B, Sverremark-Ekstrom E. Altered early infant gut microbiota in children developing allergy up to 5 years of age. Clin Exp Allergy. 2009 Apr;39(4):518-26.
7. Ling Z, Li Z, Liu X, Cheng Y, Luo Y, Tong X, et al. Altered fecal microbiota composition associated with food allergy in infants. Appl Environ Microbiol. 2014 Apr;80(8):2546-54.
8. Nylund L, Satokari R, Nikkila J, Rajilic-Stojanovic M, Kalliomaki M, Isolauri E, et al. Microarray analysis reveals marked intestinal microbiota aberrancy in infants having eczema compared to healthy children in at-risk for atopic disease. BMC Microbiol. 2013 Jan 23;13:12.
9. McGuckin MA, Linden SK, Sutton P, Florin TH. Mucin dynamics and enteric pathogens. Nat Rev Microbiol. 2011 Apr;9(4):265-78.
10. Jakobsson HE, Abrahamsson TR, Jenmalm MC, Harris K, Quince C, Jernberg C, et al. Decreased gut microbiota diversity, delayed Bacteroidetes colonisation and reduced Th1 responses in infants delivered by caesarean section. Gut. 2014 Apr;63(4):559-66.
11. Bunyavanich S, Shen N, Grishin A, Wood R, Burks W, Dawson P, et al. Early-life gut microbiome composition and milk allergy resolution. J Allergy Clin Immunol. 2016 Oct;138(4):1122-1130.
12. FAO/WHO (2001) Evaluation of Health and Nutritional Properties of Probiotics in Food Including Powder Milk with Live Acid Bacteria. Report of a Joint FAO/WHO Expert Consultation, Cordoba, Argentina.
13. Morelli L, Capurso L, FAO/WHO Guidelines on Probiotics. Journal of Clinical Gastroenterology. 2012 Oct;46:S1-S2.
14. Collins JK, Thornton G, Sullivan GO. Selection of probiotic strains for human applications. International Dairy Journal. 1998 Jun;8(5/6):487-490.
15. Ouwehand AC, Salminen S, Isolauri E. Probiotics: an overview of beneficial effects. Antonie Van Leeuwenhoek. 2002 Aug;82(1-4):279-89.
16. Gorbach SL. Probiotics in the third millennium. Dig Liver Dis. 2002 Sep;34 Suppl 2:S2-7.
17. Fiocchi A, Pawankar R, Cuello-Garcia C, Ahn K, Al-Hammadi S, Agarwal A, et al. World Allergy Organization - McMaster University Guidelines for Allergic Disease Prevention (GLAD-P): Probiotics. World Allergy Organ J. 2015 Jan 27;8(1):4.
18. Cuello-Garcia CA, Fiocchi A, Pawankar R, Yepes-Nunez JJ, Morgano GP, Zhang Y, et al. World Allergy Organization-McMaster University Guidelines for Allergic Disease Prevention (GLAD-P): Prebiotics. World Allergy Organ J. 2016 Mar 1;9:10.
19. Agostoni C, Axelsson I, Goulet O, Koletzko B, Michaelsen KF, Puntis JW et al. ESPGHAN Committee on Nutrition. Prebiotic oligosaccharides in dietetic products for infants: a commentary by the ESPGHAN Committee on Nutrition. J Pediatr Gastroenterol Nutr. 2004 Nov;39(5):465-73.
20. Gibson GR, Probert HM, Loo JV, Rastall RA, Roberfroid MB. Dietary modulation of the human colonic microbiota: updating the concept of prebiotics. Nutr Res Rev. 2004 Dec;17(2):259-75.
21. Fiocchi A, Brozek J, Schunemann H, Bahna SL, von Berg A, Beyer K, et al; World Allergy Organization (WAO) Special Committee on Food Allergy. World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow's Milk Allergy (DRACMA) Guidelines. Pediatr Allergy Immunol. 2010 Jul;21 Suppl 21:1125.
22. Koletzko S, Niggemann B, Arato A, Dias JA, Heuschkel R, Husby S, et al; European Society of Pediatric Gastroenterology, Hepatology, and Nutrition. Diagnostic approach and management of cow's-milk protein allergy in infants and children: ESPGHAN GI Committee practical guidelines. J Pediatr Gastroenterol Nutr. 2012 Aug;55(2):221-9.
23. Muraro A, Werfel T, Hoffmann-Sommergruber K, Roberts G, Beyer K, Bindslev-Jensen C, et al; EAACI Food Allergy and Anaphylaxis Guidelines Group. EAACI food allergy and anaphylaxis guidelines: diagnosis and management of food allergy. Allergy. 2014 Aug;69(8):1008-25.
24. Vandenplas Y, Mukherjee R, Dupont C, Eigenmann P, Host A, Kuitunen M, et al.; on behalf the Chinese CoMiSS Investigator Team. Protocol for the validation of sensitivity and specificity of the Cow's Milk-related Symptom Score (CoMiSS) against open food challenge in a single-blinded, prospective, multicentre trial in infants. BMJ Open. 2018 May 17;8(5):e019968.
25. Mikkelsen A, Borres MP, Bjorkelund C, Lissner L, Oxelmark L. The food hypersensitivity family impact (FLIP) questionnaire - development and first results. Pediatr Allergy Immunol. 2013 Sep;24(6):574-81.
26. Martin-Munoz MF, Fortuni M, Caminoa M, Belver T, Quirce S, Caballero T. Anaphylactic reaction to probiotics. Cow's milk and hen's egg allergens in probiotic compounds. Pediatr Allergy Immunol. 2012 Dec;23(8):778-84.
27. Lundelin K, Poussa T, Salminen S, Isolauri E. Long-term safety and efficacy of perinatal probiotic intervention: Evidence from a follow-up study of four randomized, double-blind, placebo-controlled trials. Pediatr Allergy Immunol. 2017 Mar;28(2):170-175.
28. Hajavi J, Esmaeili SA, Varasteh AR, Vazini H, Atabati H, Mardani F, et al. The immunomodulatory role of probiotics in allergy therapy. J Cell Physiol. 2019 Mar;234(3):2386-2398.
29. Rijkers GT, Bengmark S, Enck P, Haller D, Herz U, Kalliomaki M, et al. Guidance for substantiating the evidence for beneficial effects of probiotics: current status and recommendations for future research. J Nutr. 2010 Mar;140(3):671S-6S.
30. Fassio F, Guagnini F. House dust mite-related respiratory allergies and probiotics: a narrative review. Clin Mol Allergy. 2018 Jun 19;16:15.
31. Tan-Lim CSC, Esteban-Ipac NAR, Mantaring JBV 3rd, Chan Shih Yen E, Recto MST, Sison OT, et al. Comparative effectiveness of probiotic strains for the treatment of pediatric atopic dermatitis: A systematic review and network metaanalysis. Pediatr Allergy Immunol. 2021 Jan;32(1):124-136.
