 www.binnopharmgroup.ru
www.binnopharmgroup.ru

Максилак® - линейка средств для коррекции дисбактериоза и поддержания баланса микрофлоры желудочно‑кишечного тракта взрослых и детей с 3 лет в любых ситуациях ее нарушения.
Динамика уровня зонулина в стуле при инфекции COVID-19 и в постковидный период у детей
СтатьиА.В.Полунина1, В.П.Новикова1, А.Е.Блинов1, О.Н.Варламова1, А.А.Белова1, А.Л.Балашов1,2, С.Л.Баннова1, П.В.Воронцов3, С.В.Белевич2
1Санкт-Петербургский государственный педиатрический медицинский университет, Санкт-Петербург, Российская Федерация;
2Городская поликлиника №56, Санкт-Петербург, Российская Федерация;
3Санкт-Петербургский медико-социальный институт, Санкт-Петербург, Российская Федерация.
В настоящее время для определения проницаемости кишечной стенки используется оценка уровня фекального биомаркера зонулина.
Цель. На основании определения зонулина в стуле оценить состояние проницаемости кишечной стенки при новой коронавирусной инфекции у детей.
Пациенты и методы. Зонулин в стуле изучен у 35 детей с новой коронавирусной инфекцией, протекавшей у большинства в легкой степени тяжести. Забор кала для исследования проводился при установлении диагноза и через 14 дней после начала наблюдения. Затем пациентов рандомизировали на 2 группы. Группа 1 (основная, n = 19) получала синбиотик Максилак® Бэби (по 2 саше 1 раз в сутки) в течение 1 мес., группа 2 (контроль, n = 16) не получала никаких пробиотиков, пребиотиков и адсорбентов в течение месяца; третий забор стула проводили через 1 мес. после второго. Исследование проводилось методом иммуноферментного анализа с помощью тест-системы IDK Zonulin ELISA (Immundiagnostik AG, Германия).
Результаты. Уровень зонулина в начале болезни составлял 77,38 ± 12,59 нг/мл, на 14-е сутки - 76,26 ± 13,10 нг/мл, через месяц - 82,64 ± 11,99 нг/мл (р1-2 = 0,75; р1-3 = 0,04; р2-3 = 0,04). Дети, получавшие Максилак® Бэби в течение месяца, не имели значимых повышений уровня зонулина (76,26 ± 13,10 нг/мл и 79,02 ± 11,87 нг/мл; р = 0,40), тогда как в группе сравнения уровень зонулина значимо повышался (76,26 ± 13,10 нг/мл и 87,95 ± 10,96 нг/мл; р = 0,048).
Заключение. Через месяц после перенесенной коронавирусной инфекции у детей значимо увеличивается проницаемость кишечной стенки, тогда как в течение болезни она не меняется. Назначение синбиотика Максилак® Бэби у детей, перенесших коронавирусную инфекцию в легкой или среднетяжелой форме и не получавших антибиотики, эффективно предотвращает у них нарушение кишечной проницаемости.
Ключевые слова: дети, вирус SARS-CoV-2, зонулин, коронавирусная инфекция, проницаемость кишечника, COVID-19
Для цитирования: Полунина А.В., Новикова В.П., Блинов А.Е., Варламова О.Н., Белова А.А., Балашов А.Л., Баннова С.Л., Воронцов П.В., Белевич С.В. Динамика уровня зонулина в стуле при инфекции COVID-19 и в постковидный период у детей. Инфекционные болезни. 2022; 20(3): 35-40. DOI: 10.20953/1729-9225-2022-3-35-40
Dynamics of fecal zonulin levels in COVID-19 and in the post-covid period in children
A.V.Polunina1, V.P.Novikova1, A.E.Blinov1, O.N.Varlamova1, A.A.Belova1, A.L.Balashov1’2, S.L.Bannova1, P.V.Vorontsov3, S.V.Belevich2
1Saint Petersburg State Pediatric Medical University, Saint Petersburg, Russian Federation;
2City Polyclinic No 56, Saint Petersburg, Russian Federation;
3Saint Petersburg Medical and Social Institute, Saint Petersburg, Russian Federation.
Fecal zonulin is currently used as a biomarker of intestinal permeability.
Objective. To assess the state of intestinal permeability in a novel coronavirus infection (COVID-19) in children based on the determination of fecal zonulin levels.
Patients and methods. Fecal zonulin levels were assessed in 35 children with COVID-19, which was mild in most of them. Fecal sampling was performed at the time of diagnosis and 14 days after the start of observation. Patients were then randomized into two groups. Group 1 (study, n = 19) received Maxilac® Baby synbiotic (2 sachets once a day) for 1 month, group 2 (control, n = 16) did not receive any probiotics, prebiotics, and adsorbents for a month; the third stool sampling was performed 1 month after the second. The study was carried out by enzyme immunoassay using the IDK Zonulin ELISA test system (Immundiagnostik AG, Germany).
Results. Fecal zonulin levels were 77.38 ± 12.59 ng/mL at the beginning of the disease, 76.26 ± 13.10 ng/mL on day 14, and 82.64 ± 11.99 ng/mL after one month (p1-2 = 0.75; p1-3 = 0.04; p2-3 = 0.04). Children who received Maxilac® Baby for a month did not have significant increases in zonulin levels (76.26 ± 13.10 ng/mL and 79.02 ± 11.87 ng/mL; p = 0.40), while the control group demonstrated significantly elevated zonulin levels (76.26 ± 13.10 ng/mL and 87.95 ± 10.96 ng/mL; p = 0.048).
Conclusion. A month after the coronavirus infection, the intestinal permeability in children increases significantly, whereas it does not change during the course of the disease. Administration of Maxilac® Baby synbiotic in children who had a mild-to-moderate coronavirus infection and did not receive antibiotics effectively prevents intestinal permeability disorders in them.
Key words: children, SARS-CoV-2, zonulin, coronavirus infection, intestinal permeability, COVID-19
For citation: Polunina A.V., Novikova V.P., Blinov A.E., Varlamova O.N., Belova A.A., Balashov A.L., Bannova S.L., Vorontsov P.V., Belevich S.V. Dynamics of fecal zonulin levels in COVID-19 and in the post-covid period in children. Infekc. bolezni (Infectious Diseases). 2022; 20(3): 35-40. (In Russian). DOI: 10.20953/1729-9225-2022-3-35-40
Исследования течения новой коронавирусной инфекции остаются сегодня актуальными в связи с продолжающейся пандемией [1]. Согласно многочисленным наблюдениям, заболеваемость детей инфекцией COVID-19 существенно ниже по сравнению с взрослыми и составляет в Российской Федерации 7,6%, а в структуре заболевших дети составляют 10%. У четверти детей инфекция протекает без клинических проявлений; тяжелое течение заболевания отмечается у 1% больных [1-3]. Тем не менее даже при легком течении у некоторых пациентов развивается тяжелое осложнение - мультивоспалительный Кавасаки-подобный синдром [2, 3].
У взрослых пациентов, по данным мета-анализа 47 исследований с участием 10 890 пациентов, при COVID-19 диарея встречается с частотой 7,2-8,2%, тошнота или рвота -7,1-8,5%, боль в животе - 2,0-3,4% [4]; у детей частота этих симптомов, по данным разных авторов, составляет от 5% до 66% [5-8]. Наличие гастроэнтерологических симптомов при инфекции COVID-19 большинство исследователей связывают с обнаружением вируса в кишечнике и нарушением состава кишечной микробиоты [9-13]. Особое внимание уделяется возможной прогностической и терапевтической роли микроорганизмов кишечника при инфицировании вирусом SARS-CoV-2, значению кишечной микробиоты в процессе выздоровления от инфекции [14, 15] или развития осложнений [11, 14, 15]. Предполагается, что вирус SARS-CoV-2 повреждает кишечную стенку и повышает кишечную проницаемость, благодаря чему вирусные частицы попадают в кровь и вызывают тяжелое течение заболевания и осложнения в постковидном периоде [16].
Маркером повышенной проницаемости кишечной стенки является зонулин - белок, разрушающий плотные клеточные контакты [17-21]. В педиатрии этот маркер чаще всего изучают у детей в перинатальном периоде [22-24]. Актуальность его определения состоит в поиске терапевтических подходов, направленных на нормализацию кишечной проницаемости [25]. Сегодня проходит третью фазу клинических испытаний ларозатид ацетат - ингибитор зонулина; его предполагается применять для лечения целиакии [26, 27]. Предполагается, что пробиотики могут нормализовать проницаемость кишечной стенки [24, 25], однако исследований уровня зонулина в стуле у детей с новой коронавирусной инфекцией и влияния на него пробиотиков нам найти не удалось.
Цель. На основании определения уровня зонулина в стуле оценить состояние проницаемости кишечной стенки при новой коронавирусной инфекции и в постковидном периоде у детей и влияние на нее синбиотика Максилак® Бэби.
Пациенты и методы
Проведено клиническое открытое пострегистрационное наблюдательное проспективное одноцентровое исследование, включившее оценку уровня зонулина в кале у 35 детей от 3 до 14 лет с новой коронавирусной инфекцией, из них мальчиков - 21, девочек - 14. Трое детей имели среднюю степень тяжести заболевания, остальные - легкую степень. Набор детей для исследования проводился на двух клинических базах: Санкт-Петербургское государственное бюджетное учреждение здравоохранения «Городская поликлиника №56», детское поликлиническое отделение №48, и отделение для детей с новой коронавирусной инфекцией COVID-19 с палатами реанимации и интенсивной терапии ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России. Пациенты были включены в исследование только после получения положительного заключения локального этического комитета о соответствии Хельсинской декларации Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» (2000) [28] и «Правилам клинической практики в Российской Федерации» (2003). Все больные и/или их законные представители были осведомлены об участии в исследовании и добровольно подписали информированное согласие на проведение обследования.
Отбор пациентов для исследования осуществлялся методом случайной простой выборки при подтверждении диагноза новой коронавирусной инфекции результатами полимеразной цепной реакции (ПЦР) мазка из зева. Критерии включения в исследование:
1) возраст от 3 до 14 лет;
2) подтверждение диагноза новой коронавирусной инфекции результатами ПЦР мазка из зева;
3) легкое и среднетяжелое течение заболевания;
4) отсутствие сопутствующих хронических неспецифических заболеваний легких, хронической сердечной недостаточности, хронической почечной недостаточности, язвенной болезни желудка и опухолей желудка, воспалительных заболеваний кишечника, других острых и хронических заболеваний кожи, расстройств аутистического спектра (РАС);
5) назначение антибактериальной терапии;
6) информированное согласие на участие в исследовании.
Критерии исключения: возраст менее 3 лет, старше 14 лет; установленные диагнозы муковисцидоза, хронических неспецифических заболеваний легких, хронической сердечной недостаточности, хронической почечной недостаточности, язвенной болезни желудка и опухолей желудка, воспалительных заболеваний кишечника, других острых и хронических заболеваний кожи, применение антисекреторной терапии во время проведения исследования, РАС; отказ пациента или его законных представителей от исследования.
Согласно дизайну исследования, забор кала для исследования проводился при установлении диагноза и через 14 дней после начала наблюдения. Затем пациентов рандомизировали на 2 группы. Группа 1 (основная, n = 19) получала синбиотик Максилак® Бэби (по 2 саше 1 раз в сутки) в течение 1 мес., группа 2 (контроль, n = 16) не получала никаких пробиотиков, пребиотиков и адсорбентов в течение месяца. Через месяц у всех детей проводили третий забор кала. Исследование кала на зонулин проводилось на базе НИЦ Санкт-Петербургского государственного педиатрического медицинского университета методом иммуноферментного анализа с помощью тест-системы IDK Zonulin ELISA (Immun-diagnostik AG, Германия). Среднее значение показателя, заявленное производителем тест-системы по данным обследования 40 практически здоровых лиц, - 61 ± 46 нг/мл. При значениях показателя <83,15 нг/мл результат расценивался как норма, при 83,15-110,0 нг/мл - как повышенная концентрация, >110 нг/мл - как высокая концентрация.
Статистическая обработка материала проводилась с использованием пакета прикладных программ IBM SPSS Statictics 26. Для сравнения средних показателей количественных признаков в исследуемых группах использовался t-критерий Стьюдента с оценкой достоверности различий (p < 0,05) по значениям M ± m.
Результаты исследования и их обсуждение
Установлено, что частота болей в животе у обследованных детей составила 90%, однако боли в животе были неотчетливые и имели слабо выраженный характер, жалобы на них предъявлялись лишь при прицельном расспросе. Частота тошноты составила 4%, рвоты - 3%, диареи - 15%. К 14-му дню болезни все гастроэнтерологические жалобы, как правило, купировались. Динамика уровня зонулина в стуле представлена в таблице.
Таблица.
Динамика уровня зонулина в стуле у детей с новой коронавирусной инфекцией
Table.
Dynamics of fecal zonulin levels in children with COVID-19
| Время исследования / Study period |
В начале болезни (1) / At the beginning of the disease (1) |
Через 14 дней (2) / After 14 days (2) |
Через 1 мес. после выздоровления (3) / One month after recovery (3) |
| Уровень зонулина, нг/мл / Zonulin levels, ng/m |
77,38 ± 12,59 | 76,26 ± 13,10 | 82,64 ± 11,99 |
р1-2= 0,75; р1-3 = 0,04; р2-3 = 0,04
Как следует из таблицы, уровни зонулина в начале болезни и через 14 дней от начала болезни не имели значимых различий, тогда как через месяц наблюдалось его повышение.
Дети, получавшие Максилак® Бэби в течение месяца, не имели значимых повышений уровня зонулина (76,26 ± ± 13,10 нг/мл и 79,02 ± 11,87 нг/мл; р = 0,40), тогда как в группе сравнения уровень зонулина значимо повышался (76,26 ± 13,10 нг/мл и 87,95 ± 10,96 нг/мл; р = 0,048) (рисунок).
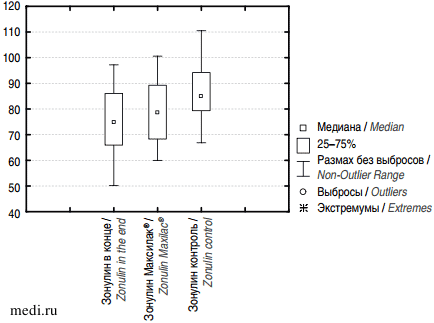 Рисунок. Динамика уровня зонулина в стуле у детей с новой коронавирусной инфекцией.
Рисунок. Динамика уровня зонулина в стуле у детей с новой коронавирусной инфекцией.
Figure. Dynamics of fecal zonulin levels in children with COVID-19.
Выявленное нами повышение уровня зонулина в стуле после перенесенной инфекции СОVID-19 в легкой или среднетяжелой форме, не требующей антибиотикотерапии, может быть связана как с непосредственным повреждением кишечного эпителия, так и с существенными изменениями кишечного микробиоценоза вследствие действия вируса на микробиоту [13, 17, 18]. В исследовании продемонстрирована протективная роль синбиотика Максилак® Бэби в отношении кишечной проницаемости после перенесенной коронавирусной инфекции. Это может быть обусловлено тем, что Максилак® Бэби, содержащий 9 культур полезных бактерий в необходимой для кишечника ребенка концентрации - 1 млрд (1 х 109) КОЕ, а также пребиотики - фруктоолигосахариды, обеспечивает условия для роста и размножения нормальной микробиоты человека [29]. Повышение проницаемости кишечника именно после перенесенной новой коронавирусной инфекции и связанная с ней эндотоксемия также могут лежать в основе патогенеза развития постковидного синдрома; эту гипотезу подтверждают данные эффективности плазмофереза при Кавасаки-подобном мультисистемном воспалительном синдроме у детей в отсроченном периоде коронавирусной инфекции [30]. Таким образом, назначение синбиотика Максилак® Бэби у детей, перенесших коронавирусную инфекцию в легкой или среднетяжелой форме и не получавших антибиотики, эффективно предотвращает нарушение кишечной проницаемости, лежащей в основе патогенеза COVID-19 и его гастроэнтерологических проявлений.
Заключение
1. Частота болей в животе у детей с инфекцией OOVID-19 составила 90%, боли в животе были неотчетливые и имели слабо выраженный характер, тошноты - 4%, рвоты - 3%, диареи - 15%.
2. Через месяц после перенесенной коронавирусной инфекции у детей значимо увеличивается проницаемость кишечной стенки, тогда как в течение болезни она не меняется.
3. Для предотвращения нарушения кишечной проницаемости у всех детей, перенесших коронавирусную инфекцию, даже в легкой или среднетяжелой форме, не получавших антибиотики и не имеющих гастроэнтерологических жалоб к моменту клинического выздоровления (на 14-й день от начала болезни), показано назначение синбиотика Максилак® Бэби.
4. Необходимы дальнейшие исследования для подтверждения значения уровня зонулина в стуле как доклинического маркера постковидных заболеваний и протективной роли пробиотиков в реабилитации лиц, перенесших коронавирусную инфекцию.
Информация о соавторах:
Новикова Валерия Павловна, доктор медицинских наук, профессор, заведующая кафедрой пропедевтики детских болезней с курсом общего ухода за детьми, заведующий лабораторией медико-социальных проблем в педиатрии НИЦ Санкт-Петербургского государственного педиатрического медицинского университета
Блинов Александр Евгеньевич, старший научный сотрудник лаборатории медико-социальных проблем в педиатрии НИЦ Санкт-Петербургского государственного педиатрического медицинского университета
Варламова Ольга Николаевна, научный сотрудник лаборатории медико-социальных проблем в педиатрии НИЦ Санкт-Петербургского государственного педиатрического медицинского университета
Белова Анна Александровна, старший лаборант кафедры пропедевтики детских болезней с курсом общего ухода за детьми Санкт-Петербургского государственного педиатрического медицинского университета
Балашов Алексей Львович, кандидат медицинских наук, доцент кафедры пропедевтики детских болезней с курсом общего ухода за детьми Санкт-Петербургского государственного педиатрического медицинского университета, главный врач Городской поликлиники №56
Баннова Светлана Леонидовна, кандидат медицинских наук, заведующая отделением для детей с новой коронавирусной инфекцией COVID-19 с палатами реанимации и интенсивной терапии Санкт-Петербургского государственного педиатрического медицинского университета
Воронцов Павел Владимирович, студент Санкт-Петербургского медико-социального института
Белевич Светлана Вячеславовна, кандидат медицинских наук, заведующая педиатрическим отделением №1 Городской поликлиники №56
Information about co-authors:
Valeria P. Novikova, MD, PhD, DSc, Professor, Head of the Department of Propaedeutics of Children's Diseases with a Course in General Child Care; Head of the Laboratory of Medical and social problems in pediatrics, Research Center of Saint Petersburg State Pediatric Medical University
Alexander E. Blinov, Senior Researcher, Laboratory of Medical and Social Problems in Pediatrics, Research Center of Saint Petersburg State Pediatric Medical University
Olga N. Varlamova, Researcher, Laboratory of Medical and Social Problems in Pediatrics, Research Center of Saint Petersburg State Pediatric Medical University
Anna A. Belova, Senior Laboratory Assistant, Department of Propaedeutics of Children's Diseases with a Course in General Child Care, Saint Petersburg State Pediatric Medical University
Aleksey L. Balashov, MD, PhD, Associate Professor of the Department of Propaedeutics of Childhood Diseases with a Course in General Child Care, Saint Petersburg State Pediatric Medical University, chief physician City Polyclinic No 56
Svetlana L. Bannova, MD, PhD, Head of the Department of Novel Coronavirus Infection, Saint Petersburg State Pediatric Medical University
Pavel V. Vorontsov, student of the Saint Petersburg Medical and Social Institute
Svetlana V. Belevich, MD, PhD, Head of the Pediatric Department No 1, City Polyclinic No 56
Литература / Referenses
1. Авдеев СН, Адамян ЛВ, Алексеева ЕИ, Багненко СФ, Баранов АА, Баранова НН, и др. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Временные методические рекомендации. Версия 15 от 22.02.2022.
2. Александрович ЮС, Байбарина ЕН, Баранов АА, Вишнева ЕА, Зверева НН, Иванов ДО, и др. Методические рекомендации. Особенности клинических проявлений и лечения заболевания, вызванного новой коронавирусной инфекцией (COVID-19) у детей. Версия 2. (03.07.2020).
3. Намазова-Баранова ЛС, Баранов АА. COVID-19 и дети. Пульмонология. 2020;30(5):609-628.
4. Sultan S, Altayar O, Siddique SM, Davitkov P, Feuerstein JD, Lim JK, et al. AGA Institute Rapid Review of the Gastrointestinal and Liver Manifestations of COVID-19, Meta-Analysis of International Data, and Recommendations for the Consultative Management of Patients with COVID-19. Gastroenterology. 2020 Jul; 159(1):320-334.e27.
5. Ермоленко КД, Гончар НВ, Скрипченко НВ. Поражение органов желудочно-кишечного тракта при новой коронавирусной инфекции у детей. Педиатрия им. Г.Н.Сперанского. 2020;99(6):135-140.
6. Попова РВ, Руженцова ТА, Хавкина ДА, Чухляев ПВ, Гарбузов АА, Мешкова НА. Нарушения функции желудочно-кишечного тракта при COVID-19 у детей. Проблемы особо опасных инфекций. 2020;(3):154-157.
7. Gupta R, Beg S, Jain A, Bhatnagar S. Paediatric COVID-19 and the GUT. Indian J Med Microbiol. 2020 Jul-Dec;38(3 & 4):261-264.
8. Полунина АВ, Шакмаева МА, Иванов ДО, Тимченко ВН, Баннова СЛ, Гурина ОП, и др. Гастроэнтерологические симптомы при новой коронавирусной инфекции у детей зависят от цитокинового статуса. В сборнике: Актуальные проблемы абдоминальной патологии у детей. Под общей редакцией проф. Бельмера СВ и проф. Ильенко ЛИ. 2022.
9. Li F, Lu H, Li X, Wang X, Zhang Q, Mi L. The impact of COVID-19 on intestinal flora: A protocol for systematic review and meta-analysis. Medicine (Baltimore). 2020 Sep 25;99(39):e22273.
10. Wang Z, Bai C, Hu T, Luo C, Yu H, Ma X, et al. Emerging trends and hotspot in gut-lung axis research from 2011 to 2021: a bibliometrics analysis. Biomed Eng Online. 2022 Apr 21;21(1):27.
11. Farsi Y, Tahvildari A, Arbabi M, Vazife F, Sechi LA, Shahidi Bonjar AH, et al. Diagnostic, Prognostic, and Therapeutic Roles of Gut Microbiota in COVID-19: A Comprehensive Systematic Review. Front Cell Infect Microbiol. 2022 Mar 4; 12:804644.
12. Новикова ВП, Хавкин АИ, Горелов АВ, Полунина АВ. Ось «легкие-кишечник» и COVID-инфекция. Инфекционные болезни. 2021;19(1):91-96.
13. Новикова ВП, Полунина АВ. Состав кишечной микробиоты при COVID-инфекции (научный обзор). Профилактическая и клиническая медицина. 2020; 4(77):81-86.
14. He Y, Wang J, Li F, Shi Y. Main Clinical Features of COVID-19 and Potential Prognostic and Therapeutic Value of the Microbiota in SARS-CoV-2 Infections. Front Microbiol. 2020 Jun 5;11:1302.
15. Najmi N, Megantara I, Andriani L, Goenawan H, Lesmana R. Importance of gut microbiome regulation for the prevention and recovery process after SARS-CoV-2 respiratory viral infection (Review). Biomed Rep. 2022 Apr;16(4):25.
16. Guimaraes Sousa S, Kleiton de Sousa A, Maria Carvalho Pereira C, Sofia Miranda Loiola Araujo A, de Aguiar Magalhaes D, Vieira de Brito T. SARS-CoV-2 infection causes intestinal cell damage: Role of interferon's imbalance. Cytokine. 2022 Apr;152:155826.
17. Fasano A. All disease begins in the (leaky) gut: role of zonulin-mediated gut permeability in the pathogenesis of some chronic inflammatory diseases. F1000Res. 2020 Jan 31;9:F1000 Faculty Rev-69.
18. Sturgeon C, Fasano A. Zonulin, a regulator of epithelial and endothelial barrier functions, and its involvement in chronic inflammatory diseases. Tissue Barriers. 2016 Oct 21;4(4):e1251384.
19. Хавкин АИ, Богданова НМ, Новикова ВП. Биологическая роль зонулина и эффективность его использования в качестве биомаркера синдрома повышенной кишечной проницаемости. Российский вестник перинатологии и педиатрии. 2021;66(1):31-38.
20. Зыбина НН, Никонов ЕЛ, Герштейн ЕС, Мамедли ЗЗ, Стилиди ИС, Кушлинский НЕ. Зонулин как маркер проницаемости клеточных контактов при соматических и онкологических заболеваниях (обзор литературы). Доказательная гастроэнтерология. 2022;11(1):28-44.
21. Ливзан МА, Гаус ОВ. Содержание фекального зонулина - биомаркер синдрома кишечной проницаемости у больных синдромом раздраженного кишечника (обзор и результаты пилотного исследования). Доказательная гастроэнтерология. 2021;10(3):47 55.
22. Хавкин АИ, Богданова НМ, Новикова ВП, Юдина ДВ. Зонулин: физиологическое и клиническое значение в перинатальном периоде. Вопросы гинекологии, акушерства и перинатологии. 2020;19(5):132-139.
23. Хасанова СС, Камилова АТ. Динамика значений фекального зонулина у недоношенных детей первых двух недель жизни. Российский вестник перинатологии и педиатрии. 2019;64(2):52-56.
24. Подсвирова ЕВ, Гурова ММ, Романова ТА. Неинвазивные фекальные биомаркеры у новорожденных детей, матери которых получали пробиотик в течение 6 недель перед родами. Практическая медицина. 2020;18(3):61-64.
25. Fortea M, Albert-Bayo M, Abril-Gil M, Ganda Mall JP, Serra-Ruiz X, Henao-Paez A, et al. Present and Future Therapeutic Approaches to Barrier Dysfunction. Front Nutr. 2021 Oct 28;8:718093.
26. Leffler DA, Kelly CP, Abdallah HZ, Colatrella AM, Harris LA, Leon F, et al. A randomized, double-blind study of larazotide acetate to prevent the activation of celiac disease during gluten challenge. Am J Gastroenterol. 2012 Oct;107(10): 1554-62.
27. Yoosuf S, Makharia GK. Evolving Therapy for Celiac Disease. Front Pediatr. 2019 May 14;7:193.
28. Этические принципы проведения биомедицинских исследований на людях: Хельсинкская декларация Всемирной медицинской ассоциации. Принята 18-й Генеральной Ассамблеей ВМА. Хельсинки, Финляндия, 1964. С испр. и доп., 1964-2008.
29. Евдокимова АГ, Жуколенко ЛВ, Иванова ТБ, Стрюк РИ. Коррекция микрофлоры кишечника синбиотиком Максилак. Экспериментальная и клиническая гастроэнтерология. 2019;166(6):62-69.
30. Грознова ОС, Воинов ВА, Донич Д, Ветров ВВ, Иванов ДО. Кавасаки-подобный мультисистемный воспалительный синдром у детей в отсроченном периоде коронавирусной инфекции (COVID-19): современное состояние проблемы и возможные новые подходы к лечению (плазмаферез). Педиатр. 2021;12(4): 45-57.
References
1. Avdeev SN, Adamyan LV, Alekseeva EI, Bagnenko SF, Baranov AA, Baranova NN, et al. Profilaktika, diagnostika i lechenie novoy koronavirusnoy infektsii (COVID-19). Vremennye metodicheskie rekomendatsii. Versiya 15 ot 22.02.2022. Moskva, 2022. (In Russian).
2. Aleksandrovich YuS, Baybarina EN, Baranov AA, Vishneva EA, Zvereva NN, Ivanov DO, et al. Metodicheskie rekomendatsii. Osobennosti klinicheskikh proyavleniy i lecheniya zabolevaniya, vyzvannogo novoy koronavirusnoy infektsiey (SOVID-19) u detey. Versiya 2. 03.07.2020.
3. Namazova-Baranova LS, Baranov AA. COVID-19 i deti. Pul'monologiya. 2020;30(5):609-628.
4. Sultan S, Altayar O, Siddique SM, Davitkov P, Feuerstein JD, Lim JK, et al. AGA Institute Rapid Review of the Gastrointestinal and Liver Manifestations of COVID-19, Meta-Analysis of International Data, and Recommendations for the Consultative Management of Patients with COVID-19. Gastroenterology. 2020 Jul; 159(1):320-334.e27.
5. Еrmolenko KD, Gonchar NV, Skripchenko NV. Gastrointestinal tract lesion with a new coronavirus infection. Pediatria n.a. G.N.Speransky. 2020;99(6):135-140.
6. Popova RV, Ruzhentsova TA, Khavkina DA, Chukhlyaev PV, Garbuzov AA, Meshkova NA. Gastrointestinal Tract Disorders in COVID-19 Infected Children. Problems of Particularly Dangerous Infections. 2020;(3):154-157.
7. Gupta R, Beg S, Jain A, Bhatnagar S. Paediatric COVID-19 and the GUT. Indian J Med Microbiol. 2020 Jul-Dec;38(3 & 4):261-264.
8. Polunina AV, Shakmaeva MA, Ivanov DO, Timchenko VN, Bannova SL, Gurina OP, i dr. Gastroenterologicheskie simptomy pri novoi koronavirusnoi infektsii u detei zavisyat ot tsitokinovogo statusa. V sbornike: Aktual'nye problemy abdominal'noi patologii u detei. Editor: Bel'mer SV, Il'enko LI. 2022. (In Russian).
9. Li F, Lu H, Li X, Wang X, Zhang Q, Mi L. The impact of COVID-19 on intestinal flora: A protocol for systematic review and meta-analysis. Medicine (Baltimore). 2020 Sep 25;99(39):e22273.
10. Wang Z, Bai C, Hu T, Luo C, Yu H, Ma X et al. Emerging trends and hotspot in gut-lung axis research from 2011 to 2021: a bibliometrics analysis. Biomed Eng Online. 2022 Apr 21;21(1):27.
11. Farsi Y, Tahvildari A, Arbabi M, Vazife F, Sechi LA, Shahidi Bonjar AH, et al. Diagnostic, Prognostic, and Therapeutic Roles of Gut Microbiota in COVID-19: A Comprehensive Systematic Review. Front Cell Infect Microbiol. 2022 Mar 4; 12:804644.
12. Novikova VP, Khavkin AI, Gorelov AV, Polunina AV. The lung-gut axis and COVID-19. Infekc. bolezni (Infectious Diseases). 2021;19(1):91-96.
13. Novikova VP, Polunina AV. The composition of the intestinal microbiota in COVID infection (review). Preventive and clinical medicine. 2020;4(77):81-86.
14. He Y, Wang J, Li F, Shi Y. Main Clinical Features of COVID-19 and Potential Prognostic and Therapeutic Value of the Microbiota in SARS-CoV-2 Infections. Front Microbiol. 2020 Jun 5;11:1302.
15. Najmi N, Megantara I, Andriani L, Goenawan H, Lesmana R. Importance of gut microbiome regulation for the prevention and recovery process after SARS-CoV-2 respiratory viral infection (Review). Biomed Rep. 2022 Apr;16(4):25.
16. Guimaraes Sousa S, Kleiton de Sousa A, Maria Carvalho Pereira C, Sofia Miranda Loiola Araujo A, de Aguiar Magalhaes D, Vieira de Brito T. SARS-CoV-2 infection causes intestinal cell damage: Role of interferon's imbalance. Cytokine. 2022 Apr; 152:155826.
17. Fasano A. All disease begins in the (leaky) gut: role of zonulin-mediated gut permeability in the pathogenesis of some chronic inflammatory diseases. F1000Res. 2020 Jan 31;9:F1000 Faculty Rev-69.
18. Sturgeon C, Fasano A. Zonulin, a regulator of epithelial and endothelial barrier functions, and its involvement in chronic inflammatory diseases. Tissue Barriers. 2016 Oct 21;4(4):e1251384.
19. Khavkin AI, Bogdanova NM, Novikova VP. Biological role of zonulin: a biomarker of increased intestinal permeability syndrome. Rossiyskiy vestnik perinatologii i pediatrii (Russian Bulletin of Perinatology and Pediatrics). 2021;66(1):31-38.
20. Zybina NN, Nikonov EL, Gershtein ES, Memdli ZZ, Stilidi IS, Kushlinsky NE. Zonulin is a marker of epithelial and endothelial barrier functions in noncommunicable diseases (narrative review). Russian Journal of Evidence-Based Gastroenterology. 2022;11(1):28 44.
21. Livzan MA, Gaus OV. Fecal zonulin as a biomarker of increased intestinal permeability in patients with irritable bowel syndrome (narrative review and pilot study results). Russian Journal of Evidence-Based Gastroenterology. 2021; 10(3):47 55.
22. Khavkin AI, Bogdanova NM, Novikova VP, Yudina DV. Zonulin: physiological and clinical role in the perinatal period. Vopr. ginekol. akus. perinatol. (Gynecology, Obstetrics and Perinatology). 2020;19(5):132-139.
23. Khasanova SS, Kamilova AT. Dynamics of fecal zonulin values in premature children of the first two weeks of life. Rossiyskiy vestnik perinatologii i pediatrii (Russian Bulletin of Perinatology and Pediatrics). 2019;64(2):52-56.
24. Podsvirova EV, Gurova MM, Romanova TA. Non-invasive fecal biomarkers in newborns whose mothers received probiotics during 6 weeks before delivery. Practical Medicine. 2020;18(3):61-64)
25. Fortea M, Albert-Bayo M, Abril-Gil M, Ganda Mall JP, Serra-Ruiz X, Henao-Paez A, et al. Present and Future Therapeutic Approaches to Barrier Dysfunction. Front Nutr. 2021 Oct 28;8:718093.
26. Leffler DA, Kelly CP, Abdallah HZ, Colatrella AM, Harris LA, Leon F, et al. A randomized, double-blind study of larazotide acetate to prevent the activation of celiac disease during gluten challenge. Am J Gastroenterol. 2012 Oct;107(10): 1554-62.
27. Yoosuf S, Makharia GK. Evolving Therapy for Celiac Disease. Front Pediatr. 2019 May 14;7:193.
28. World Medical Association Declaration of Helsinki Ethical Principles for Medical Research Involving Human Subjects Adopted by the 18th WMA General Assembly Helsinki, Finland, June 1964 and amended by the 29th WMA General Assembly, Tokyo, Japan, October 1975 35th WMA General Assembly, Venice, Italy, October 1983 41st WMA General Assembly, Hong Kong, September 1989 48th WMA General Assembly, Somerset West, Republic of South Africa, October 1996 and the 52nd WMA General Assembly, Edinburgh, Scotland, October 2000.
29. Evdokimova AG, Zhukolenko LV, Ivanova TB, Stryuk RI. Correction of intestinal microflora synbiotic Maxilac. Experimental and Clinical Gastroenterology. 2019;(6):62-69.
30. Groznova OS, Warriors VA, Donich D, Vetrov VV, Ivanov DO. Kawasaki-multisystem inflammatory syndrome in children in the delayed period of coronavirus infection (COVID-19): modern state of the problem and possible new approaches to treatment (plasmapheresis). Pediatrician (St. Petersburg). 2021;12(4):45-57.
