 www.binnopharmgroup.ru
www.binnopharmgroup.ru

Максилак® - линейка средств для коррекции дисбактериоза и поддержания баланса микрофлоры желудочно‑кишечного тракта взрослых и детей с 3 лет в любых ситуациях ее нарушения.
Пробиотики в лечении острых респираторных вирусных инфекций
СтатьиН. В. Барышникова1,2,3
1ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И. П. Павлова» Минздрава России, Санкт-Петербург
2ФГБНУ «Институт экспериментальной медицины», Санкт-Петербург
3ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России, Санкт-Петербург
Резюме
Острые респираторные вирусные инфекции (ОРВИ) традиционно занимают лидирующие позиции по заболеваемости и по частоте обращаемости в медицинские учреждения. ОРВИ страдают лица совершенно разного возраста, в том числе дети и пожилые люди, у которых заболевания протекают с более яркой симптоматикой и более высоким риском развития осложнений. Изучение вопросов патогенеза, оптимизации лечения и профилактики ОРВИ является крайне актуальным и приобрело особую значимость во время пандемии COVID-19. С другой стороны, достаточно большое число людей на планете имеют нарушения кишечной микробиоты, что негативно сказывается на процессах обмена веществ, состоянии иммунитета и может лежать в основе развития системных воспалительных реакций. В условиях дисбиоза кишечника отмечается более тяжелое и длительное течение ОРВИ, что может быть сопряжено с изменением иммунологических эффектов кишечной микробиоты, недостаточностью ряда факторов местного и общего иммунитета и нарушением функционирования оси «кишечник - легкие». Патогенетически оправдано использование препаратов для коррекции нарушений микробиоты кишечника (пробиотиков) у пациентов с ОРВИ, в том числе принимающих антибиотики по поводу бактериальных осложнений. Пробиотики оказывают иммуномодулирующие эффекты. Они могут напрямую связываться с вирусом и ингибировать прикрепление вируса к рецептору клетки-хозяина, а также способствуют улучшению работы клеточного, гуморального и местного иммунитета.
Ключевые слова: пробиотики, иммунитет, респираторные вирусные инфекции, COVID-19, коронавирусная инфекция.
Probiotics in treatment of respiratory viral infections
N. V. Baryshnikova1,2,3
1 First Saint Petersburg State Medical University n.a. academician I. P. Pavlov, Saint Petersburg, Russia
2 institute of Experimental Medicine, Saint Petersburg, Russia
3Saint Petersburg State Pediatric Medical University, Saint Petersburg, Russia
Summary
Acute respiratory viral infections (RVI) traditionally lead in frequency of morbidity and frequency of visits to medical institutions. RVI affects people of completely different ages, including children and the elderly, whose diseases occur with more severe symptoms and a higher risk of complications. The study of the pathogenesis, optimization of treatment and prevention of RVI is extremely relevant and has special significance in the time of the COVID-19 pandemic. On the other hand, quite a large number of people on the planet have disorders of the gut microbiota, which negatively affects the metabolic process, the state of immunity and may underlie the development of systemic inflammatory reactions. In situation of gut dysbiosis, a more severe and prolonged duration of RVI is noted, which may be associated with a change in the immunological effects of the gut microbiota, the insufficiency of a number of factors of local and common immunity and a disorder of the functioning of the ‘gut-lungs’ axis. Pathogenetically justified the usage of medications (probiotics) for the correction of gut microbiota disorders in patients with RVI, including those taking antibiotics for bacterial complications. Probiotics have immunomodulatory effects. They can directly inhibit the attachment of the virus to the receptor of the host cell, and also contribute to the improvement of cellular, humoral and local immunity.
Keywords: probiotics, immunity, respiratory viral infections, COVID-19, coronavirus infection.
Острые респираторные вирусные инфекции (ОРВИ) - одна из самых распространенных патологий, встречающихся в широкой клинической практике. Эта группа заболеваний лидирует как собственно по заболеваемости, так и по частоте обращаемости в медицинские учреждения. ОРВИ страдают лица совершенно разного возраста, в том числе дети и пожилые люди, у которых заболевания протекают с более яркой симптоматикой и более высоким риском развития осложнений. Более того, до сих пор инфекционные заболевания дыхательных путей являются причиной смертности, особенно среди пожилых полиморбидных пациентов. Изучение вопросов патогенеза, оптимизации лечения и профилактики ОРВИ является крайне актуальным и приобрело особую значимость во время пандемии COVID-19.
Второй медицинской проблемой, с которой очень часто сталкивается современный человек и о которой мы будем говорить, является дисбиоз кишечника. Взаимодействия в системе «хозяин - кишечная микробиота» выходят далеко за рамки местных взаимовлияний на уровне слизистой оболочки пищеварительной трубки. Тот факт, что микробиота кишечника как своеобразный экстракорпоральный орган играет важную роль в поддержании адекватного функционирования человека, не вызывает сомнения у фундаментальных ученых и представителей медицинских специальностей по всему миру. Считается, что около 90 % болезней могут быть связаны с «нездоровьем» кишечной экосистемы [1]. К сожалению, большое число людей на планете в той или иной степени имеют нарушения микробиоты желудочно-кишечного тракта, что, в свою очередь, негативно сказывается на процессах обмена веществ, состоянии иммунитета и может лежать в основе развития системных воспалительных реакций. В условиях дисбиоза кишечника отмечается более тяжелое и длительное течение ОРВИ, что может быть сопряжено с изменением иммунологических эффектов кишечной микробиоты, недостаточностью ряда факторов местного и системного иммунитета и нарушением функционирования оси «кишечник - легкие» [2, 3].
Влияние кишечной микробиоты на иммунитет
Иммунная система человека может регулироваться прямо или косвенно кишечными бактериями путем активизации местного иммунитета, увеличения количества внекишечных Т-клеток, выработки короткоцепочечных жирных кислот и контроля воспаления [4]. Представители облигатной микробиоты кишки обеспечивают так называемую иммунологическую тренировку организма, повышая его устойчивость к действию патогенов посредством ингибирования адгезии болезнетворных микробных агентов к кишечной слизи. Это обеспечивается действием секреторного иммуноглобулина А, феноменом колонизационной резистентности микроорганизмов и контролем численности определенной бактериальной популяции, локализованной на поверхности слизистой кишки, за счет присутствия в этой области антибактериальных антител [5]. Отмечено, что существует феномен иммунологической толерантности к нормальной микробиоте [6], то есть отсутствие агрессии антибактериальных антител, в частности иммуноглобулина А, в отношении представителей облигатной микробиоты кишечника, что позволяет ей адекватно сосуществовать с организмом хозяина. Кишечная микробиота посредством синтеза бактериями модулинов оказывает существенное влияние на продукцию цитокинов, обладающих, в свою очередь, широким спектром биологического действия [5-7]. Бактериальные липополисахариды, образующиеся при распаде микробных клеток, оказывают влияние на систему комплемента (фактор неспецифической иммунорезистентности), гранулоциты, В-лимфоциты [8, 9]. Представители облигатной микрофлоры бифидобактерии и лактобациллы способны регулировать как неспецифический, так и специфический клеточный и гуморальный иммунитет [5, 10]. В частности, лактобациллы оптимизируют выработку интерферона-гамма [11]. Микробиота принимает участие в развитии и созревании лимфоидных органов [12].
Иммунологические эффекты микробиоты связаны также с действием микробных метаболитов. В норме микробные метаболиты кишечных микроорганизмов оказывают позитивное, в том числе иммуномодулирующее, действие на бронхолегочную систему (см. табл.), а в условиях дисбиоза кишечника положительные эффекты вышеуказанных микробных метаболитов снижаются, потенцируя более тяжелое течение патологии органов дыхания [3].
Таблица
Иммуномодулирующее действие микробных метаболитов на бронхолегочную систему [3]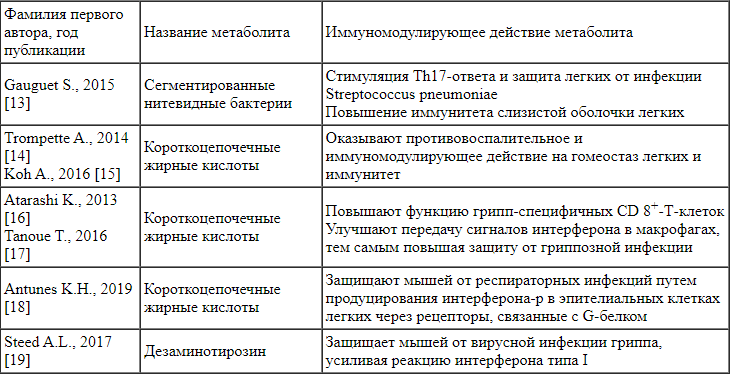 При изменении микробиоты кишки в первую очередь снижается эволюционно созданный барьер колонизационной резистентности микроорганизмов и нарушается синтез микробных метаболитов. Это приводит к негативным изменениям общего иммунного ответа слизистой оболочки кишки. Нарушение эндогенного баланса может провоцировать аллергические реакции замедленного типа, способствовать повышению выработки провоспалительных цитокинов, сопряжено с развитием синдрома повышенной эпителиальной проницаемости кишечной стенки, активацией системного воспаления, следовательно, может потенцировать развитие заболеваний внутренних органов [20, 21]. Впоследствии увеличивается вероятность восприимчивости к инфекционным агентам бактериальной или вирусной природы, в том числе ОРВИ. Клинически иммунологические изменения при нарушении микробиоты кишечника могут проявляться не только увеличением частоты простудных заболеваний, но также и поливалентной аллергией, атопическими заболеваниями, что необходимо учитывать при подборе терапии для данной категории пациентов. В подобных случаях рекомендуется использование как препаратов для коррекции нарушений микробиоты, так и антигистаминных средств.
При изменении микробиоты кишки в первую очередь снижается эволюционно созданный барьер колонизационной резистентности микроорганизмов и нарушается синтез микробных метаболитов. Это приводит к негативным изменениям общего иммунного ответа слизистой оболочки кишки. Нарушение эндогенного баланса может провоцировать аллергические реакции замедленного типа, способствовать повышению выработки провоспалительных цитокинов, сопряжено с развитием синдрома повышенной эпителиальной проницаемости кишечной стенки, активацией системного воспаления, следовательно, может потенцировать развитие заболеваний внутренних органов [20, 21]. Впоследствии увеличивается вероятность восприимчивости к инфекционным агентам бактериальной или вирусной природы, в том числе ОРВИ. Клинически иммунологические изменения при нарушении микробиоты кишечника могут проявляться не только увеличением частоты простудных заболеваний, но также и поливалентной аллергией, атопическими заболеваниями, что необходимо учитывать при подборе терапии для данной категории пациентов. В подобных случаях рекомендуется использование как препаратов для коррекции нарушений микробиоты, так и антигистаминных средств.
Ось «кишечник - легкие»
Довольно часто заболевания желудочно-кишечного тракта и дыхательных путей протекают одновременно. Большое количество патологий этих систем позволяет обозначить концепцию оси «кишечник - легкие», в которой изменения с одной стороны вызывают реакцию с другой. Особенно ярко это взаимодействие стало выраженов период пандемии COVID-19 у лиц с тяжелым острым респираторным синдромом коронавируса-2 (SARS-CoV-2), когда симптомы поражения дыхательных путей (лихорадка, кашель, одышка) связаны с появлением симптомов, характерных для заболеваний желудочно-кишечного тракта (боль в животе, тошнота, рвота, диарея) [3].
Концепция оси «кишечник - легкие» физиологически обоснована. Во-первых, слизистая оболочка, выстилающая дыхательные пути, и слизистая оболочка желудочно-кишечного тракта развиваются эмбрионально из первичной передней кишки [22, 23] и схожи по структуре [24]. Во-вторых, обе ткани создают физиологический барьер против проникновения патогенных микробов, в том числе за счет большого количества лимфоидных клеток и нормальной микробиоты (феномен колонизационной резистентности). Неудивительно, что эти две системы взаимодействуют как у здорового, так и у больного человека. Изменения согласования оси «кишечник - легкие» могут иметь огромное значение как в патогенезе, так и в лечении заболеваний [25].
Исходя из вышесказанного становится очевидным, что использование препаратов для коррекции изменений кишечной микробиоты (пробиотиков) является патогенетически обоснованным, перспективным и способствующим ускорению процесса выздоровления ОРВИ. Согласно определению Всемирной организации здравоохранения, пробиотики - это «живые микроорганизмы, которые при введении в достаточных количествах приносят пользу здоровью хозяина» [26]. Механизм позитивного действия пробиотиков на иммунитет человека может быть сопряжен как с собственно восстановлением состава кишечной микробиоты, так и с прямым взаимодействием препаратов этой группы или их метаболитов с рецепторами, например toll-like (TLR) - рецепторами на эпителиальных и иммунных клетках хозяина [27-29].
Иммунологические эффекты пробиотиков
Экспериментальный опыт показывает, что пробиотики играют важную роль в защите от респираторных вирусных инфекций. По данным 45 доклинических исследований, установлено, что на фоне приема пробиотиков наблюдалось [30]:
Обсуждаются вопросы механизма действия пробиотиков на иммунитет и работу органов дыхания у пациентов с респираторными вирусными инфекциями. Можно сказать, что пробиотики посредством восстановления качественного и количественного состава кишечной микробиоты запускают целый спектр действий по активизации собственных резервов организма. Доказано, что пробиотики повышают иммунитет, снижают тяжесть некоторых аллергических состояний, обладают противовоспалительными и антиканцерогенными свойствами [31]. В рандомизированном исследовании показано, что потребление пробиотиков увеличивает популяцию NK-Т-клеток по сравнению с контрольной группой, повышает экспрессию маркера памяти CD45R0 на поверхности CD8+-лимфоцитов и уровень противовоспалительных цитокинов, а также снижает локальную выработку провоспалительных цитокинов на уровне слизистых оболочек [32]. Противовоспалительное и иммуномодулирующее действие пробиотиков связывают также с эффектами короткоцепочечных жирных кислот (см. табл.) - широко изученных микробных метаболитов (бутират, пропионат и ацетат) [14, 15].
В работе L. Lehtoranta и соавт. (2014) предложено несколько антимикробных и противовирусных механизмов действия пробиотиков [33 с дополнениями]:
1) пробиотики могут напрямую связываться с вирусом и ингибировать прикрепление вируса к рецептору клетки-хозяина;
2) адгезия пробиотиков на поверхности эпителия может блокировать прикрепление вируса: пробиотик неспецифически покрывает рецепторные участки эпителиальной клетки или конкурирует за специфические рецепторы на ее поверхности;
3) пробиотики могут индуцировать регенерацию слизистой оболочки и улучшение выработки муцина, что ингибирует прилипание вирусов к эпителиальным клеткам и способствует подавлению репликации вируса, а также снижает проницаемость эпителиального барьера;
4) пробиотики проявляют прямую антимикробную активность в отношении патогенов, производя антимикробные вещества (бактериоцины);
5) пробиотики индуцируют выработку оксида азота (NO) и дегидрогеназы, что может оказывать противовирусное действие;
6) пробиотики модулируют иммунный ответ через эпителиальные клетки;
7) пробиотики модулируют и активируют иммунные реакции с помощью макрофагов и дендритных клеток;
8) пробиотики способствуют активации CD8+-Т-лимфоцитов, которые дифференцируются в цитотоксические Т-лимфоциты, уничтожающие инфицированные вирусом клетки;
9) пробиотики способствуют активации CD4+-T-лимфоцитов, которые дифференцируются в Т-хелперные клетки типа 1 и Т-хелперные клетки типа 2, в результате:
a) Т-хелперные клетки типа 1 активируют фагоциты, способствуя уничтожению вирусов;
b) Т-хелперные клетки типа 2 индуцируют пролиферацию В-клеток, которые перемещаются во вторичные лимфатические органы в лимфоидной ткани, связанной со слизистой оболочкой (MALT), и дифференцируются в плазматические клетки, продуцирующие иммуноглобулин, которые могут мигрировать обратно в очаг инфекции;
c) секреторные антитела нейтрализуют вирус.
Крайне интересным является изучение прямого противовирусного действия пробиотиков, то есть их способности прикрепляться к вирусным частицам [27]. Это подтверждается в экспериментальных исследованиях [34-36]. Так, пероральный прием Lactobacillus paracasei CNCM-I-1518 [37] и Bifidobacterium longum MM-2 [38] способствовал снижению вирусной нагрузки в легких мышей после заражения, а также снижению смертности мышей. Результаты клинического исследования с привлечением здоровых добровольцев имели схожие показатели: применение Bifidobacterium lactis Bl-04 за 28 дней до и в течение 5 дней экспериментальной риновирусной инфекции было сопряжено со значительно более низкими титрами риновируса в смывах из носоглотки и с меньшим числом инфицированных участников, выделяющих вирус, по сравнению с плацебо [27, 39].
Пробиотики могут усиливать противовирусный иммунный ответ организма, оптимизируя работу инфламмасом [40], они участвуют в регуляции легочного Th17-опосредованного противогрибкового иммунитета [41].
Пробиотики в лечении респираторных вирусных инфекций
Мы проанализировали ряд исследований, посвященных оценке эффективности и безопасности пробиотиков в лечении ОРВИ и коронавирусной инфекции. Существующие исследования показали, что ранний врожденный иммунитет тканей легких против чужеродных инфекций является результатом системной регуляции кишечной микробиоты с помощью NOD-подобных рецепторов [42]. Пробиотики могут стимулировать выработку IgA, регулируя легочные дендритные клетки [42], повышают противовирусную защиту легочной ткани [43-45].
В исследованиях по оценке эффективности пробиотиков в комплексной терапии респираторных вирусных инфекций наиболее часто используются Lactobacillus spp. или Bifidobacterium spp. [46] различных видов, в частности L. casei, L. paracasei, B. longum, B. bifidum, Streptococcus thermophilus [32]. Затем по частоте применения идут Enterococcus spp., Propionibacterium spp., Bacillus spp. и Escherichia coli [47]. Кроме того, некоторые виды дрожжей используются в качестве пробиотиков, например Saccharomyces boulardii и S. cerevisiae [48].
Нами рассмотрен метаанализ, в котором (12 рандомизированных исследований, 3720 участников, включая детей, взрослых [средний возраст около 40 лет] и пожилых людей) было обнаружено, что прием пробиотиков, по сравнению с плацебо, способствовал достоверному [49]:
Частота побочных эффектов у принимающих пробиотики и плацебо была сравнима.
При этом авторы подчеркивают, что некоторые подгруппы имели высокий уровень гетерогенности, а уровень доказательств был низкого или очень низкого качества. По результатам этого метаанализа можно сделать вывод, что пробиотики могут быть эффективны в профилактике ОРВИ [49].
Y Wang и соавт. (2016) провели метаанализ 23 рандомизированных клинических исследований по оценке клинической эффективности пробиотиков в терапии респираторных вирусных инфекций с участием 6269 детей и подростков в возрасте от 0 до 18 лет [46]. В этих исследованиях были использованы разные по составу пробиотики: в семи испытаниях использовались штаммы лактобацилл, в пяти исследованиях - штаммы бифидобактерий, в одном испытании -штамм L. fermentum и в 11 работах - смесь пробиотических штаммов. В трех исследованиях использовались отдельные группы с различными пробиотическими штаммами по сравнению с первой группой плацебо). Продолжительность приема препаратов варьировала от 5 дней до 12 месяцев, большинство исследований проводилось в течение более 3 месяцев с включением зимнего периода. В результате выявлено, что потребление пробиотиков значительно уменьшало число субъектов, имеющих, по крайней мере, один эпизод респираторной вирусной инфекции за наблюдаемый период (17 РКИ, 4513 детей, р = 0,004). У детей, получавших пробиотики, было меньше дней респираторной инфекции в расчете на человека по сравнению с детьми, принимавшими плацебо (шесть РКИ, 2067 детей; р = 0,030), в данной группе было отмечено меньшее число дней отсутствия (восемь РКИ, 1499 детей; р = 0,020). Однако не было статистически значимой разницы в продолжительности эпизода заболевания между группой приема пробиотика и группой плацебо (девять РКИ, 2817 детей; р = 0,190) Авторы метаанализа сделали вывод, что потребление пробиотиков может снизить частоту и продолжительность эпизода респираторной инфекции.
Во многих исследованиях также подтверждается, что использование пробиотиков у взрослых и детей клинически эффективно [30] в снижении тяжести течения и продолжительности респираторных вирусных инфекций, а также высокобезопасно [50]. В одном из научных обзоров была продемонстрирована способность различных штаммов бактерий, продуцирующих молочную кислоту, улучшать или предотвращать развитие вирусных инфекций (например, снижение титров вируса Эбола и цитомегаловируса), уменьшение тяжести и продолжительности инфекции верхних дыхательных путей или гастроэнтерита [51]. Основное внимание в этом обзоре было уделено противогриппозной активности L. lactis JCM5805, которая обладает способностью напрямую стимулировать плазмацитоидные дендритные клетки через TLR-9, что, в свою очередь, стимулирует выработку интерферона и контролирует репликацию и распространение вируса [51]. В другой работе была исследована активность пробиотического штамма B. subtilis [52] против вируса гриппа in vitro у животных: пептид Р18, продуцируемый пробиотическим штаммом, был выделен, охарактеризован, изучен и синтезирован. Было обнаружено, что этот пептид Р18 обеспечивал полное ингибирование вируса гриппа in vitro, при этом не обладая токсичностью, как многие лекарственные препараты. Противовирусный эффект P18 у мышей был сопоставим с таковым у осельтамивира фосфата. Эффект L. gasseri в профилактике респираторно-синцитиальной вирусной инфекции был показан на мышах [53]: титры респираторного вируса и провоспалительных цитокинов в легких значительно снижались, а выработка интерферонов и стимулированных интерфероном генов активизировалась на фоне лечения пробиотиком. Применение пробиотиков в раннем возрасте у недоношенных детей привело к значительному снижению частоты заболеваемости ОРВИ, особенно вызванных риновирусом, даже несмотря на то, что нагрузка вирусной РНК была одинаковой в группах пробиотиков и плацебо [54].
Длительное применение пробиотиков может значительно снизить риск возникновения респираторных вирусных инфекций и в то же время может принести пользу лицам, уже болеющим ОРВИ, например уменьшить длительность лихорадки, кашля и продолжительность приема антибактериальных средств, в том числе у детей [55, 56].
Пробиотики могут рассматриваться как новый перспективный альтернативный экономически эффективный метод снижения риска развития респираторных вирусных инфекций. Клиническая эффективность различных пробиотиков отличается, что связано с разным потенциалом пробиотических микроорганизмов по уровню воздействия на иммунную систему человека [57].
Пробиотики и COVID-19
Доказательная база по взаимосвязи между COVID-19 и микробиотой кишечника еще мала. Но с каждым днем появляется все больше исследований, в которых четко прослеживается связь нарушений кишечной микробиоты с более тяжелым течением новой коронавирусной инфекции. В ряде работ показано, что особенности состава кишечной микробиоты могут определять вероятность развития и тяжесть клинических проявлений инфекции COVID-19 [58-60], что особенно актуально для пациентов с тяжелыми факторами риска [61]. В систематических обзорах обсуждается иммуномодулирующая, противовирусная, противовоспалительная активность пробиотиков [62, 63]. Также оцениваются результаты использования пробиотиков в качестве дополнительной терапии для профилактики и (или) облегчения симптомов COVID-19 [64].
Что же уже известно мировому медицинскому сообществу про эффективность применения пробиотиков при коронавирусной инфекции?
В одноцентровом двойном слепом рандомизированном плацебо-контролируемом исследовании среди амбулаторных взрослых пациентов с симптомами COVID-19 было рассмотрено применение пробиотического комплекса (штаммы Lactiplantibacillus plantarum KABP022, KABP023 и KAPB 033 плюс штамм Pediococcus acidilactici KABP021, в общей сложности 2 х 109 колониеобразующих единиц [КОЕ]) или плацебо в течение 30 дней. Из 293 пациентов возрасте от 18 до 60 лет (средний возраст 37 лет), полностью завершивших исследование, 147 человек были рандомизированы в группу пробиотиков и 146 - в группу плацебо. Полная ремиссия была достигнута у 78 (53,1 %) испытуемых в группе пробиотиков по сравнению с 41 (28,1 %) в группе плацебо (р < 0,001). Было отмечено, что пробиотики снижали вирусную нагрузку, по результатам анализа отделяемого из носоглотки, уменьшали инфильтрацию в легких и продолжительность пищеварительных симптомов по сравнению с плацебо. Существенных изменений состава фекальной микробиоты между группами пациентов, принимающих пробиотики и плацебо, обнаружено не было, но прием пробиотиков значительно увеличивал уровень специфических иммуноглобулинов M и G против коронавируса тяжелого острого респираторного синдрома (SARS-CoV-2) по сравнению с плацебо. Авторы сделали вывод, что этот пробиотический комплекс в первую очередь работает, оказывая воздействие на работу иммунной системы хозяина, а не изменяя состав микробиоты толстой кишки [65].
В работе G. d’Ettorre (2020) [66] при анализе эффективности мультиштаммовой пробиотической смеси (S. thermophilus DSM 32345, L. acidophilus DSM 32241, L. helveticus DSM 32242, L. paracasei DSM 32243, L.plantarum DSM 32244, L. brevis DSM 27961, B. lactis DSM 32246, B. lactis DSM 32247) у 70 пациентов, инфицированных COVID-19 (28 больных получали пробиотики, 42 - плацебо), было отмечено, что использование препаратов для улучшения кишечной микробиоты достоверно лучше способствует улучшению кишечной микробиоты по сравнению с плацебо, способствует снижению диареи и других гастроэнтерологических симптомов, снижению предполагаемого риска развития дыхательной недостаточности, снижению числа пациентов, переведенных в отделение интенсивной терапии, и уменьшению смертности.
Эффективность бифидобактерий в комплексном лечении COVID-19 подтверждается и в работах российских ученых [67].
Ярким представителем современных препаратов пробиотического ряда является мультиштаммовый синбиотик «Максилак». В его состав входят девять пробиотических штаммов: L. acidophilus LA-14, L. lactis Ll-23, L. rhamnosus Lr-32, L. casei Lc-11, L. plantarum Lp-115, B. longum Bl-05, B. breve Bb-03, B. bifidum Bb-06, S. thermophilus St-21, а также фруктоолигосахариды (пребиотический компонент). Как видно из описания компонентов, в состав «Максилака» входит не только B. bifidum, о котором было сказано выше, а целый комплекс штаммов лактобацилл и бифидобактерий, которые восстанавливают микробиоту желудочно-кишечного тракта, так как обладают высокой антагонистической активностью против патогенных и условно-патогенных микроорганизмов и высоким потенциалом роста, а также опосредованно оказывают иммуномодулирующий эффект за счет стимуляции местного иммунитета, увеличения выработки эндогенных интерферонов. Фруктоолигосахариды, будучи пищевым субстратом для нормофлоры толстой кишки, способствуют более быстрому и полному восстановлению кишечного микробиоценоза. Комплексное действие «Максилака», в особенности его позитивное влияние на иммунитет, позволяет рекомендовать его использование в лечении и профилактике респираторных вирусных инфекций. Более того, у пациентов, перенесших новую коронавирусную инфекцию, «Максилак» эффективно предотвращает нарушение кишечной проницаемости в постковидный период, что особенно важно в детском возрасте, когда цитопротекторы еще противопоказаны [68]. Это подтверждается результатами исследования, в котором показано, что на фоне приема «Максилак Бэби» в течение месяца не наблюдалось повышения уровня зонулина в кале (76,26 ± 13,10 нг/мл и 79,02 ± 11,87 нг/мл; р = 0,400), тогда как в группе сравнения (дети, не получавшие «Максилак Бэби») уровень зонулина значимо повышался (76,26 ± 13,10 нг/мл и 87,95 ± 10,96 нг/мл; р = 0,048) [68]. Несомненным достоинством «Максилака» является и то, что он эффективно подавляет формирующиеся биопленки штаммов патогенных бактерий, что позволит уменьшить риски тяжелого течения бактериальных осложнений ОРВИ и может быть использован в профилактике инфекционных заболеваний, связанных с образованием биопленками патогенных микроорганизмов [69]. В исследовании П. В. Слукина и соавт. продемонстрировано, что «Максилак Бэби» подавлял формирование биопленок большей части (83 %) тест-штаммов E. coli, Klebsiella pneumoniae, Staphylococcus aureus, Candida albicans, C. parapsilosis и C. auris, а также достоверно снижал плотность зрелых биопленок 50 % тест-штаммов грамположительных бактерий и 20 % тест-штаммов грамотрицательных бактерий, снижения плотности зрелых биопленок грибов рода Candida зафиксировано не было [69]. Важным моментом высокой эффективности «Максилака» является то, что при его изготовлении применяются защитная технология SFERA и двойная оболочка, которые обеспечивают выживаемость пробиотических бактерий при прохождении агрессивных сред желудочно-кишечного тракта, в особенности кислой среды желудка, и максимальную активность синбиотика именно в кишечнике.
Пробиотики способствуют уменьшению риска развития вторичных инфекций при COVID-19 [70], уменьшению воспалительной реакции, цитокинового шторма и респираторных симптомов за счет укрепления иммунной системы хозяина, в том числе посредством улучшения микробиома кишечника и восстановления барьерной функции кишечника [71]. Следует помнить, что жалобы со стороны пищеварительной системы в случае инфицирования COVID-19 могут быть вызваны как персистенцией вируса в желудочно-кишечном тракте, так и обусловлены появлением антибиотико-ассоциированных поражений кишечника, в особенности при бесконтрольном приеме антибактериальных препаратов некоторыми пациентами [72]. Пробиотики способны ускорить выздоровление в обоих случаях за счет восстановления кишечной микробиоты и иммуномодулирующего действия и являются важным компонентом комплексной коррекции желудочно-кишечных симптомов у данной категории больных.
Заключение
В заключении важно подчеркнуть, что высокая клиническая эффективность пробиотиков в терапии ОРВИ диктует необходимость применения этих препаратов в комплексной терапии у данной категории пациентов. Важно отметить, что пробиотики являются высокобезопасными лечебными средствами, что расширяет возможности их применения у лиц разного возраста, в том числе у маленьких детей, а также у полиморбидных пожилых пациентов с патологией печени и почек, выбор лекарств для которых ограничен. Довольно часто пациенты с ОРВИ отмечают не только появление классических симптомов поражения верхних дыхательных путей, но и предъявляют жалобы со стороны пищеварительной системы, что чаще всего клинически проявляется ощущением дискомфорта в животе и диареей. Назначение пробиотиков для профилактики и комплексного лечения ОРВИ оправдано также тем, что у этой категории пациентов нередко развиваются бактериальные осложнения со стороны бронхолегочной системы или ЛОР-органов (пневмонии, бронхиты, синуситы и т. п.), что требует использования антибиотиков. В этом случае прием пробиотика с первого дня антибиотикотерапии является не только залогом успеха лечения за счет восстановления иммунологического баланса, но также обеспечивает сохранение оптимального микробного пейзажа кишечника и способствует профилактике развития антибиотик-ассоциированной диареи.
Использование современных пробиотиков, в частности Максилака®, рекомендуется для профилактики и в программах комплектного лечения респираторных вирусных инфекций. Это позволяет повысить эффективность и безопасность терапии, уменьшить тяжесть течения заболевания, ускорить выздоровление, предупредить развитие осложнений (вторичные бактериальные, аллергические, гастроэнтерологические и др.).
Сведения об авторе
Барышникова Наталья Владимировна, к.м.н., доцент, доцент кафедры внутренних болезней стоматологического факультета1, н.с. лаборатории молекулярной микробиологии2, м.н.с. лаборатории медико-социальных проблем педиатрии3. ORCID: 0000-0001-7429-0336
1ФГБОУ ВО «Первый Санкт-Петербургский государственный медицинский университет имени академика И. П. Павлова» Минздрава России, Санкт-Петербург
2ФГБНУ «Институт экспериментальной медицины», Санкт-Петербург
3ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России, Санкт-Петербург
About author
Baryshnikova Natalia V., PhD Med, associate professor, associate professor at Dept of Internal Diseases of Faculty of Dentistry1, researcher at Laboratory of Molecular Microbiology2, junior researcher at Laboratory of Medical and Social Problems of Pediatrics3. ORCID: 0000-0001-7429-0336
1 First Saint Petersburg State Medical University n.a. academician I. P. Pavlov, Saint Petersburg, Russia
2institute of Experimental Medicine, Saint Petersburg, Russia
3Saint Petersburg State Pediatric Medical University, Saint Petersburg, Russia
Для цитирования: Барышникова Н. В. Пробиотики в лечении острых респираторных вирусных инфекций. Медицинский алфавит.2023; (11): 6-12. doi.org/10.33667/2078-5631-2023-11-6-12.
For citation: Baryshnikova N. V. Probiotics in treatment of respiratory viral infections. Medical alphabet.2023; (11): 6-12. doi.org/10.33667/2078-5631-2023-11-6-12.
Список литературы / References
1. Sekirov I, Russell SL, Antunes LC, Finlay BB. Gut microbiota in health and disease. Physiol Rev. 2010 Jul; 90 (3): 859-904.
2. Мазанкова Л. Н., Павлова Л. А., Чеботарева Т. А. Бифиформ: новые аспекты применения при ОРВИ у детей. Фарматека, 2005. № 1 (97) [электронный ресурс]. Mazankova L N., Pavlova LA., Chebotareva T. A. Bifiform: New aspects of use in ARVI in children. Farmateka, 2005. No. 1 (97).
3. Zhou D., Wang Q., Liua H. Coronavirus disease 2019 and the gut-lung axis. International Journal of Infectious Diseases. 2020; 113: 300-307.
4. Samuelson DR, Welsh DA, Shellito JE. Regulation of lung immunity and host defense by the intestinal microbiota. Front Microbiol. 2015 Oct 7; 6: 1085.
5. Blum S, Schiffrin EJ. Intestinal microflora and homeostasis of the mucosal immune response: implications for probiotic bacteria? Curr Issues Intest Microbiol. 2003 Sep; 4 (2): 53-60. PMID: 14503689.
6. Azad MAK, Sarker M, Wan D. Immunomodulatory Effects of Probiotics on Cytokine Profiles. Biomed Res Int. 2018 Oct 23; 2018: 8063647.
7. Borchers AT, Selmi C, Meyers FJ, Keen CL, Gershwin ME. Probiotics and immunity. J Gastroenterol. 2009; 44 (1): 26-46.
8. Шендеров Б.А. Медицинская микробная экология: некоторые итоги и перспективы исследований. Вестник российской академии медицинских наук. 2005; 12:13-17. eLIBRARY D: 17038274. Shenderov BA. Medical microbial ecology: Some of the overall results and research prospects. RAS Bull. 2005; (12): 13-7. Russian. PMID: 16404977.
9. Frei R, Akdis M, O’Mahony L Prebiotics, probiotics, synbiotics, and the immune system: experimental data and clinical evidence. Curr Opin Gastroenterol. 2015 Mar 31 (2): 153-8.
10. Cortes-Perez NG, de Moreno de LeBlanc A, Gomez-Gutierrez JG, LeBlanc JG, Bermudez-Hu-maran LG. Probiotics and Trained Immunity. Biomolecules. 2021 Sep 24; 11 (10): 1402.
11. Servin AL. Antagonistic activities of lactobacilli and bifidobacteria against microbial pathogens. FEMS Microbiol Rev. 2004 Oct; 28 (4): 405-40.
12. Acheson DW, Luccioli S. Microbial-gut interactions in health and disease. Mucosal immune responses. Best Pract Res Clin Gastroenterol. 2004 Apr; 18 (2): 387-404.
13. Gauguet S, D’Ortona S, Ahnger-Pier K, Duan B, Surana NK, Lu R, Cywes-Bentley C, Gadjeva M, Shan Q, Priebe GP, Pier GB. Intestinal Microbiota of Mice Influences Resistance to Staphylococcus aureus Pneumonia. Infect Immun. 2015 Oct; 83 (10): 4003-14.
14. Trompette A, Gollwitzer ES, Yadava K, Sichelstiel AK, Sprenger N, Ngom-Bru C, Blanchard C, Junt T, Nicod LP, Harris NL, Marsland BJ. Gut microbiota metabolism of dietary fiber influences allergic airway disease and hematopoiesis. Nat Med. 2014 Feb; 20 (2): 159-66.
15. Koh A, De Vadder F, Kovatcheva-Datchary P, Backhed F. From Dietary Fiber to Host Physiology: Short-Chain Fatty Acids as Key Bacterial Metabolites. Cell. 2016 Jun 2; 165 (6): 1332-1345.
16. Atarash'i K, Tanoue T, Osh'ima K, Suda W, Nagano Y, Nishikawa H, Fukuda S, Saito T, Narush'ima S, Hase K, Kim S, Fritz JV, Wilmes P, Ueha S, Matsushima K, Ohno H, Olle B, Sakaguchi S, Taniguchi T, Morita H, Hatton M, Honda K. Treg induction by a rationally selected mixture of Clostridia strains from the human microbiota. Nature. 2013 Aug 8; 500 (7461):232-6.
17. Tanoue T, Atarashi K, Honda K. Development and maintenance of intestinal regulatory T cells. Nat Rev Immunol. 2016 May; 16 (5): 295-309.
18. Antunes KH, Fachi JL, de Paula R, da Silva EF, Pral LP, Dos Santos AA, Dias GBM, Vargas JE, Puga R, Mayer FQ, Maito F, Zarate-Blades CR, Ajami NJ, Sant’Ana MR, Candreva T, Rodrigues HG, Schmiele M, Silva Clerici MTP, Proenca-Modena JL, Vieira AT, Mackay CR, Mansur D, Caballero MT, Marzec J, Li J, Wang X, Bell D, Polack FP, Kleeberger SR, Stein RT, Vinolo MAR, de Souza APD. Microbiota-derived acetate protects against respiratory syncytial virus infection through a GPR43-type 1 interferon response. Nat Commun. 2019 Jul 22; 10 (1): 3273.
19. Steed AL, Christophi GP, Kaiko GE, Sun L, Goodwin VM, Jain U, Esaulova E, Artyomov MN, Morales DJ, Holtzman MJ, Boon ACM, Lenschow DJ, Stappenbeck TS. The microbial metabolite desaminotyrosine protects from influenza through type I interferon. Science. 2017 Aug 4; 357 (6350): 498-502.
20. Munoz-Garach A, Diaz-Perdigones C, Tinahones FJ. Gut microbiota and type 2 diabetes mellitus. Endocrinol Nutr. 2016 Dec; 63 (10): 560-568. English, Spanish.
21. Woldeamlak B, Yirdaw K, Biadgo B. Role of Gut Microbiota in Type 2 Diabetes Mellitus and Its Complications: Novel Insights and Potential Intervention Strategies. Korean J Gastroenterol. 2019 Dec 25; 74 (6): 314-320.
22. Ramalho-Santos M, Melton DA, McMahon AP. Hedgehog signals regulate multiple aspects of gastrointestinal development. Development. 2000 Jun; 127 (12): 2763-72.
23. Shu W, Lu MM, Zhang Y, Tucker PW, Zhou D, Morrisey EE. Foxp2 and Foxp1 cooperatively regulate lung and esophagus development. Development. 2007 May; 134 (10): 1991-2000.
24. Mestecky J, McGhee JR, Michalek SM, Arnold RR, Crago SS, Babb JL Concept of the local and common mucosal immune response. Adv Exp Med Biol. 1978; 107: 185-92.
25. Marsland BJ, Trompette A, Gollwitzer ES. The Gut-Lung Axis in Respiratory Disease. Ann Am Thorac Soc. 2015 Nov; 12 Suppl2: S 150-6.
26. HillC, Guarner F, Reid G, Gibson GR, Merenstein DJ, Pot B, Morelli L, Canani RB, Flint HJ, Salminen S, Calder PC, Sanders ME. Expert consensus document. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nat Rev Gastroenterol Hepatol. 2014 Aug; 11 (8): 506-14.
27. Николаева С. В., Усенко Д. В., Хлыповка Ю. Н., Горелов А. В. Пробиотики в комплексной профилактике респираторных инфекций детей. Лечащий врач. 2021; 9 (24): 22-27. Nikolaeva S. V., Usenko D. V., Khlypovka Yu.N., Gorelov A. V. Probiotics in the comprehensive prevention of respiratory infections in children. Attending Doctor. 2021; 9 (24): 22-27.
28. Parada Venegas D, De la Fuente MK, Landskron G, Gonzalez MJ, Quera R, Dijkstra G, Harmsen HJM, Faber KN, Hermoso MA. Short Chain Fatty Acids (SCFAs)-Mediated Gut Epithelial and Immune Regulation and Its Relevance for Inflammatory Bowel Diseases. Front Immunol. 2019 Mar 11; 10:277.
29. Ahrne S, Hagslatt ML Effect of lactobacilli on paracellular permeability in the gut. Nutrients. 2011 Jan; 3 (1): 104-17.
30. Wang F, Pan B, Xu S, Xu Z, Zhang T, Zhang Q, Bao Y, Wang Y, Zhang J, Xu C, Xue X. A me-ta-analysis reveals the effectiveness of probiotics and prebiotics against respiratory viral infection. Biosci Rep. 2021 Mar 26; 41 (3): BSR20203638.
31. Raheem A, Liang L, Zhang G, Cui S. Modulatory Effects of Probiotics During Pathogenic Infections with Emphasis on Immune Regulation. Front Immunol. 2021 Apr 8; 12:616713.
32. Darbandi Atieh et al. The effect of probiotics on respiratory tract infection with special em phasis on COVID-19: Systemic review 2010-20. International Journal of Infectious Diseases: IJID: official publication of the International Society for Infectious Diseases vol. 105 (2021): 91-104.
33. Lehtoranta L, Pitkaranta A, Korpela R. Probiotics in respiratory virus infections. Eur J Clin Microbiol Infect Dis. 2014 Aug; 33 (8): 1289-302.
34. Nakayama Y, Moriya T, Sakai F, Ikeda N, Shiozaki T, Hosoya T, Nakagawa H, Miyazaki T. Oral administration of Lactobacillus gasseri SBT2055 is effective for preventing influenza in mice. Sci Rep. 2014 Apr 10; 4: 4638.
35. Arai S, Iwabuchi N, Takahashi S, Xiao JZ, Abe F, Hachimura S. Orally administered heat-killed Lactobacillus paracasei MCC 1849 enhances antigen-specific IgA secretion and induces follicular helper T cells in mice. PLoS One. 2018 Jun 13; 13 (6): e0199018.
36. Belkacem N, Serafini N, Wheeler R, Derrien M, Boucinha L, Couesnon A, Cerf-Bensussan N, Gomperts Boneca I, Di Santo JP, Taha MK, Bourdet-Sicard R. Lactobacillus paracasei feeding improves immune control of influenza infection in mice. PLoS One. 2017 Sep 20; 12 (9): e0184976.
37. Kawahara T, Takahashi T, Oishi K, Tanaka H, Masuda M, Takahashi S, Takano M, Kawakami T, Fukushima K, Kanazawa H, Suzuki T. Consecutive oral administration of Bifidobacterium longum MM-2 improves the defense system against influenza virus infection by enhancing natural killer cell activity in a murine model. Microbiol Immunol. 2015 Jan; 59 (1): 1-12.
38. Mahooti M, Abdolalipour E, Salehzadeh A, Mohebbi SR, Gorji A, Ghaemi A. Immunomodulatory and prophylactic effects of Bifidobacterium bifidum probiotic strain on influenza infection in mice. World J M icrobiolBiotechnol. 2019 Jun 3; 35 (6):91.
39. Wang B, Hylwka T, Smieja M, Surrette M, Bowdish DME, Loeb M. Probiotics to Prevent Respiratory Infections in Nursing Homes: A Pilot Randomized Controlled Trial. J Am Geriatr Soc. 2018 Jul; 66 (7): 1346-1352.
40. Ichinohe T, Pang IK, Kumamoto Y, Peaper DR, Ho JH, Murray TS, Iwasaki A. Microbiota regulates immune defense against respiratory tract influenza A virus infection. Proc Natl Acad Sci U S A. 2011 Mar 29; 108 (13): 5354-9.
41. McAleer JP, Nguyen NL, Chen K, Kumar P, Ricks DM, Binnie M, Armenirout RA, Pociask DA, Hein A, Yu A, Vikram A, Bibby K, Umesaki Y, Rivera A, Sheppard D, Ouyang W, Hooper LV, Kolls JK. Pulmonary Th17 Antifungal Immunity Is Regulated by the Gut Microbiome. J Immunol. 2016 Jul 1; 197 (1): 97-107.
42. Clarke TB. Early innate immunity to bacterial infection in the lung is regulated systemically by the commensal microbiota via nod-like receptor ligands. Infect Immun. 2014 Nov; 82 (11): 4596-606.
43. Schuijt TJ, Lankelma JM, Scicluna BP, de Sousa e Melo F, Roelofs JJ, de Boer JD, Hoogendijk AJ, de Beer R, de Vos A, Belzer C, de Vos WM, van der Poll T, Wiersinga WJ. The gut microbiota plays a protective role in the host defence against pneumococcal pneumonia. Gut. 2016 Apr; 65 (4): 575-83.
44. Gauguet S, D'Ortona S, Ahnger-Pier K, Duan B, Surana NK, Lu R, Cywes-Bentley C, Gadjeva M, Shan Q, Priebe GP, Pier GB. Intestinal Microbiota of Mice Influences Resistance to Staphylococcus aureus Pneumonia. Infect Immun. 2015 Oct; 83 (10): 4003-14.
45. Brown RL, Clarke TB. The regulation of host defenses to infection by the microbiota. Immunology. 2017 Jan; 150 (1).
46. Wang Y, Li X, Ge T, Xiao Y, Liao Y, Cui Y, Zhang Y, Ho W, Yu G, Zhang T. Probiotics for prevention and treatment of respiratory tract infections in children: A systematic review and meta-analysis of randomized controlled trials. Medicine (Baltimore). 2016 Aug; 95 (31): e4509.
47. Szajewska H, Konarska Z, Kolodziej M. Probiotic Bacterial and Fungal Strains: Claims with Evidence. Dig Dis. 2016; 34 (3): 251-9.
48. Schreck Bird A, Gregory PJ, Jalloh MA, Risoldi Cochrane Z, Hein DJ. Probiotics for the Treatment of Infantile Colic: A Systematic Review. J Pharm Pract. 2017 Jun; 30 (3): 366-374.
49. Hao Q, Dong BR, Wu T. Probiotics for preventing acute upper respiratory tract infections. Cochrane Database Syst Rev. 2015 Feb 3; (2): CD 006895.
50. Tapiovaara L, Lehtoranta L, Poussa T, Makivuokko H, Korpela R, Pitkaranta A. Absence of adverse events in healthy individuals using probiotics - analysis of six randomised studies by one study group. Benef Microbes. 2016; 7 (2): 161-9.
51. Kanauchi O, Andoh A, AbuBakar S, Yamamoto N. Probiotics and Paraprobiotics in Viral Infection: Clinical Application and Effects on the Innate and Acquired Immune Systems. Curr Pharm Des. 2018; 24 (6): 710-717.
52. Starosila D, Rybalko S, Varbanetz L, Ivanskaya N, Sorokulova I. Anti-influenza Activity of a Bacillus subtilis Probiotic Strain. Antimicrob Agents Chemother. 2017 Jun 27; 61 (7): e00539-17.
53. Eguchi K, Fujitani N, Nakagawa H, Miyazaki T. Prevention of respiratory syncytial virus infection with probiotic lactic acid bacterium Lactobacillus gasseri SBT2055. Sci Rep. 2019 Mar 18; 9 (1): 4812.
54. Luoto R, Ruuskanen O, Waris M, Kalliomaki M, Salminen S, Isolauri E. Prebiotic and probiotic supplementation prevents rhinovirus infections in preterm infants: a randomized, placebo-controlled trial. J Allergy Clin Immunol. 2014 Feb; 133 (2): 405-13.
55. Wolvers D, Antoine JM, Myllyluoma E, Schrezenmeir J, Szajewska H, Rijkers GT. Guidance for substantiating the evidence for beneficial effects of probiotics: prevention and management of infections by probiotics. J Nutr. 2010 Mar; 140 (3): 698S-712S.
56. Vouloumanou EK, Makris GC, Karageorgopoulos DE, Falagas ME. Probiotics for the prevention of respiratory tract infections: a systematic review. Int J Antimicrob Agents. 2009 Sep; 34 (3): 197. e1-10.
57. Ozen M, Kocabas Sandal G, Dinleyici EC. Probiotics for the prevention of pediatric upper respiratory tract infections: a systematic review. Expert Opin Biol Ther. 2015 Jan; 15 (1): 9-20.
58. Yeoh YK, Zuo T, Lui GC, Zhang F, Liu Q, Li AY, Chung AC, Cheung CP, Tso EY, Fung KS, Chan V, Ling L, Joynt G, Hui DS, Chow KM, Ng SSS, Li TC, Ng RW, Yip TC, Wong GL, Chan FK, Wong CK, Chan PK, Ng SC. Gut microbiota composition reflects disease severity and dysfunctional immune responses in patients with COVID-19. Gut. 2021 Apr; 70 (4): 698-706.
59. Geva-Zatorsky N, Sefik E, Kua L, Pasman L, Tan TG, Ortiz-Lopez A, Yanortsang TB, Yang L, Jupp R, Mathis D, Benoist C, Kasper DL. Mining the Human Gut Microbiota for Immunomodulatory Organisms. Cell. 2017 Feb 23; 168 (5): 928-943. e11.
60. Zuo T, Liu Q, Zhang F, Lui GC, Tso EY, Yeoh YK, Chen Z, Boon SS, Chan FK, Chan PK, Ng SC. Depicting SARS-CoV-2 faecal viral activity in association with gut microbiota composition in patients with COVID-19. Gut. 2021 Feb; 70 (2): 276-284.
61. Segal JP, Mak JWY, Mullish BH, et al. The gut microbiome: an under recognised contributor to the COVID-19 pandemic? Therap Adv Gastroenterol. 2020; 13:1-14.
62. Gohil K, Samson R, Dastager S, Dharne M. Probiotics in the prophylaxis of COVID-19: something is better than nothing. 3 Biotech. 2021; 11 (1): 1.
63. Larenas-Linnemann D, Rodnguez-Perez N, Arias-Cruz A, et al. Enhancing innate immunity against virus in times of COVID-19: Trying to untangle facts from fictions. World Allergy Organ J. 2020; 13 (11): 100476.
64. Akour A. Probiotics and COVID-19: is there any link? Lett Appl Microbiol. 2020 Sep; 71 (3): 229-234.
65. Gutierrez-Castrellon P, Gandara-Marti T, Abreu Y Abreu AT, Nieto-Rufino CD, Lopez-Orduna E, Jimenez-Escobar I, Jimenez-Gutierrez C, Lopez-Velazquez G, Espadaler-Mazo J. Probiotic improves symptomatic and viral clearance in Covid19 outpatients: a randomized, quadruple-blinded, placebo-controlled trial. Gut Microbes. 2022 Jan-Dec; 14 (1): 2018899.
66. d’Ettorre G, Ceccarelli G, Marazzato M, Campagna G, Pinacchio C, Alessandri F, Ruberto F, Rossi G, Celani L, Scagnolari C, Mastropietro C, Trinchieri V, Recchia GE, Mauro V, Antonelli G, Pugliese F, Mastroianni CM. Challenges in the Management of SARS-CoV2 Infection: The Role of Oral Bacteriotherapy as Complementary Therapeutic Strategy to Avoid the Progression of COVID-19. Front Med (Lausanne). 2020 Jul 7; 7: 389.
67. Мескина Е. Р., Целипанова Е. Е., Хадисова М. К., Галкина Л. А., Сташко Т. В. Эффективность применения сорбированных пробиотиков в комплексной терапии пневмонии, вызванной SARS-CoV-2. Часть 1. Период разгара клинических проявлений. Терапевтический архив. 2021; 93 (4): 456-464.
Meskina E. R., Tselipanova E. E., Khadisova M. K., Galkina L. A., Stashko T. V. Efficiency of application of sorbed probiotics in complex therapy of pneumonia caused by SARS-CoV-2. Part 1. Heating clinical displays period. Therapeutic Archive. 2021; 93 (4): 456-464.
68. Полунина А. В., Новикова В. П., Блинов А.Е., Варламова О. Н., Белова А. А., Балашов А.Л., Баннова С.Л., Воронцов П. В., Белевич С. В. Динамика уровня зонулина в стуле при инфекции COVID-19 и в постковидный период у детей. Инфекционные болезни. 2022; 20(3): 35-40.
Polunina A. V., Novikova V. P., Blinov A. E., Varlamova O. N., Belova A. A., Balashov A. L., Bannova S. L., Vorontsov P. V., Belevich S. V. Dynamics of fecal zonulin levels in COVID-19 and in the post-covid period in children. Infekc. bolezni (Infectious Diseases). 2022; 20(3): 35-40. (In Russian).
69. Слукин П. В., Кукес Е. А., Фурсова А.Д., Фурсова Н. К. Синбиотики как средство борьбы против формирующихся и зрелых биопленок патогенных микроорганизмов. Инфекционные болезни. 2022; 20(4): 69-76.
Slukin P. V., Kukes E. A., Fursova A. D., Fursova N. K. Synbiotics as a means of tackling forming and mature biofilms of pathogens. Infekc. bolezni (Infectious Diseases). 2022; 20(4): 69-76. (In Russian).
70. Mak JWY, Chan FKL, Ng SC. Probiotics and COVID-19: One size does not fit all. Lancet Gastroenterol Hepatol. 2020 Jul; 5 (7): 644-645.
71. Din AU, Mazhar M, Waseem M, Ahmad W, Bibi A, Hassan A, Ali N, Gang W, Qian G, Ullah R, Shah T, Ullah M, Khan I, Nisar MF, Wu J. SARS-CoV-2 microbiome dysbiosis linked disorders and possible probiotics role. Biomed Pharmacother. 2021 Jan; 133: 110947.
72. Еремина Е. Ю. Желудочно-кишечные симптомы у инфицированных SARS-CoV-2: акцент на повышенную проницаемость слизистой оболочки. Медицинский алфавит. 2021; 20 (2): 13-20.
Eremina E. Yu. Gastrointestinal symptoms in SARS-CoV-2 infected: Emphasis on increased mucosal permeability. Medical Alphabet. 2021; 20 (2): 13-20.
