 www.binnopharmgroup.ru
www.binnopharmgroup.ru

Максилак® - это широкая линейка продуктов для взрослых и детей с рождения, для коррекции дисбактериоза и подержания баланса микрофлоры кишечника в любых ситуациях ее нарушения с удобным приемом 1 раз в день.
Максилак® – максимум для микрофлоры с заботой о себе и о семье с первого дня.
Кишечная микробиота и иммунитет. Возможности мультиштаммовых пробиотиков в коррекции иммунного статуса у детей
СтатьиТ.А. Чеботарева
Российская медицинская академия непрерывного профессионального образования
Резюме
На основании анализа зарубежных и российских научных исследований представлены современные данные о роли кишечной микробиоты в становлении иммунитета и изменениях ее качественного состава при формировании различных заболеваний. Так, например, снижение или отсутствие Helicobacter pylori ассоциировано с бронхиальной астмой и рефлюкс-эзофагитом в детском возрасте, при псориазе отмечено изменение соотношения Firmicutes/Actinobacteria, а при ожирении - Bacteroidetes/ Firmicutes в желудочно-кишечном тракте, воспалительные заболевания кишечника сопровождаются увеличением содержания Enterobacteriaceae, функциональные нарушения желудочно-кишечного тракта - ростом бактерий рода Veillonella. В статье показаны механизмы влияния микробиоты желудочно-кишечного и респираторного трактов на снижение частоты повторных инфекций путем индукции генов противовирусной защиты, что в исследованиях терапии пробиотиками подтверждено значимыми клиническими эффектами. Приводится обсуждение преимуществ мультиштаммовых пробиотиков, оказывающих всестороннее воздействие на кишечную микробиоту. Важность включения пробиотических штаммов в комплексную терапию острых респираторных инфекций подтверждена исследованиями, доказавшими их положительное влияние на иммунитет ребенка, снижение тяжести болезни и частоты осложнений и рецидивов. Результаты современных научных исследований доказывают значимость оптимального соотношения пробиотических штаммов в комбинации лакто- и бифидобактерий, а также их штаммо-специфичность. В статье представлены сведения о синбиотике, созданном с использованием инновационной защитной технологии каждой микрогранулы саше, включающем комбинацию 9 пробиотических штаммов лакто- и бифидобактерий. Присутствие в составе пребиотического компонента фруктоолигосахарида усиливает действие пробиотической составляющей.
Ключевые слова: кишечная микробиота, пребиотики, пробиотики, синбиотики, иммунитет
Для цитирования: Чеботарева Т.А. Кишечная микробиота и иммунитет. Возможности мультиштаммовых пробиотиков в коррекции иммунного статуса у детей. Медицинский совет. 2021;(11):156-164. doi.org/10.21518/2079-701X-2021-11-156-164.
Intestinal microbiota and immunity. Possibilities of multistrain probiotics in the correction of immune status in children
Tatiana A. Chebotareva
Russian Medical Academy of Continuous Professional Education; 28
Abstract
On the basis of the analysis of foreign and Russian scientific studies the current data on the role of the intestinal microbiota in the formation of immunity and changes in its qualitative composition in the formation of various diseases are presented: For example, a decrease or absence of Helicobacter pylori is associated with bronchial asthma and reflux esophagitis in childhood, a change in Firmicutes/Actinobacteria ratio in psoriasis, and Bacteroidetes/Firmicutes ratio in the gastrointestinal tract in obesity, inflammatory bowel diseases are accompanied by an increase in Enterobacteriaceae, functional disorders of the gastrointestinal tract by a growth of Veillonella bacteria. The article shows the mechanisms of influence of the microbiota of the gastrointestinal and respiratory tracts on reducing the frequency of repeated infections by induction of antiviral defense genes, which in studies of probiotic therapy is confirmed by significant clinical effects. A discussion of the benefits of multistrain probiotics with comprehensive effects on the intestinal microbiota is provided. The importance of including probiotic strains in the complex therapy of acute respiratory infections is confirmed by the studies proving their positive effect on the child’s immunity, reducing the severity of the disease and the frequency of complications and relapses. The results of modern scientific research prove the importance of the optimal ratio of probiotic strains in the combination of lacto- and bifidobacteria, as well as their strain specificity. The article presents information on a synbiotic created using an innovative protective technology of each sachet microgranule including a combination of 9 probiotic strains of lacto- and bifidobacteria. The presence of fructooligosaccharide in the prebiotic component enhances the effect of the probiotic component.
Keywords: intestinal microbiota, prebiotics, probiotics, synbiotics, immunity
For citation: Chebotareva T.A. Intestinal microbiota and immunity. Possibilities of multistrain probiotics in the correction of immune status in children. Meditsinskiy sovet = Medical Council. 2021;(11):156-164. (In Russ.) doi.org/10.21518/2079-701X-2021-11-156-164.
Введение
Изучение пробиотиков и их действия на организм человека началось сравнительно недавно, и во многом этому способствовала необходимость поиска мер борьбы с иммуноопосредованными заболеваниями: аллергическими, аутоиммунными, хроническими воспалительными заболеваниями, ожирением. В наше время получены убедительные научные данные о влиянии кишечной микробиоты (КМ) на развитие иммунитета. Нарушение иммунного ответа, связанное с нарушенной колонизацией кишечника, изменением количественного и качественного состава микробиома, может способствовать росту заболеваемости и значимому снижению качества жизни детей.
Роль кишечной микробиоты в формировании иммунитета
Исследование микробиома человека является одним из важных научных достижений XXI в. Обнаружено, что в организме человека самый широкий спектр микроорганизмов обитает в желудочно-кишечном тракте (ЖКТ). Применение современных молекулярно-биологических технологий, включая секвенирование полных геномов микробиоты, позволило получить достаточно полные представления о числе, генетической неоднородности и сложности микробиома кишечника. КМ - эволюционно сложившаяся совокупность микроорганизмов, сбалансированная экосистема, в которой бактерии находятся в динамическом равновесии, формируя микробные ассоциации, занимающие определенную экологическую нишу. Выявлена тесная взаимосвязь КМ и иммунной системы человека. Микрофлора влияет на формирование местного иммунитета, обеспечивая колонизационную резистентность в содружестве с ингибиторами микробной адгезии, продуктами секретов, муцином, лизоцимом, лактоферрином, лактопероксидазой, интерфероном, функцией мерцательного эпителия и др. Бактериальные комменсалы являются важным многофункциональным компонентом естественной антиинфекционной защиты и обеспечивают множество иммунных эффектов, что подтверждено в современных исследованиях: регуляция развития центральных и периферических органов иммунной системы, стимуляция фагоцитарной активности макрофагов, стимуляция выработки интерферона, регуляция синтеза цитокинов, стимуляция синтеза иммуноглобулинов, регуляция функциональной активности Т- и В-лимфоцитов [1]. Доказано, что КМ воздействует на рецепторы врожденного иммунитета, что лежит в основе модулирования дифференцировки T-лимфоцитов, обеспечивая укрепление противоинфекционной защиты в ЖКТ и за его пределами (рис. 1) [2].
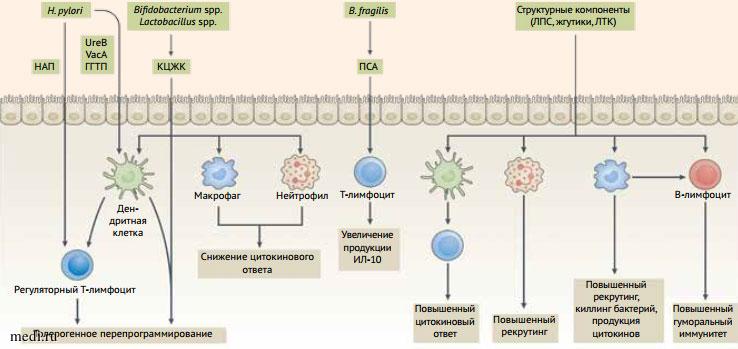 Рисунок 1. Механизмы иммунной регуляции микробиоты кишечника [2]
Рисунок 1. Механизмы иммунной регуляции микробиоты кишечника [2]Figure 1. Mechanisms of immune regulation of the gut microbiota [2]
НАП - нейтрофил-активирующий протеин, UreB - β -субъединица уреазы, VacA - вакуольный цитотоксин А, ГГТП - гамма-глутамилтранспептидаза, КЦЖК - короткоцепочечные жирные кислоты, ПСА - полисахарид А, ЛПС - липополисахариды, ЛТК - липотейхоевые кислоты.
КМ, включающая бактерии, вирусы и грибы, играет ключевую роль в физиологии и поддержании гомеостаза. Интерес к изучению микробиоценоза человека обусловлен тем, что влияние многих средовых факторов, характерных для современной цивилизации, приводит к изменениям в эволюционно выработанной системе взаимоотношений между организмом хозяина и КМ (рис. 2) [3].
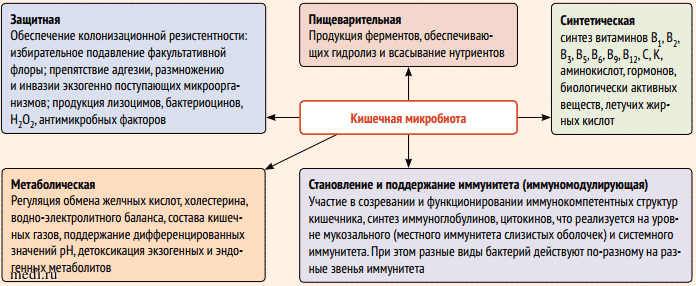 Рисунок 2. Роль кишечной микробиоты в поддержании здоровья человека сложно недооценить ввиду многообразия выполняемых ею функций [3]
Рисунок 2. Роль кишечной микробиоты в поддержании здоровья человека сложно недооценить ввиду многообразия выполняемых ею функций [3]Figure 2. The role of the gut microbiota in maintaining human health is difficult to underestimate because of the variety of functions it performs [3]
Нарушение состава кишечной микробиоты и развитие иммуноопосредованных заболеваний
В настоящее время имеются доказательства того, что изменение состава КМ связано с развитием целого ряда заболеваний, в частности аллергических, иммунопатологических состояний и др. [2, 3]. Так, например, присутствие H. pylori снижает риск бронхиальной астмы и рефлюкс-эзофагита в детском возрасте; при псориазе отмечено увеличение соотношения Firmicutes/Actinobacteria, а при ожирении - снижение соотношения Bacteroidetes/Firmicutes в ЖКТ. Воспалительные заболевания кишечника сопровождаются увеличением содержания Enterobacteriaceae, функциональные нарушения ЖКТ - увеличением роста бактерий рода Veillonella.
В исследованиях на животных моделях с целью изучения эффектов и взаимосвязей дефектов в КМ с болезнями показано, что уменьшение количественного и качественного состава КМ у мышей приводит к нарушению иммунного ответа и ухудшает исходы после бактериальных или вирусных инфекций [4, 5]. Ректальное введение фрагментов бактерий (лигандов толл-лайк рецепторов -TLR) мышам восстанавливает сниженный противовирусный иммунный ответ и устойчивость к интраназальному заражению вирусом гриппа А, что подтверждает передачу стимулирующих противоинфекционную защиту сигналов, полученных в нижних отделах ЖКТ, в слизистые оболочки других биотопов, в частности в респираторный тракт [6]. Это демонстрирует выраженное влияние на иммунитет, которое КМ оказывает не только непосредственно в своем месте базирования, но и в других органах и системах.
Ось «кишечник-легкие»
Заболевания органов ЖКТ и дыхательной системы связаны друг с другом. Так, до 50% взрослых с воспалительными заболеваниями кишечника и 33% пациентов с синдромом раздраженного кишечника имеют сопутствующие поражения легких, даже при отсутствии в анамнезе острых или хронических респираторных заболеваний [7, 8]. Обратная связь также присутствует: у людей с бронхиальной астмой обнаруживаются как функциональные, так и структурные нарушения слизистой кишечника, а у пациентов с хронической обструктивной болезнью легких (ХОБЛ) - повышенная кишечная проницаемость [9, 10]. Новые экспериментальные и эпидемиологические данные указывают на решающее перекрестное взаимодействие между КМ и легкими, которое было названо осью «кишечник - легкие» (рис. 3) [2]. Точные механизмы, лежащие в основе оси, пока что изучены не до конца, но новые данные появляются очень быстро.
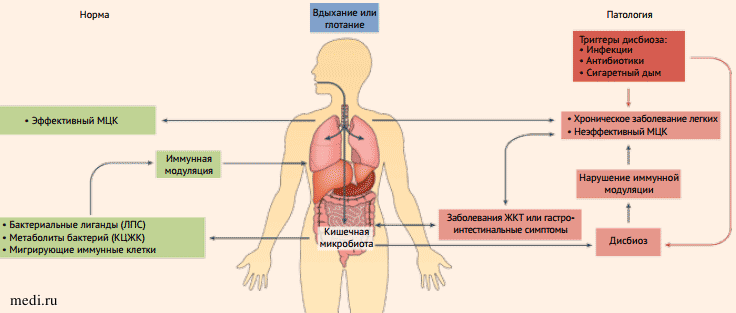 Рисунок 3. Принципы взаимодействия кишечника и легких в норме и при патологии [2]
Рисунок 3. Принципы взаимодействия кишечника и легких в норме и при патологии [2]Figure 3. Principles of gut-lung interaction in norm and pathology [2]
МЦК - мукоцилиарный клиренс, ЛПС - липополисахариды, КЦЖК - короткоцепочечные жирные кислоты.
Несмотря на то что микробиота дыхательных путей численно меньше КМ, она имеет тот же основной микробный тип и относительную численность, хотя и с важными нюансами: микробиота легких у здорового человека может быть преходящей из-за постоянных контактов с микробами окружающей среды. При эффективном сдерживании этого натиска мукозальным иммунитетом человека создаются условия для кратковременной контаминации. Микробные сообщества органов дыхания и кишечника совпадают по доминирующим микроорганизмам: Streptococcus, Veillonella, Prevotella, Bacteroides, Bifidobacterium. При респираторных заболеваниях микробиота легких, вероятно, становится устойчивой и может быть как причиной, так и следствием заболевания, образуя петлю патологической обратной связи. Бактериальные компоненты и метаболиты в кишечнике и легких обладают способностью модулировать системный и местный иммунитет, при этом определенные таксоны могут влиять на патогенез заболеваний дыхательной системы, таких как астма, ХОБЛ и респираторные инфекции.Негативные факторы окружающей среды и образа жизни, такие как поллютанты, сигаретный дым, прием антибиотиков и диета, влияют на риск заболевания, что, вероятно, обусловлено также изменением состава микробиоты респираторного тракта и ЖКТ, хотя механизмы этих патогенетически значимых эффектов пока остаются неизвестными.
Лечебная роль пробиотиков
Обобщая экспериментальные и клинические данные, можно отметить значимое влияние пробиотиков на функциональное состояние эпителиальных клеток, ответ Т-клеток, действие дендритных клеток. За счет этого достигаются повышение целостности эпителиального барьера, модуляция сигнальных путей взаимодействия КМ и клеток кишечника в сторону снижения процессов воспаления, индукция толерогенных дендритных клеток, снижающих уровень продукции провоспалительных цитокинов и повышающих продукцию регуляторных цитокинов.
Важным передаточным звеном, через который опосредуются противовоспалительные эффекты бифидо-и лактобактерий, становятся короткоцепочечные жирные кислоты (КЦЖК). Под влиянием КЦЖК дендритные клетки перепрограммируются в более толерантную сторону, снижается выработка провоспалительных цитокинов макрофагами и нейтрофилами. Таким образом, синбиотическая КМ вносит ощутимый вклад в формирование и модулирование иммунного ответа в кишечнике (рис. 4) [3].
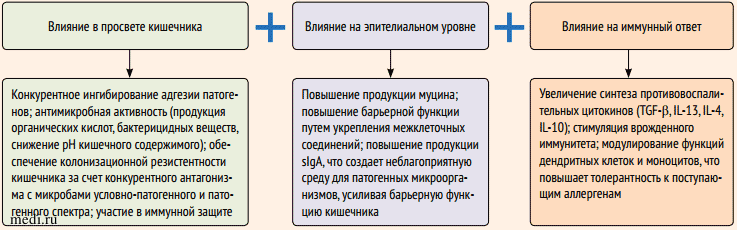 Рисунок 4. Основные механизмы противовоспалительного действия пробиотиков [3]
Рисунок 4. Основные механизмы противовоспалительного действия пробиотиков [3]Figure 4. The main mechanisms of the anti-inflammatory effect of probiotics [3]
В настоящее время результаты исследований по терапевтическим эффектам применения пробиотиков у детей свидетельствуют об уменьшении частоты и улучшении исходов респираторных инфекций [11-13]. Предполагается следующий механизм действия пробиотиков: вещества, выделяемые ими, через системный кровоток попадают в легкие и выступают в роли сигнальных молекул, запускающих иммунный ответ. Кроме того, активированные в кишечнике иммунные клетки попадают в легкие через лимфатическую систему, плюс активируется передача сигналов по системе интерферонов и активаторов транскрипции 1, которые участвуют в индукции генов противовирусной защиты (рис. 5) [14].
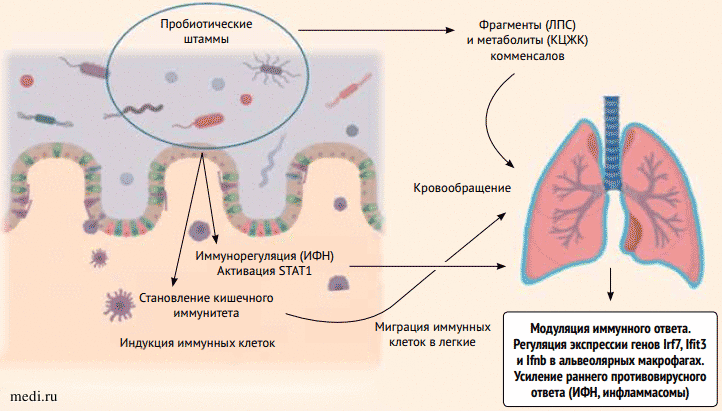 Рисунок 5. Влияние пробиотиков на иммунный ответ при вирусных инфекциях органов дыхания [14]
Рисунок 5. Влияние пробиотиков на иммунный ответ при вирусных инфекциях органов дыхания [14]Figure 5. The effect of probiotics on the immune response in viral respiratory infections [14]
ЛПС - липополисахариды, КЦЖК - короткоцепочечные жирные кислоты, ИФН - интерфероны, STAT1 - преобразователь сигналов и активатор транскрипции 1.
Пробиотики в педиатрической практике
Учитывая тесное взаимодействие органов оси «кишечник - легкие», влияющей на работу многих аспектов иммунной системы, целесообразно считать кишечный дисбиоз проблемой не только и не столько микробиологической, сколько иммунологической. Изменения КМ как следствие неправильного питания или диеты, болезни или медицинского вмешательства, такого как прием антибиотиков, связаны с измененными иммунными реакциями и гомеостазом дыхательных путей [15]. Этот подход нашел отражение и в медицинской практике, например, в педиатрии при выборе тактики лечения часто болеющих детей, на долю которых приходится до 75% всех случаев острых респираторных инфекций (ОРИ) у детей. Расширение арсенала эффективных и безопасных средств для профилактики респираторных инфекций у данной категории детей в период повышенной заболеваемости является актуальной проблемой [16].
Несмотря на то что пероральные пробиотики в настоящее время не являются частью какого-либо конкретного протокола лечения и профилактики ОРИ, удалось накопить убедительную доказательную базу, свидетельствующую о позитивных эффектах применения некоторых пробиотиков в коррекции иммунного статуса.
В последние годы все большую популярность приобретают мультиштаммовые и мультивидовые пробиотики, поскольку они оказывают комплексное воздействие на КМ. В исследованиях было показано, что мультиштаммовые пробиотики, в состав которых входят лактобациллы (Lactobacillus plantarum, Lactobacillus rhamnosus, Lactobacillus acidophilus)и бифидобактерии (Bifidobacterium lactis, Bifidobacterium bifidum), способствовали снижению выраженности симптомов ОРИ у детей (уменьшалась частота и тяжесть течения заболевания по сравнению с плацебо), уменьшению заболеваемости и сокращению продолжительности болезни (рис. 6-8) [16-18].
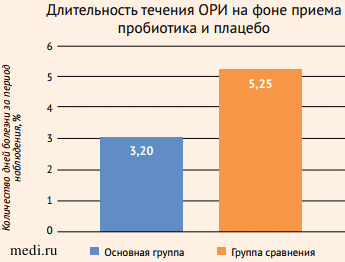 Рисунок 6. Мультипробиотик уменьшает длительность течения острых респираторных инфекций по сравнению с плацебо [16]
Рисунок 6. Мультипробиотик уменьшает длительность течения острых респираторных инфекций по сравнению с плацебо [16]Figure 6. Multiprobiotic reduces duration of acute respiratory infections compared to placebo [16]
p = 0,001
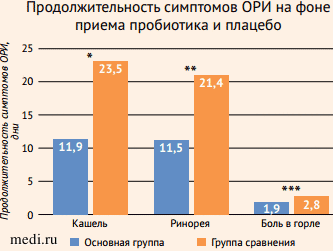 Рисунок 7. Мультипробиотик сокращает продолжительность симптомов острых респираторных инфекций по сравнению с плацебо [17]
Рисунок 7. Мультипробиотик сокращает продолжительность симптомов острых респираторных инфекций по сравнению с плацебо [17]Figure 7. Multiprobiotic reduces the duration of symptoms of acute respiratory Infections compared to placebo [17]
* p = 0,006; ** p = 0,072; *** p = 0,332
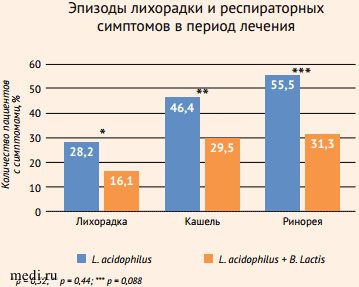 Рисунок 8. Мультипробиотик превосходит моноштаммовый пробиотик по эффективности при использовании у детей с острыми респираторными инфекциями [18]
Рисунок 8. Мультипробиотик превосходит моноштаммовый пробиотик по эффективности при использовании у детей с острыми респираторными инфекциями [18]Figure 8. Multiprobiotic outperforms mono-strain probiotic when used in children with acute respiratory infections [18]
p = 0,32; ** p = 0,44; *** p = 0,088
Использование пробиотических средств в качестве дополнительной терапии при различных состояниях практикуется весьма широко, в т. ч. обсуждается их возможный благотворный эффект при лечении пациентов с COVID-19 [19]. Однако следует отметить, что из возможных направлений применения пробиотиков при COVID-19 только их назначение во время и (или) после антибактериальной терапии для профилактики и лечения различных побочных эффектов имеет более чем убедительную доказательную базу. Как правило, в качестве пробиотиков используются препараты, содержащие различные виды и штаммы бифидо- и лактобактерий (в т. ч. B. bifidum, L. plantarum) [19, 20] (рис. 9).
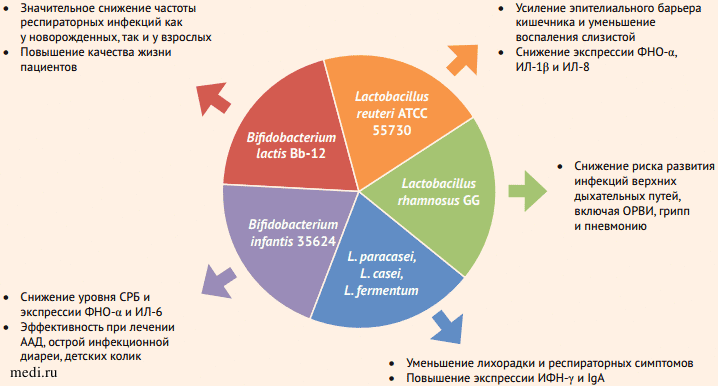 Рисунок 9. Пробиотические штаммы, имеющие значение для управления COVID-19 [20]
Рисунок 9. Пробиотические штаммы, имеющие значение для управления COVID-19 [20]Figure 9. Probiotic strains relevant for COVID-19 management [20]
Широкий видовой состав как преимущество мультипробиотиков
К мультиштаммовым пробиотическим средствам, включающим бактерии с доказанными свойствами и используемым в медицинской практике с лечебно-профилактической целью, относится синбиотик Максилак® Бэби - композиция из 9 штаммов известных пробиотиков в высокой концентрации 109 КОЕ (в т. ч. LGG, B. longum, B. bifidum) и пребиотического компонента1 (табл. 1).
Таблица 1.
Состав синбиотика Максилак® Бэби [21]
Table 1.
Composition of Maxilac® Baby synbiotic [21]
| Состав | Кол-во на саше (1,5 г) | Средняя/рекомендуемая суточная потребность (РСП*) |
| Активные компоненты | ≥ 1 х 109 КОЕ** | |
| Пробиотические микроорганизмы | ||
| Lactobacillus acidophilus LA-14 | 1,11 х 108 КОЕ | |
| Lactobacillus casei LC-11 | 1,11 х 108 КОЕ | |
| Lactobacillus paracasei Lpc-37 | 1,11 х 108 КОЕ | |
| Lactobacillus plantarum Lp-115 | 1,11 х 108 КОЕ | |
| Lactobacillus rhamnosus GG | 1,11 х 108 КОЕ | |
| Lactobacillus salivarius Ls-33 | 1,11 х 108 КОЕ | |
| Всего | 0,7 х 109 КОЕ | 5 х 107- 5 х 109 КОЕ |
| Bifidobacterium lactis Bl-04 | 1,11 х 108 КОЕ | |
| Bifidum bacterium Bifidum Bb-02/Lactis | 1,11 х 108 КОЕ | |
| Bifidobacterium longum Bl-05 | 1,11 х 108 КОЕ | |
| Всего | 0,3 х 109 КОЕ | 5 х 108 - 5 х 1010 КОЕ |
| Пребиотический компонент | ||
| Фруктоолигосахариды | 0,5 г | 5 г |
| Вспомогательные компоненты | ||
| Мальтодекстрин (наполнитель) | 0,85 г | - |
| Диоксид кремния (разрыхлитель) | 0,1 г | - |
Как было показано, по эффективности мультипробиотик превосходит моноштаммовые [18]. Это достигается за счет взаимодействия штаммов в комбинации. Хорошо известно, что штаммы, принадлежащие к родам Lactobacillus, Lactococcus, Streptococcus, Bifidobacterium и Propionibacterium, демонстрируют симбиотические взаимоотношения [21]. Смешанные штаммы пробиотиков дополняют действия друг друга на организм человека, т. е. проявляют синергические свойства [21] (табл. 2). Таким образом, синбиотик имеет преимущества по сравнению с моноштаммовыми пробиотиками.
Таблица 2.
Различия между моноштаммовыми и мультивидовыми пробиотиками [22]
Table 2.
Differences between monostrain and multistrain probiotics [22]
| Моноштаммовый пробиотик | Мультиштаммовый пробиотик |
| Особенности колонизации | |
|
|
Разные штаммы с индивидуальными характеристиками имеют больше шансов на колонизацию: |
| Влияние на организм | |
|
|
Усилено вследствие сочетания свойств штаммов: |
Синбиотики представляют собой комбинацию пребиотиков и пробиотиков. Пробиотические бактерии (лакто-и бифидобактерии), входящие в состав пробиотических средств, - живые микроорганизмы, при применении которых в терапевтических количествах происходит восстановление структуры нормальной микробиоты с последующей стабилизацией отдельных функций организма. Сами пробиотические бактерии - это представители нормальной микробиоты, которые способны оказывать положительное влияние на физиологические, биохимические и иммунологические функции макроорганизма, характер изменения которых зависит как от определенного вида и штамма бактерии, так и от индивидуальных особенностей самого организма-хозяина.
Пробиотические штаммы разделяются на три вида: кисломолочные (например, Lactobacillus acidophilus, Lactobacillus plantarum, Lactobacillus bulgaricus, Lactobacillus casei, Lactobacillus fermentum, Streptococcus thermophilus и др.), донорские (Bifidobacterium bifidum, Bifidobacterium longum, Bifidobacterium infantis, Bifidobacterium adolescentis, Lactobacillus rhamnosus GG, Lactobacillus gasseri, Enterococcus faecium, Enterococcus salivarius) и антагонисты (Bacillus subtilis, Saccharomyces boulardii) [22].
1 Листок-вкладыш к БАД Максилак® Бэби. СГР № AM.01.07.01.003.R.000079.09.19 от 05.09.2019.
Кисломолочные штаммы угнетают гнилостную и условно-патогенную флору за счет выработки молочной кислоты. Донорские штаммы обладают свойством адгезироваться на слизистой оболочке ЖКТ, нормализуя при этом состав муцинового слоя и модулируя иммунный ответ. Антагонисты не являются представителями нормальной микрофлоры человека, они не адгезируются на слизистой кишечника, проходят ЖКТ в неизмененном виде, проявляя при этом антагонизм в отношении патогенной и условно-патогенной флоры [23, 24].
Эффективность пробиотических средств и их позитивное влияние на иммунную систему во многом обусловлены штаммоспецифичностью, их оптимальным сочетанием и количеством. Рациональная комбинация 9 пробиотических штаммов лакто- и бифидобактерий, которые являются представителями молочнокислых и донорских видов пробиотиков с пребиотическим компонентом (фруктоолигосахаридами), представляет собой не только комплекс штаммов, способный нормализовать микрофлору кишечника, но и компонент, способный стимулировать их рост.
Клинические эффекты штаммов, представленных в составе синбиотика Максилак, продемонстрированы в ряде исследований. Так, комбинация L. rhamnosus GG, L. acidophilus La-5 и B. lactis BB-12 показала профилактическую роль в развитии антибиотик-ассоциированной диареи (ААД) [25].
При применении детской молочной смеси у детей в возрасте до 10 мес., обогащенной L. reuteri и B. lactis BB-12, было зарегистрировано достоверно меньше эпизодов лихорадки (р = 0,001; ВВ-12 и L. reuteri против плацебо) [26].
Комбинация штаммов Bifidobacterium bifidum, B. ongum, B. Infantis и Lactobacillus rhamnosus показала позитивное действие на эрадикацию H. pylori, а также снижение частоты возникновения нежелательных явлений антибактериальной терапии, включая развитие болезни, ассоциированной C. difficile [27-29].
Приведенная доказательная база клинической эффективности применения пробиотических штаммов явилась основанием их включения в рекомендации рабочей группы Европейского общества детских гастроэнтерологов, гепатологов и нутрициологов (ESPGHAN) Working Group for Probiotics/Prebiotics при атопии и ААД у детей [30, 31], а также Латиноамериканского консенсуса детских врачей (2015), который установил необходимость применения комбинации B. bifidum и S. hermophilus в целях снижения риска развития нозокомиальной диареи у детей [32, 33].
Максилак® Бэби изготавливается с применением инновационной защитной технологии каждой микрогранулы саше. Синбиотик применяется в режиме 1 саше в день у детей с первых дней жизни до 2 лет, 2 саше в день -у детей от 2 лет. Производится европейской компанией Labomar в соответствии со стандартами GMP и ISO 9001. В состав синбиотика включены фруктоолигосарахиды -пребиотический компонент с выраженными бифидогенными свойствами, который служит питательной средой для нормальной микрофлоры. Фруктоолигосахариды не адсорбируются и не гидролизуются в ЖКТ, устойчивы к действию агрессивных факторов, способствуют защите пробиотических штаммов, увеличивая продолжительность их нахождения в ЖКТ и создавая тем самым благоприятную среду для их активности.
Заключение
Таким образом, штаммы, входящие в состав синбиотика Максилак® Бэби, продемонстрировали свое позитивное влияние на лечение ОРИ, снижение риска их возникновения у часто болеющих детей, а также на процессы восстановления микрофлоры при многих заболеваниях и состояниях, ассоциированных с ее нарушением (ААД, кишечные инфекции, атопический дерматит и др.), что позволяет говорить о возможности применения данного комплекса у детей с рождения. Он содержит оптимальное количество пробиотических штаммов, технология производства которых обеспечивает их безопасность при применении пациентами детского возраста.
Информация об авторе:
Чеботарева Татьяна Александровна, д.м.н., профессор кафедры детских инфекционных болезней, Российская медицинская академия непрерывного профессионального образования; 125373, Россия, Москва, ул. Героев Панфиловцев, д. 28.
Information about the author:
Tatiana A. Chebotareva, Dr. Sci. (Med.), Professor of the Department of Pediatric Infectious Diseases, Russian Medical Academy of Continuous Professional Education; 28, Geroev Panfilovtsev St., Moscow, 125373, Russia
Список литературы / References
1. Калюжин В. Возможности использования пробиотиков для укрепления противоинфекционной защиты в свете иммуногомеостатической роли микробиоты. Эффективная фармакотерапия. 2013;(27):12-25.
Kalyuzhin O.V. Probiotics for anti-infectious protection in context of immunogomeostatic role of microbiota. Ehffektivnaya farmakoterapiya = Effective Pharmacotherapy. 2013;(27):12-25. (In Russ.)
2. Budden K.F., Gellatly S.L., Wood D.LA., Cooper M.A., Morrison M., Hugenholtz P., Hansbro P.M. Emerging pathogenic links between microbiota and the gut-lung axis. Nat Rev Microbiol. 2017;15(1):55-63.
3. Оганезова ИА. Кишечная микробиота и иммунитет: иммуномодулирующие эффекты Lactobacillus rhamnosus GG. РМЖ. 2018;(9):39-44. effects of Lactobacillus rhamnosus GG. RMZh = RMJ. 2018;(9):39-44. (In Russ.)
4. Schuijt TJ., Lankelma J.M., Scicluna B.P., de Sousa e Melo F., Roelofs JJ.T.H., de Boer J.D. et al. The gut microbiota plays a protective role in the host defence against pneumococcal pneumonia. Gut. 2016;65(4):575-583.
5. Fagundes C.T., Amaral F.A., Vieira A.T., Soares A.C., Pinho V., Nicoli J.R. et al. Transient TLR activation restores inflammatory response and ability to control pulmonary bacterial infection in germfree mice. J Immunol. 2012;188(3):1411-1420.
6. Ichinohe T., Pang I.K., Kumamoto Y., Peaper D.R., Ho J.H., Murray T.S., Iwasaki A. Microbiota regulates immune defense against respiratory tract influenza A virus infection. Proc Natl Acad Sci USA. 2011;108(13):5354-5359.
7. Yazar A., Atis S., Konca K., Pata C., Akbay E., Calikoglu M., Hafta A. Respiratory symptoms and pulmonary functional changes in patients with irritable bowel syndrome. Am J Gastroenterol. 2001;96(5):1511-1516.
8. Keely S., Talley NJ., Hansbro P.M. Pulmonary-intestinal cross-talk in mucosal inflammatory disease. Mucosal Immunol. 2012;5(1):7—18.
9. Rutten E.P.A., Lenaerts K., Buurman W.A., Wouters E.F.M. Disturbed intestinal integrity in patients with COPD: effects of activities of daily living. Chest. 2014;145(2):245-252.
10. Vieira W.A., Pretorius E. The impact of asthma on the gastrointestinal tract (GIT). J Asthma Allergy. 2010;3:123-130.
11. Luoto R., Ruuskanen O., Waris M., Kalliomaki M., Salminen S., Isolauri E. Prebiotic and probiotic supplementation prevents rhinovirus infections in preterm infants: a randomized, placebo-controlled trial. J Allergy Clin Immunol. 2014;133(2):405-413.
12. Jespersen L., Tarnow I., Eskesen D., Morberg C.M., Michelsen B., Bugel S. et al. Effect of Lactobacillus paracasei subsp. paracasei, L. casei 431 on immune response to influenza vaccination and upper respiratory tract infections in healthy adult volunteers: a randomized, double-blind, placebo-controlled, parallel-group study. Am J Clin Nutr. 2015;101(6):1188-1196.
13. King S., Glanville J., Sanders M.E., Fitzgerald A., Varley D. Effectiveness of probiotics on the duration of illness in healthy children and adults who develop common acute respiratory infectious conditions: a systematic review and meta-analysis. Br J Nutr. 2014;112(1):41-54.
14. Shahbazi R., Yasavoli-Sharahi H., Alsadi N., Ismail N., Matar C. Probiotics in Treatment of Viral Respiratory Infections and Neuroinflammatory Disorders. Molecules. 2020;25(21):4891.
15. Zhang J., Garrett S., Sun J. Gastrointestinal symptoms, pathophysiology, and treatment in COVID-19. Genes Dis. 2021;8(4):385-400.
16. Pregliasco F., Anselmi G., Fonte L., Giussani F., Schieppati S., Soletti L. A new chance of preventing winter diseases by the administration of synbiotic formulations. J Clin Gastroenterol. 2008;42(3 Suppl., Pt. 2):S224-S233.
17. Garaiova I., Muchova J., Nagyova Z., Wang D., Li J.V., Orszaghova Z. et al. Probiotics and vitamin C for the prevention of respiratory tract infections in children attending preschool: a randomised controlled pilot study. Eur J Clin Nutr. 2015;69(3):373-379.
18. Leyer G.J., Li S., Mubasher M.E., Reifer C., Ouweh A.C. Probiotic effects on cold and influenza-like symptom incidence and duration in children. Pediatrics. 2009;124(2):e172-e179.
19. Авдеев С.Н., Адамян Л.В., Алексеева Е.И., Багненко С.Ф., Баранов А.А., Баранова Н.Н. и др. Временные методические рекомендации. Профилактика, диагностика и лечение новой коронавирусной инфекции (COVID-19). Версия 11 (0705.2021). М., 2021. 225 с. 225 p. (In Russ.)
20. Singh K., Rao A. Probiotics: A potential immunomodulator in COVID-19 infection management. Nutr Res. 2021;87:1-12.
21. Урсова Н.И. Терапевтический потенциал современных пробиотиков. Педиатрическая фармакология. 2013;10(2):46-56.
Ursova N.I. Therapeutic potential of modern probiotics. Pediatricheskaya farmakologiya = Pediatric Pharmacology. 2013;10(2):46-56. (In Russ.)
22. Плоскирева А.А. У каждого штамма свой эффект, или Предназначение пробиотиков. Участковый педиатр. 2018;(2):16-17. Ploskireva A.A. Each strain has its own effect, or Mission of probiotics. Uchastkovyy pediatr = District Pediatrician. 2018;(2):16-17. (In Russ.)
23. Salminen S., Isolauri E., Salminen E. Clinical use of probiotics for stabilizing the gut mucosal barrier: successful strains and future challenges. Antonie Van Leeuwenhoek. 1996;70(2-4):347-358.
24. Яблокова ЕА., Горелов А.В. Пробиотики: современный инструмент в руках клинициста. Педиатрия. Consilium Medicum. 2018;(4):59-62.
Yablokova E.A., Gorelov A.V. Probiotics are a modern tool for a clinician. Pediatriya. Consilium Medicum = Pediatrics Consilium Medicum. 2018;(4):59-62. (In Russ.)
25. Blaabjerg S., Artzi D.M., Aabenhus R. Probiotics for the Prevention of Antibiotic-Associated Diarrhea in Outpatients - A Systematic Review and Meta-Analysis. Antibiotics. 2017;6(4):21.
26. Weizman Z., Asli G., Alsheikh A. Effect of a probiotic infant formula on infections in child care centers: comparison of two probiotic agents. Pediatrics. 2005;115(1):5-9.
27. Lv Z., Wang B., Zhou X., Wang F., Xie Y., Zheng H., Lv N. Efficacy and safety of probiotics as adjuvant agents for Helicobacter pylori infection: a meta-analysis. Exp Ther Med. 2015;9(3):707-716.
28. Tong J.L., Ran Z.H., Shen J., Zhang C.X., Xiao S.D. Meta-analysis: the effect of supplementation with probiotics on eradication rates and adverse events during Helicobacter pylori eradication therapy. Aliment Pharmacol Ther. 2007;25(2):155-168.
29. Wang Z.H., Gao Q.Y, Fang J.Y. Meta-analysis of the efficacy and safety of Lactobacillus-containing and Bifidobacterium-containing probiotic compound preparation in Helicobacter pylori eradication therapy. J Clin Gastroenterol. 2013;47(1):25-32.
30. Hojsak I., Fabiano V., Pop T.L., Goulet O., Zuccotti G.V.,Cokugras F.C. et al. Guidance on the use of probiotics in clinical practice in children with selected clinical conditions and in specific vulnerable groups. Acta Paediatr. 2018;107(6):927-937.
31. Szajewska H., Canani R.B., Guarino A., Hojsak I., Indrio F., Kolacek S. et al. Probiotics for the Prevention of Antibiotic-Associated Diarrhea in Children. J Pediatr Gastroenterol Nutr. 2016;62(3):495-506.
32. Bustos S.P., Chamorro J.F.V. Probioticos en diarrea aguda, asociada a antibioticos y nosocomial: evidencia en pediatria. Revista Colombiana De Gastroenterologia. 2018;33(1):41-48.
33. Cruchet S., Furnes R., Maruy A., Hebel E., Palacios J., Medina F. et al. The use of probiotics in pediatric gastroenterology: a review of the literature and recommendations by Latin-American experts. Paediatr Drugs. 2015;17(3):199-216.
