 www.binnopharmgroup.ru
www.binnopharmgroup.ru

Максилак® - это широкая линейка продуктов для взрослых и детей с рождения, для коррекции дисбактериоза и подержания баланса микрофлоры кишечника в любых ситуациях ее нарушения с удобным приемом 1 раз в день.
Максилак® – максимум для микрофлоры с заботой о себе и о семье с первого дня.
Как повысить эффективность лечения больных с синдромом раздраженного кишечника?
СтатьиЕ.В. Голованова
Московский государственный медико-стоматологический университет имени А.И. Евдокимова; 127473, Россия, Москва, ул. Делегатская, д. 20, стр. 1
Резюме
В настоящей статье рассмотрены вопросы повышения эффективности лечения синдрома раздраженного кишечника (СРК), одного из наиболее распространенных функциональных расстройств желудочно-кишечного тракта (ЖКТ). Актуальность данного вопроса обусловлена высокой частотой выявления патологии среди молодого трудоспособного населения и сложностями в подборе эффективного лечения, снижающего не только выраженность симптомов, но и частоту рецидивов. Недостаточно эффективная терапия снижает приверженность больных к лечению и существенно ухудшает качество их жизни. Причиной неэффективного лечения чаще всего является выбор лекарственного препарата, который не может обеспечить положительное воздействие на все факторы формирования болевого синдрома. Кроме этого, часто не проводятся мероприятия, направленные на коррекцию таких факторов патогенеза, как нарушение кишечной микрофлоры. Между тем в многочисленных исследованиях доказано, что дисбаланс кишечной микробиоты сопровождается повышением проницаемости слизистой оболочки ЖКТ, что приводит к проникновению агрессивных агентов через расширенные межклеточные пространства. Это сопровождается возникновением субклинического воспаления в подслизистом слое, что ведет к нарушениям моторной функции и повышению висцеральной чувствительности. Таким образом, дисбаланс кишечной микрофлоры - один из важнейших факторов формирования клинических симптомов СРК. В статье с позиций доказательной медицины обоснованы преимущества применения регулятора моторики пищеварительного тракта тримебутина при функциональных заболеваниях ЖКТ. Представлены современные научные данные об эффективности коррекции микробиоты в купировании симптоматики СРК. В частности, в двойном слепом плацебо-контролируемом исследовании показана эффективность мультиштаммового пробиотического комплекса на выраженность клинических симптомов СРК.
Оптимальная схема лечения больного с СРК должна включать препарат, корректирующий моторику ЖКТ и снижающий висцеральную гиперчувствительность в комплексе с пробиотическим комплексом, содержащим штаммы бактерий, показавших свою эффективность у данной группы больных.
Ключевые слова: синдром раздраженного кишечника, абдоминальный болевой синдром, висцеральная гиперчувствительность, тримебутин, нарушение микробиоты кишечника, пробиотики, синбиотики
Для цитирования: Голованова Е.В. Как повысить эффективность лечения больных с синдромом раздраженного кишечника? Медицинский совет. 2021;(5):
How to improve effectiveness of treatment of patients with irritable bowel syndrome?
Elena V. Golovanova.
Yevdokimov Moscow State University of Medicine and Dentistry; 20, Bldg. 1, Delegatskaya St., Moscow, 127473, Russia
Abstract
This article discusses ways to improve the effectiveness of treatment of irritable bowel syndrome (IBS), one of the most common functional gastrointestinal disorders (FGID). The significance of this issue is caused by high frequency of pathology detection among the young employable population and the difficulties in choosing an effective treatment that relieves not only the symptom severity, but also the frequency of relapses. Inadequate therapy reduces patients’ compliance with treatment and significantly worsens their quality of life. The choice of a drug that fails to provide a positive effect on all factors that form the pain syndrome is the most common reason for ineffective treatment. In addition, the measures aimed at managing such pathogenic factors as intestinal microbiota dysbiosis are often not taken. Meanwhile, numerous studies have shown that the intestinal microbiota imbalance is accompanied by increased intestinal permeability, which leads to the penetration of aggressive agents through extended intercellular spaces. This is accompanied by the occurrence of subclinical inflammation in the submucosal layer, which results in impaired motor function and increased visceral sensitivity. Thus, the intestinal microflora imbalance is one of the most important factors that form clinical symptoms of IBS. The article substantiates the advantages of using trimebutin, a gastrointestinal tract motility regulator, in functional gastrointestinal diseases from the standpoint of evidence-based medicine. The modern scientific knowledge on the effectiveness of microbiota adjustment in alleviating IBS symptoms is presented. In particular, the double-blind, placebo-controlled study has shown the efficacy of a multi-strain probiotic complex in relieving clinical symptom severity of IBS. The optimal treatment regimen for a patient with IBS should include a drug regulating the gastrointestinal motility and reducing visceral hypersensitivity and a probiotic complex containing bacterial strains that have proved their efficacy in this group of patients.
Key words: irritable bowel syndrome, abdominal pain syndrome, visceral hypersensitivity, trimebutin, intestinal microbiota dysbiosis, probiotics, synbiotics
For citation: Golovanova E.V. How to improve effectiveness of treatment of patients with irritable bowel syndrome? Meditsinskiy sovet = Medical Council. 2021;(5): (In Russ.) doi:
Введение
Функциональные заболевания (ФЗ) желудочнокишечного тракта (ЖКТ) являются актуальной медицинской проблемой во всем мире, что обусловлено широкой распространенностью этой патологии среди лиц молодого трудоспособного возраста. В эпидемиологических исследованиях показано, что больные с ФЗ ЖКТ являются нетрудоспособными значительно чаще и большее число дней в году, чем лица этой же возрастной группы с другой патологией [1]. Большой проблемой является также недостаточная эффективность лечения данной категории пациентов, что стимулирует постоянный поиск новых лекарственных препаратов и схем их применения.
Наиболее распространенным среди ФЗ ЖКТ является синдром раздраженного кишечника (СРК). Интенсивная и трудно поддающаяся лечению симптоматика при СРК (абдоминальный болевой синдром, расстройства стула), которая приводит к выраженному снижению качества жизни (КЖ), обусловлена прежде всего нарушениями моторной функции пищеварительного тракта.
Патогенез формирования абдоминального болевого синдрома при СРК
Одним из основных факторов развития патологии является расстройство регуляции моторики ЖКТ вследствие дисбаланса взаимодействия центрального и периферического отделов нервной системы, т. е. нарушения функционирования т. н. оси «мозг - кишечник - мозг». Взаимодействие периферического отдела нервной системы с головным мозгом осуществляется посредством передачи импульсов с висцеральных рецепторов (ноцицепторов) в составе энтеральной нервной системы (ЭНС). Энтеральная нервная система осуществляет регуляцию моторно-эвакуаторной функции пищеварительного тракта путем синтеза биологически активных веществ и реакции ответственных за стимуляцию моторики нервных клеток, расположенных на всем протяжении пищеварительного тракта в виде сплетений, известных под названиями «ауэрбаховское» и «мейснеровское», а также расположенных в виде отдельных клеток (клетки Кахаля).
В регуляции моторики пищеварительного тракта также принимают участие опиоидные рецепторы m (мю), k (каппа) и δ (дельта). Стимуляция этих рецепторов приводит к нормализации моторной функции пищеварительного тракта на всем протяжении. Кроме этого, опиоидные рецепторы отвечают за выраженность передаваемого нервного импульса, т. е. участвуют в формировании висцеральной гиперчувствительности (ВГЧ), которая является основополагающим фактором развития интенсивного рецидивирующего болевого синдрома, не поддающегося полной коррекции препаратами со спазмолитическим эффектом. В исследованиях показано, что ВГЧ определяет выраженность и стойкость болевого абдоминального синдрома при СРК и напрямую достоверно коррелирует с интенсивностью боли. Также ВГЧ стимулирует развитие «вторичного» спастического сокращения гладкой мускулатуры ЖКТ, что, в свою очередь, по принципу «порочного круга» вновь приводит к нарушению моторной и эвакуаторной функций кишечника.
Причинами неэффективного лечения СРК, проявляющегося в недостаточном купировании симптомов и частом их рецидивировании, является применение препаратов, которые не могут комплексно воздействовать на сложную многоступенчатую регуляцию функционирования пищеварительного тракта и не могут нормализовать моторику ЖКТ на всем протяжении, а также не обладают возможностью снижать висцеральную гиперсенситивность.
Выбор лекарственного препарата для купирования симптомов СРК с позиций доказательной медицины
Европейские и российские эксперты рекомендуют для лечения больных СРК в качестве препаратов первой линии спазмолитики, показавшие свою эффективность и безопасность в хорошо спланированных рандомизированных контролируемых исследованиях и метаанализах. В Римских критериях IV пересмотра 2016 г. и в российских клинических рекомендациях 2017 г. в список этих препаратов включен тримебутина малеат, имеющий явные преимущества перед другими спазмолитиками за счет воздействия на энкефалинергическую систему пищеварительного тракта (УДД 2, УУР B) [2].
Тримебутин является агонистом (стимулятором) опиоидных рецепторов всех типов, основная функция которых в организме - регулирование болевых ощущений. Опиоидные (син. опиатные) рецепторы - это разновидность рецепторов нервной системы, относящихся к рецепторам, сопряженным с G-белком [3-5]. Эти рецепторы широко распространены в головном, спинном мозге, а также на всем протяжении пищеварительного тракта и в других органах. В процессе функционирования четыре основные группы опиатных рецепторов (р (мю), 8 (дельта), к (каппа) и ноцицептиновые (ORL1)) связываются как с эндогенными (синтезируемыми в организме), так и с экзогенными (поступающими извне) опиоидными лигандами. При активации опиоидного рецептора ингибируется аденилатциклаза, которая играет важную роль при синтезе вторичного посредника - циклической АМФ (цАМФ), а также осуществляется регулирование ионных каналов. В частности, угнетение потенциал-зависимых кальциевых каналов в пресинаптическом нейроне приводит к уменьшению выброса возбуждающих нейромедиаторов (таких как глутаминовая кислота), а активация калиевых каналов в постсинаптическом нейроне приводит к гиперполяризации мембраны, что уменьшает чувствительность нейрона к возбуждающим нейромедиаторам [6, 7]. Экзогенной опиоидной лигандой является и молекула тримебутина, которая стимулирует все типы опиоидных рецепторов, что обуславливает действие препарата на всем протяжении ЖКТ. Стимулируя к-рецепторы, тримебутин блокирует возбуждающие нейроны ЭНС и, таким образом, угнетает исходно гиперактивированную моторику. Наряду с этим, стимулируя р- и δ-опиоидные рецепторы, препарат блокирует тормозные нейроны ЭНС и, таким образом, стимулирует моторику ЖКТ при ее исходном угнетении. За счет нормализации моторной активности пищеварительного тракта тримебутина малеат вторично способствует снятию спастического компонента двигательных расстройств и снижению болевого синдрома, связанного со спазмом. Кроме того, тримебутин повышает порог болевой чувствительности в результате воздействия на глутаматные рецепторы синапсов задних рогов спинного мозга [2]. Препарат обладает собственным спазмолитическим действием за счет имеющегося у него свойства блокировать натриевые и кальциевые каналы гладкой мускулатуры ЖКТ.
Основанием для включения препарата в европейские и российские клинические рекомендации послужила мощная доказательная база: эффективность тримебутина при лечении больных СРК продемонстрирована в ряде метаанализов и систематических обзоров [8-12]. Анализ подгрупп различных спазмолитиков в метаанализе, изучавшем их эффективность в купировании абдоминального болевого синдрома у больных СРК, выявил статистически достоверное улучшение при абдоминальной боли для тримебутина (RR 1,32; 95% CI 1,07 до 1,64; 140). Тримебутин обладает высоким уровнем доказанной эффективности при болях в животе, запоре и диарее у больных СРК, улучшает их общее клиническое состояние, повышает качество жизни и обладает хорошим профилем безопасности (УДД 1a, УУР А)1, 2 [10, 13-18].
1 Приказ Минздрава России от 24 декабря 2012 г. №1420н «Об утверждении стандарта специализированной медицинской помощи при синдроме раздраженного кишечника (без диареи)».
2 NПриказ Минздрава России от 9 ноября 2012 г. №774н «Об утверждении стандарта специализированной медицинской помощи при синдроме раздраженного кишечника (с диареей)».
Модулирующий моторику кишечника эффект тримебутина у больных СРК продемонстрирован в российском клиническом исследовании [19], в котором через 4 нед. лечения тримебутином в суточной дозе 600 мг у пациентов с СРК с запорами частота стула увеличилась в 94% случаев, а у пациентов с СРК с диареей уменьшилась в 75%. В китайском рандомизированном исследовании показана высокая эффективность тримебутина в коррекции диареи у больных с функциональной диспепсией и СРК с диареей [15].
На российском рынке доступен для широкого применения препарат тримебутина под торговым названием Необутин®, который хорошо зарекомендовал себя в реальной клинической практике, доказал терапевтическую эффективность и высокую безопасность. Эффективность данного препарата показана в ряде российских клинических исследований, причем было выявлено [20], что эффект наступает уже после первого его приема. Через 20 мин после приема 200 мг тримебутина (Необутин®) все пациенты отмечали улучшение (уменьшение выраженности боли по 10-балльной шкале): полное исчезновение боли отметил 21 пациент (87,5%), существенное уменьшение боли - 3 пациента (12,5%). У 2 больных через 20 мин интенсивность болевого синдрома снизилась с 6 до 1 балла, а у 1 пациента - с 7 до 2 баллов. Через полчаса после приема 200 мг препарата Необутин® больные отметили полное исчезновение абдоминальной боли. Таким образом, применение препарата Необутин®позволяет купировать болевой синдром у больных СРК в течение 20 мин. В другом российском исследовании, включавшем 60 больных с различными вариантами СРК, улучшение состояния после приема первой таблетки препарата отметили 75% участников. Лечение препаратом Необутин® в суточной дозе 600 мг в сутки курсом 30 дней сопровождалось выраженной терапевтической эффективностью в отношении основного симптома патологии: абдоминального болевого синдрома. Полное купирование боли отметили 30% участников, уменьшение ее интенсивности - 40%. Кроме этого, больные отмечали исчезновение метеоризма в 47% случаев и урчания в животе - в 50%. В этой работе показана также высокая безопасность препарата Необутин®: слабовыраженные побочные эффекты выявлены у 5 больных (8,3%), серьезных побочных явлений не наблюдали [21].
Несмотря на быстрый эффект препарата Необутин® в отношении абдоминального болевого синдрома, для полного и стойкого купирования клинических симптомов необходим курсовой прием до 30 дней, поскольку для нормализации нарушенной моторики ЖКТ недостаточно нескольких дней приема. Для предупреждения рецидивов рекомендуется прием препарата Необутин® курсом до 12 нед., пролонгация курса лечения до 3 мес. приводит к большему клиническому эффекту в отношении болевого абдоминального синдрома [18]. В связи с этим оптимальной формой для курсового лечения больных СРК является Необутин® Ретард (300 мг) с пролонгированным действием, преимуществом которого является 2-кратный суточный прием, что повышает приверженность больных к лечению.
Применение спазмолитических препаратов в качестве монотерапии СРК приводит к эффективному купированию симптомов не более чем в 30% случаев [2], поэтому непрерывно происходит поиск новых терапевтических возможностей и схем для более эффективного лечения этой категории пациентов.
Роль коррекции нарушений баланса кишечной микрофлоры при СРК
В последние годы все больше работ посвящено изучению дисфункции взаимодействия между нормальной микрофлорой толстой кишки и слизистой оболочкой кишечника у больных СРК. Известно, что микрофлора оказывает значительное местное влияние на состояние моторики ЖКТ и нарушение баланса микроорганизмов приводит к снижению порога чувствительности миоцитов, стимуляции выработки холецистокинина и других биологически активных веществ, активации иммунной системы в слизистой оболочке [22]. Изменения в микробиоте толстой кишки могут привести к избыточному размножению газообразующих микроорганизмов и/или микроорганизмов, участвующих в деконъюгации желчных кислот, а это, в свою очередь, приводит к нарушению водно-электролитного обмена в толстой кишке [23] и формированию клинических симптомов СРК.
Представители облигатной микрофлоры кишечника вырабатывают большое количество различных биологически активных веществ, регулирующих моторику ЖКТ: медиаторы (гистамин, серотонин, циклические АМФ и др.), токсины и пептиды, бактериальные метаболиты желчных кислот, короткоцепочечные жирные кислоты (КЦЖК) и др. Проведенные в последнее время исследования также показали, что микробная флора участвует в формировании висцеральной гиперчувствительности у пациентов СРК.
Роль нарушений микробиоты в формировании СРК подтверждается растущим количеством доказательств возникновения данной патологии после приступа острого гастроэнтерита, который сопровождается воспалением, индуцированным инфекционными агентами [24]. У ряда больных СРК коррекция избыточного бактериального роста в тонкой кишке (СИБР) сопровождается выраженным снижением симптоматики, что также свидетельствует о вкладе микробных аномалий в симптомы СРК [25].
Большое количество исследований по изучению эффективности коррекции нарушенной микрофлоры ЖКТ в лечении СРК позволило накопить данные, свидетельствующие о том, что использование пробиотических штаммов (живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина) может быть полезным для контроля клинических симптомов СРК [26, 27]. Эксперты Всемирной гастроэнтерологической организации (ВГО), участвовавшие в разработке глобальных клинических рекомендаций по применению пробиотических и пребиотических средств при заболеваниях гастроэнтерологического профиля, подчеркивают возможность применения пробиотиков у больных СРК с целью снижения выраженности абдоминальной боли, вздутия, распирания, улучшения качества жизни. Российские клинические рекомендации по диагностике и лечению синдрома раздраженного кишечника у взрослых 2017 г. также включают использование пробиотиков для коррекции нарушения микрофлоры кишечника с целью купирования клинических симптомов [2].
Наряду с этим, по-прежнему требуются разъяснения необходимости четкого определения выбора бактериальных штаммов, дозировки и жизнеспособности используемых пробиотических организмов. В качестве штаммов, доказавших эффективность при СРК, ВГО указывает на Lactobacillus plantarum, Lactobacillus rhamnosus, L. acidophilus, Enterococcus faecium [28]. При выборе препарата необходимо учитывать также современные требования к пребиотическим средствам, среди которых: соответствие штаммового состава задачам восстановления нормальной иерархической структуры доминирования видов (т. е. наличие в составе бифидо-и лактобактерий), способность оставаться жизнеспособными при прохождении через ЖКТ (доставка в кишечнорастворимой капсуле), безопасность при применении у человека (штамм должен быть зарегистрирован в международном депозитарии штаммов согласно номенклатуре), количество микроорганизмов не менее миллиарда (109) бактериальных клеток в капсуле или таблетке на момент продажи, стабильность при хранении в обычных условиях, клинически доказанная польза для здоровья (ВГО).
В одном из британских исследований была показана эффективность LAB4, мультиштаммового пробиотика, в воздействии на симптомы СРК [29]. В двойном слепом рандомизированном плацебо-контролируемом исследовании приняли участие 52 больных с СРК (отбор по критериям Римских критериев II). Участники были рандомизированы для получения пробиотического препарата, содержащего два штамма Lactobacillus acidophilus CUL60 (NCIMB 30157) и CUL21 (NCIMB 30156), Bifidobacterium lactis CUL34 (NCIMB 30172) и Bifidobacterium bifidum CUL20 (NCIMB 30153) с общим количеством 2,5 x 1010 КОЕ в капсуле или плацебо в течение 8 нед. Сравнение эффективности пробиотика с плацебо через 6 нед. показало значительную разницу в баллах по шкале тяжести симптомов в пользу пробиотика (P = 0,0347; разница между группами: -47,82; 95% ДИ: от -92,18 до -3,4) и через 8 нед. (P = 0,0217; разница между группами: -52,73; 95% ДИ: от -97,67 до -7,78), но через 2 нед. после окончания лечения не было обнаружено значительных различий между группами пробиотика и плацебо (рис. 1).
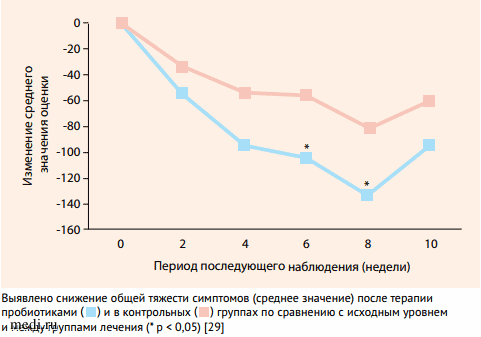 Рисунок 1. Влияние полиштаммового пробиотика LAB4 на выраженность тяжести симптомов у больных СРК. Выявлено снижение общей тяжести симптомов (среднее значение) после терапии пробиотиками и в контрольных группах по сравнению с исходным уровнем и между группами лечения (*p <0,05)
Рисунок 1. Влияние полиштаммового пробиотика LAB4 на выраженность тяжести симптомов у больных СРК. Выявлено снижение общей тяжести симптомов (среднее значение) после терапии пробиотиками и в контрольных группах по сравнению с исходным уровнем и между группами лечения (*p <0,05)
Figure 1. Effect of LAB4 multistrain probiotic on the symptom severity in patients with IBS. Mean decrease in the overall symptom severity score was also detected after probiotic therapy in the control groups as compared to the baseline and between the treatment groups (*p <0.05)
Выявлено снижение общей тяжести симптомов (среднее значение) после терапии пробиотиками и в контрольных группах по сравнению с исходным уровнем и между группами лечения (* p < 0,05) [29]
На протяжении всего исследования для всех оцениваемых симптомов в группе больных, принимавших полиштаммовый пробиотик, было зарегистрировано более выраженное улучшение, чем в группе плацебо (рис. 2).
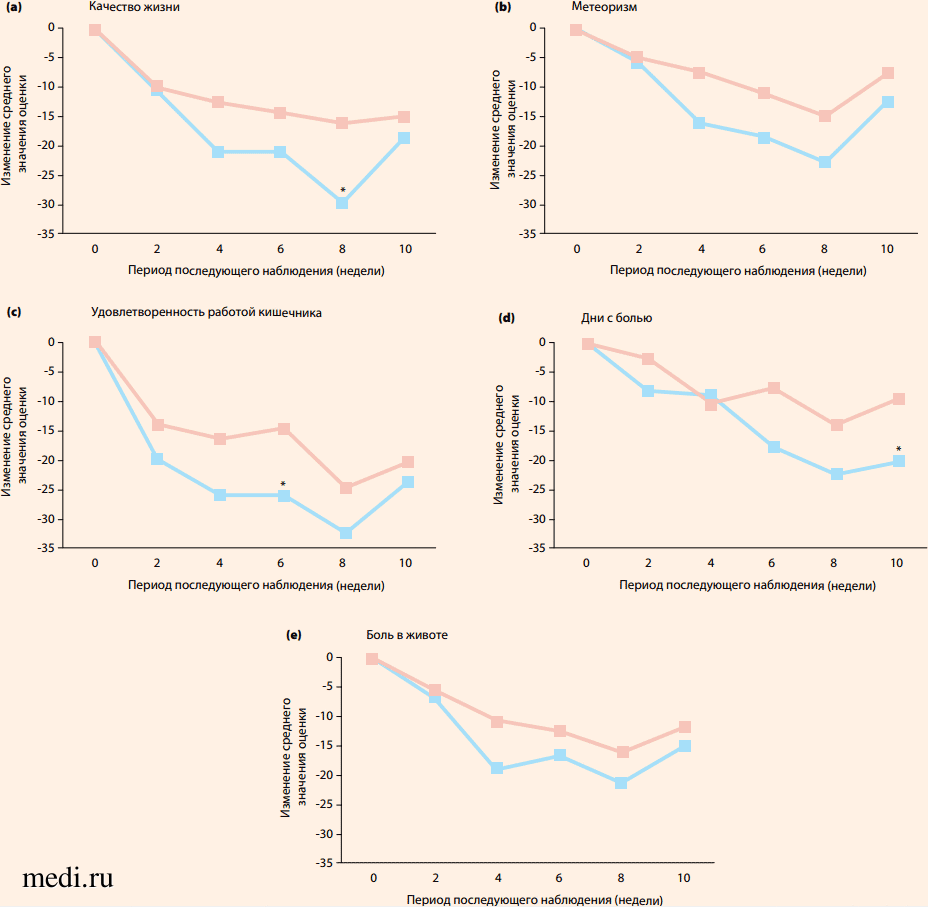 Рисунок 2. Изменение (среднее значение) показателей в баллах для (а) качества жизни, (б) вздутия живота, (в) удовлетворенности работой кишечника, (г) дней с болью и (д) боли в животе в течение 10-недельного исследования (* p < 0,05)
Рисунок 2. Изменение (среднее значение) показателей в баллах для (а) качества жизни, (б) вздутия живота, (в) удовлетворенности работой кишечника, (г) дней с болью и (д) боли в животе в течение 10-недельного исследования (* p < 0,05)
Figure 2. Mean change in scores for (a) quality of life, (b) abdominal bloating, (c) satisfaction with bowel habits, (d) days with pain, and (e) abdominal pain during the 10-week study (*p <0.05)
Значительные улучшения качества жизни (рис. 2a) были зарегистрированы у тех, кто получал пробиотик, в конце периода приема препарата (p = 0,0068; разница между группами: -13,58; 95% ДИ: от -23,38 до -3,78 на 8-й нед.), и это было связано со значительным улучшением удовлетворенности работой кишечника (рис. 2c) у испытуемых в группе пробиотика по сравнению с группой плацебо через 6 нед. (p = 0,0422; разница между группами: -11,05; 95% ДИ: от -21,70 до -0,39). Количество зарегистрированных дней с болью (рис.2d) было значительно ниже в группе пробиотика на 10-й нед., чем в группе плацебо (p = 0,0448; разница между группами: -10,97; 95% ДИ: от -21,69 до -0,26) [29]
Таким образом, у добровольцев, получавших мультиштаммовый пробиотический комплекс в течение 8-недельного периода, наблюдалось статистически значимое улучшение показателей тяжести симптомов СРК и показателей качества жизни, уменьшение дней с болью и улучшение работы кишечника, чем в группе плацебо. Это подтверждает эффективность сочетания в комплексе нескольких штаммов, дополняющих положительное действие друг друга на функционирование ЖКТ.
Данные, опубликованные в систематическом обзоре, полученные на основании анализа более 20 РКИ, свидетельствуют о снижении выраженности симптомов и улучшении качества жизни больных СРК при применении пробиотиков, содержащих штаммы L. plantarum и B. Infantis [30].
На российском рынке доступна к использованию мультиштаммовая синбиотическая биологически активная добавка под торговым названием Максилак®, которая отвечает всем современным требованиям к пробиотическим средствам. Комплекс содержит 9 штаммов пробиотических бактерий, обладающих доказанным положительным эффектом на состояние слизистой ЖКТ в дозе, соответствующей требованиям ВГО. Необходимо отметить, что в состав Максилак® входят штаммы, рекомендованные ВГО (Lactobacillus plantarum, Lactobacillus rhamnosus, L. Acidophilus), а также штаммы, эффективность которых показана в вышеописанных исследованиях (Bifidobacterium bifidum, Bifidobacterium Infantis).
Максилак® создан с уникальной технологией защиты капсулы SFERA, что позволяет сохранить жизнеспособность всех входящих в ее состав бактериальных штаммов при прохождении через верхние отделы пищеварительного тракта. Инновационная технология капсулы позволяет без потери качественного и количественного состава пройти три агрессивных естественных барьера, а именно: кислую среду желудка, соли желчных кислот и пищеварительные ферменты, а оболочка из коллоидных полисахаридов защищает содержимое от воздействия влаги и высоких температур.
Преимуществом Максилак® является то, что этот комплекс является синбиотиком, т. к., помимо бактериальных пробиотических штаммов, содержит пребиотик, фруктоолигосахариды, которые стимулируют быстрое размножение бифидобактерий, уменьшают количество токсинов в кишечнике, нормализуют моторную функцию ЖКТ, принимают участие в регуляции липидного и жирового обмена, стимулируют синтез витаминов группы В. Режим дозирования Максилак® - 1 капсула в день курсом до 30 дней.
Заключение
Таким образом, комбинированное применение регулятора моторики Необутин® с доказанной высокой эффективностью и синбиотика Максилак®, содержащего штаммы, показавшие свою эффективность при СРК, дает возможность существенно повысить эффективность лечения этой категории пациентов, воздействуя комплексно на патогенетические звенья нарушений моторики и висцеральной чувствительности. Нормализация моторики на всем протяжении пищеварительного тракта способствует стабильности баланса кишечной микробиоты, а коррекция нарушенного состава микрофлоры, в свою очередь, снижает висцеральную гиперсенситивность и регулирует перистальтику ЖКТ. Такое лечение не только быстро и эффективно купирует клинические симптомы, но и снижает риск развития рецидива, тем самым существенно повышая качество жизни больных СРК.
Информация об авторе:
Голованова Елена Владимировна, д.м.н., профессор кафедры поликлинической терапии, Московский государственный медикостоматологический университет имени А.И. Евдокимова; 127473, Россия, Москва, ул. Делегатская, д. 20, стр. 1
Information about the author:
Elena V. Golovanova, Dr. of Sci. (Med.), Professor of Department of Polyclinic Therapy, Yevdokimov Moscow State University of Medicine and Dentistry; 20, Bldg. 1, Delegatskaya St., Moscow, 127473, Russia
Список литературы
1. Drossman D.A., Hasler W.L. Rome IV-Functional GI Disorders: Disorders of Gut-Brain Interaction. Gastroenterology. 2016;150(6):1257-1261.
2. Ивашкин В.Т., Шелыгин Ю.А., Баранская Е.К., Белоусова ЕА., Бениашвили А.Г, Васильев С.В. и др. Клинические рекомендации Российской гастроэнтерологической ассоциации и Ассоциации колопроктологов России по диагностике и лечению синдрома раздраженного кишечника. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2017;27(5):76-93.
3. Dhawan B.N., Cesselin F., Raghubir R., Reisine T., Bradley P.B., Portoghese P.S., Hamon M. International Union of Pharmacology. XII. Classification of opioid receptors. Pharmacol Rev. 1996;48(4):567-592.
4. Janecka A., Fichna J., Janecki T. Opioid receptors and their ligands. Curr Top Med Chem. 2004;4(1):1-17.
5. Waldhoer M., Bartlett S.E., Whistler J.L. Opioid receptors. Annu Rev Biochem. 2004;73:953-990.
6. Schatzberg A.F., Charles B. Nemeroff. The American Psychiatric Publishing Textbook of Psychopharmacology. The American Psychiatric Publishing; 2009. 1648 р.
7. Katzung B.G. Basic & clinical pharmacology. 10th ed. McGraw-Hill Medical; 2007. 1200 р.
8. Poynard T., Naveau S., Mory B., Chaput J.C. Metaanalysis of smooth muscle relaxants in the treatment of irritable bowel syndrome. Aliment Pharmacol Ther. 1994;8(5):499-510.
9. Poynard T., Regimbeau C., Benhamou Y Metaanalysis of smooth muscle relaxants in the treatment of irritable bowel syndrome. Aliment Pharmacol Ther. 2001;15(3):355-361.
10. Ruepert L., Quartero A.O., de Wit NJ.,van der Heijden GJ., Rubin G., Muris J.W. Bulking agents, antispasmodics and antidepressants for the treatment of irritable bowel syndrome. Cochrane Database Syst Rev. 2011;(8):CD003460.
11. Martinez-Vazquez M.A., Vazquez-Elizondo G., Gonzalez-Gonzalez J.A., Gutierrez-Udave R., Maldonado-Garza HJ., Bosques-Padilla FJ. Effect of antispasmodic agents, alone or in combination, in the treatment of Irritable Bowel Syndrome: systematic review and meta-analysis. Rev Gastroenterol Mex. 2012;77(2):82-90.
12. Delvaux M., Wingate D. Trimebutine: mechanism of action, effects on gastrointestinal function and clinical results. J Int Med Res. 1997;25(5):225-246.
13. Phillips B., Ball C., Sackett D., Badenoch D., Straus S., Haynes B., Dawes M., Howick J. Oxford Centre for Evidence-Based Medicine-levels of evidence (March 2009). 2009.
14. Schang J.-C., Devroede S.G., Pilote М. Effects of trimebutine on colonic function in patients with chronic idiopathic constipation: evidence for the need of a physiologic rather than clinical selection. Dis Colon Rectum. 1993;36(4): 330-336. /
15. Zhong Y.Q., Zhu J., Guo J.N., Yan R., Li HJ., Lin Y.H., Zeng Z.Y A randomized and case-control clinical study on trimebutine maleate in treating functional dyspepsia coexisting with diarrhea-dominant irritable bowel syndrome. Zhonghua Nei Ke Za Zhi. 2007;46(11):899-902.
16. Luttecke K. A trial of trimebutine in spastic colon. J Int Med Res. 1978;6(2):86-88.
17. Schaffstein W., Panijel M., Luttecke K. Comparative safety and efficacy of trimebutine versus mebeverine in the treatment of irritable bowel syndrome. A multicenter double-blind study. Current Therapeutic Research, Clinical and Experimental. 1990;47(1):136-1345.
18. Маев И.В., Самсонов А.А., Семенова А.В., Кузнецова Е.И., Андреев Д.Н., Лобанова Е.Г. Опыт применения тримебутина малеата в режиме пролонгированной монотерапии у пациентов с синдромом раздраженного кишечника. Consilium Medicum. 2018;20(8):74-79.
19. Минушкин О.Н., Елизаветина ГА., Ардатская М.Д. и др. Тримебутин при синдроме раздраженного кишечника. Consilium Medicum. 2011;(8):46-51.
20. Трухан Д.И., Гришечкина И.А., Быховцев НА. Тримебутин в лечении синдрома раздраженного кишечника и других функциональных гастроинтестинальных расстройств. Медицинский совет. 2016;(19):82-86.
21. Минушкин ОН., Топчий ТБ., Чеботарева А.М., Баркалова Л.В., Серебренникова ЕЯ. Лечение СРК в свете Римских критериев - IV. Результаты клинического наблюдения эффективности применения препарата Необутин у пациентов с абдоминальной болью при СРК. Эффективная фармакотерапия. Гастроэнтерология. 2018;(1):34-35.
22. Quigley E.M. Probiotics in irritable bowel syndrome: an immunomodulatory strategy? J Am Coll Nutr. 2007;26:684-690.
23. Агафонова Н.А. Механизмы формирования моторных нарушений при функциональных заболеваниях желудочно-кишечного тракта. От патогенеза к лечению. Доктор.ру. 2015;1;2(103):55-58.
24. Dupont A.W. Post-infectious irritable bowel syndrome. Curr Gastroenterol Rep. 2007;9(5):378-384.
25. Pimentel M. Do antibiotics influence IBS?. Am J Gastroenterol. 2002;97(10):2681.
26. FAO/WHO. Health and Nutritional Properties of Probiotics in Food Including Powder Milk with Live LacticAcid Bacteria. Food and Agriculture Organization of the United Nations and World Health Organization; 2001.
27. Quigley E., Flourie B. Probiotics and irritable bowel syndrome: a rationale for their use and an assessment of the evidence to date. Neurogastroenterol Motil. 2007;19(3):166-172.
28. Guarner F., Sanders M.E., Eliakim R., Fedorak R., Gangl A., Garisch J. et al. Probiotics and prebiotics. World Gastroenterology Organisation Global Guidelines. 2017.
29. Williams EA., Stimpson J., Wang D., Plummer S., Garaiova I., Barker M.E., Corfe M. Clinical trial: a multistrain probiotic preparation significantlyreduces symptoms of irritable bowel syndrome in a double-blindplacebo-controlled study & B. Aliment Pharmacol Ther. 2009;29(1):97-103.
30. Sniffen J.C., McFarland L.V., Evans C.T., Goldstein EJ.C. Choosing an appropriate probiotic product for your patient: An evidencebased practical guide. PLoS ONE. 2018;13(12):e0209205.
References
1. Drossman D.A., Hasler W.L. Rome IV-Functional GI Disorders: Disorders of GutBrain Interaction. Gastroenterology. 2016;150(6):1257-1261.
2. Ivashkin V.T., Shelygin YuA., Baranskaya Y.K., Belousova YA., Beniashvili A.G., Vasilyev S.V. et al. Diagnosis and treatment of the irritable bowel syndrome: clinical guidelines of the Russian gastroenterological association and Russian association of coloproctology. Rossiyskiy zhurnal gastroehnterologii, gepatologii, koloproktologii = Russian Journal of Gastroenterology, Hepatology, Coloproctology. 2017;27(5):76-93. (In Russ.)
3. Dhawan B.N., Cesselin F., Raghubir R., Reisine T., Bradley P.B., Portoghese P.S., Hamon M. International Union of Pharmacology. XII. Classification of opioid receptors. Pharmacol Rev. 1996;48(4):567-592.
4. Janecka A., Fichna J., Janecki T. Opioid receptors and their ligands. Curr Top Med Chem. 2004;4(1):1-17.
5. Waldhoer M., Bartlett S.E., Whistler J.L. Opioid receptors. Annu Rev Biochem. 2004;73:953-990.
6. Schatzberg A.F., Charles B. Nemeroff. The American Psychiatric Publishing Textbook of Psychopharmacology. The American Psychiatric Publishing; 2009. 1648 p.
7. Katzung B.G. Basic & clinical pharmacology. 10th ed. McGraw-Hill Medical; 2007. 1200 p.
8. Poynard T., Naveau S., Mory B., Chaput J.C. Metaanalysis of smooth muscle relaxants in the treatment of irritable bowel syndrome. Aliment Pharmacol Ther. 1994;8(5):499-510.
9. Poynard T., Regimbeau C., Benhamou Y. Metaanalysis of smooth muscle relaxants in the treatment of irritable bowel syndrome. Aliment Pharmacol Ther. 2001;15(3):355-361.
10. Ruepert L., Quartero A.O., de Wit NJ., van der Heijden GJ., Rubin G., Muris J.W. Bulking agents, antispasmodics and antidepressants for the treatment of irritable bowel syndrome. Cochrane Database Syst Rev. 2011;(8):CD003460.
11. Martinez-Vazquez M.A., Vazquez-Elizondo G., Gonzalez-Gonzalez J.A., Gutierrez-Udave R., Maldonado-Garza HJ., Bosques-Padilla FJ. Effect of antispasmodic agents, alone or in combination, in the treatment of Irritable Bowel Syndrome: systematic review and meta-analysis. Rev Gastroenterol Mex. 2012;77(2):82-90.
12. Delvaux M., Wingate D. Trimebutine: mechanism of action, effects on gastrointestinal function and clinical results. J Int Med Res. 1997;25(5):225-246.
13. Phillips B., Ball C., Sackett D., Badenoch D., Straus S., Haynes B., Dawes M., Howick J. Oxford Centre for Evidence-Based Medicine-levels of evidence (March 2009). 2009.
14. Schang J.-C., Devroede S.G., Pilote М. Effects of trimebutine on colonic function in patients with chronic idiopathic constipation: evidence for the need of a physiologic rather than clinical selection. Dis Colon Rectum. 1993;36(4): 330-336.
15. Zhong Y.Q., Zhu J., Guo J.N., Yan R., Li HJ., Lin Y.H., Zeng Z.Y A randomized and case-control clinical study on trimebutine maleate in treating functional dyspepsia coexisting with diarrhea-dominant irritable bowel syndrome. Zhonghua Nei Ke Za Zhi. 2007;46(11):899-902.
16. Luttecke K. A trial of trimebutine in spastic colon. J Int Med Res. 1978;6(2): 86-88.
17. Schaffstein W., Panijel M., Luttecke K. Comparative safety and efficacy of trimebutine versus mebeverine in the treatment of irritable bowel syndrome. A multicenter double-blind study. Current Therapeutic Research, Clinical and Experimental. 1990;47(1):136-1345
18. Mayev I.V., Samsonov A.A., Semenova A.V., Kuznetsova E.I., Andreyev D.N., Lobanova E.G. Experience in trimebutine maleate use in a prolonged monotherapy regimen in patients with irritable bowel syndrome. Consilium Medicum. 2018;20(8):74-79. (In Russ.)
19. Минушкин О.Н., Елизаветина ГА., Ардатская МД. и др. Тримебутин при синдроме раздраженного кишечника. Consilium Medicum. 2011;(8):46-51. (In Russ.)
20. Trukhan D.I., Grishechkina I.A., Bykhovtsev N.A. Trimebutin in the treatment of irritable bowel syndrome and other functional gastrointestinal disorders. Meditsinskiy sovet = Medical Council. 2016;(19):82-86. (In Russ.)
21. Минушкин О.Н., Топчий Т.Б., Чеботарева А.М., Баркалова Л.В., Серебренникова Е.Я. Лечение СРК в свете Римских критериев - IV. Результаты клинического наблюдения эффективности применения препарата Необутин у пациентов с абдоминальной болью при СРК. Ehffektivnaya farmakoterapiya. Gastroehnterologiya = Эффективная фармакотерапия. Гастроэнтерология. 2018;(1):34-35. (In Russ.)
22. Quigley E.M. Probiotics in irritable bowel syndrome: an immunomodulatory strategy? J Am Coll Nutr. 2007;26:684-690.
23. Agafonova N.A Mechanisms underlying motility problems in functional gastrointestinal disorders: from pathogenesis to treatment. Doctor.Ru. 2015;1;2(103): 55-58. (In Russ.)
24. Dupont A.W. Post-infectious irritable bowel syndrome. Curr Gastroenterol Rep. 2007;9(5):378-384.
25. Pimentel M. Do antibiotics influence IBS?. Am J Gastroenterol. 2002;97(10):2681.
26. Hotel, Amerian. (2001). Health and Nutritional Properties of Probiotics in Food Including Powder Milk with Live Lactic Acid Bacteria - Joint FAO/WHO Expert Consultation; 2014.
27. Quigley E., Flourie B. Probiotics and irritable bowel syndrome: a rationale for their use and an assessment of the evidence to date. Neurogastroenterol Motil. 2007;19(3):166-172.
28. Guarner F., Sanders M.E., Eliakim R., Fedorak R., Gangl A., Garisch J. et al. Probiotics and prebiotics. World Gastroenterology Organisation Global Guidelines. 2017.
29. Williams E.A., Stimpson J., Wang D., Plummer S., Garaiova I., Barker M.E., Corfe M. Clinical trial: a multistrain probiotic preparation significantlyreduces symptoms of irritable bowel syndrome in a doubleblindplacebo-controlled study & B. Aliment Pharmacol Ther. 2009;29(1):97-103.
30. Sniffen J.C., McFarland L.V., Evans C.T., Goldstein E.J.C. Choosing an appropriate probiotic product for your patient: An evidencebased practical guide. PLoS ONE. 2018;13(12):e0209205.
