Влияние L-карнитина на образование радикалов кислорода фагоцитами крови пациентов с постинфарктным кардиосклерозом
Статьи
Опубликовано в: Кардиоваскулярная терапия и профилактика, 2016; 15(5)
Асташкин Е. И., Глезер М. Г., Орехова Н. С., Грачев С. В., Киселева А. Е.
ФГБОУ ВО “Первый Московский государственный медицинский университет им. И. М. Сеченова” Минздрава России. Москва, Россия
Цель. Изучить влияние L-карнитина на образование радикалов кислорода фагоцитами крови пациентов с постинфарктным кардиосклерозом.
Материал и методы. Образование радикалов кислорода регистрировали по люцигенин-зависимой хемилюминисценции на люминометре “Биотокс-7” (Россия) у 15 пациентов с постинфарктным кардиосклерозом. Оценивали “базальную” и стимулированную форболовым эфиром (РМА) хемилюминисценцию, а также ингибиторную активность L-карнитина.
Результаты. В образцах цельной крови больных, перенесших инфаркт миокарда, была зарегистрирована спонтанная хемилюминисценция, что свидетельствует о наличии в крови предактивированных (праймированных”) фагоцитов. В ответ на добавление РМА (1 мкМ), после латентного периода времени (96±15 сек), наблюдалось значимое увеличение образования радикалов кислорода. L-карнитин (3 мм), добавленный после РМА снижал амплитуду максимального ответа на РМА 18±3%. L-карнитин (30 мМ) выраженным образом подавлял спонтанное образование радикалов кислорода. На фоне действия L-карнитина (30 мМ) при добавлении РМА (1 мкМ) наблюдалось увеличение латентного периода времени в 1,9 раза, а также снижение скорости генерации радикалов кислорода и уменьшение амплитуды максимального ответа на этот агент в 2,3 раза.
Заключение. L-карнитин снижает спонтанное и индуцированное РМА образование радикалов кислорода предактивированными фагоцитами крови пациентов с постинфарктным кардиосклерозом. Эти данные свидетельствуют об антиокислительной активности высоких концентраций L-карнитина и его способности дозозависимым образом снижать системный окислительный стресс у этой группы пациентов.
Ключевые слова: постинфарктный кардиосклероз, фагоциты крови, активные формы кислорода, L-карнитин, форболовый эфир.
Influence of L-carnitine on reactive oxygen species production by blood phagocytes in postinfarction cardiosclerosis patients
Astashkin E. I., Gleser M. G., Orekhova N. S., Grachev S. V., Kiseleva A. E.
I.M. Sechenov First Moscow State Medical University of the Ministry of Health, Moscow, Russia
Aim. To study the influence of L-carnitine on reactive oxygen species production by phagocytes in blood of patients with postinfarction cardiosclerosis.
Material and methods. Peroxide species formation was registered via lucigenine-dependent chemiluminescence by luminometer “Biotox-7” (Russia) in 15 patients with postinfarction cardiosclerosis. We studied the baseline and stimulated by forbole ether (PMA) chemiluminescence, and inhibitory activity of L-carnitine.
Results. In whole blood samples of the patients after myocardial infarction there was spontaneous chemiluminescence registered, that witness on the pre-activated (primed) phagocytes presence in blood. The response to addition of PMA (1mcM), after latent time period (96±15 s), was as the significant increase of active oxygen species formation. L-carnitine (3 mM), added after PMA, decreased the amplitude of maximum response to PMA by 18±3%. L-carnitine (30 mM) seriously suppressed the spontaneous formation of oxygen species formation. At the background of L-carnitine action (30 mM) with addition of PMA (1 mcM) there was increase of latent time by 1,9 times, and decrease of oxygen reactive species generation with the decrease of amplitude of maximum response on this agent, by 2,3 times.
Conclusion. L-carnitine does decrease spontaneous and induced by PMA reactive oxygen species production by pre-activated (primed) phagocytes of blood of post infarction cardiosclerosis patients. This data points on antioxidant activity of higher L-carnitine concentrations and on its ability to decrease systemic oxydative stress in dose-dependent manner for the studied kind of patients.
Key words: postinfarction cardiosclerosis, blood phagocytes, active oxygen species, L-carnitine, phorbol ether.
НАДФН — никотинамид аденин динуклеотид фосфат восстановленный, РКС — протеинкиназа С, РМА — форболовый эфир (форбол-12-миристат-13-ацетат), L-Car — L-карнитин (у-триметиламино Р-гидроксибутировая кислота), О2-• — супероксид анион радикал.
Введение
Окислительный стресс характеризуется увеличением уровня радикалов кислорода либо в результате их образования, либо вследствие снижения активности антиокислительной защитной системы. Этот процесс играет важную роль в патогенезе практически всех видов сердечно-сосудистых заболеваний, связанных с ишемией [1]. В этих условиях основными источниками радикалов кислорода в сердце являются митохондрии кардиомиоцитов и фагоциты крови, инфильтрирующие пораженный участок, в котором произошло нарушение кровоснабжения [2]. Рост уровня радикалов кислорода выше некоторого критического значения сопровождается нарушением структуры всех видов макромолекул, включая белки, липиды (прежде всего липидные компоненты мембран), углеводы и дезоксирибонуклеиновую кислоту. Все это приводит к нарушению функциональной активности миокарда и, как следствие, к ишемии различных органов и тканей, возникновению системного воспаления, при котором, наряду с секрецией провоспалительных цитокинов, протеолитических ферментов, катионных белков и других биологически высоко активных соединений, генерируются в большом количестве радикалы кислорода, формируются патологические циклы [3]. Важную роль в этих процессах играют клетки крови, специализирующиеся на образовании и секреции радикалов кислорода — моноциты и нейтрофилы. Последний вид клеток количественно преобладает в крови. Нейтрофилы первыми реагируют на повреждения и некроз клеток сердца. Эти клетки фиксируются на поверхности эндотелия, а затем выходят из микрососуда и в результате хемотаксиса попадают в пораженную область сердца, где в процессе “дыхательного взрыва” образуют большое количество радикалов кислорода, которые в асептических условиях разрушают видоизмененные и/или погибшие клетки, что способствует их эффективному фагоцитозу [4]. Неадекватная активность фагоцитов сопровождается гибелью нормальных окружающих клеток, и увеличивает зону поражения сердца при ишемии/реперфузии. L-карнитин (L-Саг) (у-триметиламиноргидроксибутировая кислота) играет важную роль в энергетическом обмене в кислород-зависимых клетках, включая кардиомиоциты [5]. L-Car участвует в переносе длинноцепочечных жирных кислот в матрикс митохондрий [6], окисление которых является основным источником энергии, используемой для синтеза аденозинтрифосфата в процессе окислительного фосфорилирования в физиологических условиях [7]. Однако было показано, что помимо этих процессов L-карнитин влияет на окислительный стресс и функциональную активность сердца после ишемии/реперфузии [8].
Целью работы было изучить влияние L-карнитина на спонтанное и индуцированное стандартным агентом образование радикалов кислорода фагоцитами крови пациентов с постинфарктным кардиосклерозом.
Материал и методы
Исследование проведено у 15 пациентов (8 женщин и 7 мужчин, средний возраст 68±7 лет) с постинфарктным кардиосклерозом и признаками сердечной недостаточности II-III функционального класса, которые проходили лечение в условиях кардиологического отделения московской ГКБ № 59. Все пациенты, в соответствии с рекомендациями по ведению больных, получали ингибиторы ангиотензинпревращающего фермента, ß-адреноблокаторы, петлевые диуретики, 8 пациентам были назначены антагонисты альдостерона. В исследование включали пациентов в стабильном состоянии при отсутствии изменений в состоянии или терапии в течение 7 сут., предшествующих исследованию, подписавших информированное согласие на проведение терапии и взятие крови для анализов.
В работе использовали L-карнитин (Элькар для внутривенного и внутримышечного введения 100 мг/мл, компания ПИК-ФАРМА, Россия) и следующие реактивы: люцигенин, форболовый эфир (форбол-12-миристат-13-ацетат; РМА), диметилсульфоксид, среду RPMI-1640, эмбриональную сыворотку телят фирмы Sigma. Периферическую кровь пациентов забирали из локтевой вены в пластиковые пробирки, содержание гепарина (30 МЕ/мл).
Измерение активных форм кислорода. К пробам крови (объемом 50-100 мкл) добавляли люцигенин (конечная концентрация 30 мкМ). Спонтанное и индуцированное стандартным стимулятором образование радикалов кислорода регистрировали на хемилюминометре “Биотокс”-7 (Россия). Измерения проводили при 25о С. Образование супероксид анионов (О2-•) регистрировали в непрерывном режиме, и выражали в количестве импульсов в сек, а также оценивали по интегральным значениям хемилюминесценции (светосумма за 10 мин). При построении графиков использовали усредненные значения, определенные в четырех-шести измерениях.
Статистический обсчет результатов проводили с помощью программы SigmaPlot.
Результаты
На рисунке 1 показана типичная картина образования радикалов кислорода фагоцитами крови пациентов. Первоначально наблюдалось “спонтанное” увеличение генерации радикалов кислорода, уровень которых с течением времени (10-15 мин) достигал стационарных значений и выходил на плато (рисунок 1). Высказано предположение, что в основе такого “спонтанного” образования радикалов кислорода фагоцитами крови пациентов, по-видимому, лежит стимуляция исходно предактивированных клеток в результате их взаимодействия со стенкой кюветы, поскольку только клетки, подвергшиеся перестройке и переходу из состояния покоя в состояние активации метаболизма (праймирования) способны отвечать на последующую стимуляцию выраженным образованием радикалов кислорода. Чтобы проверить данное предположение к пробам крови добавляли стандартный стимулятор — РМА, жирорастворимый агент, который проникает через плазматическую мембрану и активирует различные изоформы фермента протеинкиназы С (РКС) [9]. Этот фермент осуществляет фосфорилирование различных белковых компонентов никотинамид аденин динуклеотид фосфат восстановленного (НАДФН)-оксидазного ферментативного комплекса, что сопровождается его активацией [10].
Рис. 1 Влияние последовательных добавок РМА и L-карнитина на образование О2-• фагоцитами крови пациентов.

Примечание: по оси ординат — количество имп/с, 1 — РМА (1 мкМ), 2 — L-карнитин (3 мМ).
Особенностью действия РМА является наличие латентного периода времени, который наблюдается от момента добавления до начала генерации радикалов кислорода (рисунок 1). Очевидно, этот период складывается из времени транспорта РМА через мембрану и стимуляции компонентов НАДФН-оксидазы под влиянием РКС. Величина такого латентного периода в представленных опытах составляла 96±22 сек (n=5) (рисунок 2).
Рис. 2 Изменение латентного периода времени (Lag периода), который проходит с момента добавления одного РМА (1 мкМ) или сначала L-карнитина (30 мМ), а затем РМА (1 мкМ) до начала генерации радикалов кислорода.
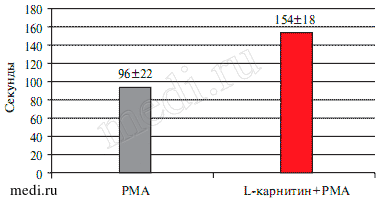
Примечание: один РМА; L-карнитин + РМА — на фоне действия L-карнитина (30 мМ) добавили РМА (1 мкМ). По оси ординат — секунды.
В результате воздействия РМА (1 мкМ) происходит резкое усиление образования радикалов кислорода. Амплитуда такого ответа на РМА в максимуме составляла 4534±507 имп/сек (п=6) (рисунок 3). Эти данные еще раз подтверждают наличие в крови этих пациентов предактивированных фагоцитов, поскольку переход из состояния покоя в состояние стимуляции, минуя стадию предактивации, невозможен. L-карнитин (3 мМ), добавленный после РМА на максимуме его действия, достоверно снижал уровень радикалов кислорода (рисунок 1). На рисунке 2 показаны результаты статистической обработки этих результатов. Среднее значение уровня радикалов кислорода на максимуме ответа на РМА после воздействия L-карнитина уменьшалось с 4534±507 имп/сек (100%) до 3718±225 (до 82±6%) (п=8) (р<0,05). В опытах, когда L-карнитин (30 мМ) добавляли на плато “спонтанного” образования радикалов кислорода, было зарегистрировано достоверное снижение их уровня на 82±7% от исходного (рисунок 4). L-карнитин увеличивал продолжительность латентного периода времени при действии РМА в 1,9 раза (рисунок 4), снижал скорость образования радикалов кислорода и уменьшал амплитуду ответа на РМА с 4534 имп/с (100%) до 2000 имп/с (до 44±7%) (рисунок 5).
Рис. 3 Влияние РМА и L-карнитина, добавленного после РМА, на стационарный уровень радикалов кислорода.
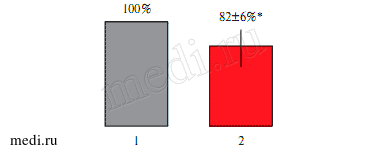
Примечание: 1 — РМА (1 мкМ) в максимуме образования радикалов кислорода, 2 — L-карнитин (3 мМ) после РМА (1 мкМ) (п=5; * — р<0,05).
Рис. 4 Влияние L-карнитина и РМА на стационарный уровень радикалов кислорода в образцах крови пациентов.
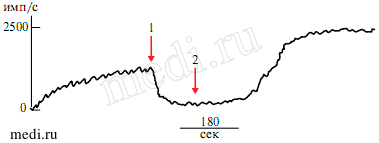
Примечание: по оси ординат — количество имп/с, 1 — L-карнитин (30 мМ), 2 — РМА (1 мкМ).
Рис. 5 L-карнитин снижает амплитуду образования радикалов кислорода, индуцированную РМА.
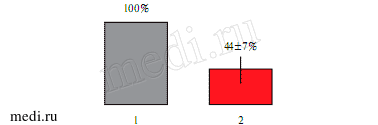
Примечание: 1 — один РМА (1 мкМ), 2 — РМА (1 мкМ), добавленный после L-карнитина (30 мМ) (n=5; * — р<0,05).
Обсуждение
В многочисленных работах было установлено, что L-Car оказывает защитное влияние на повреждения, вызываемые радикалами кислорода при ишемии-реперфузии и окислительном стрессе [11, 12]. Такие цитопротективные эффекты карнитина носят сложный характер и развиваются на разных уровнях клеточной организации. В экспериментальных исследованиях установлено, что L-Car и его производные являются прямыми антиокислителями, и удаляют уже образовавшиеся радикалы кислорода [13-15]. Помимо этого, L-Car связывает двухвалентные катионы с переменной валентностью (Fe2+ и Cu2+) как в растворах, так и в составе активных групп ферментов, продуцирующих радикалы кислорода, включая мембранные комплексы НАДФН-оксидаз, а также I и III ферментативные комплексы внутренней мембраны митохондрий [12-14, 16-18], т.е. оказывает опосредованное антиокислительное действие. В 2015г было показано, что L-Car является хелатным комплексоном, связывающим ионы Са2+ [19], которые необходимы для развития “дыхательного взрыва” в фагоцитах крови, инфильтрирующих сердце и коронарные сосуды в условиях ишемии и реперфузии. Особенностью L-Car является то, что он нейтрализует активные формы кислорода не только внутри, но и снаружи клеток [17]. В связи с этим становится ясно, что механизмы защитных эффектов отличаются и зависят от концентрации L-Car и продолжительности его действия на клетки.
В настоящей работе изучено влияние высоких концентраций L-Car на образование радикалов кислорода фагоцитами в пробах цельной крови пациентов с постинфарктным кардиосклерозом, т.е. в условиях, частично сохраняющих взаимодействие и влияние других клеток крови, а также регуляторных цитокинов на фагоциты [20]. Установлено, что даже в таких экстремальных ситуациях L-Car подавляет активацию изначально праймированных фагоцитов крови и дозозависимым образом снижает уровень радикалов кислорода, индуцированный одним из наиболее сильных стимуляторов — РМА. Известно, что мишенью действия РМА являются различные изоформы РКС, как Са2+-зависимые, так и Са2+-независимые [9, 10]. Возможно, что одной из причин снижения уровня радикалов L-карнитином на фоне действия РМА, а не полного подавления их образования, лежит сохранение активности Са2+-независимых РКС, которые фосфорилируют цитоплазматические компоненты НАДФН-оксидазного комплекса, и тем самым активируют этот фермент. Следует отметить, что при использовании высоких концентраций L-Car, когда могут быть задействованы его разные цитопротективные механизмы, снижение уровня радикалов кислорода наблюдается уже в первые минуты воздействия, т.е. в условиях острого окислительного стресса.
Заключение
L-карнитин (Элькар для внутривенного и внутримышечного введения 100 мг/мл, компания ПИК-ФАРМА, Россия) дозозависимым образом снижает образование радикалов кислорода предактивированными (праймированными) фагоцитами крови у пациентов с постинфарктным кардиосклерозом. Полученные результаты свидетельствуют об антиокислительной активности высоких концентраций L-карнитина и его способности снижать системный окислительный стресс у этой группы пациентов.
Литература
1. Zweier JL, Talukder MAH. The role of oxidants and free radicals in reperfusion injury. Cardiovasc Res 2006; 70: 181-90.
2. Clempus RE, Griendling KK. Reactive oxygen species signaling in vascular smooth muscle cells. Cardiovasc Res 2006; 71: 216-25.
3. Santos CXC, Anilkumar N, Zhang M, et al. Redox signaling in cardiac myocytes. Free Radic Biol Med 2011; 50(7): 777-93.
4. Vinten-Johansen J. Involvement of neutrophils in the pathogenesis of lethal myocardial reperfusion injury. Cardiovasc Res 2004; 61: 481-97.
5. Astashkin EI, Glezer MG. Pharmacological regulation of energy substrates metabolism in cardiomyocytes in pathological conditions associated with ischemia. Cardiovascular Therapy and Prevention 2006; 5(2): 112-23. Russian (Асташкин Е. И., Глезер М. Г. Фармакологическая регуляция обмена энергетических субстратов в кардиомиоцитах при патологических состояниях, связанных с ишемией. Кардиоваскулярная терапия и профилактика 2006; 5(2): 112-23).
6. Palmieri F. Diseases caused by defects of mitochondrial carriers: a review. Biochem Biophys Acta 2008; 1777: 564-78.
7. Astashkin EI, Glezer MG. The role of L-carnitine in energy metabolism of cardiomyocytes and treatment of the cardiovascular system diseases. Cardiology and Cardiovascular Surgery 2012; 6(2): 58-65. Russian (Асташкин Е.И., Глезер М. Г Роль L-карнитина в энергетическом обмене кардиомиоцитов и лечении заболеваний сердечно-сосудистой системы. Кардиология и сердечно-сосудистая хирургия 2012; 6(2): 58-65).
8. Lee BJ, Lin JS, Lin YC, et al. Effects of L-carnitine supplementation on oxidative stress and antioxidant enzymes activities in patients with coronary artery disease: a randomized, placebo-controlled trial. Nutr J 2014; 13: 79. doi: 10.1186/1475-2891-13-79.
9. Gray RD, Lucas CD, Mackellar A, et al. Activation of conventional protein kinase C (PKC) is critical in the generation of human neutrophil extracellular traps. J Inflamm (Lond) 2013; 10(1): 12. doi: 10.1186/1476-9255-10-12.
10. Yamasaki T, Takahashi A, Pan J, et al. Phosphorylation of Activation Transcription Factor-2 at Serine 121 by Protein Kinase C Controls c-Jun-mediated Activation of Transcription. J Biol Chem 2009; 284(13): 8567-81.
11. Surai PF. Antioxidant action of carnitine: molecular mechanisms and practical applications EC. Veterinary Science 2015; 2(1): 66-84.
12. Astashkin EI, Glezer MG. Effect of L-carnitine supplementation on oxidative stress in cardiovascular diseases. Medical Council 2016; 10: 94-100. Russian (Асташкин Е. И., Глезер М. Г. Влияние L-карнитина на оксидативный стресс при сердечно-сосудистых заболеваниях. Медицинский Совет 2016; 10: 94-100).
13. Reznick AZ, Kagan VE, Ramsey R, et al. Antiradical effects in L-propionyl carnitine protection of the heart against ischemia-reperfusion injury: The possible role of iron chelation. Arch Biochem Biophys 1992; 296(2): 394-401.
14. Gülcin I. Antioxidant and antiradical activities of L-carnitine. Life Sci 2006; 78(8): 803-11.
15. Solarska K, Lewinska A, Karowicz-Bilinska A, Bartosz Gr. The antioxidant properties of carnitine in vitro. Cell Mol Biol Lett 2010; 15(1): 90-7.
16. Anderson EJ, Kypson AP, Rodriguez E, et al. Substrate-specific derangements in mitochondrial metabolism and redox balance in the atrium of the type 2 diabetic human heart. JACC 2009; 54(20): 1891-8.
17. Kolodziejczyk J, Saluk-Juszczak J, Wachowicz B. L-carnitine protects plasma components against oxidative alterations. Nutrition 2011; 27(6): 693-9.
18. Vanella A, Russo A, Acquaviva R, et al. L-Propionyl-carnitine as superoxide scavenger, antioxidant, and DNA cleavage protector. Cell Biol Toxicol 2000; 16(2): 99-104.
19. Banihani AA, Bayachou M, Alzoubi K. L-carnitine is a calcium chelator: a reason for its useful and toxic effects in biological systems. J Basic Physiol Pharmacol 2015; 26(2): 141-5.
20. Saluk-Juszczak J, Olas B, Wachowicz B, et al. L-carnitine modulates blood platelet oxidative stress. Cell Biol Toxicol 2010; 26(4): 355-65.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
 pikfarma.ru
pikfarma.ru
 pikfarma.ru
pikfarma.ru
