Уважаемый посетитель!
Эта информация для специалистов здравоохранения
Нажимая «ПРОДОЛЖИТЬ», Вы подтверждаете, что им являетесь
 pikfarma.ru
pikfarma.ru
Элькар® - метаболическое средство пациентов с хронической ишемией мозга и патологией сердца / постинфекционной астенией, далее...
Лечение постинфекционной астении и постковидного синдрома
Роль L-карнитина в энергетическом обмене кардиомиоцитов и лечении заболеваний сердечно-сосудистой системы
СтатьиОпубликовано в: Кардиология и сердечно-сосудистая хирургия, 2016 №6 С 58-65
Д.б.н., проф. Е.И. Асташкин, д.м.н., проф. М.Г. Глезер
ГБОУ ВПО Первый МГМУ им. И.М. Сеченова Минздрава России
Ключевые слова: L-карнитин, митохондрии, энергетический обмен сердца, сердечно-сосудистые заболевания.
The role of L-carnitine in the energetic metabolism of cardiomyocytes and treatment of cardio-vascular diseases
E.I. Astashkin, M.G. Glezer
Key words: L-carnitine, mitochondria, cardiac metabolism, cardio-vascular diseases.
Энергетический обмен в кардиомиоцитах в физиологических и патологических условиях
Для обеспечения сократимости и выживаемости кардиомиоцитов в условиях ишемии/реперфузии необходим достаточный синтез аденозинтрифосфорной кислоты (АТФ). В физиологических условиях в состоянии покоя молекулы АТФ в сердце образуются в результате окисления энергетических субстратов, главным образом длинноцепочечных жирных кислот (ДЦ-ЖК), вклад которых в образование АТФ составляет около 70—80%, а также глюкозы и лактата [37], пирувата, аминокислот и кетоновых тел. Основной путь энергетического обмена связан с Р-окислением ЖК в митохондриях (МХ), а вспомогательный путь представлен гликолизом с последующим окислением в МХ пирувата. Ограничивающими скорость этапами в окислении энергетических субстратов являются два самых медленно функционирующих фермента в последовательной цепи ферментативных реакций: митохондриальная пируватдегидрогеназа (PDH) для глюкозы и карнитинпальмитоилтрансфераза-1 (СРТ-1) — для ДЦ-ЖК. L-карнитин играет важную роль в энергетическом обмене сердца, так как участвует в транспорте ацильных остатков ЖК с помощью системы «карнитинового челнока» (см. рисунок). В его состав входят СРТ-1, расположенная на внешней мембране МХ, карнитинацилкарнитинтранслоказа (САСТ), локализованная во внутренней мембране МХ, которая обменивает карнитин МХ и ацилкарнитины цитоплазмы, и СРТ2, находящаяся в матриксе МХ [37]. Поскольку активированные ДЦ-ЖК в виде ацил-КоА растворимы в воде, а не в липидах, то они не способны проникнуть через внутреннюю мембрану МХ. В связи с этим СРТ-1 катализирует перенос ацильного остатка ЖК с КоА на L-карнитин, в результате образуется эфир — ацилкарнитин [35], который и транспортируется с помощью молекул переносчиков — САСТ — через внутреннюю мембрану МХ в обмен на свободный карнитин матрикса, который переносится из МХ в цитоплазму.
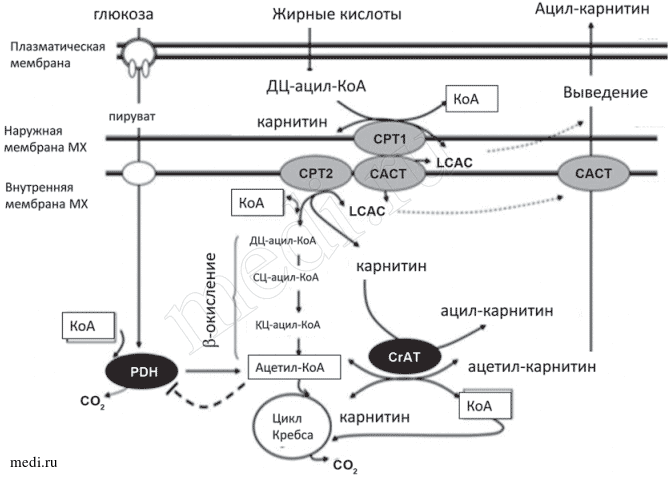
Участие L-карнитина, карнитинового челнока и карнитинацилтранcферазы (CrАT) в регуляции энергетического обмена в митохондриях и выведении токсичных ацилкарнитинов из клеток (по [41]).
В матриксе МХ ДЦ-ацилкарнитин (LСАС) подвергается воздействию СРТ2 и превращается в ацил-КоА. Последний вступает в цикл Р-окисления ЖК, в ходе которого укорачивается его ацильный "хвост" до длины среднецепочечных ацил-КоА (СЦ-ацил-КоА) и затем короткоцепочечных (КЦ-ацил-КоА), с образованием в каждом витке окисления одного ацетил-КоА. Когда поступление ацил-КоА превосходит его потребление в цикле Р-окисления, ацил-КоА вновь превращается в ацилкарнитины, которые удаляются из МХ в цитоплазму, а затем из клеток — в кровь. Этот процесс предупреждает накопление ацил-КоА в цитоплазме и тормозит развитие липотоксического эффекта.
Карнитинацилтрансферазы различаются по длине переносимых ацильных групп. Так, СРТ переносит жирнокислотные остатки с длиной цепи больше 12 атомов углерода; карнитиноктоноилтрансфераза (СОТ) — соответственно С5—С12 ацилы; карнитинацетилтрансфераза (СrАТ) — С2—С5 ацилы. СrАТ — матриксный фермент, который предпочтительно образует эфиры короткоцепочечных ЖК (КЦ-ЖК) с L-карнитином. Особая роль этого фермента в регуляции метаболизма в МХ связана со снижением отношения ацетил-КоА/свободный КоА в результате переноса ацетильных остатков на карнитин и увеличением уровня свободного КоА (регенерации КоА), который используется PDH, а также ферментом цикла трикарбоновых кислот (цикла Кребса) — а-кетоглютаратдегидрогеназой. Необходимо отметить, что ограничение активности СrАТ возможно вследствие снижения внутримитохондриальной концентрации L-карнитина при повышенном удалении из клеток ДЦ-ацилкарнитинов [41, 56, 57] и соответственно при этом будет снижаться уровень свободного КоА.
Из ацетил-КоА, образовавшегося в МХ и выходящего в цитоплазму, синтезируется малонил-КоА, который снижает активность ключевого, самого медленного фермента в окислении липидов СРТ1 и тем самым тормозит транспорт ДЦ-ЖК в МХ и их окисление, уменьшая вклад ЖК в синтез АТФ [30, 35].
Таким образом, наряду с СРТ1, САСТ и СРТ2 L-карнитин контролирует скорость окисления ДЦ-ЖК, выступая в качестве специфического кофактора, облегчающего их перенос через внутреннюю мембрану МХ.
Следует отметить, что и при окислении продуктов метаболизма глюкозы в МХ, и при окислении ЖК образуется один и тот же продукт — ацетил-КоА, который, с одной стороны, по закону отрицательной обратной связи тормозит активность PDH, а с другой стороны, выходя в цитоплазму, превращается в ингибитор СРТ1 — малонил-КоА. Таким образом, ацетил-КоА, его транспорт в цитоплазму и образование малонил-КоА выступают в качестве универсального механизма, регулирующего скорости окисления основных энергетических субстратов.
Нарушение функциональной активности МХ играет ключевую роль при ряде патологических состояний, включая повреждения, вызываемые ишемией/реперфузией, наблюдающиеся при стенокардии, инфаркте миокарда (ИМ), сердечной недостаточности (СН), инсульте и сахарном диабете [9, 25].
При ишемии в результате недостатка кислорода тормозится образование АТФ, снижается сократительная активность сердца, возникает симпатикоадреналовый стресс, следствием которого является освобождение из адипоцитов больших количеств ДЦ-ЖК, поступающих из крови в кардиомиоциты. Избыточный уровень ацетил-КоА, образующегося в цикле Р-окисления ЖК, тормозит активность PDH, что затрудняет окисление пирувата в МХ и способствует его превращению в молочную кислоту. В результате развивается внутриклеточный ацидоз, нарушается ионный гомеостаз. Удаление избытка ацетил-КоА из МХ с помощью образования ацетилкарнитина и активации CrAT приводит к синтезу большого количества ингибитора CРТ1 — малонил-КоА, тормозящего окисление ДЦ-ЖК в МХ. Помимо этого, L-карнитин участвует в удалении избытка ДЦ-ЖК из МХ, а затем — из цитоплазмы, предупреждая их цитотоксический эффект. В связи с этим становится ясной важная защитная роль L-карнитина при ишемии. Таким образом, очевидно, что достаточно высокое содержание и обмен L-карнитина в организме играет важную роль в поддержании нормального функционирования клеток.
Обмен L-карнитина в организме человека
Содержание L-карнитина и его ацильных эфиров в организме зависит от следующих трех процессов:
— поступления с пищей и абсорбции в кишечнике;
— синтеза эндогенного L-карнитина и последующего его переноса в кровь, а затем транспорта в органы, где L-карнитин не образуется;
— реабсорбции из первичной мочи в почках, в которую L-карнитин секретируется через почечные канальцы.
Поступление L-карнитина в организм человека
L-карнитин поступает в организм человека из двух источников — с продуктами питания (экзогенный L-карнитин, всасывается в кишечнике) и в результате синтеза эндогенного L-карнитина в печени, почках и клетках мозга [12], которые, в отличие от сердца, содержат γ-бутиробетаингидроксилазу — последний фермент в цепи реакций синтеза L-карнитина. Основным источником L-карнитина являются мясные продукты, в основном красное мясо [72]. С пищей в организм человека карнитин попадает в количестве 2—12 мкмоль/сут/кг массы тела и только 1—2 мкмоль/сут/кг массы тела синтезируется эндогенно [71]. Биодоступность экзогенного L-карнитина составляет от 54 до 87% в зависимости от содержания в используемых продуктах. Неабсорбированный L-карнитин разрушается микроорганизмами в толстой кишке [46].
Биосинтез L-карнитина
Структурно L-карнитин является разветвленной аминокислотой. Синтез эндогенного L-карнитина происходит с использованием двух незаменимых аминокислот — метионина и лизина, а также широкого набора кофакторов: витамина С, ионов железа, пироксидина, ниацина и др. [71], недостаток которых сопровождается снижением образования L-карнитина. Наиболее существенное влияние оказывает витамин С, в отсутствие которого синтез L-карнитина не происходит [25, 55, 71].
Транспорт L-карнитина через плазматическую мембрану клеток
L-карнитин поступает в клетки, которые его не синтезируют (кардиомиоциты, скелетные миоциты и др.), из крови через плазматическую мембрану пассивно по градиенту концентрации L-карнитина и градиенту ионов Na+, без использования АТФ с помощью Na+-зависимых переносчиков (OCTN2) [63, 66]. В организме L-карнитин не подвергается катаболизму, а выделяется с мочой. В почках L-карнитин и его предшественник Y-бутиробетаин эффективно реабсобируются, что и поддерживает достаточно высокий уровень L-карнитина в крови [70]. Переносчик OCTN2 способен также транспортировать ацилкарнитины из цитоплазмы клеток в кровь [63, 66, 70].
Защитные эффекты L-карнитина при ишемии и реперфузии
Суммарно положительные эффекты экзогенного L-карнитина при ишемически/реперфузионном повреждении можно представить себе следующим образом:
— L-карнитин, способствуя увеличению образования малонил-КоА, тормозит транспорт избыточного количества ДЦ-ЖК в МХ и соответственно процесс ß-окисления ЖК [37];
— удаляет из МХ и клеток токсичные метаболиты ацил-КоА, главным образом КЦ-ацил-КоА [56];
— поддерживает в клетках баланс между ацил-КоА и свободным КоА (Vaz, Wanders, 2002), увеличивая содержание последнего, тем самым активирует PDH, соответственно снижая образование молочной кислоты [41, 56, 71];
— поддерживает соотношение между ацилкарнитинами (эфирная форма L-карнитина) и свободным L-карнитином [24, 56];
— обладая антиоксидантными свойствами, защищает клетки сердца от последствий оксидантного стресса, гипоксии и ишемии [76].
В связи с последним важно отметить, что L-карнитин подавляет дисфункцию МХ, возникающую при ишемии/ реперфузии и связанной с ней активацией мега-поры (надмолекулярной поры с транзиторной проницаемостью — mPTP), размер которой позволяет транспортироваться веществам с молекулярной массой 1500 Да. Переход mPTP в открытое состояние, когда проапоптозные митохондриальные белки выходят в цитоплазму и активируют ферментативный каскад каспаз, приводит к исчезновению градиентов ионов через внутреннюю мембрану МХ, торможению или полной остановке синтеза АТФ и гибели клеток по одному из двух механизмов — апоптозу или некрозу [1].
В ряде экспериментальных исследований показано, что L-карнитин снижал набухание МХ и деполяризацию внутренней мембраны МХ, индуцированных ДЦ-ЖК и пальмитоил-КоА [27], блокировал активацию mPTP, вызванную олеиновой кислотой, в результате усиления ее Р-окисления [42], тормозил открывание mPTP, благодаря снижению уровня радикалов кислорода, образующихся в МХ [77]. Установлено, что L-карнитин подавлял апоптоз, зависимый от МХ, как в условиях in vitro, так и in vivo [14, 44, 62]. Кроме того, благодаря усилению окисления ЖК, L-карнитин предупреждает образование церамида — одного из наиболее сильных индукторов апоптоза.
Таким образом, можно полагать, что эффекты L-карнитина на уровне МХ или целой клетки происходят вследствие ингибирования повреждения мембран МХ, что связано с улучшением энергетического обмена и блокадой утечки электронов в транспортной цепи МХ, уменьшением генерации радикалов кислорода.
L-карнитин в клинических исследованиях у пациентов с сердечно-сосудистыми заболеваниями
Стенокардия
Обычно антиангинальную и противоишемическую эффективность того или иного средства оценивают по снижению частоты приступов стенокардии или потребности в короткодействующих нитратах, а также по изменению толерантности к физической нагрузке, времени возникновения депрессий сегмента ST или возникновению болей при нагрузочных пробах. Возможна также оценка по изменению локальной сократимости при нагрузочной эхокардиографии (ЭхоКГ) или нарушению перфузии миокарда при нагрузочной сцинтиграфии [2]. Эффект L-карнитина (и его производных ацетил- или пропионилкарнитина) изучен и подтвержден в нескольких рандомизированных плацебо-контролируемых исследованиях, различающихся по структуре, длительности приема препарата и используемым дозировкам. Во всех исследованиях показано достоверное увеличение толерантности к физической нагрузке (в среднем на 14%), времени до возникновения депрессий ST при проведении нагрузочных проб (15—25%) и нагрузку до начала приступа стенокардии, уменьшении выраженности депрессии сегмента ST, оцененной на нагрузке, которая являлась максимальной до начала терапии и времени восстановления депрессий после нагрузки [5, 10, 11, 15, 16, 31—33].
Число пациентов, включенных в эти исследования, колебалось от 12 до 200, используемые дозы составляли от 900 мг до 3 г/сут, продолжительность лечения — от 1 до 6 мес. В ряде исследований показано достоверно большее, чем на фоне плацебо, снижение (вплоть до полного исчезновения) частоты приступов стенокардии [15, 16], потребности в других кардиоактивных препаратах. Лечение в течение 6 мес L-карнитином улучшало функцию сердца, при этом большее число пациентов достигали I функционального класса стенокардии [10].
Важно, что лечение L-карнитином в течение 30 дней в суточной дозе 3 г (16 пациентов со стабильной стенокардией) приводило, по данным ЭхоКГ, к улучшению параметров функции левого желудочка и меньшей распространенности проявлений ишемической дисфункции [11].
В одном сравнительном перекрестном исследовании, в котором у 46 пациентов оценивали эффективность приема в течение 6 нед 1,5 г пропионил-L-карнитина и дилтиазема (в течение 3 нед в дозе 180 мг и последующих 3 нед 360 мг). Оба типа терапии приводили к сопоставимому увеличению продолжительности нагрузки (582±35 с для пропионил-L-карнитина и 588±33 с для дилтиазема), времени до появления депрессии SТ (436±38 и 465±36 с соответственно) и к увеличению времени до появления депрессии сегмента SТ по сравнению с исходным (на 20 и 28% соответственно). В обоих случаях значимо уменьшалась степень депрессии SТ на максимуме нагрузки (на 23 и 35%; р<0,05). Дилтиазем в отличие от L-карнитина увеличивал время до появления нагрузочной стенокардии (в среднем на 22%). В то же время, по данным суточного мониторирования ЭКГ, противоишемический эффект был незначительно более выражен при использовании L-карнитина. В период исследования отмечено уменьшение частоты приступов стенокардии на 70 и 57%, в то же время потребность в приеме нитроглицерина снижалась на 57 и 70% соответственно при приеме пропионил-L-карнитина и дилтиазема. Следует отметить, что большее число пациентов предъявляли жалобы на сердцебиение при приеме дилтиазема, чем L-карнитина [6].
Важно подчеркнуть, что во всех исследованиях отмечают хорошую переносимость L-карнитина и малое число нежелательных проявлений, сравнимое с частотой нежелательных явлений, возникающих при приеме плацебо.
Следует отметить, что антиангинальный и противоишемический эффект L-карнитина не связан с изменением артериального давления, частоты сердечных сокращений [8, 15, 32] и обусловлен, по-видимому, лишь улучшением метаболизма миокарда и сохранением запасов АТФ в период ишемии. Следует, правда, отметить, что, по данным экспериментальных работ, пропионил-L-карнитин снижает общее периферическое сопротивление [13], а также предупреждает развитие вазоконстрикции [23, 54]. Однако у пациентов с ИБС пропионил-L-карнитин при внутривенном введении не изменяет системную или коронарную гемодинамику [7, 8].
Острый коронарный синдром
Рекомендации по лечению больных с острым коронарным синдромом предусматривают восстановление нарушенного коронарного кровотока в возможно наиболее ранние сроки заболевания. При этом борьба с ишемическим/реперфузионным повреждением миокарда играет важную роль в дальнейшей судьбе пациентов, и с этой целью предлагаются различные подходы (ишемическое пред- и посткондиционирование, назначение Р-адреноблокаторов, ингибиторов ангиотензинпревращающего фермента, антагонистов минералокортикоидных рецепторов, нитратов), в том числе воздействие на метаболизм миокарда с помощью глюкозо-инсулинокалиевой смеси [69], фосфокреатина [3, 18, 53, 64, 73], триметазидина у пациентов, которым не проводилась тромболитическая терапия [68]. Известно, что в период длительной ишемии уровень свободного и общего L-карнитина уменьшен в зоне ишемии и вокруг нее [61]. A. Rebuzzi и соавт. [47] показали, что введение L-карнитина в течение 8 ч после начала симптомов уменьшает распространенность ИМ. Доказательством того, что L-карнитин снижает объем пораженного миокарда при остром ИМ, могут служить данные, полученные в нескольких клинических исследованиях. Так, в плацебо-контролируемом рандомизированном исследовании введение L-карнитина (2 г/сут) к 28-му дню от начала заболевания (101 пациент) обеспечивало достоверно меньшие уровни креатинфосфокиназы (КФК), чем на фоне плацебо (95,5±23,6 и 116,2±26,2 Ме/л; p<0,01), фракции МВ КФК (58,6±16,6 и 73,3±21,5 Ме/л; p<0,01). Меньшим был и индекс QRS на ЭКГ, определенный как сумма зубцов Q и R в отведениях V1—V6 (7,4±1,2 с против 10,7±2,0 с; p<0,01) [60]. Аналогично в другом многоцентровом плацебо-контролируемом рандомизированном исследовании (351 пациент с ИМ) при введении L-карнитина в течение 48 ч, начатом в течение 8 ч от начала заболевания, снижение вольтажа зубца R оказалось на 15% меньше, чем на фоне плацебо [17]. Кроме того, в группе больных, леченных L-карнитином, меньшим было число эпизодов ишемии (17,6% против 36%; отношение шансов — ОШ 0,49 при 95% ДИ от 0,98 до 0,24) и число пациентов с СН III/IV функционального класса по классификации NYHA в сочетании с увеличением левого желудочка — 23,4% против 36% пациентов; ОШ —0,56 при 95% ДИ от 1,86 до 0,17) [17].
В двойном слепом плацебо-контролируемом исследовании CEDIM (The L-Carnitine Ecocardiografia Digitalizzata Infarto Miocardico, 472 пациента с первичным передним ИМ) [29] L-карнитин или плацебо вводили в течение 5 дней внутривенно в суточной дозе 9 г и затем давали в течение 12 мес внутрь в суточной дозе 6 г. В группе, получавшей L-карнитин, наблюдалось достоверное снижение объемов сердца, начиная с 3-го месяца терапии (конечный систолический объем 55,0±1,63 мл против 58,9± 1,75 мл; p=0,03 и конечный диастолический объем — 99,3±2,06 мл против 105,4±2,37 мл; p=0,01). Значимых различий по ФВ к 12-му месяцу лечения не наблюдалось (45,8±0,57% против 45,2±0,52%; p=0,46). В другом исследовании (160 пациентов после ИМ) показано, что прием L-карнитина в течение года по сравнению с плацебо приводил к более выраженному снижению систолического АД, улучшению функции левого желудочка и уменьшению частоты приступов стенокардии [21].
Данные по снижению смертности пациентов с ИМ разноречивы, что может быть обусловлено различными протоколами введения L-карнитина. Так, в исследовании CEDIM различий по смертности не получено [17], не было различий также по частоте смертельных исходов или случаев развития СН (6% против 9,6% в группе плацебо; различия недостоверны). В то же время отмечена хорошая переносимость препарата при длительном приеме и не было отмены препарата из-за побочных эффектов [29]. В других исследованиях [21] отмечено значительное уменьшение смертности (1,2% против 12,5%; p<0,005). Меньшим был комбинированный показатель смертности от заболеваний сердца + частота развития нефатального ИМ (15,6% против 26% в группе плацебо). Положительный эффект, возможно, обусловлен протективным эффектом в отношении некроза сердца и осложнений в течение первых 28 дней [60]. Хотя в рандомизированном двойном слепом плацебо-контролируемом исследовании CEDIM 2 (2330 пациентов с острым передним ИМ) L-карнитин вводили инфузионно в вену в дозе 9 г/сут в течение первых 5 дней и затем в течение 6 мес внутрь в дозе 4 г/сут, не выявлено существенного влияния на смертность и частоту развития СН (9,2% против 10,5% в группе плацебо; p=0,27). Однако одним из наиболее важных результатов этого исследования явилось значимое снижение ранней смертности после ИМ — на 5-е сутки острого периода снижение составило 39% (ОР 0,61 при 95% ДИ от 0,37 до 0,98; p=0,04) [67]. Отчасти снижение смертности в ранние сроки ИМ (2-е сутки) может быть обусловлено снижением у большего числа пациентов частоты возникновения желудочковых экстрасистол высоких градаций (IVa и IVb по Lown) при введении 5 г L-карнитина, чем у пациентов, получавших плацебо (р=0,028) [39]. Сходные данные получены в параллельном двойном слепом плацебо-контролируемом исследовании у 56 пациентов с ИМ, которым в течение 36 ч вводили L-карнитин в дозе 100 мг/кг каждые 12 ч в период от 5 до 12 ч от начала заболевания. В группе, получавших L-карнитин, эпизоды нарушений ритма уменьшались на 80% и достоверно сокращалось время регистрации мультиформных или парных экстрасистол [52]. Меньшее число нарушений ритма сердца в группе L-карнитина (13,7% против 28% на фоне плацебо) отмечено и в другом исследовании [60]. Антиаритмическую активность L-карнитина и усиление действия классических антиаритмических препаратов отмечали и у пациентов с хронической формой ИБС при мониторировании ЭКГ [40, 43]
Применение L-карнитина при операциях аортокоронарного шунтирования и чрескожной ангиопластики (АКШ и ЧКА)
В нескольких исследованиях оценено влияние добавления карнитина на пациентов, подвергнутых операции коронарной реваскуляризации. Так, 96 пациентов с ИМ без подъема SТ в течение 24 ч после проведения коронарной ангиопластики были рандомизированы на группу, в которой вводили L-карнитин в дозе 5 г/сут болюсом за 30 мин до ЧКА и в последующие 3 дня по 10 г/сут инфузионно, и группу контроля. В группе лечения меньшим (р<0,01) через 12 и 24 ч после хирургического вмешательства был максимальный уровень МВ-КФК и через 8 ч — уровень тропонина I. Многофакторный анализ показал, что терапия L-карнитином была независимым предиктором уменьшения уровня МВ-КФК (r=0,596; р<0,001) и тропонина I (r=0,633; р<0,001) [75].
Внутривенное введение пропионил-L-карнитина до операций аортокоронарного шунтирования значительно улучшало раннее послеоперационное восстановление у больных сахарным диабетом, что проявлялось увеличением сердечного индекса и снижением давления в легочной артерии [34]. Это позволило предположить, что карнитин может быть более эффективным в профилактике ишемического повреждения, чем в лечении последствий ИМ.
У пациентов, которым в отличие от группы плацебо проводилось экстракорпоральное кровообращение во время АКШ, назначение L-карнитина предупреждало развитие ишемических изменений и сохраняло в пределах нормы уровень лактата, пирувата, отношения сукцинат/ фумарат, отражающих гликолитический клеточный метаболизм [19].
Весьма интересные и важные данные получены у 27 пациентов с кардиогенным шоком. В открытом исследовании показано назначение L-карнитина в виде внутривенного болюса 4 г с последующей инфузией 6 г в период шока, обеспечив к 10-му дню 77,8% выживаемость, что существенно выше указываемых в литературе 25—30% [20].
Сердечная недостаточность
Возможность применения L-карнитина при СН обоснована результатами ряда экспериментальных [26, 36, 58, 59, 65, 74] и клинических исследований. Так, группа немецких исследователей [49] выявила уменьшение содержания L-карнитина в биоптатах из правого желудочка сердца и увеличение содержания в плазме крови у пациентов, которым была произведена трансплантация сердца в связи с терминальной стадией СН. По сравнению со здоровыми людьми отмечено значительное (57%) снижение общего карнитина в миокарде у пациентов с легкой, умеренной и тяжелой дилатационной кардиопатией (6,1±0,5 нмоль/мг неколлагенового белка против 9,9±0,8 нмоль/мг неколлагенового белка; р<0,0001), также как у пациентов с различной этиологией СН (6,6±1,1 нмоль/мг неколлагенового белка; р<0,02). Достоверно ниже была концентрация свободного карнитина в миокарде (4,6±0,4 нмоль/мг неколлагенового белка в группе пациентов с дилатационной кардиомиопатией), при СН различного генеза (4,4±0,5 нмоль/мг неколлагенового белка), чем в контроле (9,7±0,7 нмоль/мг неколлагенового белка; р<0,0001 и р<0,005 для обеих групп). Напротив, в плазме крови уровень свободного и общего карнитина у пациентов с СН был значительно выше, чем в группе контроля (67±5,5 мкмоль/л против 41±3,7 мкмоль/л; р<0,005). Снижение уровня общего карнитина и свободного карнитина показано и при менее тяжелых формах СН по сравнению с таковым у здоровых лиц (общий карнитин 5,7 9,7±0,7 нмоль/мг неколлагенового белка при 95% ДИ от 4,2 до 7,0 9,7±0,7 нмоль/ мг неколлагенового белка против 9,3 9,7±0,7 нмоль/мг неколлагенового белка при 95% ДИ от 7,6 до 12,0 9,7±0,7 нмоль/мг неколлагенового белка в контроле; р<0,005 и 4,29,7±0,7 нмоль/мг неколлагенового белка при 95% ДИ от 3,7 до 5,3 9,7±0,7 нмоль/мг неколлагенового белка против 10,39,7±0,7 нмоль/мг неколлагенового белка при 95% ДИ от 7,5 до 12,2 9,7±0,7 нмоль/мг неколлагенового белка в контроле; р<0,001). Это явилось основанием для предположения о том, что нарушение содержания L-карнитина в миокарде является неспецифическим маркером СН [48,50].
В большинстве клинических исследований показано улучшение сократимости и функционально-структурных характеристик сердца при СН. Данные по влиянию на выживаемость или неблагоприятные сердечно-сосудистые исходы неоднозначны. Так, в одноцентровом слепом рандомизированном плацебо-контролируемом исследовании у 30 пациентов с СН (ГГ—Ш ФК по классификации NYНА, средняя ФВ 29,5±7%) изучали эффект пропионил-L-карнитина при остром (внутривенное болюсное введение карнитина в дозе 30 мг/кг) и постоянном (1,5 мг/сут в течение 1 мес) введении. Болюсное введение L-карнитина достоверно (р<0,001) снижало давление в легочной артерии и давление заклинивания в легочных капиллярах. Постоянное введение увеличивало максимальное потребление кислорода на 45% (от 16,0±3 до 23,5±2 мл/кг/мин; p<0,001), время нагрузки на 21% (от 8,1 ±0,5 до 9,8± 0,4 мин; р<0,01), максимальную нагрузочную частоту сердечных сокращений на 12% (р<0,01). Эти изменения сопровождались снижением давления в легочной артерии (р<0,05) и маловыраженным, но достоверным (р<0,01) уменьшением полости левого желудочка. Эти изменения выявлялись уже через 2 нед от начала терапии, но дальнейшая динамика показателей с 15-го до 30-го дня отсутствовала [4].
Положительные эффекты получены и у пациентов с СН пожилого возраста (65—82 года) при добавлении к терапии L-карнитина в дозе 2 г/сут в течение 45 дней. В частности лучшими, чем в группе плацебо, были показатели частоты пульса, выраженности отеков, одышки, меньшей была необходимость приема сердечных гликозидов и диуретиков. При этом показано достоверное снижение уровня холестерина и триглицеридов в крови [28, 38]. В двойном слепом исследовании 60 пациентов (48— 73 года, с СН П—Ш ФК по классификации NYНА и ФВ <50%) получали пропионил-L-карнитин или плацебо по 500 мг 3 раза в день. Эффект проявлялся через 1 мес и становился более отчетливым через 90 и 180 дней от начала терапии. Так, длительность выполнения нагрузочного теста увеличивалась на 16,4, 22,9 и 25,9%, а ФВ — на 8,4, 11,6 и 13,6% соответственно через 30, 80 и 180 дней лечения [38]. Сходные данные получены в другом двойном слепом плацебо-контролируемом исследовании (50 пациентов 48—69 лет с легкой или умеренной СН), в котором пропионил-L-карнитин использовали в дозе 1 г 2 раза в день в течение 6 мес. Отмечено, что длительность максимальной нагрузки увеличилась на 11% через 90 дней и на 16,4% после 180 дней терапии. Через 30, 90 и 180 дней ФВ увеличивалась соответственно на 7,3, 10,7 и 12,1%, а системное сосудистое сопротивление уменьшалось на 14,9, 20 и 20,6%. В группе плацебо изменения не выявлены [45].
Однако в двух других исследованиях, несмотря на повышение толерантности к физической нагрузке, сердечного выброса при длительном лечении (до 3 лет), отмечали более высокие летальность и частоту госпитализаций [22, 51]. Таким образом, требуются дополнительные исследования для определения необходимости применения и оптимального режима терапии L-карнитином у пациентов с СН.
В то же время особый интерес представляет собой исследование, проведенное у пациентов с так называемой диастолической СН. В наблюдение были включены 29 пациентов с СН II ФК по классификации NYHA с диастолической дисфункцией и ФВ >45%, которые получали 1500 мг L-карнитина в течение 3 мес, и 31 пациент, получавший стандартную терапию [55]. По данным Эхо КГ, улучшение структурно-функционального состояния сердца происходило только в группе L-карнитина. Отмечено уменьшение размеров левого предсердия (с 3,6±0,4 до 3,4±0,5 см после лечения; p=0,01); времени изоволюмического расслабления (с 127±26 до 113±24 мс; p=0,007); скорости раннего пика E’ со стороны перегородки митрального кольца (с 0,064±0,01 до 0,074±0,01 м/с после лечения; p=0,01) и боковой стенки (0,082±0,01 м/с против 0,091±0,02 м/с; p=0,006). Под влиянием L-карнитина уменьшалась также выраженность клинической симптоматики, в частности одышка, которая является частой жалобой у пациентов с диастолической СН и частой причиной их госпитализаций.
В настоящее время в России зарегистрирован и производится отечественный лекарственный препарат L-карнитина (элькар, компания ПИК-ФАРМА) в форме для внутривенного/внутримышечного введения и для приема внутрь. Это дает возможность оценить его место в лечении пациентов с сердечно-сосудистой патологией в более широкой практике.
Литература
1. Асташкин Е.И., Глезер М.Г. Гибель клеток при ишемии/реперфузии сердца. Современные подходы к профилактике и лечению. М: Медиком 2012; 12.
2. Глезер М.Г., Киселева И.В., Новикова М.В., Шокина Т.В. Стабильная стенокардия. Пособие для врачей общей практики. М: Медиком 2010; 120.
3. Перепеч Н.Б., Недошивин О.А., Нестерова И.В. Неотон и тромболитическая терапия при инфаркте миокарда. Тер арх 2001; 9: 50—55.
4. Anand I., Chandrashekhan Y., De Giuli F. et al. Acute and chronic effects of propionyl-L-carnitine on the hemodynamics, exercise capacity, and hormones in patients with congestive heart failure. Cardiovasc Drugs Ther 1998; 12: 3: 291—299.
5. Arsenian M.A. Carnitine and its derivatives in cardiovascular disease. Prog Cardiovasc Dis 1997; 40: 3: 265—286.
6. Bartels G.L., Remme W.J., Holwerda K.J., Kruijssen D.A. Antiischaemic efficacy of L-propionylcarnitine — a promising novel metabolic approach to ischaemia? Eur Heart J 1996; 17: 3: 414— 420.
7. Bartels G.L., Remme W.J., Pillay M. et al. Acute improvement of cardiac pump function with intravenous L-propionylcarnitine in humans. J Cardiovasc Pharmacol 1992; 20: 1: 157—164.
8. Bartels G.L., Remme W.J., Pillay M. et al. Effects of L-propionylcamitine on ischemia-induced myocardial dysfunction in men with angina pectoris. Am J Cardiol 1994; 74: 2: 125—130.
9. Brass E.P Pivalate-generating prodrugs and carnitine homeostasis in man. Pharmacol Rev 2002; 54: 4: 589—598.
10. Cacciatore L., Cerio R., Ciarimboli M. et al. The therapeutic effect of L-carnitine in patients with exercise-induced stable angina: a controlled study. Drugs Exp Clin Res 1991; 17: 4: 225—235.
11. Canale C., Terrachini V., Biagini A. et al. Bicycle ergometer and echocardiographic study in healthy subjects and patients with angina pectoris after administration of L-carnitine: Semiautomatic computerized analysis of M-mode tracings. Int J Clin Pharmacol Ther Toxicol 1988; 26: 4: 221—224.
12. Cave M.C., Hurt R.T., Frazier T.H. et al. Obesity, inflammation, and the potential application of pharmaconutrition. Nutr Clin Pract 2008; 23: 1: 16—34.
13. Cevese A., Schena F., Cerutti G. Short-term hemodynamic effects of intravenous propionyl-L-carnitine in anesthetized dogs. Cardiovasc Drugs Ther 1991; 5: 45—56.
14. Chang B., Nishikawa M., Sato E. et al. L-Carnitine inhibits cisplatin-induced injury of the kidney and small intestine. Arch Biochem Biophys 2002; 405: 1: 55—64.
15. Cherchi A. Effects of L-carnitine on exercise tolerance in chronic stable angina: a multicenter, double-blind, randomized, placebo controlled crossover study. Int J Clin Pharmacol Ther Toxicol 1985; 23: 10: 569—572.
16. Cherchi A., Lai C., Onnis E. et al. Propionylcarnitine in stable effort angina. Cardiovasc Drugs Ther 1990; 4: 2: 481—486.
17. Chiariello M., Nrevetti G., Policicclio A. et al. L-Carnitine in acute myocardial infarction. A multicentre randomized trial. In: Clinical aspects of human carnitine deficiency. Ed. A. Borum. New York: Pergamon Press 1986; 242—243.
18. Cisowski M., Bochenek A., Kucewicz E. et al. The use of exogenous creatine phosphate for myocardial protection in patients undergoing coronary artery bypass surgery. J Cardiovasc Surg 1996; 37: 6: Suppl 1: 75—80.
19. Corbucci G.G., Menichetti A., Cogliatti A. et al. Metabolic aspects of acute tissue hypoxia during extracorporeal circulation and their modification induced by L-carnitine treatment. Int J Clin Pharmacol Res 1992; 12: 3: 149—157.
20. Corbucci G.G., Loche F L-carnitine in cardiogenic shock therapy: pharmacodynamic aspects and clinical data. Int J ClinPharmacol Res 1993; 13: 2: 87—91.
21. Davini P., Bigalli A., Lamanna F., Boem A. Controlled study on L-carnitine therapeutic efficacy in post infarction. Drug Exp Clin Res 1992; 18: 8: 355—365.
22. De Giuli F., Pasini E., Opasich C. et al. Effects of propionyl-L-carnitinein patients with heart failure. J Mol Cell Cardiol 1995; 27: 44.
23. Duncker D.J., Sassen L.M.A., Bartels G.L. et al. L-propionylcarnitine does not affect myocardial metabolic or functional response to chronotropic and inotropic stimulation following repetitive ischemia in anesthetized pigs. J Cardiovasc Pharmacol 1993; 22: 3: 488—498.
24. Ferrari R., Merli E., Cicchitelli G. et al. Therapeutic effecs of L-carnitine and propionyl-L-carnitine on cardiovascular disease: a review. Ann N Y Acad Sci 2004; 1033: 79—91.
25. Flanagan J.L., Simmons P.A., Vehige J. et al. Role of carnitine in disease. Nutr Metab 2010; 7: 30—43.
26. Folts J., Shug Al., Koke Jr., Bittar N. Protection of the ischemic dog myocardium with carnitine. Am J Cardiol 1978; 41: 7: 1209—1214.
27. Furuno T., Kanno T., Arita K. et al. Roles of long chain fatty acids and carnitine in mitochondrial membrane permeability transition. Biochem Pharmacol 2001; 62: 8: 1037—1046.
28. Ghidini O., Azzurro M., Vita G., Sartori G. Evaluation of the therapeutic effcacy of L-carnitine in congestive heart failure. Int J Clin Pharmacol Ther Toxicol 1988; 26: 4: 217—220.
29. Iliceto S., Scrutinio D., Bruzzi P et al. Effect of L-carnitine administration on left ventricular remodeling after acute anterior myocardial infarction: the L-Carnitine Ecocardiografia Digitalizzata Infarto Miocardico (CEDIM) trial. J Am Coll Cardiol 1995; 26: 2: 380—387.
30. Indiveri C., Iacobazzi V., Tonazzi A. et al. The mitochondrial carnitine/acylcarnitine carrier: Function, structure and physiopathology. Mol Aspects Med 2011; 32: 4—6: 223—233.
31. Iyer R.N., Khan A.A., Gupta A. et al. L-carnitine moderately improves the exercise tolerance in chronic stable angina. J Ass Phys India 2000; 48: 1: 1050—1052.
32. Kamikawa T., Suzuki Y., Kobayashi A. et al. Effects of L-carnitine on exercise tolerance in patients with stable angina pectoris. Jpn Heart J 1984; 25: 4: 587—597.
33. Lagioia R., Scrutinio D., Mangini S.G. et al. Propionyl-L-carnitine: a new compound in the metabolic approach to the treatment of effort angina. Int J Cardiol 1992; 34: 2: 167—172.
34. Lango R., Smolen’ski R.T., Rogowski J. et al. Propionyl-L-carnitine improves hemodynamics and metabolic markers of cardiac perfusion during coronary surgery in diabetic patients. Cardiovasc Drugs Ther 2005; 19: 4: 267—275.
35. Lee K., Kerner J., Hoppel Ch.L. Mitochondrial carnitinepalmitoyltransferase 1a (CPT1a) is part of an outer membrane fatty acid transfer complex. J Biol Chem 2011; 286: 29: 25655—25662.
36. Liedtke Aj., Nellis S.H. Effects of carnitine in ischemic and fatty acid supplemented swine heart. J Clin Invest 1979; 64: 2: 440—447.
37. Lopaschuk G.D., Ussher J.R., Folmes C.D.L. et al. Myocardial fatty acid metabolism in health and disease. Physiol Rev 2010; 90: 1: 207—258.
38. Mancini M., Rengo F., Lingetti M. et al. Controlled study on the therapeutic efficacy of propionyl-L-carnitinein patients with congestive heart failure. Arzneimittelforschung 1992; 42: 9: 1101—1104.
39. Martina B, Zuber M., Weiss P. et al. Anti-arrhythmia treatment using L-carnitine in acute myocardial infarct. Schweiz Med Wochenschr 1992; 122: 37: 1352—1355.
40. Mondillo S., Faglia S., D’Aprile N. et al. Therapy of arrhythmia induced by myocardial ischemia. Association of L-carnitine, propafenone and mexiletine Clin Ter 1995; 146: 12: 769—774.
41. Noland R.C., Koves T.R., Seiler S.E. et al. Carnitine insufficiency caused by aging and overnutrition compromises mitochondrial performance and metabolic control. J Biol Chem 2009; 284: 34: 22840—22852.
42. Oyanagi E., Yano H., Kato Y. et al. L-Carnitine suppresses oleic acid-induced membrane permeability transition of mitochondria. Cell Biochem Funct 2008; 26: 7: 778—786.
43. Palazzuoli V., Mondillo S., Faglia S. et al. The evaluation of antiarrhythmic activity of L-carnitine and propafenone in ischemic cardiomyopathy. Clin Ter 1993; 142: 2: 155—159.
44. Pillich R.T., Scarsella G., Risuleo G. Reduction of apoptosis through the mitochondrial pathway by the administration of acetyl-L-carnitine to mouse fibroblasts in culture. Exp Cell Res 2005; 306: 1: 1—8.
45. Pucciarelli G., Mastursi M., Latte S. et al. The clinical and hemodynamic effects of propionyl-L-carnitine in the treatment of congestive heart failure. Clin Ter 1992; 141: 11: 379—384.
46. Rebouche Ch.J. Kinetics, pharmacokinetics, and regulation of L-carnitine and acetyl-L-carnitinemetabolism. Ann N Y Acad Sci 2004; 1033: 1: 30—41.
47. Rebuzzi A.G., Schiavoni G., Amico C.M. et al. Beneficial effect of L-carnitine in the reduction of necrotic area in acute myocardial infarction. Drugs Exp Clin Res 1984; 10: 219—223.
48. Regitz V., Bossaller C., Strasser R. et al. Metabolic alterations in end-stage and less severe heart failure — myocardial carnitine decrease. J Clin Chem Clin Biochem 1990; 28: 9: 611—617.
49. Regitz V., Shug A.L., Fleck E. Defective myocardial carnitine metabolism in congestive heart failure secondary to dilated cardiomyopathy and to coronary, hypertensive and valvular heart diseases. Am J Cardiol 1990; 65: 11: 755—760.
50. Regitz V., Fleck E. Role ofcarnitine in heart failure. In: L-carnitine and Its Role in Medicine: From Function to Therapy. Eds. R. Ferrari, S. Di Mauro, G. Sherwood. New York: Academic Press 1992; 295—323.
51. Rizos I. Three-year survival ofpatients with heart failure caused by dilated cardiomyopathy and L-carnitine administration. Am Heart J 2000; 139: 2 Pt: 3: S120—S123.
52. Rizzon P., Biasco G., Di Biase M. et al. High doses of L-carnitine in acute myocardial infarction: metabolic and antiarrhythmic effects. Eur Heart J 1989; 10: 6: 502—508.
53. Ruda M.Ya., Samarenko M.B., Afonskaya N.I., Saks V.A. Reduction of ventricular arrhythmias by phosphocreatine (Neoton) in patients with acutemyocardial infarction. Am Heart J 1988; 116: 2: Pt 1: 393—397.
54. Sassen L.M.A., Bezstarosti K., Van der Giessen WJ. et al. L-propionylcarnitine increases postischemic blood flow but does not affect recovery of the energy charge. Am J Physiol 1991; 261: 1: Pt 2: H172—H180.
55. Serati A.R., Motamedi M.R., Emami S. et al. L-carnitine treatment in patients with mild diastolic heart failure is associated with improvement in diastolic function and symptoms. Cardiology 2010; 116: 3: 178—182.
56. Sharma Sh., Black St.M. Carnitine homeostasis, mitochondrial function, and cardiovascular disease. Drug Disc Today Dis Mech 2009; 6: 1—4: e31—e39.
57. Sharma Sh., Sud N, Wiseman D.A. et al. Altered carnitine homeostasis is associated with decreased mitochondrial function and altered nitric oxide signaling in lambs with pulmonary hypertension. Am J Physiol Lung Cell Mol Physiol 2008; 294: 1: L46—L56.
58. Shrago E., Shug Al., Sul H. et al. Control of energy production m myocardial ischemia. Circ Res 1976; 38: Suppl 1: 75—79.
59. Shug Al., Thomsen Jh., Folts Jd. et al. Changes in tissue levels of carnitine and other metabolites during myocardial ischemia and anoxia. Arch Biochem Biophys 1978; 187: 1: 25—33.
60. Singh R.B., Niaz M.A., Agarwal P. et al. A randomized, doubleblind, placebo controlled trial of L-carnitine in suspected myocardial infarction. Postgrad Med J 1996; 72: 843: 45—50.
61. Spagnoli L.G., Corsi M, Villaschi S. et al. Myocardial carnitine deficiency in acute myocardial infarction. Lancet 1982; 1: 8286: 1419—1420.
62. Sparagna G.C., Hickson-Bick D.L., Buja L.M., McMillin J.B. A metabolic role for mitochondria in palmitate-induced cardiac myocyte apoptosis. Am J Physiol Heart Circ Physiol 2000; 279: 5: 2124—2132.
63. Stanley C.A. Carnitine deficiency disorders in children. Ann N Y Acad Sci 2004; 1033: 42—51.
64. Steifa M, Zeman K, Groch L. et al. The effect of creatine phosphate (Neoton) in acute myocardial infarct (a prospective multicenter pilot study). Vnitr Lek 1993; 39: 2: 136—142.
65. Suzuki Y, Masumura Y, Kobayashi A. et al. Myocardial carnitinedeciency in chronic heart failure. Lancet 1982; 1: 8263: 116.
66. Tamai I., Ohashi R, Nezu J. et al. Molecular and functional identification of sodium ion-dependent, high affinity human carnitine transporter OCTN2. 1998; 273: 32: 20378—20382.
67. Tarantini G., Scrutinio D., Bruzzi P et al. Metabolic treatment with L-carnitine in acute anterior ST segment elevation myocardial infarction. A randomized controlled trial. Cardiology 2006; 106: 4: 215—223.
68. THE EMIP-FR GROUP Effect of 48-h intravenous trimetazidine on short- and long-term outcomes of patients with acute myocardial infarction, with and without thrombolytic therapy A double-blind, placebo-controlled, randomized trial. Eur Heart J 2000; 21: 18: 1537—1546.
69. van der Horst I.C., Zijlstra F., van’t Hof A.W.J. et al. Infarct Study Group: Glucose-insulin-potassium infusion in patients treated with primary angioplasty for acute myocardial infarction. The glucose-insulin-potassium study: a randomized trial. J Am Coll-Cardiol 2003; 42: 5: 784—791.
70. vanVlies N., Ferdinandusse S., Turkenburg M. et al. PPAR-alpha activation results in enhanced carnitine biosynthesis and OCTN2-mediated hepatic carnitin accumulation. Biochem Biophys Acta 2007; 1767: 9: 1134—1142.
71. Vaz F.M., Wanders R.J. Carnitine biosynthesis in mammals. Biochem J 2002; 361: Pt 3: 417—429.
72. Wall B.T., Stephens F.B., Constantin-Teodosiu D. et al. Chronic oral ingestion of L-carnitine and carbohydrate increases muscle carnitine content and alters muscle fuel metabolism during exercise in humans. J Physiol 2011; 589: 4: 963—973.
73. Weber P., Vlasicova Y., Labrova R., Semrad B. Use of creatine phosphate in treatment of cardio-cerebral syndrome associated with acute myocardial infarct in the aged. Cas Lek Cesk 1995; 134: 2: 53—56.
74. Wittels B., Spann J.F. Defective lipid metabolism in the failing heart. J Clin Invest 1968; 47: 1787—1794.
75. Xue Y.Z., Wang L.X., Liu H.Z. et al. L-carnitine as an adjunct therapy to percutaneous coronary intervention for non-ST elevation myocardial infarction. Cardiovasc Drugs Ther 2007; 21: 6: 445—448.
76. Ye J., Li J., Yu Y. et al. L-carnitine attenuates oxidant injury in HK-2 cells via ROS-mitochondria pathway. Regul Pept 2010; 161: 1—3: 58—66.
77. Zhu X., Sato E.F., Wang Y. et al. Acetyl-L-carnitine suppresses apoptosis of thioredoxin 2-deficient DT40 cells. Arch Biochem Biophys 2008; 478: 2: 154—160.

