Уважаемый посетитель!
Эта информация для специалистов здравоохранения
Нажимая «ПРОДОЛЖИТЬ», Вы подтверждаете, что им являетесь
 pikfarma.ru
pikfarma.ru
Элькар® - метаболическое средство пациентов с хронической ишемией мозга и патологией сердца / постинфекционной астенией, далее...
Лечение постинфекционной астении и постковидного синдрома
Можно ли улучшить результаты консервативного лечения пациентов с острым коронарным синдромом?
СтатьиМ.Г. Глезер, Е.И. Асташкин, А.Е. Киселева
ГБОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова, Москва, Россия
Опубликовано в журнале:
"Кардиология" 2016;56:9
Почти 60% пациентов с острым коронарным синдромом (ОКС) без подъема сегмента ST не подвергаются реваскуляризационным процедурам. В данном обзоре анализируются причины выбора консервативной тактики ведения пациентов с ОКС. Рассматриваются возможности улучшения исходов при использовании современных лекарственных препаратов. Особое внимание уделено препаратам, влияющим на энергетический обмен кардиомиоцитов в условиях ишемии и реперфузии, приводятся данные о влиянии L-карнитина на маркеры высокого риска и снижении частоты развития неблагоприятных исходов у пациентов с ОКС.
Ключевые слова: острый коронарный синдром, консервативная тактика, антиагреганты, антикоагулянты, метаболические цитопротекторы, L-карнитин, триметазидин.
Современная парадигма лечения пациентов с острым коронарным синдромом (ОКС) — скорейшее восстановление коронарного кровотока. Однако, как показывает международная и российская практика, многие из этих пациентов не получают реперфузионного лечения по объективным или субъективным причинам [1—4]. К объективным причинам выбора консервативной тактики ведения можно отнести случаи, когда польза от реваскуляризации весьма сомнительна или возможный риск превышает пользу данного типа лечения. К таким факторам могут быть отнесены случаи деменции, тяжелой хронической болезни почек или другой тяжелой сопутствующей патологии, далеко зашедшие стадии злокачественных новообразований при малой ожидаемой продолжительности жизни, высокий риск крупных кровотечений. Кроме того, это могут быть пациенты, у которых имеются технические сложности проведения чрескожного вмешательства, например, со стенозом ствола левой коронарной артерии или с выраженным кальцинозом коронарных артерий [5—8].
Следует отметить, что пациент может быть первоначально госпитализирован в стационар, который не имеет возможности проведения коронарографии. По данным московского регистра ОКС, в 2013 г. переведено из «неинвазивных стационаров» в «инвазивные» учреждения для вмешательства 4,5% пациентов с ОКС с подъемом сегмента ST и 3,5% пациентов c ОКС без подъема сегмента ST [1]. Хотя в последние годы ситуация в Москве изменилась, но по данным регистра РЕКОРД 3, частота переводов из «неинвазивных» в «инвазивные» центры в других регионах остается низкой и составляет 16% [2]. Частота применения консервативной тактики у пациентов с ОКС без подъема сегмента ST достигает 60% [4].
Довольно частой причиной может быть отказ пациента или его родственников от проведения коронарографии и стентирования. Среди других субъективных причин называют недооценку тяжести состояния больных с ОКС без подъема сегмента ST врачами. Так, по данным Канадского регистра ОКС, врачи не направляли пациентов на коронарографию, так как в 68,4% случаев не считали, что эти пациенты относятся к группе высокого риска, хотя 59,1% этих пациентов имели высокий или промежуточный риск по шкале TIMI [9]. Мало врачей на практике используют рекомендованные шкалы оценки риска. Так, по данным ALKK study, 59% врачей никогда не используют шкалу TIMI и 47% врачей — шкалу GRACE (данные получены в 103 клиниках Германии, из которых 97% — «инвазивные» стационары и 67% — имеющие отделения острой коронарной патологии) [10]. Это служит доказательством того, что необходимо проводить работу по увеличению информированности об ОКС как среди населения, так и среди врачей.
Пациенты, которым проводится консервативная терапия, нуждаются в качественной медикаментозной поддержке не меньше, а может быть, даже больше, чем пациенты, подвергающиеся реперфузионным вмешательствам. Наиболее яркие примеры касаются использования новых дезагрегантов и антикоагулянтов. По данным исследования PLATO, использование тикагрелора по сравнению с клопидогрелом
обеспечивает лучший прогноз у пациентов с ОКС, как получивших инвазивное лечение, так и при консервативной тактике в отношении снижения риска смерти по всем причинам (относительный риск — ОР 0,76, 95% доверительный интервал — ДИ 0,64—0,90), комбинированной точки (смерть, инфаркт миокарда — ИМ, инсульт: ОР 0,83, 95% ДИ 0,74— 0,93), риска развития ИМ (ОР 0,86, 95% ДИ 0,74—0,99) и смерти по сердечно-сосудистым причинам (ОР 0,77, 95% ДИ 0,64—0,93) [4, 11].
Другим примером может быть выбор оптимального анти-коагулянта для пациентов с ОКС и введение в практику назначения фондапаринукса вместо эноксапарина. По данным исследования OASIS 5 [12], в которое были включены 20 078 пациентов с ОКС без подъема сегмента ST, назначение фондапаринукса, даже если не превосходило эффективность эноксапарина, то снижало практически вдвое риск развития кровотечений и приводило к меньшей частоте смертельных исходов и сумме неблагоприятных исходов, таких как смерть + ИМ или смерть + ИМ и инсульт. Важно, что наибольшее снижение риска отмечено у пожилых, женщин, пациентов с почечной недостаточностью, т.е. категорий пациентов, которые чаще всего остаются на консервативной терапии. В иссле-довании OASIS 6 показано, что у пациентов с ОКС с подъемом сегмента ST, которым проводилась консервативная терапия, фондапаринукс обеспечивал достоверно большее снижение смертности на 9-й день (р=0,04), 30-й день (р=0,03) и к 6-му месяцу наблюдения (р=0,03) по сравнению с использованием нефракционированного гепарина [13, 14].
Современная тактика проведения антикоагулянтной и анти-агрегантной терапии, несмотря на большие прямые затраты на лекарственные препараты, оказывается экономически выгодной с точки зрения суммарных затрат на лечение, что должны учитывать руководители органов здравоохранения [15—18].
Неменьший интерес представляют данные о целесообразности и возможности использования при лечении пациентов с ОКС препаратов, оказывающих влияние на метаболизм миокарда, в связи с тем, что при тяжелой ишемии в первую очередь происходит изменение энергетического обмена кардиомиоцитов, протекающего в митохондриях. Именно эти изменения в последующем приводят к гибели кардиомиоцитов и формированию сердечной недостаточности [19].
Накоплен большой объем информации о благоприятных эффектах цитопротектора триметазидина в коррекции метаболических нарушений при ишемии и реперфузии [20]. Относительно возможности применения триметазидина при ОКС очень важные данные были получены в исследовании EMIP-FR [21]. Часто это исследование трактуют как неудавшееся, в связи с тем, что добавление к стандартному лечению триметазидина (болюс 40 мг + 48 ч инфузия в дозе 60 мг/сут) в первые 24 ч ИМ (из них 66% поступивших в первые 6 ч) в общей группе пациентов (n=19 725) не привело к снижению смертности (35 и 458 дней) по сравнению с таковой в группе плацебо. Однако у 44% пациентов, которым не проводился тромболизис, введение триметазидина обеспечивало меньшее нарушение локальной сократимости миокарда за счет уменьшения числа дискинетичных сегментов миокарда по сравнению с группой получавших стандартную терапию без триметазидина (6,9 против 9,1; р=0,01) и снижало смертность в течение 1 года наблюдения на 13% (13,3% против 15,1%; р=0,027).
В качестве другого подхода к коррекции нарушений энергетического обмена при ишемическом/реперфузионном повреждении предлагается внутривенное введение L-карнитина.
Для оценки целесообразности применения L-карнитина при ОКС у пациентов, не подвергшихся инвазивной реперфузии, нами проведено проспективное двойное слепое рандомизиро-ванное, плацебо-контролируемое исследование с включением 58 пациентов старше 18 лет, подписавших информированное согласие. В исследование не включали пациентов с болями или изменениями на ЭКГ, возникшими в связи с повышением артериального давления — АД (более 180 и 100 мм рт.ст.), имеющих признаки кардиогенного шока, хронических заболеваний печени и почек с выраженными нарушениями функции (повышение активности аспартатаминотрансферазы, аланинамино-трансферазы более чем в 2 раза от верхней границы нормы и снижение уровня клубочковой фильтрации менее 30 мл/мин), хронических интоксикаций (алкоголизм, наркомания).
Все пациенты получали общепринятую при ОКС терапию, включавшую тромболизис по показаниям, двухкомпонентную дезагрегантную терапию (ацетилсалициловая кислота + клопидогрел), антикоагулянтную терапию (гепарин или фондапаринукс), статины, β-адреноблокаторы, ингибиторы ангиотензинпревращающего фермента или сартаны, нитраты. Частота назначения разных групп препаратов значимо не различалась в исследуемых группах.
Рандомизация на группы проводилась случайным образом с помощью таблицы простых чисел. Препарат L-карнитина (элькар для внутривенного и внутримышечного введения 100 мг/мл, компания ПИК-ФАРМА, Россия) или плацебо вводили внутривенно капельно сразу после рандомизации пациента. Перед внутривенным введением содержимое ампулы растворяли в 100—200 мл 0,9% хлорида натрия. Препарат вводили в течение первых 3 суток по 2 г 2 раза в сутки, с 4-х по 15-е сутки (или до выписки, если она происходила раньше) по 2 г 1 раз в сутки. Таким образом, продолжительность наблюдения составляла 15 дней и более при более поздней выписке.
В качестве маркеров высокого риска неблагоприятных исходов оценивали продолжительность корригированного интервала QT (QTс) и дисперсию интервала QT (ΔQT), которую определяли как разницу между максимальной и минимальной длительностью интервала QT в каждом из 12 общепринятых отведений ЭКГ, которую регистрировали в день поступления и затем на 2, 3, 5, 7-е и 12—15-е сутки госпитализации. Дисперсию QT рассматривают как показатель электрической нестабильности миокарда. Установлено [22], что в группе L-карнитина по отношению к группе плацебо снижение ΔQTc (в %) было значимо большее, начиная со 2-х суток лечения (р=0,008), и межгрупповое различие выраженности ΔQTc достигло максимального значения на 12—14-е сутки наблюдения и составило 27,6% (р<0,0001). В группе леченных L-карнитином ΔQTc снижалась с 79,9 ±19,9 до 60,4±17,5 мс (р<0,0001) и составила к 12—14-му дню лечения 41,1±7,6 мс (р<0,0001), в группе плацебо — соответственно с 74,9±23,2 до 68,3±22,4 мс (р=0,277) и 53,5±15,0 мс (р=0,0003). В группе пациентов, получавших L-карнитин, снижение ΔQTc носило достоверный характер с первого дня заболевания и при нестабильной стенокардии, и при ИМ. Это наиболее уязвимый период для возникновения фатальных нарушений ритма сердца. В подгруппах пациентов с ИМ снижение ΔQTc (в %) при лечении L-карнитином было значимо больше в сравнении с плацебо, начиная со вторых суток лечения (р=0,049) и до окончания наблюдения. В группе получавших плацебо при нестабильной стенокардии изменения не носили достоверного характера, а при ИМ — достоверность отмечена лишь к 7-м суткам заболевания.
Снижение ΔQTc при исходной величине ΔQTc >80 мс было выражено в большей степени, чем у пациентов с ΔQTc <80 мс. При этом в группе получавших L-карнитин выраженность снижения ΔQTc практически не зависела от ее исходной величины и была статистически значимой у пациентов c большой и не очень большой исходной ΔQTc.
В обеих группах больных отмечалось уменьшение частоты сердечных сокращений (ЧСС) и QTc [23]. Однако в группе получавших плацебо уменьшение QTc не было достоверным (с 439,1±36,9 до 422,9±27,7 мс к 12—14-му дню заболевания). В группе пациентов, получавших L-карнитин, уменьшение было достоверным с первого дня заболевания и на 2-е сутки лечения составило 32,8 мс (p<0,0001). В группе L-карнитина снижение было достоверно большим на всех сроках наблюдения и к 12—14-му дню составило в группе L-карнитина 9,3±7,3%, в группе плацебо — 2,0±8,2% (р=0,002). Более выраженное уменьшение QTc происходило в группах пациентов, исходно имевших длительность QTc более 440 мс, в группе L-карнитина достоверное уменьшение наблюдалось с первого дня заболевания, в группе плацебо — лишь к 7-му дню заболевания. При исходном QTс менее 440 мс в группе L-карнитина достоверное уменьшение наблюдалось к 7-му дню заболевания, в группе плацебо изменений не было. У пациентов с ИМ достоверные изменения QTc при лечении L-карнитином наблюдались со 2-го дня заболевания, и выраженность снижения достоверно отличалась от динамики QTc в группе плацебо. При нестабильной стенокардии уменьшение QTc не носило достоверного характера. L-карнитин у пациентов с ОКС уменьшает выраженность изменений маркера высокого риска неблагоприятных исходов — корригированного интервала QT.
Еще один важный аспект был рассмотрен в рамках проведенного нами исследования — влияние L-карнитина на раннее постишемическое ремоделирование миокарда [24]. Лечение L-карнитином приводило к достоверному уменьшению конечного систолического и конечного диастолического объемов (КСО и КДО; р<0,0001), тем самым способствуя повышению сократительной функции миокарда левого желудочка (ЛЖ) сердца, в то время как введение плацебо приводило к менее выраженному уменьшению КСО, но к значительному увеличению КДО (p=0,0004). Наиболее выраженные изменения фракции выброса отмечены у пациентов с исходно сниженной фракцией выброса, причем достоверное увеличение отмечено только у пациентов получавших L-карнитин (р=0,00002). Эти данные позволяют полагать, что введение L-карнитина уменьшает степень раннего постинфарктного ремоделирования ЛЖ. Методом тканевой допплерографии показано, что в группе пациентов, получавших L-карнитин, в отличие от плацебо, происходило улучшение параметров сократительной функции миокарда. Так, наблюдалось увеличение пиковой систоли-ческой скорости (Sm) базального (с 3,5±1,3 до 4,1±1,2 м/с; р<0,002) и среднего (с 2,7±1,2 до 3,2±1,2 м/с; р<0,004) сегмен-тов межжелудочковой перегородки. Увеличивалась Sm базаль-ного (с 3,6±1,7 до 4,3±1,8 м/с; р<0,001), среднего (с 2,5±1,3 до 2,9±1,2 м/с; р<0,01) и верхушечных (с 1,7±0,9 до 2,0±0,8 м/с; р<0,01) сегментов боковой стенки. Кроме того, увеличивалась Sm базальных (от 3,1±1,4 до 3,6±1,2 м/с; р<0,006) и средних (от 2,6±1,1 до 2,7±0,4 м/с) сегментов нижней стенки. В группе пациентов, получавших стандартную терапию и плацебо, достоверного увеличения Sm исследуемых сегментов миокарда ЛЖ не наблюдалось.
Следует отметить, что и в более ранних рандомизированных плацебо-контролируемых исследованиях при использовании L-карнитина были показаны позитивные эффекты у пациентов с ИМ в отношении уменьшения размеров ИМ, оцененных по выходу в крови маркеров повреждения миокарда [25] или по изменению зубцов комплекса QRS на ЭКГ [25, 26]. В группах больных, леченных L-карнитином, меньшим было число эпизодов ишемии (17,6% против 36%; отношение шансов — ОШ 0,49 при 95% ДИ от 0,98 до 0,24) [26]. В нескольких исследованиях показана меньшая степень изменений объемов сердца в позднем периоде ИМ [27], в том числе уменьшение почти в 2 раза числа случаев ремоделирования с увеличением размеров ЛЖ [26]. Показано также уменьшение частоты формирования сердечной недостаточности высоких классов (III/IV по классификации NYHA) [26]. Важно, что в ряде исследований было оценено влияние терапии L-карнитином на частоту развития осложнений, при этом было показано, что меньшей была частота комбинированной точки (смерть и повторные ИМ) [27], отмечено статистически значимое снижение ранней смертности после ИМ — на 5-е сутки острого периода снижение составило 39% (ОР 0,61 при 95% ДИ от 0,37 до 0,98; p=0,04) [28]. Отчасти снижение смертности в ранние сроки ИМ (2-е сутки) может быть обусловлено снижением у большего числа пациентов частоты возникновения желудочковых экстрасистол высоких градаций (IVa и IVb по Lown) при введении 5 г L-карнитина, по сравнению с пациентами, получавшими плацебо (p=0,028) [29].
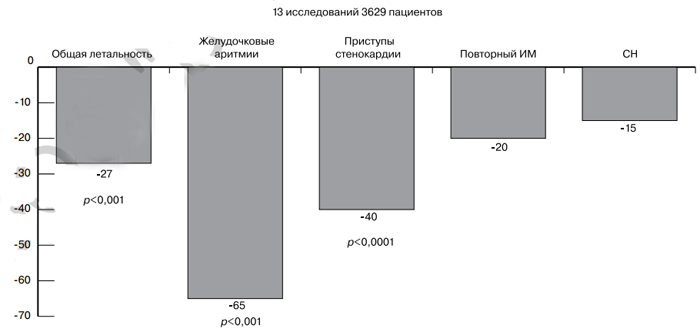
Рис. 1. Мета-анализ: влияние L-карнитина на заболеваемость и смертность при ИМ [30].
ИМ — ифаркт миокарда; СН — сердечная недостаточность.
И наконец, мета-анализ 13 исследований (3629 больных), проведенных при ИМ, показал (рис. 1), что L-карнитин снижает на 27% (р<0,001) общую смертность, частоту желудочковых нарушений ритма на 65% (р<0,0001) и на 40% частоту приступов стенокардии (р<0,0001) [30, 31]. При этом не выявлено существенных различий по выраженности положительного эффекта L-карнитина при приеме внутрь после ИМ в зависимости от применяемых суточных доз в диапазоне от 2 до 6 г [31, 32].
Объяснениями положительных эффектов служат данные о ключевой роли L-карнитина в поддержании синтеза аденозинтрифосфата (АТФ) [19, 33]. L-карнитин участвует в транспорте длинноцепочечных жирных кислот (ДЦ-ЖК), не растворимых в воде, через внутреннюю мембрану митохондрий в матрикс (система карнитинового челнока; рис. 2), т.е. под влиянием фермента карнитинпальмитоилтрансферазы-1 (КПТ-1) с ДЦ-ацил-КоА на L-карнитин переносится ДЦ-ацил и образуется эфир ДЦ-ацилкарнитин. Затем это соединение с помощью транслоказы карнитин/ДЦ-ацилкарнитин (АККТ) переносится через внутреннюю мембрану в митохондрии в обмен на L-карнитин из митохондрий. В митохондриях под влиянием фермента КПТ-2 ДЦ-ацил с карнитина переносится на КоА, и образовавшийся ДЦ-ацил-КоА подвергается многократному циклу β-окисления, в котором генерируется ацетил-КоА. Окисление ацетил-КоА в цикле трикарбоновых кислот (Кребса) сопровождается образованием восстановленного никотинамидадениннуклеотида (НАДН+) и восстановленного флавинадениндинуклеотида, которые отдают свои электроны в дыхательную цепь митохондрий, а выделяющаяся в результате транспорта электронов энергия используется для синтеза АТФ.
Помимо этого, в последние годы было установлено [33], что L-карнитин является прямым антиоксидантом, удаляющим образовавшиеся радикалы кислорода, а также подавляющим их генерацию ферментами в цитоплазме клеток и непосредственно в дыхательной цепи митохондрий, поскольку L-карнитин образует комплексы с ионами Fe2+ и Cu2+ в их активных центрах. Снижение уровня активных форм кислорода (АФК) под влиянием L-карнитина тормозит образование пероксинитрита — цитотоксического агента, необратимо взаимодействующего с различными белковыми мишенями, который образуется при действии супероксид-анионов на радикалы NO. Таким образом, L-карнитин увеличивает биодоступность NO — универсального регулятора эндотелиальных клеток как периферических сосудов, так и коронарных артерий, тем самым снижая нагрузку на сердце при ИМ.
Данные о том, что карнитин уменьшает окислительный стресс, получены в различных исследованиях. В частности, в эксперименте на кардиомиоцитах крыс, где окислительный стресс был вызван добавлением пероксида водорода (H2O2). L-карнитин предупреждал поражение миокарда, вызванное окислительным стрессом, сохранял функцию митохондрий и частично предотвращал апоптоз кардиомиоцитов [34]. Эти данные подтверждены в рандомизированных клинических исследованиях [35].
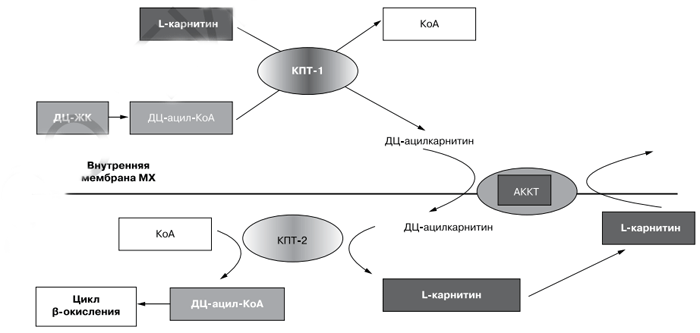
Рис. 2. Карнитиновый челнок [19].
КПТ-1 и КПТ-2 - карнитин-пальмитоил трансфераза 1 и 2 соотвественно; ЖК — жирные кислоты; ДЦ — длинноцепочечные; КоА -коэнзим A; MX — митохондрии; АККТ — карнитин/ДЦ-ацилкарнитин транслоказа.
Таким образом, L-карнитин, снижая окислительный стресс, активирует антиапоптозные сигналы и снижает проапоптозные влияния. Соответственно можно ожидать уменьшения выраженности постинфарктного ремоделирования под влия-нием L-карнитина. Действительно, многочисленные исследования свидетельствуют о позитивном влиянии L-карнитина на выраженность ишемического и реперфузионного повреждения сердца, что сопровождается уменьшением зоны некроза миокарда [36]. Это сочетается с улучшением функционального постишемического восстановления [37] и ограничивает постинфарктное ремоделирование сердца [38, 39].
Кроме того, L-карнитин обладает свойствами хелатного комплексона, связывающего ионы Са2+, что изменяет не только уровни свободного Са2+ в клетках, но и регуляторное влияние этого вторичного мессенджера на многочисленные реакции и процессы, включая сократимость сердца [33]. Несомненно, определенный интерес представляют данные о противовоспалительном действии L-карнитина у пациентов с ИБС [40].
В данном обзоре мы сконцентрировали внимание на работах, посвященных лечению пациентов с ОКС, не подвергающихся инвазивной реперфузии, и которые, как известно, имеют худший прогноз, в связи с чем необходим более тщательный подход к выбору медикаментозной терапии.
Сведения об авторах:
ГБОУ ВО Первый Московский государственный медицинский университет имени И.М. Сеченова, Москва, Россия
Глезер М.Г. - д.м.н., проф. кафедры профилактической и неотложной кардиологии ИПО, зав. лабораторией функциональных методов исследования и рациональной фармакотерапии сердечно-сосудистых заболеваний НИЦ.
Киселева А.Е. - аспирант кафедры профилактической и неотложной кардиологии ИПО.
Асташкин Е.И. - д.биол.н., проф. кафедры патологии, зав. лабораторией экстремальных состояний НИЦ.
Литература
1. Érlikh A.D., Matskeplishvili S.T., Gratsianskiĭ N.A., Buziashvili IuI First Moscow «snapshot» register of acute coronary syndromes: characteristics of patients, management and outcomes during hospitalization. Kardiologiya 2013;53(12):4–13. Russian (Эрлих А.Д., Мацкеплишвили С.Т., Грацианский Н.А., Бузиашвили Ю.И. и все участники московского регистра ОКС. Первый Московский регистр острого коронарного синдрома: характеристика больных, лечение и исходы за время пребывания в стационаре. Кардиология 2013;53(12):4–13.)
2. Érlikh A.D., Gratsianskiĭ N.A., on behalf of RECORD-3 participants. Registry of Acute Coronary Syndromes «RECORD-3». Characteristics of Patients and Treatment During Initial Hospitalization. Kardiologiya 2016;58(4):16–24. Russian (Эрлих А.Д., Грацианский Н.А. от имени участников регистра РЕКОРД-3 Российский регистр острого коронарного синдрома «РЕКОРД-3». Характеристика пациентов и лечение до выписки стационара. Кардиология 2016;4:16–25).
3. Mårtensson S., Gyrd-Hansen D., Prescott E. et al. Trends in time to invasive examination and treatment from 2001 to 2009 in patients admitted first time with non-ST elevation myocardial infarction or unstable angina in Denmark. BMJ Open. 2014;4(1):e004052.
4. James S.K., Roe M.T., Cannon C.P. et al; PLATO Study Group. Ticagrelor versus clopidogrel in patients with acute coronary syndromes intended for non-invasive management: substudy from prospective randomised PLATelet inhibition and patient Outcomes (PLATO) trial. BMJ 2011;342:d3527.
5. Russian recommendations. Diagnosis and treatment of patients with acute myocardial infarction with ST elevation ECG segment. Ministry of Health, Moscow, 2014. Russian (Российские рекомендации. Диагностика и лечение больных острым инфарктом миокарда с подъемом сегмента ST электрокардиограммы. МЗ РФ. Москва; 2014).
6. Russian recommendations Diagnosis and treatment of patients with c acute coronary syndrome without ST-segment elevation ECG Health Ministry,
Moscow, 2016. Russian (Российские рекомендации Диагностика и лечение больных c острым коронарным синдромом без подъема сегмента ST электрокардиограммы МЗ РФ. Москва; 2016).
7. Amsterdam E.A., Wenger N.K., Brindis R.G. et al. 2014 AHA/ACC Guideline for the Management of Patients With Non-ST-Elevation Acute Coronary Syndromes. A Report of the American College of Cardiology/ American Heart Association Task Force on Practice Guidelines. Circulation 2014;130:e344–e426.
8. 2015 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: Task Force for the Management of Acute Coronary Syndromes in Patients Presenting without Persistent ST-Segment Elevation of the European Society of Cardiology (ESC). Eur Heart J 2016;37(3):267–315.
9. Lee C.H., Tan M., Yan A.T. et al. Canadian Acute Coronary Syndromes (ACS) Registry II Investigators. Use of cardiac catheterization for non-ST-segment elevation acute coronary syndromes according to initial risk: reasons why physicians choose not to refer their patients. Arch Intern Med 2008;168(3):291–296.
10. Zeymer U., Schneider S., Zahn R., Andresen D. Reported underuse of risk scores in patients with acute coronary syndromes without persistent ST elevations in clinical practice: results of a survey of the ALKK study group. Clin Res Cardiol 2014;103(1):83–84.
11. Lindholm D., Varenhorst C., Cannon C.P. et al. Ticagrelor vs. clopidogrel in patients with non-ST-elevation acute coronary syndrome with or without revascularization: results from the PLATO trial. Eur Heart J 2014;35(31):2083– 2093.
12. Budaj A., Eikelboom J.W., Mehta S.R. et al. OASIS 5 Investigators. Improving clinical outcomes by reducing bleeding in patients with non-ST-elevation acute coronary syndromes. Eur Heart J 2009;30(6):655–661.
13. Yusuf S., Mehta .S.R, Chrolavicius S. et al. OASIS-6 Trial Group. Effects offondaparinux on mortality and reinfarction in patients with acute ST-segment elevation myocardial infarction: the OASIS-6 randomized trial. JAMA 2006;295(13):1519–1530.
14. Schiele F. Fondaparinux and acute coronary syndromes: update on the OASIS 5-6 studies. Vasc Health Risk Manag 2010;6:179–187.
15. Pyadushkina E.A., Gerasimova K.V., Omel'yanovskii V.V. et al. Pharmacoeconomic analysis of the use of antiplatelet therapy ticagrelor and clopidogrel for the prevention of cardiovascular events and death in patients with acute coronary syndrome Medical Technology. Evaluation and selection 2012;10(4): 35–45. Russuan (Пядушкина Е.А., Герасимова К.В., Омельяновский В.В. и др. Фармакоэкономический анализ применения антитромбоцитарной терапии тикагрелором и клопидогрелом с целью профилактики сосудистых явлений и смерти у пациентов с острым коронарным синдромом. Медицинские технологии. Оценка и выбор 2012;10(4):35–45).
16. Kulikov A.Yu. Pharmacoeconomic analysis of dual antiplatelet therapy of aspirin and ticagrelor in patients with acute coronary syndrome treated with percutaneous coronary vascularization procedures Pharmacoeconomics Theory and Practice 2016;4(1):21–25. Russian (Куликов А.Ю. Фармакоэкономический анализ двойной антитромбоцитарной терапии ацетилсалициловой кислотой и тикагрелором у пациентов с острым коронарным синдромом, получающих лечение с применением процедуры чрескожной коронарной васкуляризации). Фармакоэкономика теория и практика 2016;4(1):21–25.)
17. Ross Terres J.A., Lozano-Ortega G., Kendall R., Sculpher M.J. Cost-effectiveness of fondaparinux versus enoxaparin in non-ST-elevation acute coronary syndrome in Canada (OASIS-5). BMC Cardiovasc Disord 2015;15:180.
18. Sculpher M.J., Lozano-Ortega G., Sambrook J. et al. Fondaparinux versus Enoxaparin in non-ST-elevation acute coronary syndromes: short-term cost and long-term cost-effectiveness using data from the Fifth Organization to Assess Strategies in Acute Ischemic Syndromes Investigators (OASIS-5) trial. Am Heart J 2009;157(5):845–852.
19. Astashkin E.I., Glezer M.G. The role of L-Carnitine in energy metabolism of cardiomyocytes and treatment of diseases of the cardiovascular system. Cardiology and Cardiovascular Surgery 2012;6(2):58–65. Russian (Асташкин Е.И., Глезер М.Г. Роль L-карнитина в энергетическом обмене кардиомиоцитов и лечении заболеваний сердечно-сосудистой системы. Кардиология и сердечно-сосудистая хирургия 2012; 6(2):58–65).
20. Astashkin E.I., Glezer M.G. Cardioprotection during heart damage caused by ischemia and reperfusion. J Heart Fail 2016;3. Russian (Асташкин Е.И., Глезер М.Г. Кардиопротекция при повреждениях сердца, вызываемых ишемией и реперфузией. Журнал Сердечная недостаточность 2016;3).
21. Effect of 48-h intravenous trimetazidine on short- and long-term outcomes of patients with acute myocardial infarction, with and without thrombolytic therapy; A double-blind, placebo-controlled, randomized trial. The EMIP-FR Group. European Myocardial Infarction Project Free Radicals. Eur Heart J 2000;21(18):1537–1546.
22. Glezer M.G., Kiseleva A.E., Astashkin E.I. Effect of L-Carnitine on QT Dispersion in Patients With Acute Coronary Syndrome Kardiologiya 2015;55(3):4–9. Russian (Глезер М.Г., Киселева А.Е., Асташкин Е.И. Влияние L-карнитина на дисперсию интервала QT у пациентов с острым коронарным синдромом. Кардиология 2015;55(3):4–9).
23. Glezer M.G., Kiseleva A.E., Astashkin E.I. Effect of L-carnitine on CHCC QTc and in patients with acute coronary syndrome. Heart Journal 2015;14(2/82):78–84. Russian (Глезер М.Г., Киселева А.Е., Асташкин Е.И Влияние L-карнитина на ЧCC и QTс у пациентов с острым коронарным синдромом. Сердце 2015;14(2/82):78–84).
24. Glezer M.G., Kiseleva A.E., Prokofieva E.B., Astashkin E.I. Effect of L-carnitine on the echocardiographic parameters in patients with acute coronary syndrome. Heart Failure Journal 2015;16(4):234–224. Russian (Глезер М.Г., Киселева А.Е., Прокофьева Е.Б., Асташкин Е.И. Влияние L-карнитина на эхокардиографические показатели у пациентов с острым коронарным синдромом. Журнал Сердечная Недостаточность 2015;16 (4):234–240).
25. Singh R.B., Niaz M.A., Agarwal P. et al. A randomized, double blind, placebo controlled trial of L-carnitine in suspected myocardial infarction. Postgrad Med J 1996;72:843:45–50.
26. Chiariello M., Nrevetti G., Policicclio A. et al. L-Carnitine in acute myocardial infarction. A multicentre randomized trial. In: Clinical aspects of human carnitine deficiency. Ed. А. Borum. New York: Pergamon Press 1986; 242–243.
27. Iliceto S., Scrutinio D., Bruzzi P. et al. Effect of L-carnitine administration on left ventricular remodeling after acute anterior myocardial infarction: the L-Carnitine Ecocardiografia Digitalizzata Infarto Miocardico (CEDIM) trial. J Am Coll Cardiol 1995;26(2):380–387.
28. Tarantini G., Scrutinio D., Bruzzi P. et al. Metabolic treatment with L-carnitine in acute anterior ST segment elevation myocardial infarction. A randomized controlled trial. Cardiology 2006;106(4):215–223.
29. Martina B., Zuber M., Weiss P. et al. Anti-arrhythmia treatment using L-carnitine in acute myocardial infarct. Schweiz Med Wochenschr 1992;122(37):1352–1355.
30. DiNicolantonio J.J., Lavie C.J., Fares H. et al. L-carnitine in the secondary prevention of cardiovascular disease: systematic review and meta-analysis. Mayo Clin Proc 2013;88(6):544–551.
31. Dinicolantonio J.J., Niazi A.K., McCarty M.F. et al. L-carnitine for the treatment of acute myocardial infarction. Rev Cardiovasc Med 2014; 15(1):52–62.
32. Shang R., Sun Z., Li H. Effective dosing of L-carnitine in the secondary prevention of cardiovascular disease: a systematic review and meta-analysis. BMC Cardiovasc Disord 2014;14:88.
33. Astashkin E.I., Glezer M.G. Effect of L-carnitine on oxidative stress in cardiovascular diseases. Medical Council 2016;10:94–100. Russian (Асташкин Е.И., Глезер М.Г. Влияние L-карнитина на оксидативный стресс при сердечно-сосудистых заболеваниях. Медицинский Совет 2016;10:94–100).
34. Mao C.Y., Lu H.B., Kong N. et al. Levocarnitine protects H9c2 rat cardiomyocytes from H2O2-induced mitochondrial dysfunction and apoptosis. Int J Med Sci 2014;11(11):1107–1115.
35. Lee B.J., Lin J.S., Lin Y.C., Lin P.T. Effects of L-carnitine supplementation on oxidative stress and antioxidant enzymes activities in patients with coronary artery disease: a randomized, placebo-controlled trial. Nutr J 2014;13:79.
36. Ura K., Hironaka Y., Sakurai I. Effect of carnitine on size limitation of experimental myocardial infarct. Am J Cardiovasc Pathol 1990;3:131–142.
37. Liedtke A.J., Demaison L., Nellis S.H. Effects of L-propionyl-L-carnitine on mechanical recovery during reflow in intact hearts. Am J Physiol 1988;255:H169–H176.
38. Micheletti R., Di Paola E., Schiavone A. et al. Propionyl-L-carnitine limits chronic ventricular dilatation after myocardial infarction in rats. Am J Physiol 1993; 264:H1111–H1117.
39. Beyersdorf F., Acar C., Buckberg G.D. et al. Studies on prolonged acute regional ischemia. V. Metabolic support of remote myocardium during left ventricular power failure. J Thorac Cardiovasc Surg 1989;98:567–579.
40. Lee B.J., Lin J.S., Lin Y.C., Lin P.T. Anti-inflammation effects of L-carnitine supplementation (1000 mg/d) in coronary artery disease patients. Nutrition 2015;31:475–479.

